Совершенствование биотехнологии симбиотического бактериального концентрата
Автор: Бояринева И.В., Хамагаева И.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (94), 2022 года.
Бесплатный доступ
В сфере пищевых технологий в настоящее время вопрос получения бактериальных концентратов с высокой урожайностью и жизнеспособностью микробных клеток является актуальным вопросом. Целенаправленное регулирование технологических параметров изготовления бактериальных препаратов оказывает существенное влияние на их качество и, следовательно, на качество готовых пищевых продуктов. В статье представлены результаты исследований по совершенствованию технологии жидкого бактериального концентрата на основе симбиотической закваски для хлебопекарного производства. Этот бактериальный концентрат состоит из консорциума микроорганизмов, характерных для ферментационной микрофлоры ржаных заквасок. Определена оптимальная доза внесения инокулята с целью наращивания биомассы симбиотической закваски. Особенность технологии - принципиально новый подход к подготовке инокулята и получению биомассы симбиотической закваски. Особое внимание при производстве симбиотического концентрата было уделено оптимизации состава питательной среды и созданию условий для роста мезофильных лактобактерий и дрожжей, не сбраживающих лактозу, характерной для бродильной микрофлоры, используемой в хлебопекарном производстве. Для получения биомассы используется простая в приготовлении и дешевая питательная среда на основе творожной сыворотки; в качестве инокулята используется симбиотическая закваска, близкая к естественной закваске для получения ржаного хлеба; благодаря сбалансированному составу среды интенсифицируется процесс накопления биомассы; микробная биомасса характеризуется высоким титром жизнеспособных клеток. Установлена высокая выживаемость клеток в условиях инфракрасной сушки. Полученный концентрат симбиотической закваски обладает высокой ферментативной активностью, хорошей подъемной силой и имеет высокий титр мезофильных лактобактерий и дрожжей, не сбраживающих лактозу.
Закваска, концентрат симбиотической закваски, консорциум, питательная среда, биомасса
Короткий адрес: https://sciup.org/140301793
IDR: 140301793 | УДК: 637.1 | DOI: 10.20914/2310-1202-2022-4-89-95
Текст научной статьи Совершенствование биотехнологии симбиотического бактериального концентрата
Одной из важнейших задач производства биопрепаратов является совершенствование методов культивирования, что обеспечивается разработкой новых питательных сред и совершенствованием режимов культивирования, позволяющих получить высокое количество клеток микроорганизмов в концентрате и выход биомассы.
Правильный подбор состава питательной среды дает возможность получить биомассу полезных микроорганизмов. Главная цель при подборе среды для выращивания любого микроорганизма состоит в том, чтобы создать сбалансированную смесь необходимых питательных веществ в таких концентрациях, при которых рост будет наилучшим.
Поскольку потребности микроорганизмов чрезвычайно разнообразны, нельзя составить универсальную среду, оптимальную для роста всех микроорганизмов. Существуют самые различные по составу и технике приготовления питательные среды. Применяются всевозможные естественные и искусственные субстраты, начиная от простой водопроводной воды и солевых растворов до сложных экстрактов из зародышей животных и растений, от отбросов (навоз) до полноценных белков человека и животных.
Для размножения любой культуры необходимо обеспечить подходящее биофизическое окружение. Умелое обращение с биофизическими и биологическими факторами приобретает особую важность в получении накопительных культур и последующего выделения микроорганизмов в виде чистой культуры. Температура, аэрация и давление определяются условиями культивирования. Все эти факторы влияют на скорость роста, выход биомассы, метаболизм и химический состав бактерий [1].
Важную роль в процессе культивирования или выращивания микроорганизмов при этом играет активность посевного материала. Инокулят должен обладать высокой биохимической активностью, использование которого позволит интенсифицировать процесс наращивания клеток и получить биомассу с высоким титром бактерий [2].
В ходе создания поликомпонентных микробных препаратов стоит учитывать не только антагонистическую активность или ростостимулирующие свойства полезных бактерий, но также и их биосовместимость между собой. Высокая степень совместимости штаммов непосредственно влияет на возможность применения, эффективность и стабильность разрабатываемого продукта [3, 4]. Важно, чтобы культуры в многоштаммовом биопрепарате не вступали в конкурентные взаимоотношения между собой, а пребывали в нейтральном или синергичном взаимодействии [5].
При подборе питательной среды для микробного консорциума первоочередной задачей является обеспечение роста лактозонеусваиваю-щих дрожжей и мезофильных лактобактерий [6].
Дрожжи и некоторые представители лактобактерий могут проявлять активность по отношению к другим углеводам помимо лактозы. Известно, что в технологии приготовления хлеба из ржаной муки применимы закваски с использованием чистых культур лактобактерий и дрожжей. В состав заварок ржаной муки входят такие лактобактерии и дрожжи, как
Lactobacillus plantarum, L. brevis, L. delbrueckii, L. fermentum, Saccharomyces cerevisiaе . Известно, что ржаная мука обладает высокой биологической ценностью и характеризуется большим удельным весом в составе водорастворимого белково-углеводного комплекса [7].
В процессе ферментации закваски температура выступает в качестве основного фактора, влияющего на динамику микробного сообщества и кинетику образования метаболитов. Более высокие температуры вызывают сдвиг в сторону увеличения содержания молочной кислоты, тем самым повышая кислотность закваски. Гомоферментативные и факультативно гетероферментативные виды молочнокислых бактерий (LAB), принадлежащие, например, к группе Lactobacillus delbrueckii , часто преобладающая в заквасках, приготовленных при повышенных температурах, вызывает быстрое снижение рН водно-мучной питательной смеси, главным образом, за счет образования молочной кислоты. Гетероферментативные типы дрожжи, как правило, преобладают в заквасках, которые выдерживаются при более низких температурах и в течение длительных периодов брожения, образуя смесь молочной, уксусной кислот и/или этанола [8].
Таким образом, технология получения бактериального концентрата зависит от многих факторов.
Необходимо совершенствовать производственный цикл сброженной закваски путем поиска взаимосвязи между количественным составом рецептурных компонентов, технологическими параметрами постадийного приготовления сброженной закваски и ее биотехнологическими свойствами для выявления оптимальных диапазонов варьирования, обеспечивающие требуемый качественный и количественный микробный состав [9].
Существующая традиционная технология приготовления ржаного хлеба и сортов ржано-пшеничного хлеба предусматривает использование жидких заквасок, выращенных на чистых культурах микроорганизмов по трехфазной схеме цикла разведения и поддерживаемых непрерывным периодическим освежением. Эта технология слишком трудоемкая.
В связи с этим, актуальным является создание концентрированной закваски с высокими биотехнологическими свойствами, использование которой позволит интенсифицировать бродильные процессы и значительно упростить технологию приготовления ржаного хлеба.
Цель работы – разработать технологию бактериального концентрата для хлебопекарного производства, используя механизм гетеро-ферментативного брожения кефирной грибковой закваски.
Материалы и методы
Экспериментальные исследования проводились на кафедре «Технология молочных продуктов. Товароведение и экспертиза товаров», в проблемной научно-исследовательской лаборатории ВСГУТУ. Объектом исследований служила кефирная грибковая закваска. Морфологию микрофлоры закваски изучали путем приготовления препаратов, окрашенных метиленовым синим и по Граму с последующим микрокопированием в иммерсионной системе с объективом 90 с нанесением капель кедрового масла. Количество лактозных дрожжей определяли на картофельно-лактозном агаре методом предельных разведений. Количество дрожжей, не сбраживающих лактозу, определяли на картофельно-сахарозном агаре методом предельных разведений. Общее количество дрожжей в закваске определяли методом предельных разведений с последующим посевом в чашках Петри со средой Сабуро.
Количественный учет термофильных и мезофильных лактобактерий проводили на среде «Бактофок». Состав среды: Бактофок-МК 20,0 г; натрия хлорид 5,0 г; глюкоза 1,0 г; агар микробиологический 13,0 г; вода дистиллированная 1000 см3. Все ингредиенты растворяют в воде, прибавляют замоченный заранее агар, нагревают до полного его расплавления, устанавливают рН=7,3±0,1, фильтруют через ватно-марлевый фильтр, разливают во флаконы и стерилизуют при температуре (121 ±1)℃ в течение 15 мин. Хранят при температуре 4–10 ℃.
Результаты и обсуждение
Ранее была оптимизирована питательная среда для получения бактериального концентрата симбиотической закваски с учетом сбалансированного роста мезофильных лактобактерий и дрожжей, не сбраживающих лактозу. Для наращивания биомассы симбиотической закваски определена оптимальная доза инокулята 5% от объема питательной среды. Доказано, что внесение в питательную среду 15% картофельного отвара и 0,8% агара ускоряет рост дрожжей и обеспечивает высокий выход биомассы симбиотической закваски [10].
Следующие экспериментальные исследования посвящены разработке технологии бактериального концентрата симбиотической закваски в жидкой и сухой формах.
Технологический процесс производства концентрата состоит из следующих основных стадий: приготовление закваски, приготовление картофельного отвара, приготовление питательной среды, наращивание биомассы симбиотической закваски, отделение культуральной жидкости от суспензии клеток, центрифугирование, розлив, укупорка, сушка, маркировка и хранение.
Средой для получения биомассы симбиотический закваски служит сыворотка творожная с добавлением буферных солей и стимуляторов роста. Сыворотку предварительно осветляют. Для этого ее нагревают до температуры 92–95 °С, добавляют 40%-ный раствор гидроокиси натрия, выдерживают 10–15 мин и фильтруют. В подготовленную сыворотку вносят картофельный отвар, натрий лимоннокислый, калий фосфорнокислый, магний сернокислый, сахарозу, аскорбиновую кислоту, агар и устанавливают рН среды в пределах 6,0–6,5.
Компонентный состав питательной среды представлен в таблице 1.
Таблица 1.
Компонентный состав питательной среды
Table 1.
Component composition of the nutrient medium
|
Сырье и основные материалов Raw materials and base materials |
Расход Volume |
|
Сыворотка творожная ǀ Curd whey |
850 мл |
|
Отвар картофельный ǀ Potato broth |
150 мл |
|
Натрий лимоннокислый трехзамещенный Sodium citric acid tri – substituted |
1,0 г/л |
|
Калий фосфорнокислый однозамещенный ǀ Potassium phosphate monosubstituted |
0,5 г/л |
|
Магний сернокислый ǀ Magnesium sulphate |
0,1 г/л |
|
Аскорбиновая кислота ǀ Ascorbic acid |
0,1 г/л |
|
Агар микробиологический ǀ Microbiological agar |
0,8 г/л |
|
Сахароза ǀ Sucrose |
0,5 г/л |
Готовую среду стерилизуют при температуре (121±1)°С в течение 30–40 минут, затем охлаждают до температуры (30±2)°С.
Приготовление картофельного отвара проводится следующим образом: очищенный и нарезанный ломтиками картофель массой 200 г. заливают 1 л дистиллированной воды и кипятят в течение 1 часа. Отвар фильтруют, к фильтрату добавляют воду до первоначального объема, устанавливают pH 3,5, разливают и стерилизуют при температуре 121 °С в течение 10 минут. В охлажденную до температуры (30±1)°С питательную среду вносят картофельный отвар в количестве 15%, затем инокулят в количестве 5% от массы среды. Среду с инокулятом тщательно перемешивают и нейтрализуют рН до значений 6,0–6,5.
Наращивание биомассы симбиотической закваски проводят в условиях периодического культивирования при двукратной нейтрализации и перемешивании среды через 12 и 24 часа культивирования. Продолжительность культи вирования составляет 24±2 часа при темпера туре (30±1)°С (рисунок 1).
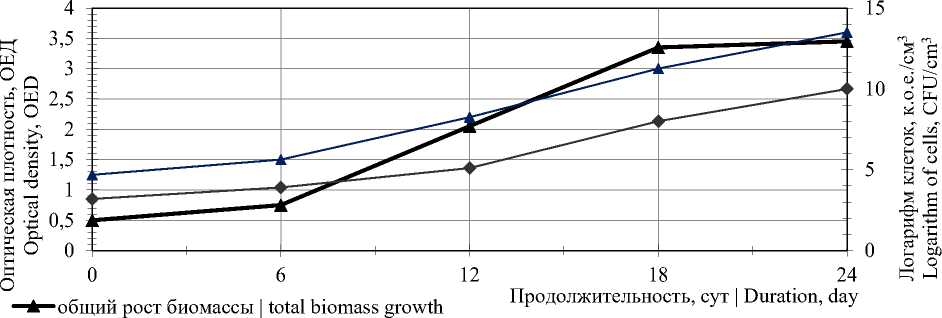
—*— содержание мезофильных лактобактерий | the content of mesophilic lactobacilli содержание дрожжей, не сбраживающих лактозу | the content of yeast that does not ferment lactose
Рисунок 1. Влияние условий культивирования на рост биомассы и количественное содержание мезофильных лактобактерий и дрожжей, не сбраживающих лактозу
Figure 1. Influence of cultivation conditions on biomass growth and quantitative content of mesophilic lactobacilli and yeast that do not ferment lactose
После окончания процесса культивирования сливают верхний слой отделившейся сыворотки, оставшуюся биомассу охлаждают до температуры (5±3)°С и центрифугируют при частоте оборотов 3500 об/с продолжительно- стью 15 минут. Таким образом, суспензию клеток отделяют от культуральной жидкости с целью получения жидкого бактериального концентрата. Качественные показатели жидкого бактериального концентрата представлены в таблице 2.
Таблица 2.
Качественная характеристика бактериального концентрата
Table 2.
Qualitative characteristics of bacterial concentrate
|
Показатель | Indicator |
Характеристика | Characteristic |
|
Консистенция и внешний вид | Consistency and appearance |
Однородная, допускается отделение сыворотки |
|
Цвет | Colour |
От белого до светло-желтого |
|
Активная кислотность, рН | Active acidity, pH |
5,5–7,0 |
|
Количество мезофильных лактобактерий, к.о.е./см3, не менее The number of mesophilic lactobacilli, K.F.U./cm3, not less |
1×1010 |
|
Количество дрожжей, не сбраживающих лактозу, к.о.е./см3, не менее The amount of yeast that does not ferment lactose, K.F.U./cm3, not less |
1×1010 |
|
Объем продукта (см3), в котором не допускается The volume of the product (cm3) in which it is not allowed: – БГКП (коли-формы) | BGKP (coliforms) – S. aureus – патогенные микроорганизмы | pathogenic microorganisms (в том числе сальмонеллы) | (including salmonella) |
10 10 50 |
|
Плесени, к.о.е./см3, не более | Mold, K.F.U./cm3, no more |
10 |
Данные, представленные в таблице 2, показывают, что бактериальный концентрат характеризуется высоким титром жизнеспособных клеток мезофильных лактобактерий и дрожжей, не сбраживающих лактозу.
Анализ литературных данных показывает, что как слишком раннее, так и слишком позднее отделение клеток отрицательно сказывается на жизнеспособности микроорганизмов, а также на активности бактериальных концен- тратов. Большинство исследователей рекомендуют отделять клетки молочнокислых бактерий в конце логарифмической фазы или перед началом стационарной фазы [11].
Использование сухих заквасок позволяет исключить сложные этапы приготовления и поддержания живой закваски, требующие контроля многочисленных параметров и специального оборудования, а также обеспечивает вкус и аромат, свойственные длительному холодному брожению [12].
Нами изучена возможность создания сухой закваски на основе мучного полуфабриката с использованием жидкого концентрата симбиотической закваски, включающий консорциум лактобактерий и дрожжей.
Основные требования, предъявляемые к сухим закваскам – это сохранение в них после сушки большого количества жизнеспособных клеток дрожжей и молочнокислых бактерий, обеспечивающих активное кислотонакопление и хорошую подъемную силу. На следующем этапе были уточнены и выбраны оптимальные технологические параметры подготовки закваски перед сушкой, способствующие интенсивному развитию микрофлоры и максимальному накоплению микробных клеток.
Симбиотическую закваску культивировали на заварке из ржаной муки, затем смешивали с мукой до влажности (28–30)% и доводили кислотность до (35–38)°Н.
Характеристика ржаной закваски представлена в таблице 3.
Важное значение для получения активной сухой закваски имеет способ сушки. Необходимо отметить, что ржаные закваски – сложная биологическая система, состоящая из микробов разных классов: прокариотов и эукариотов; и для каждого вида микроорганизмов необходимо подобрать определенный режим высушивания.
Нами был выбран метод сушки на ИК-установке при температуре (37–40)°C с интенсивным вентилированием. Высушивание проводили до влажности биоматериала 6–8%. Сухую биомассу после сушки измельчали на коллоидной мельнице до порошкообразного состояния.
В дальнейшем исследовали биохимическую активность сухой закваски (таблица 4).
Таблица 3.
Физико-химические и микробиологические показатели закваски перед сушкой
Table 3.
Physico-chemical and microbiological parameters of the starter before drying
|
Показатель Indicator |
Характеристика Characteristic |
|
Массовая доля влаги, %, не более | Mass fraction of moisture, % |
28±2 |
|
Кислотность, °Н | Acidity after fermentation, °N |
38±1 |
|
Подъемная сила, мин. | Lifting force, min |
20±2 |
|
Количество мезофильных лактобактерий, к.о.е. в 1 см3 | Amount of mesophilic lactobacilli, K.F.U./cm3 |
8×1010 |
|
Количество дрожжей, не сбраживающих лактозу, к.о.е. в 1 см3 | Amount of not ferment lactose yeast K.F.U./cm3 |
4×1010 |
Таблица 4.
Физико-химические и микробиологические показатели сухой симбиотической закваски
Table 4.
Physico-chemical and microbiological parameters of dry symbiotic starter culture
|
Показатель Indicator |
Характеристика Characteristic |
|
Массовая доля влаги, %, не более | Mass fraction of moisture, % |
7±1 |
|
Кислотность, °Н | Acidity after fermentation, °N |
12 |
|
Подъемная сила, мин. | Lifting force, min |
15–18 |
|
Количество мезофильных лактобактерий, к.о.е. в 1 см3 | Amount of mesophilic lactobacilli, K.F.U./cm3 |
5×109 |
|
Количество дрожжей, не сбраживающих лактозу, к.о.е. в 1 см3 | Amount of not ferment lactose yeast K.F.U./cm3 |
3×108 |
Данные, представленные в таблице 4, свидетельствуют, что сушка на ИК-установке обеспечивает хорошую выживаемость мезофильных лактобактерий и дрожжей. Вероятно, это обусловлено симбиотическими взаимоотношениями мезофильных лактобактерий и дрожжей, что способствует выживаемости последних. Кроме того, высокомолекулярные полисахариды и слизи, содержащиеся в ржаной муке, оказывают защитное действие на микроорганизмы при сушке.
Заключение
Проведенные исследования показали возможность получения активной сухой закваски на основе использования концентрата симбиотической закваски из мучного полуфабриката, содержащего одновременно дрожжи и молочнокислые бактерии.
Созданы условия для роста мезофильных лактобактерий и дрожжей, не сбраживающих лактозу, характерной для бродильной микрофлоры, используемой в хлебопекарном производстве. Готовый сухая бактериальная закваска из ржаной муки представляет собой сыпучий биопродукт приятного кисломолочного вкуса и запаха, свойственного запаху биологической ржаной закваски, и высокое количество жизнеспособных клеток мезофильных лактобактерий и дрожжей.
Поэтому сухую закваску можно использовать для производства ржаной закваски на производстве, минуя стадию разводочного цикла. Расход концентрата симбиотической закваски на мучном полуфабрикате благодаря ее высокой кислотности составляет 5% к массе муки ржаной закваски.
Использование при производстве ржаного хлеба концентрата симбиотической закваски улучшает его качественные характеристики: вкус, аромат, окраску корки, сроки хранения. Это объясняется стабильным составом и высокой биохимической активностью микрофлоры концентрата.
Список литературы Совершенствование биотехнологии симбиотического бактериального концентрата
- Тихонов И.В., Рубан Е.А., Грязнева Т.Н., Самуйленко А.Я. и др. Биотехнология; под ред. акад. РАСХН Е.С. Воронина. СПб.: ГИОРД, 2005. 792 с.
- Нагызбеккызы Э. и др. Подбор оптимальных параметров культивирования штаммов молочнокислых бактерий, перспективных в качестве стартерных культур при разработке закваски прямого внесения // Международный журнал прикладных и фундаментальных исследований. 2019. № 7. С. 14-18.
- Волкова Г.С., Куксова Е.В., Серба Е.М. Изучение биологических межштаммовых взаимодействий и ростовых свойств производственных штаммов молочнокислых бактерий // Актуальные вопросы молочной промышленности, межотраслевые технологии и системы управления качеством. 2020. Т. 1. № 1(1). С. 104-109.
- Ковалевская В.С. и др. Изучение биосовместимости и биотехнологических свойств молочнокислых бактерий // Научные труды Кубанского государственного технологического университета. 2016. № 14. С. 284-288.
- Малкова А.В., Иркитова А.Н., Дудник Д.Е. Биосовместимость штаммов бацилл, перспективных для включения в состав микробного биопрепарата // Вестник биотехнологии и физико-химической биологии имени Ю.А. Овчинникова. 2022. Т. 18. № 2. С. 19-24.
- Занданова Т.Н., Гоголева П.А. Подбор питательной среды для получения бактериального концентрата микробного консорциума // Вестник КрасГАУ. 2018. №5 (140).
- Шелубкова Н.С. и др. Оптимизация параметров замеса макаронного теста из композитной муки // Вестник Красноярского государственного аграрного университета. 2018. №. 5 (140). С. 232-239.
- De Vuyst L., Van Kerrebroeck S., Leroy F. Microbial ecology and process technology of sourdough fermentation // Adv. Appl. Microbiol. 2017. V. 100. P. 49-160. https://doi.org/10.1016/bs.aambs. 2017.02.003
- Акулич А.В., Самуйленко Т.Д. Анализ производственного цикла заварочных отделений хлебопекарных предприятий Республики Беларусь // Хранение и переработка сельхозсырья. 2020. V. 4. P. 128-138. https://doi.org/10.36107/spfp.2019.208
- Бояринева И.В., Хамагаева И.С. Исследование условий культивирования микрофлоры симбиотической закваски для хлебопекарного производства // Вестник ВСГТУ. 2015. № 2. С. 74-80.
- Morgan C.A., Herman N., White P.A., Vesey Morgan G. Preservation of microorganisms by drying // Journal of Microbiological Methods. 2006. V. 66 (2). P.183-193. https://doi.org/10.1016/j.mimet.2006.02.017
- Шилина А.А., Игонина Е.Д. Влияние вида закваски на скорость размножения микроорганизмов и эффективность в производственных условиях // Балтийский морской форум: материалы VIII Международного Балтийского морского форума: в 6 т., Калининград, 05-10 октября 2020 года. Калининград: Калининградский государственный технический университет, 2020. С. 138-142.
- Bastías D.A., Johnson L.J., Card S.D. Symbiotic bacteria of plant-associated fungi: friends or foes? // Current opinion in plant biology. 2020. V. 56. P. 1-8.
- Rai A.N. CRC Handbook of symbiotic cyanobacteria. CRC Press, 2018.
- Checcucci A. et al. Creation and characterization of a genomically hybrid strain in the nitrogen-fixing symbiotic bacterium Sinorhizobium meliloti // ACS Synthetic Biology. 2018. V. 7. №. 10. P. 2365-2378.
- Krishnan M. et al. Insect gut microbiome-An unexploited reserve for biotechnological application // Asian Pacific journal of tropical biomedicine. 2014. V. 4. P. S16-S21. https://doi.org/10.12980/APJTB.4.2014C95
- Bonnet S.I. et al. The tick microbiome: why non-pathogenic microorganisms matter in tick biology and pathogen transmission // Frontiers in cellular and infection microbiology. 2017. V. 7. P. 236. https://doi.org/10.3389/fcimb.2017.00236
- Shi Y.M. et al. Global analysis of biosynthetic gene clusters reveals conserved and unique natural products in entomopathogenic nematode-symbiotic bacteria // Nature Chemistry. 2022. V. 14. №. 6. P. 701-712. https://doi.org/10.1038/s41557-022-00923-2
- Vigneron A., Masson F., Vallier A., Balmand S. et al. Insects recycle endosymbionts when the benefit is over // Current Biology. 2014. V. 24. №. 19. P. 2267-2273. https://doi.org/10.1016/j.cub.2014.07.065
- Calcott M.J. Ackerley D.F., Knight A., Keyzers R.A. et al. Secondary metabolism in the lichen symbiosis // Chemical Society Reviews. 2018. V. 47. №. 5. P. 1730-1760. https://doi.org/10.1039/C7CS00431A


