Совершенствование методов контроля процессов коррозии на объектах машиностроения при высоких параметрах водных теплоносителей
Автор: Щербаков В.Н.
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
Введение. Цель работы — повышение надёжности методов прогнозирования поведения гидроксида лития в пароводяном тракте на ТЭС и АЭС и оперативного контроля водородного показателя паровых растворов. Разработан метод оперативного контроля на основе кондуктометрических измерений водородного показателя паровых растворов ингибитора коррозии конструкционных материалов гидроксида лития, применяемого на ТЭС и АЭС.Материалы и методы. Для практической реализации высокотемпературного оперативного контроля водородного показателя паровых растворов использован метод математического моделирования.Результаты исследования. Разработан метод контроля водородного показателя паровых растворов гидроксида лития, основанный на определении концентрации в паре путём конденсации пара в охлаждаемом кондуктометрическом датчике, размещённом в паровом пространстве парогенератора, что позволило значительно повысить точность определения концентрации гидроксида лития. Предложены уравнения, описывающие изменение предельной молярной эквивалентной электропроводности и констант диссоциации гидроксида лития в широком диапазоне изменения параметров состояния...
Машиностроение, коррозионные процессы, автоматический контроль, паровая фаза, кондуктометрические методы, мониторинг
Короткий адрес: https://sciup.org/142217055
IDR: 142217055 | DOI: 10.23947/1992-5980-2018-18-4-414-420
Текст научной статьи Совершенствование методов контроля процессов коррозии на объектах машиностроения при высоких параметрах водных теплоносителей
1Don State Technical University, Rostov-on-Don, Russian Federation
∗
Работа выполнена в рамках инициативной НИР.
∗∗∗ The research is done within the frame of independent R&D.
Образец для цитирования: Щербаков, В. Н. Совершенствование методов контроля процессов коррозии на объектах машиностроения при высоких параметрах водных теплоносителей / В. Н. Щербаков // Вестник Дон. гос. техн. ун-та. ― 2018. ― Т. 18, № 4. ― С. 414-420.
Введение . При организации и ведении водно-химических режимов (ВХР) на ТЭС и АЭС одной из главных задач является сведение к минимуму коррозионных повреждений теплосилового оборудования в зоне контакта с водой и паром [1]. Дозирование в питательную воду LiOH в необходимых количествах обеспечивает создание на поверхности металла прочной защитной литий-ферритной плёнки, замедляющей коррозию и коррозионное растрескивание теплообменных труб парогенераторов АЭС с ВВЭР–1000 [2, 3], а также значительное увеличение времени наработки оборудования на отказ [3]. При дозировании LiOH в питательную воду барабанных котлов ТГ–104 на ТЭС также наблюдается формирование защитной литий-ферритной плёнки [4]. На АЭС LiOH применяют в России и за рубежом [4–6]. В перспективных атомных реакторах IV поколения SCWR ( supercritical water-cooled reactor ), обеспечивающих увеличение термического КПД по сравнению с существующими ( PWR ) c 33 до 44 %, при давлении Р =25 МПа температуру Т водяного пара планируют увеличить до 953 K [6]. Для создания на ТЭС и АЭС оперативного контроля значений рН водных и паровых растворов LiOH , определяющих эффективность защиты от коррозии, необходимы данные о предельной эквивалентной электропроводности Ʌ о и константах диссоциации K d LiOH при высоких Р и Т , представленные в виде, удобном для практических расчётов. Методика расчёта рН растворов LiOH на основании данных об удельной электропроводности χ, предложенная авторами для жидкой фазы [7], неприемлема для паровой фазы при малых значениях плотности ρ и концентрации С в связи с высокой погрешностью определения χ и K d [8].
Целью настоящей работы является повышение надёжности методов прогнозирования поведения LiOH в пароводяном тракте на ТЭС и АЭС и оперативного контроля рН паровых растворов.
Для достижения поставленной цели созданы уравнения для расчёта Ʌо и K d на линии насыщения и в перегретом паре при Т до 773,15 K, а также разработана методика оперативного контроля рН паровых растворов LiOH .
Материалы и методы . По сравнению с традиционным контролем, связанным с отбором и охлаждением проб, оперативный контроль рН при помощи кондуктометрических датчиков, установленных в теплоносителе парогенераторов и работающих при Т и Р , близких к рабочим, является более объективным и практически безынерционным [7, 8]. В расчётах рН для жидкой фазы в [7] были использованы экспериментальные данные о K d LiOH [8], ионном произведении K w [9], и диэлектрической проницаемости ε для воды [10]. Определение концентрации С водных растворов LiOH осуществлялось на основании зависимостей С LiOH = f (χ LiOH ) T=Const , полученных на основании экспериментальных данных о χ растворов.
При измерении χ растворов в паровой фазе (особенно при малых ρ и С ), когда полярные свойства растворителя ослаблены, степень диссоциации LiOH мала и сопротивление межэлектродного пространства измерительной ячейки кондуктометрического преобразовател я может стать соизмеримым с сопротивлением электрического изолятора, что приведёт к большим погрешностям определения χ [8].
Машиностроение и машиноведение
Для практической реализации высокотемпературного оперативного контроля рН необходимые данные о Ʌ о и K d могут быть получены в исследуемом диапазоне изменения параметров состояния методом математического моделирования и представлены в виде уравнений.
Результаты исследования . На основании анализа существующих методов в данной работе предложен метод контроля рН паровых растворов LiOH , основанный на определении C LiOH в паре путём конденсации пара в кондуктометрическом датчике с охлаждаемым капилляром [11], размещённом в паровом пространстве парогенератора в потоке теплоносителя. В этом случае С LiOH в паре равна С LiOH в конденсате пара и может быть определена из зависимостей С LiOH = f (χ LiOH ) T=Const , полученных для жидкой фазы [7]. Конденсация пара позволяет значительно повысить точность определения χ и С [8]. Вычисления рН для парорастворов LiOH производились по методике, описанной в [12], с использованием данных [8] о K d .
С целью оценки эффективности применения LiOH для защиты от коррозии в атомных реакторах IV поколения SCWR авторами [6] на основании экспериментальных данных о K d [13–15] выполнен расчёт рН водных и паровых растворов LiOH при Р =25 МПа в широком диапазоне изменения ρ, Т , С и предложено эмпирическое уравнение для вычисления моляльной константы ассоциации K a [16] в диапазоне изменения ρ от 50 до 1000 кг/м 3 и Т от 373 до 873 K :
log10Ka = а1 + а2/τ + + (а3 + а4/τ)∙log10δ + (а5 + а6/τ)∙(logδ)2, где δ=ρ/ρс; τ=T/Tс; ρс, Tc — плотность и температура раствора в критической точке; а1, а2, а3, а4, а5, а6 — константы.
В перегретом паре с уменьшением ρ и Т K d LiOH уменьшается, уменьшается и разность между pH H 2 O и pH парорастворов LiOH , что снижает эффективность защиты от коррозии элементов конструкций при высоких Р и Т . Авторами вычислены значения рН парорастворов LiOH при Р =25 Мпа ; Т =673, 723 и 773 K для С =10–6, 10– 5 , 10– 4 , 10– 3 и 10– 2 моль/кг. В расчётах были использованы экспериментальные данные о K d LiOH [8], ионном произведении K w [9], и диэлектрической проницаемости воды ε [10]. На рис. 1 представлена зависимость рН водных и паровых растворов LiOH от ρ при Р =25 МПа для С =10– 6 –10 2 , моль/кг.
В области ρ<330 кг/м 3 авторы [13–15] не выполняли экспериментальные исследования, поэтому на рисунке представлены только результаты расчёта рН LiOH с использованием данных о K d LiOH , полученных по уравнению авторов [16 ].
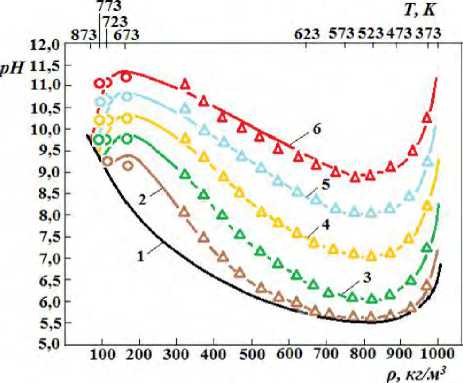
Рис.1. Зависимость рН водных и паровых растворов LiOH от плотности ρ при Р =25 МПа : 1 — Н 2 О ; 2, 3, 4, 5, 6 — С LiOH =10 – 6, 10 – 5, 10 – 4, 10 – 3, 10 – 2 моль/кг;
Δ,○ — расчёт рН по данным о K d [13–15] и [8];
линии 2, 3, 4, 5, 6 — расчёт рН по данным о K d , полученным из уравнения [16]
Полученные авторами ранее на основании измерений электропроводности высокотемпературных растворов LiOH , значения Ʌ о и K d [8], необходимые для создания уравнений, описывающих изменение Ʌ о и K d при изменении ρ и Т , приведены в таблицах 1 и 2 в сопоставлении с данными других авторов. Для создания уравнений, описывающих поведение Ʌо на линии насыщения, с целью уменьшения погрешности аппроксимации данных диапазон изменения ρ был разбит на 2 части (от 100 до 500 и от 500 до 958 кг/м 3 ), для каждой из которых предложено уравнение вида:
Ʌо=bо∙ρ3 + b1∙ρ2 + b2∙ρ + b3, где bо, b1, b2, b3 — определяемые константы; ρ — плотность раствора, кг/м3. Значения bо, b1, b2, b3 для ρ=(100– 500) и (500–958) кг/м3 равны –0,000004; 0,005878; –2,810820; 1942,943226 и –1,25711∙10–5; 0,024177411; – 16,58559801; 5334,222549 соответственно. Для значений рKd=–log10 Kd вычислены значения коэффициентов d1–d6 в уравнении, аналогичном представленному в [16] и приведённому выше:
рKd=d1+ d2/τ + (d3 + d4/τ)∙log10δ + (d5 + d6/τ)∙(logδ)2, где δ=ρ/ρс; τ=T/Tс; ρс, Tc — плотность и температура раствора в критической точке; d1, d2, d3, d4, d5, d6 — константы.
При вычислении констант d 1 – d 6 были использованы полученные авторами ранее экспериментальные данные о K d [8]. На линии насыщения авторы учитывали только свои экспериментальные данные. Расчёты для перегретого пара при Т =673,15 и 773,15 K выполнены в двух вариантах: в первом рассматривались только авторские данные о K d [8], во втором — все данные, приведённые в табл. 2.
Таблица 1
Зависимость предельной молярной электропроводности Ло LiOH от плотности р на линии насыщения и в перегретом паре
|
р, кг/м3 |
Ло^10, См^м2/кмоль |
||
|
Линия насыщения |
Т = 673 K |
T = 773 K |
|
|
100 |
1710[8] |
1675[8] |
1665[8] |
|
130 |
1675[8] |
1630[8] |
1620[8] |
|
160 |
1630[8] |
1590[8] |
1575[8] |
|
200 |
1575[8] |
1550[8] |
1545[8] |
|
300 |
1510[8] |
1480[8] |
1475[8] |
|
400 |
1475[8] |
1460[8]; 1392[13] |
1455[8] |
|
433 |
1452[15] |
||
|
500 |
1450[8] |
1435[8]; 1539[13] |
1428[8]; 1574[13] |
|
600 |
1370[8] |
1380[8]; 1355[13] |
1388[8]; 1377[13] |
|
621 |
1277[15] (Р = 23,86 МПа) |
- |
- |
|
700 |
1265[8] |
1275[8]; 1270[13] |
1276[13] |
|
714 |
1189[15] (Р = 9,52 МПа) |
- |
- |
|
800 |
1100[8] |
1088[13] |
1109[13] |
|
871 |
1017[15] (Р = 9,91МПа) |
- |
- |
|
917 |
780[8] |
- |
- |
|
922 |
754[15] (Р = 9,4 МПа) |
- |
- |
|
950 |
594[13] |
- |
- |
|
958 |
573[8] |
- |
- |
Для линии насыщения: d 1 =119,50984; d 2=-115,33347; d 3=-174,20233; d 4 =167,90533; d 5=-143,78368; d 6 =183,09356.
Для первого варианта расчёта для перегретого пара: d 1 =7,6323975; d 2=-3,214114; d 3=-10,9289; d 4 =2,5463453; d 5=-10,34132; d 6 =15,190972; для второго варианта расчёта d 1 =10,113404; d 2=-6,133638; d 3=-17,85984; d 4 =8,888042; d 5 =-8,405401; d 6 =14,648395.
Отклонения в % экспериментальных значений Ло и pK d от вычисленных по предложенным уравнениям представлены в табл. 3.
Таблица 2
Зависимость отрицательного логарифма констант диссоциации LiOH рК d от плотности р на линии насыщения и в перегретом паре
|
р, кг/м3 |
p K d , моль/кг |
||
|
Линия насыщения |
T = 673,15 K |
Т = 773,15 K |
|
|
100 |
10,04[8] |
10,07[8]; 11,06 [16] |
10,16[8]; 13,34[16] |
|
130 |
8,41[8] |
8,56[8] |
8,67[8] |
|
160 |
7,24[8] |
7,32[8] |
7,69[8] |
|
200 |
6,25[8] |
6,42[8]; 6,45[16] |
6,89[8]; 8,16[16] |
|
300 |
4,40[8] |
4,69[8]; 4,13[16] |
5,20[8]; 5,64[16] |
|
379 |
3,48[15] |
||
|
400 |
3,86[8] |
3,98[8]; 2,82[16]; 3,14[13] |
4,31[8]; 4,01[16] |
|
433 |
3,1[15] |
||
|
500 |
3,28[8] |
3,38[8]; 2,81[13] |
3,43[8]; 3,15[13] |
|
600 |
2,52[8]; |
2,45[8]; 2,32[13]; 1,26[16] |
2,58[8]; 2,43[13]; 1,97[16] |
|
650 |
2,13[13] |
2,25[13] |
|
|
700 |
2,08[8]; |
2,01[8]; 1,83[13] |
2,07[13] |
|
712 |
1,59[17] |
||
|
750 |
1,82[13] |
1,89[13] |
|
|
800 |
1,63[13]; 0,343[16] |
1,65[13]; 0,753[16] |
|
|
807 |
1,41[15] ( Р = 11.02 МПа ) |
- |
- |
|
922 |
1,29[15] ( Р = 9,4 МПа ) |
- |
- |
|
961 |
1,03[15] ( Р = 4,88 МПа ) |
- |
- |
Машиностроение и машиноведение
Таблица 3
Отклонение (в %) экспериментальных значений предельной эквивалентной электропроводности (6Ло) и отрицательного логарифма моляльных констант диссоциации (б рК d ) от значений, вычисленных по уравнениям
ρ, кг/м3 бЛо брК Линия насыщения Линия насыщения T=673,15 K 1 вариант расчёта T=773,15 K 1вариант расчёта T=673,15 K 2 вариант расчёта T=773,15 K 2 вариант расчёта 100 0,36[8] 0,04[8] 1,20[8] 1,36[8] 3,40[8]; 5,86 [16] 10,9[8]; 15,5[16] 130 0,47[8] 0,23[8] 0,18[8] 1,22[8] 2,42[8] 11,7[8] 160 0,28[8] 0,33[8] 2,62[8] 1,86[8] 3,42 [8] 10,5[8] 200 0,34[8] 0,11[8] 0,92[8] 0,39[8] 0,52[8]; 0,98[16] 5,95[8]; 10,5[16] 300 0,09[8] 2,50[8] 0,29[8] 3,86[8]; 9,17[16] 1,99[8]; 5,96[16] 379 3,05[15] 400 0,03[8] 0,12[8] 4,99[8] 4,07[8] 14,8[8]; 20,2[16]; 7,96[13] 6,44[8]; 0,56[16]; 433 0,41[15] 500 0,09[8] 0,16[8] 8,95[8] 2,40[8] 21,77[8]; 5,90[13] 8,78[8]; 0,67[13] 600 0,10[8] 0,17[8] 4,56[8] 6,11[8] 13,72[8]; 8,89[13]; 67,8[16] 5,24[8]; 0,60[13]; 24,1[16] 650 - - - - 10,6[13] 4,02[13] 700 0,44[8] 0,05[8] 7,82[8] - 14,38[8]; 5,95[13] 8,03[13] 750 - - - 14,2[13] 11,5[13] 800 0,26[8] - - - 12,8[13] 11,3[13] 917 2,27[8] - - - - - 958 1,51[8] - - - - -
Обсуждение и заключения. Как очевидно из рис. 1, полученные авторами значения рН LiOH при Т =673 K ниже по сравнению с полученными путём расчёта [6] в среднем на 0,2; при Т =723 К выше на 0,1-0,2; при Т =773 K выше на 0,1-0,7 единиц рН .
Таким образом, величина рассогласования данных о рН LiOH в перегретом паре, полученных авторами и изложенных в [6], возрастает с увеличением Т и С . Такое рассогласование можно считать удовлетворительным, если учесть, что с уменьшением р до 200-100 кг/м3 погрешность экспериментальных данных [8] о K d LiOH возрастает до 180 % и, кроме того, при составлении уравнения авторами [6] не использовались экспериментальные данные о K d при р<330 кг/м3.
Отклонение экспериментальных значений Ло и рKd от вычисленных по предложенным в настоящей работе уравнениям на линии насыщения не превышает 1 % и только при р=917 и р=958 кг/м3 достигает 2,27 и 1,51 % для Ло (табл. 3). В перегретом паре при Т=673,15 и Т=773,15 K для первого варианта расчёта с использованием только авторских экспериментальных данных о Kd [8] наибольшее отклонение экспериментальных дан- ных рKd от расчётных не превышает 2,5 % при ρ=100–300 кг/м3 и возрастает до 8,95 % с увеличением ρ до 400– 700 кг/м3. Для второго варианта расчёта с учётом данных всех авторов, представленных в табл. 2, наибольшая погрешность расчёта по уравнению при ρ=100–300 кг/м3 и Т=673,15 K; Т=773,15 K достигает 15,5 % для данных авторов [16], а при ρ=100–300 кг/м3 и Т=673,15 K; Т=773,15 K — 67,8 %.
На основании анализа полученных результатов можно сделать вывод о том, что использование LiOH в качестве корректирующей добавки для регулирования рН с целью предотвращения коррозионного разрушения элементов конструкций перспективных атомных реакторов IV поколения SCVR не вызывает затруднений при Т ≤673,15 K и Р =25 МПа . С ростом температуры уже при Т =773,15 K для эффективной защиты от коррозии необходимо увеличивать С LiOH до 10– 2 моль/кг, что выдвигает задачу исследования растворимости LiOH в паре при этих параметрах состояния.
Предложенные в настоящей работе метод оперативного контроля рН паровых растворов LiOH и математические модели для расчёта Ʌ о и K d обеспечивают возможность определения рН при помощи измерительновычислительного комплекса, работающего непрерывно в автоматическом режиме, имеющего малое время запаздывания сигнала и обеспечивающего приемлемую для практических расчётов погрешность результатов измерения. Использование таких устройств в современных системах химико-технологического мониторинга на ТЭС и АЭС позволит значительно повысить надёжность методов прогнозирования поведения LiOH в пароводяном тракте и оперативного контроля рН .
Список литературы Совершенствование методов контроля процессов коррозии на объектах машиностроения при высоких параметрах водных теплоносителей
- Воронов, В. Н. Водно-химические режимы ТЭС и АЭС/В. Н. Воронов, Т. И. Петрова. -Москва: Издательский дом МЭИ, 2009. -238 с.
- Горбатых, В. П. Перспективы использования гидроксида лития в контурах АЭС с ВВЭР/В. П. Горбатых, С. О. Иванов//Вестник Моск. энерг. ин-та. -2007. -№ 1. -С. 14-28.
- Горбатых, В. П. О возможности применения гидроксида лития на различных этапах жизненного цикла парогенераторов АЭС с ВВЭР/В. П. Горбатых, С. О. Иванов//Вестник Моск. энерг. ин-та. -2011. -№ 2. -С. 10-14.
- Беляков, И. И. Исследование причин повреждения экранных труб барабанных котлов на литиевом водном режиме/И. И. Беляков, А. Ф. Белоконова, А. В. Михайлова//Электрические станции. -1980. -№ 6. -С. 30-34.
- Совершенствование водно-химического режима второго контура на Калининской АЭС/С. П. Горбатенко//Теплоэнергетика. -2001. -№ 1. -С. 22-28.
- Carvajal-Ortiz R.A., Plugatyr A., Svishchev I.M. On the pH control at supercritical water-cooled reactor operating conditions//Nuclear Engineering and Design. 2012. -V. 248. -P. 340-342.
- Shcherbakov V.N., Lukashov Yu.Yu, Lukashov Yu.M. Electrolytical properties of solution of lithium hydroxide at high temperatures and pressures//Thermal Engineering. 2013. -V. 60. No. 4. -P. 280-284.
- Щербаков, В. Н. Исследование электрофизических свойств водных теплоносителей при высоких параметрах: дис. … канд. техн. наук/В. Н. Щербаков. -Москва, 1980. -204 с.
- Bandura A.V., Lvov S.N. The ionization constant of water over wide ranges of temperature and density//Journal of Physical and Chemical Reference Data. 2006. -V. 35. No.1. P. 15-30.
- Александров, А. А. Теплофизические свойства рабочих веществ теплоэнергетики./А. А. Александров, К. А. Орлов, В. Ф. Очков. -Москва: Издательский дом МЭИ, 2009. -225 с.
- Кондуктометрический датчик: авторское свидетельство 958943 СССР: G01N 27/02/Д. Л. Тимрот. -№ 3248961; заявл. 16.02.81; опубл. 15.09.82, Бюл. № 34. -3 с.
- Дамаскин, Б. Б. Электрохимия/Б. Б. Дамаскин, О. А. Петрий, Г. А. Цирлина. -Москва: Химия, 2006. -672 с.
- Ho P.C., Palmer D.A. Determination of ion association in dilute aqueous lithium chloride and lithium hydroxide solutions to 600C and 300 MPa by electrical conductance measurements//Journal of Chemical and Engineering Data. 1998. -V. 43. No.2. P. 162-170.
- Ho P.C., Bianchi H., Palmer D.A., Wood R.H. Conductivity of dilute aqueous electrolyte solutions at high temperatures and pressures using a flow cell//Journal of Solution Chemistry 2000. -V. 29. No.2. P. 217-235.
- Ho P.C., Palmer D.A., Wood R.H. Conductivity measurements of dilute aqueous LiOH, NaOH and KOH solutions to high temperatures and pressures using a flow-through cell//Journal of Physical Chemistry B. 2000. -V. 104. No.50. P. 12084-12089.
- Plugatyr A., Carvajal-Ortiz R.A., Svishchev I.M. Ion-pair association constant for LiOH in supercritical water//Journal of Chemical and Engineering Data. -V. 56. No.9. P. 3637-3642.
- Взаимосвязь между коэффициентами распределения примесей котловой воды и константами диссоциации/Г. В. Василенко//Теплоэнергетика. -1995. -№ 7. -С. 64-67.


