Совершенствование технологии получения хитозана
Автор: Лябин Михаил Павлович, Семенов Павел Сергеевич
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 2 (2), 2011 года.
Бесплатный доступ
Основные применения хитозана. Возможность получения биополимера нового «мягкого» способа.
Хитин, хитозан, медицина, биотехнология, биоинженерия, получение, деацетилирование
Короткий адрес: https://sciup.org/14967526
IDR: 14967526 | УДК: 663/66
Текст научной статьи Совершенствование технологии получения хитозана
Хитозан – вещество ХХI в., природный полисахарид, находящий широкое применение в различных областях народного хозяйства. Если в 1994 г. в мире производилось только 1 000 т хитозана, из которых 800 т – в Японии, то сегодня мировой оборот его производства составляет 150–200 тыс. т в год. Лидерами в производстве хитозана являются такие страны, как Китай, Малайзия, Польша и США.
Исследованиями хитозана занимаются более чем в 15 странах, и в настоящее время известно более 70 направлений его практического применения, наиболее важными из которых во всем мире признаны:
Помимо перечисленного, хитозан используют при изготовлении ткани [2; 4] для нижнего белья и носков, а в фотографических процессах, связанных с быстрым проявлением изображения, применяют такие важные характеристики хитозана, как его пленкообразующие свойства, поведение в системах, содержащих желатин и комплексы серебра, обеспечивающее отсутствие поперечной (в слоях пленки) диффузии красителя, оптические характеристики полимера.
Весьма перспективно использование хитозана в бумажной промышленности: благодаря большей прочности при водных обработках ионных связей, образующихся при нанесении хитозана на целлюлозное волокно при формировании бумаги, по сравнению с существующими в обычной бумаге водородными связями, заметно возрастает прочность бумажного листа, особенно в мокром состоянии. При этом одновременно улучшаются и другие важные свойства – сопротивление продавливанию, излому, стабильность изображения.
Такие неоспоримые достоинства хитозана, как биосовместимость с альгинатами, фосфатами, в частности глицерофосфатом натрия, гиалоурановой кислотой, кальцием, физиологическая активность при отсутствии токсичности, совершенная безопасность для человека и экологическая чистота (биодеструкция), низкая иммуногенность, способность к пленко-, волокно- и гелеобразованию, высокая сорбционная емкость, умеренная цитостатическая активность в отношении бактерий, грибов и атипичных клеток, позволяют широко использовать его в биоинженерии для моделирования различный тканей, в том числе и хрящевой [9; 10; 14].
Как известно, основным источником при промышленном получении хитозана служит хитин, являющийся основой наружного скелета ракообразных, кутикулы насекомых, клеточной стенки грибов и некоторых бактерий.
По химической структуре хитин является линейным аминополисахаридом, цепь которого состоит из N-ацетил-2-амино-2-дезо-киси-D-гликопиранозных звеньев [3] (рис. 1).
Хитин как нерастворимый полимер не поддается выделению из панциря напрямую. Для его получения необходимо последовательное полное, комплексное удаление белковой и
H
O
CH 3 CO
I ..
NH

O
CH 2 OH
CH OH
O
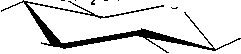
HO
NH CO CH 3
Рис. 1. Структурная формула хитина
минеральной составляющих панциря. В настоящее время известно несколько способов, относящихся к химической группе извлечения хитина из панцирьсодержащего сырья. В большинстве этих способов операции депротеинизации и деминерализации включают обработку измельченных панцирей растворами соляной кислоты и едкого натра с последующей промывкой водой. После этого проводится удаление с помощью отбеливающих реагентов красящих пигментов и промывка спиртом и эфиром липофильных веществ. К основным недостаткам большинства способов извлечения хитина относится необходимость использования специального, коррозионно-стойкого дорогостоящего (предпочтительно изготовленного из титана) оборудования, использование больших объемов подготовленной воды для отмывки сырья, применение в технологической схеме и последующая утилизация отработанной едкой щелочи и органических растворителей. Помимо вышеперечисленного, традиционные методы очистки хитина уже на ранних стадиях обработки сырья приводят к разрушению полимерных цепей, что ограничивает области его использования, особенно в качестве биоинженерного компонента.
Хорошо известно, что основным масштабным источником панцирьсодержащего сырья являются камчатские крабы. Принимая во внимание ценность, уникальность и широкую сферу практического использования этого продукта, представляется актуальным изыскание иных доступных сырьевых ресурсов.
Учитывая вышесказанное, предложено извлекать хитозан из доступного сырья панцирей ракообразных рода Pandalus с использованием модифицированной нами схемы, применяемой ранее для плесневых грибов рода Aspergillum.
Мягкие щадящие условия предложенного метода позволяют использовать реакторы для неагрессивных и слабоагрессивных сред, а также исключают необходимость дополнительной очистки сточных вод. Вывод из цикла органических растворителей способствует повышению пожарной безопасности и снижению токсичности процесса.
Для лучшего сохранения нативной структуры биополимера строго соблюдалось поддержание оптимального температурного режима на стадии депротеинирования не более 70 °C, на стадии деминерализации не более 20 °C. Как показал опыт, наиболее предпочтительно – 4 °C, но это ведет к значительному увеличению продолжительности процесса.
Так как практически нерастворимый хитин не нашел широкого применения в какой-либо отрасли промышленности, наибольший практический интерес представляет его производное – хитозан, хорошо растворимый в разбавленных органических кислотах, в частности в водном растворе уксусной кислоты.
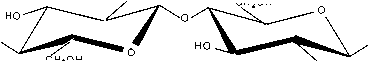
Хитозан (II) является β -(1–4)-2-амино-2дезокси-D-гликополисахаридом, содержащим, как правило, 5–15 % ацетамидных групп, а также до 1 % групп, соединенных с аминокислотами и пептидами [12]. Из хитина (I) данный биополимер получается в результате удаления ацетильной группы из положения С2 действием раствором щелочи путем полиме-раналогичных превращений (рис. 2).
Протекание процесса затруднительно, потому что трансрасположение в элементарном звене макромолекулы хитина заместителей (ацетамидной и гидроксильной групп) у С2 и С3 обусловливает значительную гидролитическую устойчивость ацетамидных групп, в том числе и в условиях щелочного гидролиза.
Поэтому отщепление ацетамидных групп удается, как правило, осуществить лишь в
O
CH 3
CO
NH
CH 2 OH
+NaOH
-CH 3 COONa
NH
CH 2 OH
CO
CH 3
(I) (II)
Рис. 2. Схема реакции получения хитозана из хитина сравнительно жестких условиях – при обработке 40–49%-м водным раствором NaOH при температуре 110–140 °C в течение 4–6 часов [9; 11].
Реакция деацетилирования сопровождается одновременным разрывом гликозидных связей полимера, то есть уменьшением молекулярной массы, изменением надмолекулярной структуры, степенью кристалличности, снижением его вязкости и т. д. [1; 8; 12].
Для сохранения молекулярной массы полимера предпочтительно снижать температуру обработки хитина [7].
Измельчение хитина облегчает доступ деацетилирующего агента внутрь структуры, благодаря чему достигается равномерное протекание процесса деацетилирования и сопровождающей его деструкции [9]. При использовании слишком крупных частиц хитина данный процесс проходит не в полной мере, поверхностные слои таких частиц деацетилированы в большей степени, чем внутренние. При последующем растворении в уксусной кислоте эти поверхностные слои образуют раствор, а внутренние слои частиц, не полностью деацетилированные, только набухают. Такой неоднородный хитозан может иметь ограниченное применение. В случае достаточно тонкого измельчения хитина все слои частиц деацетилируются в одинаковой степени, что приводит к получению более однородного продукта.
Также хорошо известно, что наличие кислорода в среде, в которой проводится реакция деацетилирования, увеличивает степень деструкции хитина, поэтому кислород из зоны реакции необходимо удалять.
При сушке готового продукта в условиях высоких температур (более 50 °C), а также в результате длительного хранения хитозана возможно его уплотнение, потемнение и снижение растворимости, что отрицательно сказывается на потребительских свойствах.
Результаты органолептических и физико-химических испытаний (см. таблицу) сви- детельствуют о соответствии качества полученного хитозана по определенным параметрам, нормам технических условий на хитозан пищевой, что показывает возможность получения продукта по предложенному нами способу, перспективность его дальнейшей разработки.
Как мы полагаем, для получения хитозана со структурой, наиболее близкой к природной, следует подобрать еще более мягкие условия проведения процесса получения хитина, возможно, в условиях ферментативного катализа и обеспечивать перемешивание реакционной массы на стадии его деацетилирования.
Экспериментальная часть
Процесс депротеинирования проводился на предварительно отсортированном и промытом сырье. В качестве депротеинирующего реагента применялся 10 %-й раствор натрия бикарбоната в присутствии катионных и анионных ПАВ, обладающих депигментирующим и обезжиривающим свойствами, что исключает применение агрессивных и токсических реагентов: раствора концентрированной щелочи, перекисных соединений и органических растворителей. Максимально щадящее воздействие на полимер предотвращает его деградацию и исключает развитие вторичной пигментации готового продукта.
Стадия деминерализации проводилась 0,1 M раствором НСl. По окончании процесса полимер подвергался тщательной многократной промывке дистиллированной водой на воронке Бюхнера, отжиму и сушке.
Процесс деацетилирования предварительно измельченного до размеров 1-2 х 2-3 мм хитина проводили в двугорлом реакторе, снабженном термометром и подключенном к водоструйному насосу, в 40%-м растворе NaOH (при соотношении к хитозану 1 : 20) при 100 °C в течение 1–2 ч.
Готовый продукт многократно промывали дистиллированной водой на воронке Бюхне-
Физико-химические свойства хитозана
Состав полученного хитозана из панциря ракообразных рода Pandalus определяли методом элементного анализа. В результате проведения анализа содержание азота составило 8,6 %, водорода – 6,46 %, углерода – 43,8 %, кислорода – 40,9 %.
Для оценки уровня качества полученного хитозана были использованы показатели, заложенные в технические условия на пищевой хитозан (ТУ 9289-067-00472124-03). Органолептические показатели:
Внешний вид: чешуйки размером 1–3 мм. Цвет: белый с кремовым оттенком.
Вкус: свойственный данному продукту, без постороннего привкуса.
Запах: свойственный данному продукту, без постороннего запаха.
Измерение среды раствора продукта в уксусной кислоте проводили на pH-метре марки pH-150 МИ.
Массовую долю влаги определяли путем сушки продукта в вакууме при температуре 100–105 °С до постоянной массы.
Список литературы Совершенствование технологии получения хитозана
- Быкова, В. М. Сырьевые источники и способы получения хитина и хитозана: Хитин, его строение и свойства/В. М. Быкова, С. В. Немцев//Хитин и хитозан. Получение, свойства и применение. -М.: Наука, 2002. -C. 7-23.
- Волокнистые, пленочные и пористые материалы на основе хитозана/Е.Л. Илларионова [и др.]//Химические волокна. -1995. -№ 6. -С. 18-22.
- Гальбрайх, Л. С. Хитин и хитозан: строение, свойства, применение/Л. С. Гальбрайх//Соровский образовательный журнал. -2001. -Т. 7, № 1. -С. 51-56.
- Гальбрайх, Л. С. Модифицированные волокнистые и пленочные материалы/Л. С. Гальбрайх//Химические волокна. -2005. -№ 5. -С. 21-27.
- Исследование композиций целлюлозахитозан. Твердофазная модификация, реология, пленки/Г. А. Вихорева [и др.]//Химические волокна. -2000. -№ 6. -С. 14-18.
- Кильдеева, Н. Р. Получение материалов медицинского назначения из растворов биосовместимых полимеров/Н. Р. Кильдеева, Л. С. Гальбрайх, Г. А. Вихорева//Химические волокна. -2005. -№ 6. -С. 21-24.
- Общая химическая технология/под ред. И. П. Мухленова. -М.: Высш. шк., 1984. -255 с.
- Пат. 2116314 Российская Федерация, МПК 6 С08 В37/08. Способ получения хитозана/Г. И. Касьянов, О. И. Квасенков, А. И. Николаев, Е. Е. Касьянова. -№97104789/04; заяв. 26.03.97; опубл. 27.07.98//Изобретения. -1998. -№ 21. -220 с.
- Хитин и хитозан. Получение, свойства и применение/под ред. К. Г. Скрябина, Г. А. Вихоревой, В. П. Варламова. -М.: Наука, 2002. -368 с.
- Chitosan as antimicrobial agent: applications and mode of action/E. Rabea, M. Badawy, C. Stevens, G. Smagghe [et al.]//Biomacromol. -2003. -Vol. 4, № l. -P. 14-57.
- Chitosan Preparation from Persian Gulf Shrimp Shells and Investigating the Effect of Time on the Degree of Deacetylation/M. Shahabi Viarsaghl, M. Janmaleki, H. Reza Falahatpisheh1, J. Masoumi//Journal of Paramedical Sciences (JPS). -2009. -Vol. 1. -P. 2-7.
- Hoemann, C. Tissue engineering of cartilage using an injectable and adhesive chitosan-based celldelivery vehicle/C. Hoemann, J. Sun, A. Le'gare//Osteoarthritis Cartil. -2005. -Vol. 13. -P. 318-329.
- Kyung, W. K. Antimicrobial activity of native chitosan, degraded chitosan-carboxymethylated chitosan/W. K. Kyung, R. I. Thomas, L. Chan//Journal of Food Protection. -2003. -№ 66. -P. 1495-1498.
- Ultrastructure of hybrid chitosan-glycerol phosphate blood clots by environmental scanning electron microscopy/M. Iliescu, C. D. Hoemann, M. S. Shive, A. Chenite//Microsc. Res. Technique. -2008. -Vol. 71, № 3. -P. 236-247


