Совместимость фунгицидных протравителей сои с инокулянтами
Автор: Саенко Г.М., Бушнева Н.А.
Рубрика: Защита растений и иммунология
Статья в выпуске: 3 (175), 2018 года.
Бесплатный доступ
При выращивании сои обязательным приёмом является инокуляция семян. В то же время соя часто поражается различными болезнями. Современная стратегия защиты растений предусматривает применение экологически безопасных методов контроля вредных организмов, выгодным является предпосевное протравливание семян. Вопрос совместного применения фунгицидных протравителей с инокулянтами остаётся не изученным. С этой целью были проведены исследования в лабораторных условиях. Оценивали рост штриха бактерий Bradyrhizobium japonicum в минерально-растительной среде с добавлением в неё препаратов для обработки семян сои против болезней. Определено, что препараты не оказывали негативного влияния на ризобии, в вариантах со штаммом 6-1 интенсивность роста составила 4 балла.
Соя, ризобии, азотфиксация, штамм бактерии, совместимость фунгицидов и инокулянтов
Короткий адрес: https://sciup.org/142216721
IDR: 142216721 | УДК: 579.64:632.952 | DOI: 10.25230/2412-608X-2018-3-175-124-127
Текст научной статьи Совместимость фунгицидных протравителей сои с инокулянтами
Введение . Соя обладает уникальной способностью формировать симбиотические отношения с бактериями рода Rhizobium вида Bradyrhizobium. Благодаря такому симбиозу растения получают из воздуха необходимое количество азота для своего роста и развития на протяжении всего периода вегетации [1; 2]. При благоприятных условиях клубеньковые азотфиксирующие бактерии могут накапливать за сезон 100 – 400 кг/га азота, доступного растениям. Такого количества хватает как растениям сои, так и следующим культурам, для которых соя является ценным предшественником [3].
Поскольку культурное растение соя родом из Китая, то её симбиотические бактерии Bradyrhizobium japonicum присутствуют в естественных биоценозах только на юго-востоке Азии. На большей же части территории Российской Федерации специфическая соевая аборигенная культура азотфиксирующих бактерий B. japonicum отсутствует. Однако в местах систематического выращивания сои формируются локальные популяции ри-зобий, но они подвергаются неблагоприятному влиянию погодных условий, уничтожаются пестицидами и интенсивной обработкой почвы, что не позволяет бактериям создать на новом месте обитания устойчивую популяцию. Поэтому при выращивании сои обязательным приёмом является искусственное заражение (инокуляция) семян культурой B. japonicum [4].
В то же время при возделывании сои часто наблюдается её поражение различными возбудителями грибных, бактериальных и вирусных болезней, которые существенно снижают урожайность, ухудшают посевные и товарные качества семян (всхожесть, скорость и энергию прорастания, жизнеспособность) [5]. А тенденция увеличения посевных площадей под сою влечёт за собой накопление патогенной инфекции и ещё большую распространённость различных болезней. Современная стратегия многих производственников в плане защиты растений предусматривает применение экологически безопасных методов контроля вредных организмов. Так как значительная часть болезней передается через семена или почву, экономически выгодным и экологически целесообразным является предпосевное протравливание семян. Рациональное использование протравителей, их применение согласно оптимальному регламенту и в комплексе с биологически активными веществами позволяет значительно сократить недоборы урожая от болезней даже в годы массового развития патогенов [6; 7].
Изучение вопросов совместного применения протравителей с микроэлементами и нитрагином было начато еще в 70-х годах прошлого столетия на горохе и вике [8]. Кроме того, отсутствовали знания о действии современных протравителей на клубеньковые бактерии, их симбиотическую активность и продуктивность сои. На сегодняшний день имеются данные о комплексном применении перспективных протравителей с инокулянтами на сое в Орловской области. В результате проведённых там исследований было установлено, что заблаговременная обработка семян сои протравителями и нитрагини-зация в день посева позволяют снизить инфекционную нагрузку, сохранить азот-фиксирующую способность клубеньковых бактерий и повысить урожайность на 10–20 % [6]. Во ВНИИ сои (г. Благовещенск) изучали совместимость местных коллекционных штаммов ризобий сои с фунгицидами и ростстимулирующими препаратами. Было показано, что коллекционные штаммы ризобий сои быстрорастущего вида Sinorhizobium fredii были более устойчивы к изучаемым препаратам, чем штаммы медленнорастущего вида Bradyrhizobium japonicum, и могут быть использованы при совместном применении для предпосевной обработки семян сои [9]. В условиях Краснодарского края вопрос совместного применения фунгицидов с инокулянтами на сортах сои остаётся не изученным. Поэтому нашей целью на первом этапе исследований было установить совместимость фунгицидных протравителей с инокулянтами в лабораторных условиях.
Материалы и методы. В лабораторных условиях изучали совместимость инокулянтов с фунгицидными протравителями. В опытах использовали протравители семян сои, разрешённые к применению на территории РФ: Максим, КС (25 г/л); ТМТД, ВСК (400 г/л); Скарлет, МЭ (100 + 600 г/л) и препарат Зеребра, ВР (500 + 100 мг/л). Инокулянты были представлены препаратами Нитрофикс, Ж – жидкий инокулянт украинского производства на основе аргентинских штаммов ризобий; Ризоформ, Ж – жидкий инокулянт производства ЗАО «Щёлково Агро-хим», и штаммом бактерии Bradyrhizobium japonicum 6–1 амурского происхождения.
Для определения совместимости фунгицидного протравителя и инокулянта использовали метод диффузии в агар [10; 11; 12; 13]. При изучении влияния протравителей на интенсивность роста штриха чистых культур B. japonicum использовали агаризованную минеральнорастительную среду (МРС) с соевой мукой следующего состава, г/л: K 2 HPO 4 – 0,5; KH 2 PO 4 – 0,5; MgSO 4 – 0,1; CaSO 4 – 0,1; NaCl – 0,2; соль молибдена – следы; манит – 20,0; соевая мука – 10,0; агар-агар – 20,0. Изучаемые препараты вносили в среду, в специально сделанные лунки затем вносили на питательную среду инокулянты, чашки выдерживали в термостате при оптимальной температуре + 27 ºС в течение
7 суток и отмечали интенсивность роста штриха в баллах (1 – скудный рост, 2 – умеренный, 3 – хороший, 4 – обильный рост) [14].
Результаты исследований. В лабораторных условиях провели исследования по определению совместимости препаратов и инокулянтов. В чашки Петри были добавлены препараты для обработки семян сои в лунки питательной среды согласно схеме опыта. Затем штрихом нанесли культуру бактерий B. japonicum различных инокулянтов.
Результаты проведённых исследований показывают, что на 7-е сутки инкубации рост бактерий B. japonicum на питательной среде без внесения фунгицидов находился на уровне 3–4 баллов. А все испытываемые препараты не оказывали отрицательного влияния на ризобии (таблица).
Таблица
Интенсивность роста бактерии
Bradyrhizobium japonicum различных инокулянтов в чашках Петри при внесении фунгицидов в питательную среду на 7-е сутки инкубации
ВНИИМК, 2017 г.
|
Вариант |
Интенсивность роста штриха бактерий B. japonicum , балл |
||
|
B. japonicum штамм 6–1 (амурское происхождение) |
Нитрофикс, Ж |
Ризоформ, Ж |
|
|
Контроль (без препарата) |
4 |
3 |
3 |
|
Максим, КС |
4 |
3 |
3 |
|
ТМТД, ВСК |
4 |
3 |
3 |
|
Скарлет, МЭ |
4 |
3 |
3 |
|
Зеребра, ВР |
4 |
3 |
3 |
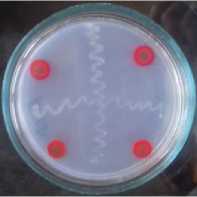
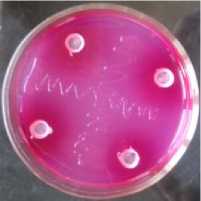
Хороший рост (3 балла) бактерий B. japonicum инокулянта Нитрофикс, Ж наблюдался при наличии фунгицидов и Зе-ребры в агаризованной минерально-растительной среде (МРС) с соевой мукой. Такая же интенсивность роста бактерий отмечалась в чашках Петри с Ризофор-мом, Ж и препаратами. В вариантах со штаммом 6–1 (амурское происхождение) и испытываемыми препаратами отмечен высший балл интенсивности роста бактерии (рисунок).
На рисунке видно как диффундировали в питательную среду препараты ТМТД,
ВСК и Скарлет, МЭ, что привело к её полному окрашиванию, и видно, что рост штриха бактерий B. japonicum ни чуть не уменьшился по сравнению с контролем.

б
а

в г

д
Рисунок – Совместимость фунгицидов и бактерий штамма B. japonicum 6–1 (амурское происхождение) в чашках Петри (ориг.): а – чистая культура B. japonicum 6–1;
б – штамм B. japonicum 6–1 + Максим, КС; в – штамм B. japonicum 6–1 + ТМТД, ВСК; г – штамм B. japonicum 6–1 + Скарлет, МЭ;
д – штамм B. japonicum 6–1 + Зеребра
При изучении совместимости протравителей и инокулянтов в лабораторных условиях была определена возможность их применения на семенах сои в интегрированной системе защиты. Лучшие варианты будут взяты для второго этапа исследований – полевого опыта, где мы будем вести наблюдения за образованием ризобий на корнях растений сои, проанализируем количество образовавшихся клубеньков, их размеры и жизнеспособ- ность, а также развитие болезней и урожайность культуры.
Выводы. На первом этапе исследования в лабораторных условиях была проведена оценка роста штриха бактерий B. japonicum в минерально-растительной среде (МРС) с соевой мукой с добавлением в неё препаратов для обработки семян сои против болезней. По данным опыта было определено, что во всех его вариантах наблюдали хороший рост бактерий B. japonicum инокулянтов Нитрофикс, Ж и Ризоформ, Ж – 3 балла, а в варианте с применением штамм B. japonicum 6–1 (амурское происхождение) рост был обильный – 4 балла. Это позволяет в дальнейшем использовать все эти варианты для проверки в полевых условиях.
Список литературы Совместимость фунгицидных протравителей сои с инокулянтами
- Коць С., Маменко П. Инокуляция и инкрустация семян сои: обзор технологии применения и рынка препаратов//Спецвыпуск ж. «Пропозиция». -2015. -С. 24-28.
- Тильба В.А., Синеговская В.Т. Роль симбиотической азотфиксации в повышении фотосинтетической продуктивности сои//Доклады Российской академии сельскохозяйственных наук. -2012. -№ 5. -С. 16-18.
- Белка В. Отечественные инновационные технологии на сое: . -2011. -URL: http://pesticidov.net/ru/articles/bio/2304/(дата обращения: 28.05.2018).
- Савенко О. Об эффективности инокуляции семян сои: . -2011. -URL: https://www.agronom.info/info/news/29628/(дата обращения: 30.05.2018).
- Пивень В.Т., Бушнева Н.А., Дряхлов А.И., Саенко Г.М. Защита посевов сои от болезней, вредителей и сорняков//Земледелие. -2010. -№ 3. -С. 30-33.
- Борзенкова Г.А. Оптимизация технологии предпосевного протравливания и возможность его сочетания с инокуляцией для защиты сои от семенной инфекции//Зернобобовые и крупяные культуры. -2014. -№ 1 (9). -С. 22-30.
- Саенко Г.М., Бушнева Н.А. Эффективность предпосевной обработки семян сои против болезней и вредителей всходов//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2017. -Вып. 1 (169). -С. 75-82.
- Щербина Е.А. Совмещение нитрагинизации семян гороха с протравливанием ТМТД//Сб. науч. тр. ВНИИЗБК. -1976. -Т. 6. -С. 127-132.
- Якименко М.В., Бегун С.А., Сорокина А.И. Совместимость местных коллекционных штаммов ризобий сои с фунгицидами и ростстимулирующими препаратами//Дальневосточный аграрный вестник. -2016. -№ 2 (38). -С. 38-41.
- Маслиенко Л.В., Курилова Д.А. Разработка микробиологического метода снижения вредоносности фузариоза на сое//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2012. -Вып. 2 (151-152). -С. 167-175.
- Егоров Н.С. Основы учения об антибиотиках. -М.: Изд-во МГУ Наука, 2004. -528 с.
- Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. -М.: Изд-во Моск. ун-та, 1957. -78 с.
- Ваксман З.А. Антагонизм микробов и антибиотические веществ. -М.: Гос. изд-во иностр. лит., 1947. -391 с.
- Бегун С.А., Тильба В.А. Способы, приёмы изучения и отбора эффективных штаммов клубеньковых бактерий сои/Методы аналитической селекции. -Благовещенск: изд-во «Зея», 2005. -70 с.


