Совместимые вещества штамма Halomonas sp. SMB31, синтезируемые в ответ на осмотический стресс
Автор: Ананьина Людмила Николаевна, Горбунов Алексей Аркадьевич, Шестакова Елена Анатольевна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Исследование физиологии штамма Halomonas sp. SMB31 показало, что он рос в минеральной среде Раймонда с глюкозой (1 г/л) в качестве субстрата в широком диапазоне концентраций хлорида натрия 1-20%, с оптимумом роста при 5%-ном NaCl. На основе полученных данных штамм отнесен к группе умеренногалофильных бактерий. Анализ этанольных экстрактов клеток штамма Halomonas sp. SMB31, выращенных в присутствии повышенных концентраций соли (5-, 10-, 15%-ном NaCl), методом ЯМР 1Н показал, что преобладающим совместимым веществом являлся эктоин. Кроме того, в клетках присутствовала глутаминовая кислота. Увеличение солености среды культивирования с 5% до 10% NaCl приводило к накоплению клетками гидроксиэктоина. Установлено, что внутриклеточное количество эктоина штамма Halomonas sp. SMB31 зависело от концентрации хлорида натрия и фазы роста бактериальной культуры.
Эктоин, совместимые вещества, ямр-спектроскопия, высокоэффективная жидкостная хроматография
Короткий адрес: https://sciup.org/147227105
IDR: 147227105 | УДК: 579.222.3: | DOI: 10.17072/1994-9952-2019-4-404-411
Текст научной статьи Совместимые вещества штамма Halomonas sp. SMB31, синтезируемые в ответ на осмотический стресс
Род Halomonas был предложен R.H. Vreeland с соавторами [1980] для нового вида H. elongata, объединяющего восемь штаммов грамотрицатель-ных бактерий, растущих в полноценной среде с казаминовыми кислотами в присутствии 32%-ной морской соли. Позднее, благодаря молекулярногенетическому анализу последовательностей гена 16S рРНК, было пересмотрено таксономическое положение представителей родов Deleya и Halovibrio, а также видов Paracoccus halodenitrificans и Volcaniella eurihalina, с целью объединения с видами рода Halomonas [Mellado et al., 1995; Dobson,
Franzmann, 1996]. В настоящее время род Halomonas включает 94 вида и является фенотипически и генетически гетерогенным [Mellado et al., 1995; Dobson, Franzmann, 1996; Arahal et al., 2002]. На основе филогенетического анализа последовательностей генов 16S рРНК, 23S рРНК, gyr B и rpo D в системе рода Halomonas можно выделить две, значительно удаленные друг от друга группы ( группа 1 или Halomonas sensu stricto и группа 2) [Arahal et al., 2002; de la Haba et al., 2012]. Неоднократно высказывалось мнение о том, что виды группы 2 могут представлять новый род
[Arahal et al., 2002; de la Haba et al., 2012]. Кроме того, некоторые виды, среди которых H. pantelleriensis и H. taeanensis , очевидно, не попадают ни в одну из перечисленных групп, так как имеют низкий уровень родственного сходства с представителями какой-либо из них [Arahal et al., 2002; de la Haba et al., 2012].
Бактерии рода Halomonas выделены преимущественно из почвенных и водных экосистем, характеризующихся высокими концентрациями солей и/или щелочными рН [Arahal et al., 2001]. Для выживания в условиях высокого осмотического давления внешней среды клетки накапливают низкомолекулярные высокорастворимые в воде органические соединения, которые не нарушают метаболизм – совместимые вещества [Roberts, 2005]. Таковыми являются сахара, многоатомные спирты, аминокислоты, бетаины, эктоины или их производные. В настоящее время известны работы, посвященные исследованию механизмов осмоадаптации бактерий рода Halo-monas на примере видов филогенетической группы Halomonas sensu stricto (H. elongata, H. halophila и H. halmophila), Н. boliviensis (филогенетическая группа 2) и вида H. pantelleriensis, не относящегося ни к одной из филогенетических групп рода [Wohlfarth et al., 1990; Ono et al., 1998; Romano et al., 2001; Van-Thuoc et al., 2010].
Между тем имеющиеся данные могут не в полной мере раскрывать особенности адаптации бактерий рода Halomonas к высокой осмолярности среды. Ввиду вышесказанного, цель настоящего исследования – изучение физиологии и совместимых соединений штамма Halomonas sp. SMB31, на основе анализа нуклеотидной последовательности гена 16S рРНК, филогенетически близкородственного виду H. taeanensis (уровень сходства 99.8%) [Ананьина, 2007, Корсакова и др., 2013], в сравнении с ранее исследованными видами рода Halomonas.
Материалы и методы исследования
Изучение кинетики роста штамма в зависимости от концентрации хлорида натрия (см. табл. 1) проводили при культивировании в 100 мл минеральной среды Раймонда (МСР) [Розанова, Назина, 1982], содержащей 1 г/л глюкозы (ОАО «Дальхимфарм», Россия), в колбах объёмом 250 мл на орбитальном шейкере УВМТ-12-250 («Элион», Россия) при 100 об/мин. Оптическую плотность измеряли на спектрофотометре BioSpecmini TCC-240A (Shimadzu corporation, Япония) при 540 нм в кювете с длиной оптического пути 1 см. Дополнительно способность к росту в присутствии разных концентраций хлорида натрия (1-, 5-, 10-, 15-, 20-, 25-, 30%-ного) и без него изучали, культивируя исследуемый штамм на агаризо-ванной полноценной среде Раймонда (ПСР) [Plotnikova et al., 2011] при 28°С. Рост оценивали спустя две недели по наличию колоний.
Таблица 1
Рост Halomonas sp. SMB31 в присутствии разных концентраций хлорида натрия
|
Среда культивирования |
Концентр ация хлори да натрия в среде культивирования, % |
|||||||
|
0 |
1 |
5 |
10 |
15 |
20 |
25 |
30 |
|
|
Агаризованная ПСР* |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Жидкая МСР** |
0.15 (98) |
0.79 (24) |
1.07 (24) |
1.04 (30) |
0.89 (80) |
0.59 (98) |
0.11 (98) |
н.о. |
Примечания: *Рост культуры оценивался по появлению колоний размером не менее 1 мм на агаризованной среде ( - – нет роста, + – рост). **Рост культуры оценивался путем измерения оптической плотности среды культивирования (исходная ОП 540 = 0.11–0.15), в скобках указано время культивирования (часы), н.о. – не
определяли .
Для исследования совместимых веществ бактериальную культуру выращивали в минеральной среде Раймонда, содержащей 1-, 5-, 10-, 15%-ный NaCl и 1 г/л глюкозы, при 28°С до стационарной фазы роста. В экспериментах инокулятом (1% об./об.) служила культура, выросшая до фазы замедленного роста при 28°С в минеральной среде Раймонда, содержащей 5%-ный NaCl и 1 г/л глюкозы. Экстракцию органических соединений из клеток проводили 80%-ным раствором этанола, следуя процедуре, разработанной Bernard с соавторами [1993]. 20 мкл каждого образца анализировали изократической высокоэффективной жидкостной хроматографией (ВЭЖХ) на приборе Shimadzu prominence LC-20AD (Shimadzu corporation, Япония), снабженном UV/VIS- детектором CPD-20A (Shimadzu corporation, Япония) и колонкой Сепарон SGX 100 NH2, 4.6×150 мм, 5 мкм (Dr. Maisch GmbH, Германия), согласно методике, описанной в статье [Garcia-Estepa et al., 2006]. Идентификацию соединений проводили при сравнении времени удерживания с коммерческими препаратами эктоина и гидроксиэктоина (Fluka, Германия). Количество совместимых веществ рассчитывали на 1 мг сухого веса биомассы. Сухой вес определяли согласно опубликованной методике [Fuhrer et al., 2005]. Дополнительно состав этанольных экстрактов клеток исследовали методом спектроскопии ЯМР 1H. Для этого высушенный осадок растворяли в 0.5 мл D2O (ООО «Астра-хим», Россия) и записывали спектр при 30°С на приборе Bruker Avance Neo 400 (Bruker
Corporation, США), при частоте 400 МГц.
Химические сдвиги (δ) указаны в м.д., относительно сигнала метильной группы эктоина (2.24 м.д.). Идентификацию сигналов в спектре проводили сравнением с литературными данными, со спектрами аутентичных образцов и путем добавления веществ к пробе. Количественные измерения проводили методом внутреннего стандарта, в качестве которого использовали малеиновую кислоту (СН-группы около 6.35 м.д.).
Результаты и их обсуждение
Физиологическая характеристика штамма
Исследуемый штамм Halomonas sp. SMB31 был способен к росту на агаризованной полноценной среде Раймонда (с триптоном и дрожжевым экстрактом) в присутствии хлорида натрия до 30%, образуя на поверхности единичные колонии диаметром 1 мм, и не рос без соли (табл. 1). Штамм H. elongata 1H9T (=ATCC 33173T=CECT 4279T= DSM 2581T) в питательном бульоне был способен к росту без внесения морской соли и в ее присутствии до 32% [Vreeland et al., 1980]. В среде HM [Ventosa et al., 1982] с протеозо-пептоном, дрожжевым экстрактом и глюкозой штаммы H. elongata CECT 4279T и H. boliviensis LC1T росли без морской соли и в ее присутствии до 20 и 25%, соответственно [Mata et al., 2002; Quillaguaman et al., 2004]. Оптимальный рост H. elongata CECT 4279T находился в широком диапазоне (3–8%) морской соли, а у штамма H. boliviensis LC1T при 5%-ном NaCl. Верхним пределом диапазона роста штаммов H. halophila CCM 3662T (=FS-7T) и H. halmophila ATCC 19717T (=CCM 2833T= NCMB 1971T) служила концентрация морской соли – 25%, для роста было необходимо 2 и 3%, соответственно [Mata et al., 2002]. Оптимум роста обоих штаммов наблюдался при концентрации 7.5% соли. H. pantelleriensis AAPT был способен расти при концентрации хлорида натрия от 1.25 до 15%, с оптимумом при 10%-ном NaCl [Romano et al., 1996]. Таким образом, анализ имеющейся в литературе информации о физиологии штаммов, являвшихся объектами исследований процессов осмоадаптации, выявил, что все штаммы, за исключением H. pantelleriensis AAPT, способны к росту в широком диапазоне солености среды культивирования, некоторые штаммы росли без соли, но оптимум роста всех культур находился в пределах 0.5-2.5М NaCl.
В 1984 г. Imhoff и Rodriguez-Valera отметили положительную корреляцию внутриклеточного количества бетаина от концентрации соли в среде культивирования, содержащей дрожжевой экстракт – источник глицинбетаина. Vreeland с соав- торами [1983] описал похожую зависимость для аминокислотного пула вида H. elongata, выращенного в минеральной среде с аланином. Поэтому дальнейшее культивирование штамма Halomonas sp. SMB31 проводили в минеральной среде Раймонда и единственным органическим соединением – глюкозой, которая служила источником углерода и энергии. Для роста исследуемого штамма Halomonas sp. SMB31 сохранилась потребность в присутствии как минимум 1%-ного NaCl, максимальное значение оптической плотности и наименее короткая фаза адаптации были отмечены при 5%-ном NaCl (табл. 1). Верхняя граница концентрации хлорида натрия, при которой возможен рост, снизилась до 20%. На примере бактерий Vibrio costicola NRC 508, H. halodenitrificans NRC 509 и H. elongata 1H9T было показано, что при культивировании на среде с дрожжевым экстрактом накопление экзогенного бетаина сопровождалось повышением солеустойчивости бактерий [Forsyth, Kushner, 1970; Vreeland, Martin, 1980].
Спектр органических соединений, накапливаемых клетками штамма Halomonas sp. SMB31
Как показало исследование этанольных экстрактов клеток методом спектроскопии ЯМР 1Н, применяемым для анализа смесей органических соединений разных химических классов, преобладающим соединением являлся эктоин (рисунок; табл. 2). Минорным компонентом была глутаминовая кислота (рисунок; табл. 2). В этанольных экстрактах клеток, выросших в присутствии 10- и 15%-ного NaCl, помимо перечисленных выше компонентов, был выявлен гидроксиэктоин (рисунок, б). Согласно литературным данным, в ЯМР-спектрах клеточных экстрактов бактерий видов H. elongata , H. halophila , H. halmophila , H. pantelleriensis, культивированных в присутствии 10% или 1.8М NaCl при оптимальной для роста температуре, были обнаружены сигналы эктоина, глутаминовой кислоты и гидроксиэктоина, а в экстрактах H. halmophila были выявлены сигналы аланина [Ono et al., 1998; Romano et al., 2001; Wohlfarth et al., 1990]. Кроме того, было отмечено, что виды группы Halomonas sensu stricto отличались относительными пропорциями минорных компонентов пула совместимых веществ [Wohlfarth et al., 1990]. Увеличение концентрации хлорида натрия в среде культивирования с 5 до 15% приводило к снижению доли глутаминовой кислоты (с 12.2 до 0.5%), и увеличению доли эктоинов за счет накопления гидроксиэктоина в клетках штамма Halomonas sp. SMB31 (табл. 2). Полученные результаты согласуются с ранее опубликованными для представителя вида H. pantelleriensis [Romano et al., 2001].
а б
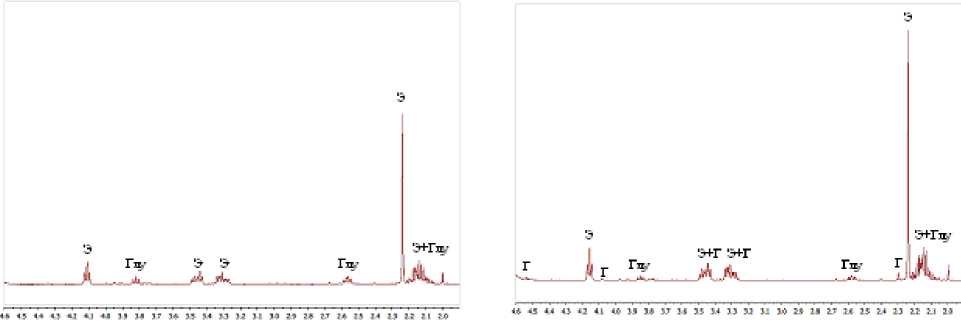
5,м.д. 6,м.д.
1Н ЯМР-спектры этанольных экстрактов клеток штамма Halomonas sp. SMB31 , культивированного в минеральной среде Раймонда с глюкозой в присутствии 5% (а) и 10% (б) NaCl при температуре 28°С:
Э - эктоин, Глу - глутаминовая кислота, Г - гидроксиэктоин
Таблица 2
Отношение интегральных интенсивностей сигналов протонов соединений к интегральной интенсивности сигналов всех протонов в спектрах ЯМР 1Н штамма Halomonas sp. SMB31 (%)
|
Концентрация NaCl в среде культивирования, % |
Эктоин |
Гидроксиэктоин |
Глутаминовая кислота |
Неидентифицированные соединения |
|
5 |
78.1 |
0.0 |
12.2 |
9.7 |
|
10 |
82.5 |
2.2 |
6.0 |
9.3 |
|
15 |
67.9 |
14.4 |
0.5 |
17.2 |
Влияние условий культивированияна биосинтез эктоинов
Установлено, что повышение концентрации хлористого натрия с 5 до 15% привело к возрастанию внутриклеточного количества эктоина и гидроксиэктоина у исследуемого штамма (табл. 3). Несмотря на рост бактериальной культуры в присутствии 1%-ного NaCl (табл. 1), количество эктоина в клетках было крайне мало (табл. 3). На при-
Таблица 3
Внутриклеточное количество эктоинов* (мкмоль/мг сухого веса биомассы) штамма Halomonas sp. SMB31
|
Концентрация NaCl в среде культивирования, % |
Cтационарная фаза, 28°С |
log -Фаза, 28°С |
||
|
Эктоин |
Гидроксиэктоин |
Эктоин |
Гидроксиэктоин |
|
|
1 |
0.0018 |
0.0 |
н.о.** |
н.о. |
|
5 |
0.34±0.15 |
0.0 |
0.11±0.01 |
0.0 |
|
10 |
0.60±0.10 |
0.02 |
н.о. |
н.о. |
|
15 |
0.58±0.03 |
0.14±0.04 |
н.о. |
н.о. |
Примечание. *определение количества в клеточных экстрактах осуществляли методом ВЭЖХ, стандартное отклонение рассчитывали для значений выше 0.1 мкмоль/мг сухого веса биомассы, ** - не определяли.
Подобная закономерность была отмечена для штамма Halomonas sp. SPCl [Cummings, Gilmour, 1995], что согласуется с результатами анализа промоторной области ectABC-оперона штамма H. elongata DSM 2581T, в которой выше стартового мере штаммов H. elongata KS3, H. elongata ATCC 33173T, H. boliviensis LC1T было показано, что накопление в клетках эктоина осмозависимо [Wohlfarth et al., 1990; Ono et al., 1998; Van-Thuoc et al., 2010]. Внутриклеточное количество эктоина штамма Halomonas sp. SMB31 зависело от стадии роста (табл. 3). Так, внутриклеточный пул эктоина был в три раза больше на стационарной стадии роста, чем на стадии логарифмического роста (табл. 3).
кодона ect A-гена расположены области связывания с вегетативным сигма-фактром и сигма-фактором стационарной фазы роста [Schwibbert et al., 2011].
Гидроксиэктоин в клетках исследуемого штамма Halomonas sp. SMB31 накапливался при культивировании с 10% NaCl и более, при этом его внутриклеточное количество имело положительную зависимость от солености среды. Аккумуляция гидроксиэктоина в клетках бактерий рода Halomonas (разных видов) индуцируется при высоких концентрациях хлорида натрия в среде культивирования: H. elongata и H. boliviensis – при 10% NaCl [Wohlfarth et al., 1990; Ono et al., 1998; Guzman et al., 2009], H. pantelleriensis – 1.8М NaCl [Romano et al., 2001]. Таким образом, гидроксиэктоин накапливается при концентрациях хлорида натрия, превышающих таковые оптимума роста. Van-Thuoc с соавторами [2010] предположил, что биосинтез гидроксиэктоина регулируется внутриклеточным количеством эктоина. Высокая внутриклеточная концентрация эктоина может приводить к активации эктоингидроксилазы, фермента, катализирующего превращение эктоина в гидроксиэктоин, и/или может ингибировать эктоинсинтазу (фермент, катализирующий синтез эктоина из N-γ-ацетил-1-2,4-диаминобутирата).
Заключение
В настоящее время осмоадаптация исследована у отдельных представителей рода Halomonas, которые отличаются по потребности ионов натрия для роста. Практически все исследованные культуры, за исключением вида H. pantelleriensis [Romano et al., 2001], были способны к росту в полноценных средах при концентрации солей, близких к насыщенным (30%-ного NaCl). Ранее исследованные галомонады отнесены к группе умеренногалофильных организмов, оптимум роста которых находится в диапазоне 5–10% соли. Для штамма Halomonas sp. SMB31 (близкородственного виду H. taeanensis) в полноценной среде Раймонда верхним пределом диапазона роста служила концентрация хлорида натрия 30%, а оптимум роста наблюдался при 5%-ном NaCl. Исследование механизмов осмоадаптации Halomonas sp. SMB31 выявило их сходство с таковыми ранее исследованных видов рода Halomonas. В пуле совместимых соединений бактерий рода Halomonas преобладал эктоин, его количество возрастало с увеличением соли в среде культивирования и зависело от фазы роста [Wohlfarth et al., 1990; Cummings, Gilmour, 1995; Ono et al., 1998; Van-Thuoc et al., 2010]. При концентрации хлорида натрия в среде культивирования выше максимальных значений диапазона оптимума роста в клетках исследованного нами штамма Halomonas sp. SMB31 и штамма H. elongata ATCC 33173T [Wohlfarth et al., 1990] накапливался гидроксиэктоин. Полученные результаты могут указывать на высокую консервативность механизмов адаптации к высокой осмо- лярности среды у умеренногалофильных бактерий рода Halomonas.
Исследование выполнено при финансовой поддержке РФФИ и Министерства образования и науки Пермского края в рамках научного проекта № 17-44-590178.
Список литературы Совместимые вещества штамма Halomonas sp. SMB31, синтезируемые в ответ на осмотический стресс
- Ананьина Л.Н. Нафталинметаболизирующий консорциум микроорганизмов, выделенный из засоленной почвы: дис. … канд. биол. наук. Пермь, 2007. 166 с.
- Корсакова Е.С. Разнообразие бактерий семейства Halomonadaceae района солеразработок Верхнекамского месторождения солей // Микробиология. 2013. Т. 82, № 2. С. 247-250.
- Розанова Е.П., Назина Т.Н. Углеводородокисляющие бактерии и их активность в нефтяных пластах // Микробиология. 1982. Т. 51, № 2. С. 342-348.
- Arahal D.R. et al. Chromohalobacter salexigens sp. nov., a moderately halophilic species that includes Halomonas elongata DSM 3043 and ATCC 33174 // Int. J Syst. Evol. Microbiol. 2001. Vol. 51. P. 1457-1462.
- Arahal D.R. et al. Phylogeny of the family Halomonadaceae based on 23S and 16S rRNA sequence analyses // Int. J. Syst. Evol. Microbiol. 2002. Vol. 52. P. 241-249.
- Bernard T. et al. Ectoine accumulation and osmotic regulation in Brevibacterium linens // J. Gen. Microbiol. 1993. Vol. 139. P. 129-136.
- Cummingst S.P., Gilmour D.J. The effect of NaCl on the growth of a Halomonas species: accumulation and utilization of compatible solutes // Microbiobgy. 1995. Vol. 141. P. 1413-1418.
- de la Haba R.R. et al. Multilocus sequence analysis of the family Halomonadaceae // Int. J. Syst. Evol. Microbiol. 2012. Vol. 62. P. 520-538.
- Dobson S.J., Franzmann P.D. Unifcation of the genera Deleya (Baumann et al. 1983), Halomonas (Vreeland et al. 1980), and Halovibrio (Fendrich 1988) and the species Paracoccus halodenitrifcans (Robinson and Gibbons 1952) in to a single genus, Halomonas, and placement of the genus Zymobacter in the family Halomonadaceae // Int. J. Syst. Bacteriol. 1996. Vol. 46. P. 550-558.
- Forsyth M.P., Kushner D.J. Nutrition and distribution of salt response in populations of moderately halophilic bacteria // Can. J. Microbiol. 1970. Vol. 16. P. 253-261.
- Fuhrer T. et al. Experimental identification and quantification of glucose metabolism in seven bacterial species // J. Bacteriol. 2005. Vol. 187. P. 1581-1590.
- García-Estepa R. et al. The ectD gene, which is involved in the synthesis of the compatible solute hydroxyectoine, is essential for thermoprotection of the halophilic bacterium Chromohalobacter salexigens // J. Bacteriol. 2006. Vol. 188. P. 3774-3784.
- Guzmán H. et al. A process for the production of ectoine and poly(3-hydroxybutyrate) by Halomonas boliviensis // Appl. Microbiol. Biotechnol. 2009. Vol. 84. P. 1069-1077.
- Imhoff J.F., Rodriguez-Valefra A. Betaine is the main compatible solute of halophilic eubacteria // Journal of Bacteriology. 1984. Vol. 160. P. 478-479.
- Mata J.A. et al. A detailed phenotypic characterrisation of the type strains of Halomonas species // Syst. Appl. Microbiol. 2002. Vol. 25. P. 360-375.
- Mellado E. et al. Phylogenetic inferences and taxonomic consequences of 16Sribosomal DNA sequence comparison of Chromohalobacter marismortui, Volcaniella eurihalina, and Deleya salina and reclassifcation of V. eurihalina as Halomonas eurihalina comb. nov. // Int. J. Syst. Bacteriol. 1995. Vol. 45. P. 712-716.
- Ono H. et al. Accumulation of compatible solutes, ectoine and hydroxyectoine, in a moderate halophile, Halomonas elongata KS3 isolated from dry salty land in Thailand // J. Ferment. Bioeng. 1998. Vol. 85.P. 362-368.
- Plotnikova E.G. et al. Thalassospira permensis sp. nov., a new terrestrial halotolerant bacterium isolated from a naphthalene-utilizing microbial consortium // Mikrobiologiia. 2011. Vol. 80. P 691-699.
- Quillaguamán J. et al. Halomonas boliviensis sp. nov., an alkalitolerant, moderate halophile isolated from soil around a Bolivian hypersaline lake // Int. J. Syst. Evol. Microbiol. 2004. Vol. 54. P. 721-725.
- Roberts M.F. Organic compatible solutes of halotolerant and halophilic microorganisms // Saline Systems. 2005. Vol. 4. P. 1-5.
- Romano I. et al. Characterization of a haloalkalophilic strictly aerobic bacterium, isolated from Pantelleria Island // Syst. Appl. Microbiol. 1996. Vol. 19. P. 326-333.
- Romano I. et al. Accumulation of osmoprotectants and lipid pattern modulation in response to growth conditions by Halomonas pantelleriense // Syst. Appl. Microbial. 2001. Vol. 24. P. 342-352.
- Schwibbert K. et al. A blueprint of ectoine metabolism from the genome of the industrial producer Halomonas elongata DSM 2581T // Environ. Microbiol. 2011. Vol. 13. P. 1973-1994.
- Van-Thuoc D. et al. High productivity of ectoines by Halomonas boliviensis using a combined two-step fed-batch culture and milking process // J. Biotechnol. 2010. Vol. 147. P. 46-51.
- Ventosa A. et al. Numerical taxonomy of moderately halophilic gram-negative rods // Microbiology. 1982. Vol. 128. P. 1959-1968.
- Vreeland R.H. et al. Halomonas elongata, a new genus and species of extremely salt-tolerant bacteria // Int. J. Syst. Bacteriol. 1980. Vol. 30. P. 485-495.
- Vreeland R.H. et al. Relationship of the internal solute composition to the salt tolerance of Halomonas elongate // Can. J. Microbiol. 1983. Vol. 29. P. 407-414.
- Vreeland R.H., Martin E.L. Growth characteristics, effects of temperature, and ion specificity of the halotolerant bacterium Halomonas elongate // Can. J. Microbiol. 1980. Vol. 26. P. 746-752.
- Wohlfarth A., Severin J., Galinski E.A. The spectrum of compatible solutes in heterotrophic halophilic eubacteria of the family Halomonadaceae // J. Gen. Microbiol. 1990. Vol. 136. P. 705-771.


