Современная тактика ведения пациентов молодого возраста с синдромом удлиненного интервала Qt: от ранней диагностики к имплантации кардиовертера-дефибриллятора и мониторингу маркеров риска внезапной смерти
Автор: Ильдарова Рукижат Абдул-Гафуровна, Школьникова Мария Александровна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 1 т.30, 2015 года.
Бесплатный доступ
Актуальность первичных электрических заболеваний сердца у детей и лиц молодого возраста в настоящее время крайне высока, так как они являются основной причиной злокачественных желудочковых аритмий и внезапной сердечной смерти (ВСС). К этой группе заболеваний относится синдром удлиненного интервала QT, распространенность которого, по последним данным, достигает 1:2500-3000 новорожденных. Клинические проявления заболевания и эффективность лечения больных зависят от конкретного молекулярно-генетического варианта синдрома. Стратификация риска внезапной смерти (ВС) у больных синдромом удлиненного интервала QT основывается на клинических, электрокардиографических и молекулярно-генетических факторах и маркерах. Общепринятый подход к лечению синдрома удлиненного интервала QT заключается в назначении бета-адреноблокаторов. Эффективным методом профилактики ВС при синдроме удлиненного интервала QT является имплантация кардиовертера-дефибриллятора.
Внезапная сердечная смерть, удлинение интервала qt, кардиовертер-дефибриллятор
Короткий адрес: https://sciup.org/14919999
IDR: 14919999 | УДК: 616.12-008
Текст научной статьи Современная тактика ведения пациентов молодого возраста с синдромом удлиненного интервала Qt: от ранней диагностики к имплантации кардиовертера-дефибриллятора и мониторингу маркеров риска внезапной смерти
На сегодняшний день одной из наиболее важных нерешенных проблем клинической кардиологии является проблема ВСС у лиц молодого возраста [1, 9]. В возрасте до 35 лет частота ВСС составляет около 1:100000, при этом у лиц, занимающихся спортом высоких достижений, риск повышается более чем в 2 раза [12, 41]. Согласно данным C. Antzelevich, на долю ВСС приходится 19% от всех случаев ВС у детей в возрасте от 1 до 13 лет и более 30% – у детей старшего возраста. При этом в 10% случаев ВСС в молодом возрасте развивается у лиц, не имеющих структурных изменений со стороны сердца [41]. Большинство случаев ВС в молодом возрасте обусловлено злокачественными желудочковыми аритмиями, в качестве причины которых все чаще диагностируются первичные электрические заболевания сердца, в том числе врожденный синдром удлиненного интервала QT (СУИQT) [11].
СУИQT является наследственным заболеванием с высоким риском ВСС, характеризующимся удлинением интервала QT на электрокардиограмме (ЭКГ), приступами потери сознания на фоне эпизодов жизнеугрожающих желудочковых аритмий, наиболее часто – желудочковой тахикардией типа “пируэт” [9]. В ряде случаев первым проявлением синдрома может служить ВСС. Частота синдрома по разным данным составляет от 1:2000 до 1:3000 [11, 54]. Тяжесть этой наследственной патологии обусловлена жизнеугрожающими аритмиями и высокой летальностью, которая в отсутствие лечения достигает 40–70% в течение первого года после клинической манифестации [47].
Клинически выявляют два основных варианта синдрома: наиболее распространенный в популяции синдром Романо–Уорда с аутосомно-доминантным типом наследования и синдром Джервелла–Ланге–Нильсена – с аутосомно-рецессивным типом наследования. С момента первого исследования, доказавшего генетическую природу синдрома в 1997 г., выявлено более 400 мутаций в 12 генах, ответственных за развитие синдрома, проявляющихся нарушением функции сердечных ионных каналов [11, 41]. При этом до настоящего времени в большинстве стран мутации в известных генах выявляются только у 50–75% пробандов [23], что диктует необходимость дальнейшего изучения генетических механизмов заболевания.
Установлено, что клинические проявления заболевания и эффективность лечения больных зависят от конкретного молекулярно-генетического варианта синдрома [23]. До 80% случаев СУИQT обусловлены тремя основными молекулярно-генетическими вариантами, клиникоэлектрофизиологическая диагностика которых до настоящего времени недостаточно разработана. Степень поражения ионных каналов, а, следовательно, выраженность нарушения функции сердечных ионных каналов, зависит от вида и локализации мутации и обусловливает тяжесть заболевания [11, 41, 44].
Несмотря на успехи, достигнутые в понимании патофизиологических механизмов развития синдрома, его клинической интерпретации, до настоящего времени не решены проблемы ранней диагностики, недостаточно изучены факторы и маркеры риска ВСС при различных молекулярно-генетических вариантах синдрома, необходима разработка более эффективных методов лечения и профилактики ВСС. Наиболее остро эти проблемы затрагивают пациентов детского возраста, так как имеются лишь единичные специальные исследования синдрома удлиненного интервала QT у детей [11, 29].
Диагностика синдрома удлиненного интервала QT
На долю детей с манифестным СУИQT приходится около 5–7% от всех госпитализированных в специализированный аритмологический центр в возрасте до 18 лет, эти пациенты составляют большинство (около 60%) среди детей с имплантированными кардиовертерами-дефибрилляторами (ИКД) [4]. Клиническими проявлениями СУИQT служат удлинение интервала QT на ЭКГ, эпизоды желудочковой аритмии – наиболее часто фибрилляции желудочков, реже желудочковая полиморфная тахикардия, зарегистрированные различными методами, и син-копальные состояния (рис. 1).
Заболевание, как правило, выявляют либо на фоне выраженного удлинения QT при профилактических осмотрах, либо при целенаправленном обследовании в связи с приступами потери сознания. До настоящего времени диагностика СУИQT остается трудной задачей, особенно в отношении спорных субклинических и немых форм заболевания, а также при синкопальной форме в связи с гипердиагностикой в этих случаях эпилепсии.
Согласно данным Международного Регистра СУИQT, у 50% пробандов первое синкопальное состояние развилось в возрасте до 12 лет. Прогностически неблагоприятным является возраст манифестации первого синкопе ранее 6 лет [8]. Установлено, что триггеры синкопе с высокой степенью достоверности позволяют предположить молекулярно-генетический вариант синдрома. Так, потеря сознания во время плавания или ныряния ассоциируется только для LQT1. Возникновение синкопе во сне или в покое характерно при LQT3, а индуцированное резким звуком – типично для больных с LQT2 [50]. Физическая нагрузка провоцирует синкопе у пациентов с LQT1 и реже – с LQT2. На LQT1 и LQT2 приходится до 90% случаев синдрома, чем объясняется тот факт, что у большинства пациентов синкопе провоцируются именно физической нагрузкой [31]. При оценке зависимости риска жизнеугрожающих событий от пола и возраста было установлено, что у мальчиков в возрасте до 15 лет значительнее удлинение QTc, выше риск ВСС, однако в возрасте >15 лет ситуация меняется в противоположную сторону [11, 45].
Стандартная ЭКГ в 12 отведениях позволяет выявить удлинение интервала QT различной степени выраженности, оценить дисперсию интервала QT и изменения морфологии зубца Т. Формула Базетта остается наиболее популярным инструментом коррекции интервала QT по отношению к частоте сердечных сокращений (ЧСС) [17]. Согласно рекомендациям 2008 г., приняты следующие значения для определения удлинения интервала QT: для лиц женского пола QTc ≥ 460 мс, для лиц мужского пола – ≥ 450 мс [14]. Дисперсия интервала QT (разница между
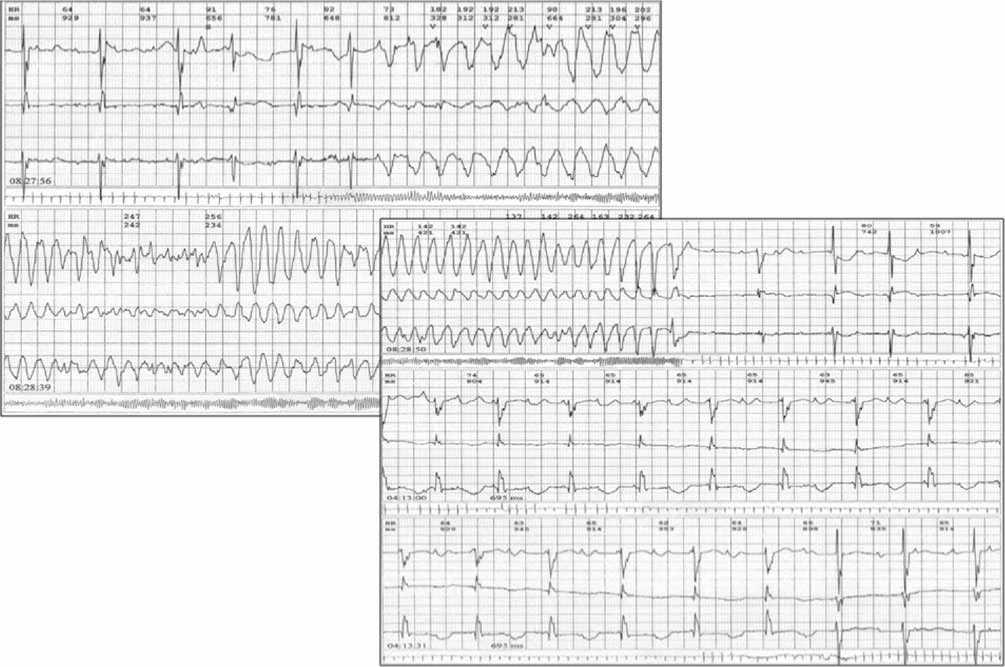
Рис. 1. Фрагмент записи ХМ больного Дмитрия П. Регистрируется желудочковая тахикардия, стартовавшая с ранней желудочковой экстрасистолы (R на T) и трансформировавшаяся в тахикардию типа “пируэт”; пароксизм сопровождался синкопе. Функциональная атриовентрикулярная (АВ) блокада на фоне экстремально длинного интервала QT после залпа
наименьшим и наибольшим значениями интервала QT, измеренными в разных отведениях ЭКГ) отражает гетерогенность продолжительности процесса реполяризации в миокарде желудочков. У больных с СУИQT была выявлена корреляция между дисперсией QT и риском развития желудочковой тахикардии [16]. Кроме того, этот показатель позволяет оценивать эффективность медикаментозной терапии. S.G. Priori с соавт. показали, что среди больных с рецидивами синкопе на фоне антиаритми-ческой терапии дисперсия интервала QT больше, чем у пациентов, получавших бета-блокаторы либо подвергшихся симпатэктомии [43].
Полиморфная желудочковая тахикардия типа “пируэт” (TdP) как причина синкопе у больных с СУИQT впервые описана F. Dessertene в 1996 г. [26]. Предполагается, что механизмом веретенообразной тахикардии может служить триггерная активность, обусловленная ранними постдеполяризациями, или механизм “повторного входа” (ре-ентри) вследствие выраженной трансмуральной дисперсии реполяризации [46]. Желудочковой тахикардии типа “пируэт” в 45–65% случаев предшествует последовательность “short-long-short” (короткий-длинный-ко-роткий интервал, включающий экстрасистолу). Это служит косвенным подтверждением того, что в основе TdP лежит механизм триггерной активности [39].
Еще одним характерным для СУИQT электрокарди- ографическим феноменом является макроальтернация зубца T, то есть изменение полярности и амплитуды зубца Т в последовательных кардиоциклах. Это редко встречающийся феномен, который обладает высокой специфичностью и достоверно ассоциируется с желудочковой тахикардией при различных сердечно-сосудистых заболеваниях и ВСС (рис. 2) [11, 41, 47].
Диагноз редко вызывает сомнения, когда удлинение QT очевидно. Однако около 30% больных имеют пороговые или подпороговые значения этого интервала (5–2 перцентили возрастного распределения показателя), которые в отсутствие у больных синкопе можно интерпретировать как сомнительные [7]. Доля больных с клинически немыми мутациями составляет от 10 до 36% случаев, учитывая результаты молекулярно-генетического анализа [23]. При этом риск ВСС среди этой группы больных сохраняется. В работах по изучению данных генетического анализа молодых людей со структурно нормальным сердцем, умерших внезапно, в 20% случаев были выявлены мутации в генах, ответственных за развитие СУИQT [41]. Немые формы синдрома чаще встречаются среди больных с LQT1 [45]. В этих случаях актуальным становится поиск методов неинвазивной диагностики синдрома, заключающихся в провокации изменений на ЭКГ. Такими провоцирующими тестами стали введение альфа- и бета-адреностимуляторов [6, 53].
Рис. 2. Макроальтернация зубца Т у больного СУИQT, зарегистрированная при 24-часовом суточном мониторировании ЭКГ – изменение полярности Т зубца в последовательных комплексах
В 2002 г. M. Ackerman и в 2003 г. W. Shimizu независимо друг от друга предложили протоколы провоцирующих тестов с применением эпинефрина, которые были эффективны не только в выявлении удлиненного интервала QT у больных с LQT1, но и в дифференциальной диагностике наиболее распространенных молекулярногенетических вариантов СУИQT [6, 13]. В протоколе M. Ackerman на фоне инфузии эпинефрина отмечалось удлинение QT у больных с LQT1, в то время как у больных с LQT2 и LQT3, а также в группе контроля QT уменьшался. В исследовании W. Shimizu после болюсного введения эпинефрина больные с LQT1 демонстрировали достоверно большее, чем при LQT2 удлинение QTc на фоне повышения ЧСС. При этом в динамике у больных с LQT1 увеличение QTc сохранялось в течение 5 мин после введения препарата, тогда как у больных с LQT2 показатель продолжительности QTc быстро возвращался к исходному значению. У больных с LQT3 после введения эпинефрина продолжительность QTc уменьшалась.
Более доступным тестом, позволяющим достичь тех же результатов, является проба с физической нагрузкой. В работах Takenaka с соавт. и Wong с соавт. было показано, что проба с физической нагрузкой играет большую роль в дифференциальной диагностике LQT1 и LQT2. В обеих работах отмечалось выраженное увеличение QTc на нагрузке у больных с LQT1, тогда как при LQT2 динамика QTc на нагрузке была незначительной [56]. Schwartz c соавт. в 1995 г. показали, что LQT3 ассоциируется со значительным укорочением QT на нагрузке, большим, чем при LQT1 и LQT2, также, чем в группе контроля [49]. Это согласуется с тем, что желудочковая тахикардия при LQT3 является брадизависимой. H. Swan c соавт. (1999 г.) в своем исследовании выявили значительное увеличение интервала QT у больных СУИQT при снижении ЧСС в периоде восстановления при сравнении с группой контроля [55]. Нашими исследованиями, включающими 173 пациента с СУИQT, увеличение QTc на нагрузке достоверно больше у детей с синкопальной формой синдрома при сравнении с бессинкопальными больными [5, 6]. Максимальная ЧСС, достигнутая в ходе нагрузки у пациентов с LQT1, достоверно ниже, чем при LQT2. Таким образом, LQT1 характеризуется уменьшенным хронотропным ответом на нагрузку и более выраженным удлинением интервала QT после нагрузки, тогда как при LQT2
отмечается нормальный прирост ЧСС и значимое укорочение интервала QT на нагрузке. Кроме того, динамика интервала QTc на нагрузке в группах LQT1 и LQT2 была разнонаправленной: у детей с LQT1 эти интервалы достоверно увеличивались, в то время как у больных с LQT2 они достоверно уменьшались.
Так как основным и принципиальным отличием больных с СУИQT от здоровых служит удлинение электрической систолы, изучению подверглось соотношение электрической и механической систолы желудочков. Еще в 1991 г. de Ferrari с соавт. впервые описали явления миокардиальной дисфункции у больных с врожденным СУИQT. Обращали на себя внимание ускорение времени ранней систолы и замедление времени расслабления миокарда у больных с СУИQT в сравнении с группой контроля, а также особенности движения миокарда в систолу в виде плато или двойного пика. Удлинение электрической систолы у детей с СУИQT сопровождается развитием выраженного несоответствия электрической систолы механической систоле, удлинением времени изово-люметрического расслабления и изменением продольной систолической деформации [2]. При этом степень нарушения электромеханического сопряжения не является геноспецифической, но достоверно ассоциируются с неблагоприятным прогнозом.
Стратификация риска развития желудочковой тахикардии при синдроме удлиненного интервала QT
Одной из особенностей желудочковой тахикардии типа “пируэт” является возможность ее самопроизвольного купирования [42], вследствие чего пациенты с СУИQT нередко имеют в анамнезе большое число син-копальных состояний. В то же время уже первый эпизод желудочковой тахикардии может привести к ВС [59], поэтому важно оценивать индивидуальный риск развития ВС для каждого пациента.
Общепринятая стратификация риска основывается на демографических параметрах, клинических проявлениях, электрокардиографических маркерах и данных генетического анализа [15, 18, 30, 40].
Молекулярно-генетический вариант синдрома имеет большое значение в прогнозировании риска развития ве- ретенообразной желудочковой тахикардии. По мере накопления данных в Международных регистрах оценивалось влияние не только варианта на течение СУИQT, но и взаимосвязь той или иной локализации с продолжительностью интервала QT и другими клиническими проявлениями синдрома. Так, было высказано предположение, что мутации, локализующиеся в С-терминальной части белка, ассоциируются с более благоприятным прогнозом [27, 40]. Ряд авторов сообщают о тяжелом течении заболевания и неблагоприятном прогнозе для жизни у больных с LQT2 при локализации мутаций в порообразующей час ти белка [37]. У этих больных синкопе манифестируют в более раннем возрасте. Кроме того, было доказано, что мутация в порообразуюшей части белка в 11 раз повышает риск жизнеугрожаемых событий у больных c QTc до 500 мс, и далее на каждые 10 мс риск увеличивается на 16% [57].
Исследование, проведенное в 2007 г. и объединившее данные трех международных регистров, позволило изучить взаимосвязь 77 различных мутаций у больных с LQT1 с симптомами. Было установлено, что мутации в трансмембранной области белка, в отличие от мутаций в С- и N-терминальной частях белка, а также мутации с доминант-негативным эффектом ассоциируются с большей продолжительностью интервала QT на ЭКГ, наличием синкопе в анамнезе и неэффективностью антиадре-нергической терапии [32, 40].
Также описаны отдельные мутации, наличие которых означает более высокий риска развития желудочковой тахикардии: для больных с LQT3 это мутация ДKPQ, а для больных с LQT1 – мутация A341V [25, 60].
Независимые факторы риска для детей были описаны в исследовании Goldenberg с соавт. (2008), которые проанализировали клинические и электрокардиографические характеристики 3015 детей с СУИQT в возрасте от 1 до 12 лет [29]. Было установлено, что QTc более 500 мс в три раза повышает риск развития внезапной остановки кровообращения (ВОК) и ВСС у мальчиков, но не у девочек. Напротив, риск рецидива желудочковой тахикардии при наличии синкопе в анамнезе был достоверно выше у девочек, чем у мальчиков. Мужской пол ассоциировался с высоким риском развития жизнеугрожаемых событий в детском возрасте. Но наиболее значимым предиктором развития желудочковой тахикардии было синкопе в анамнезе.
Индивидуальные шкалы риска синкопе и ВСС
Для оценки индивидуального риска (ИР) развития синкопе и ВСС нами была разработана шкала ИР, на основании которой больные были распределены на группы высокого, умеренного и низкого риска (табл. 1). Предикативная ценность индивидуального профиля риска, основанного на данной шкале, была исследована в груп-
Таблица 1
Шкала индивидуального риска развития жизнеугрожающей аритмии у больных с СУИQT
|
Факторы риска |
Баллы |
|
Синкопе, провоцированный нагрузкой, эмоциями, звуковым раздражителем, плаванием |
1 |
|
Синкопе без определенного триггера |
0,5 |
|
Первый синкопе в возрасте до 6 лет |
1 |
|
QTc ≥ 500 мс |
1 |
|
QTc = 460 – 499 мс . |
0,5 |
|
Альтернация зубца Т |
1 |
|
Желудочковая экстрасистолия |
0,5 |
|
Синусовая брадикардия менее 2‰ |
0,5 |
|
Внезапная остановка кровообращения в анамнезе |
1 |
|
ВСС в возрасте до 40 лет родственника I степени |
0,5 |
|
Максимальный суммарный риск |
6,5 |
пе больных с рецидивами синкопе на терапии бета-блокаторами [3]. Установлено, что вероятность рецидива синкопе тем выше, чем выше суммарный балл. Таким образом, применение этой шкалы позволяет выявить больных, нуждающихся в антиаритмической терапии, а также предположить эффективность бета-блокаторов в каждом случае.
Лечение больных с синдромом удлиненного интервала QT
Оптимизация лечения больных с СУИQT остается трудной и до конца не решенной проблемой, хотя разработанный в настоящее время комбинированный подход позволяет уменьшить риск ВСС в течение 10 лет с момента манифестации СУИQT до 2% в сравнении с 78% у лиц, не получающих адекватной терапии [37]. Рекомендации по лечению СУИQT основаны преимущественно на данных Международных Регистров и специализированных клиник; проспективные рандомизированные исследования в этой области не проводились [9, 23]. Основные методы лечения – терапия бета-блокаторами и левосторонняя симпатэктомия (ЛСЭ), а также имплантация кардиовертера-дефибриллятора. Ведутся разработки и геноспецифической терапии.
Краеугольным камнем терапии синдрома является блокада бета-адренорецепторов, которая предотвращает внезапное учащение ритма сердца, не влияя существенно на продолжительность интервала QT. К 1985 г. была накоплена доказательная база и бесспорно установлена высокая эффективность антиадренергической терапии. Так, в исследовании, где ретроспективно были проанализированы результаты лечения 233 больных с синко-пальной формой заболевания, было показано, что смертность после первого синкопе в течение 15 лет составила 9% среди тех, кто получал бета-адреноблокаторы и/или подвергся ЛСЭ, в то время как в группе нелечен-ных пациентов этот показатель приблизился к 60% [47, 58]. В 1991 г. A.J. Moss с соавт. констатировал снижение смертности с 50 до 5% за 10-летний период на фоне применения бета-блокаторов в группе больных из 328 человек [34]. Была установлена эффективность бета-адреноблокаторов при различных молекулярно-генетических ва- риантах синдрома. Согласно данным Международного Регистра, бета-адреноблокаторы предотвращают развитие желудочковой тахикардии у 81% пациентов с LQT1, у 59% – с LQT2, у 50% – с LQT3 [21, 45]. Среди бета-адреноблокаторов в терапии СУИQT наиболее широко применяются пропранолол, надолол и атенолол, кроме того, в некоторых клиниках назначают метопролол и бисопролол [19, 23, 28]. Наиболее эффективны в терапии СУИQT пропранолол и надолол. Однако пропранолол имеет ряд недостатков, связанных с необходимостью его четырехкратного приема, а также развитием толерантности при длительном
Таблица 2
Шкала экстремального риска для больных с ИКД
Впервые ЛСЭ у больных с СУИQT была применена A. Moss с соавт. в 1969 г. [33]. В 1976 г. P. Schwartz с соавт. продемонстрировали увеличение порога желудочковой фибрилляции и продолжительности рефрактерного периода миокарда желудочков после аналогичной операции [52]. В 2004 г. были опубликованы результаты симпатэктомии у 147 пациентов [48]. За восемь лет наблюдения на 91% уменьшилось количество синкопальных состояний, продолжительность интервала QT стала меньше в среднем на 39 мс; смертность в группе высокого риска снизилась до 3%. Кроме того, ЛСЭ уменьшает дисперсию интервала QT. Как и медикаментозная, хирургическая бета-адреноблокада наиболее эффективна при LQT1 [12]. В настоящее время симпатэктомия рекомендована пациентам, у которых рецидивы желудочковой тахикардии сохраняются, несмотря на прием максимально допустимой дозы бета-блокаторов [42]. Тем не менее, в группе больных с высоким риском ВСС ЛСЭ менее эффективна. Так, в работе Bos с соавт. анализировались результаты симпатэктомии у 52 больных, средний возраст которых составил 10 лет. Рецидивы жизнеугрожаемых событий после операции имели место у 23% больных с наиболее тяжелым течением заболевания [20].
Имплантация кардиовертеров-дефибрилляторов является одним из относительно новых методов лечения детей с СУИQT [11, 23, 42]. Согласно рекомендациям Американского и Европейского обществ кардиологов от 2006 г., ИКД терапия в сочетании с бета-адреноблокаторами независимо от возраста показана: больным, пережившим остановку сердца (класс I); тем, у кого сохраняются синкопальные состояния и/или желудочковая тахикардия на фоне приема бета-блокаторов (класс IIa); для профилактики ВСС у пациентов из группы высокого риска ВС, например, с диагностированным вторым и третьим молекулярно-генетическим вариантом синдрома или с QTc превышающим 500 мс (класс IIb) [1, 24].
По данным Европейского регистра, только у 28% больных с ИКД имело место хотя бы одно срабатывание [51]. На основании анализа данных регистра были выявлены независимые предикторы мотивированных срабатываний: возраст имплантации, выраженное удлинение интервала QTc, ВОК в анамнезе и рецидивы синкопе на ан-тиаритмической терапии. Эти факторы легли в основу шкалы риска мотивированных срабатываний, модифи- цированной нами для детского возраста (табл. 2). Прогнозируемый риск, рассчитанный по данной шкале, имеет три градации: крайне низкий – суммарный балл <1; умеренный – суммарный балл ≥1 и <3 и высокий – суммарный балл ≥3. Вероятность мотивированных срабатываний была в 14 раз выше у больных с суммарным риском ≥1 в сравнении с больными с суммарными риском <1 [3].
Изучение молекулярных основ СУИQT открыло возможности для применения ген-специфической терапии. Во всех случаях синдрома отмечается увеличение продолжительности потенциала действия, однако клеточный механизм, лежащий в основе этого, различен. Это отражается не только на различиях в клинической картине заболевания, но и влияет на эффективность терапии. В 1995 г. P. Schwartz с соавт. убедительно продемонстрировали эффективность препарата I класса – мексилетина у пациентов с LQT3 [23]. Другим препаратом IС класса, который был применен в лечении LQT3, является флекаи-нид. В группе больных с мутацией SCN5A-D1790G отмечалось повышение ЧСС, уменьшение продолжительности интервала QT и подавление альтернации зубца Т на фоне терапии флекаинидом [12, 23].
Новые направления в лечении СУИQT, основанные на знании молекулярных основ патогенеза, в настоящее время интенсивно разрабатываются [32]. Однако пока бета-адреноблокаторы по-прежнему остаются препаратом первого выбора.
Все больные с диагнозом СУИQT вне зависимости от объема проводимой терапии должны находиться под непрерывным мониторным наблюдением с оценкой динамики всех индивидуальных маркеров риска ВС не реже 1 раза в год. Повышение концентрации факторов и маркеров риска, что, например, типично для подростков мужского пола с LQT1, служит основанием для усиления терапии. Мониторинг позволяет значительно снизить риск ВС даже у больных с тяжелым течением синдрома.
Заключение
Таким образом, СУИQT является одной из ведущих причин внезапной аритмической смерти детей со структурно нормальным сердцем. Истинная распространенность синдрома высока, однако она все еще не включает немые формы заболевания, распространенность которых пока не известна. Это диктует необходимость проведения скрининговых молекулярно-генетических исследований на популяционном уровне. Для своевременной ранней диагностики синдрома актуально проведение
ЭКГ-скрининга новорожденных, обследование лиц, имеющих синкопальные состояния в анамнезе, а также родственников умерших внезапно в молодом возрасте. Необходимо также обследование родственников больных с уже установленным диагнозом СУИQT. При выявлении заболевания необходимо как можно раньше при помощи неинвазивных критериев оценить предполагаемый молекулярно-генетический вариант синдрома и назначить адекватную терапию. Сформулированы независимые критерии стратификации риска развития ВС для взрослых и детей, на основании которых осуществляется регулярное мониторирование пациентов. Своевременное выявление пациентов с СУИQT позволяет значительно снизить число случаев ВСС, в том числе у детей и лиц молодого возраста.
Список литературы Современная тактика ведения пациентов молодого возраста с синдромом удлиненного интервала Qt: от ранней диагностики к имплантации кардиовертера-дефибриллятора и мониторингу маркеров риска внезапной смерти
- Бокерия Л.А., Ревишвили А.Ш., Неминущий Н.М. Внезапная сердечная смерть. -М.: Гэотар-Медиа, 2011. -272 с.
- Верченко Е.Г., Березницая В.В., Ильдарова Р.А. и др. Electromechanical phenomena associated with congenital long QT syndrome in children//Eur. Heart J. -2011. -Vol. 32 (Abstract supplement). -P. 1114.
- Ильдарова Р.А. Роль фенотипической экспрессии в стратификации риска жизнеугрожающих аритмий и оптимизация терапии у детей с различными молекулярно-генетическими вариантами синдрома удлиненного интервала QT: автореф. дис.. канд. мед. наук. -М., 2013. -17 с.
- Ильдарова Р.А., Школьникова М.А., Березницкая В.В. и др. Efficacy of ICD therapy in high-risk children with Long QT syndrome//Eur. Heart J. -2012. -Vol. 33 (Abstract supplement) -P. 4102.
- Калинин A.A., Ильдарова P.A., Школьникова М.А. Влияние пробы с дозированной физической нагрузкой на функцию синусового узла и реполяризацию у детей с наследственным синдромом удлиненного интервала QT//Кардиология. -2011. -№ 9. -С. 49-56.
- Калинин Л.А., Школьникова М.А. Метаанализ данных по применению стресс-тестов в диагностике врожденного синдрома удлиненного интервала QT//Вестник аритмологии. -2013. -№ 74. -С. 60-67.
- Миклашевич И.М., Школьникова М.А., Калинин Л.А. и др. Нормальные значения временных параметров ЭКГ у детей по результатам клинико-эпидемиологического исследования “ЭКГ-скрининг детей и подростков Российской Федерации”//Кардиология. -2009. -Т. 49, № 10. -С. 47-54.
- Школьникова М.А. Первичные электрические заболевания сердца как причина внезапной смерти//Доктор. Ру. -2008. -№ 3(40). -С. 25-32.
- Школьникова М.А., Макаров Л.М., Березницкая В.В. и др. Жизнеугрожающие аритмии и внезапная сердечная смерть у детей//Вестник аритмологии. -2000. -№ 18. -С. 57-58.
- Школьникова М.А., Харлап М.С., Ильдарова Р.А. Генетически детерминированные нарушения ритма сердца//Рос. кардиологич. журн. -2011. -№1(87). -С. 8-25.
- Школьникова М.А., Харлап М.С., Ильдарова Р.А. и др. Диагностика, стратификация риска внезапной смерти и лечение молекулярно-генетических вариантов синдрома удлиненного интервала QT//Кардиология. -2011. -№ 5. -С. 50-61.
- ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death//Circulation. -2006. -Vol. 114. -P. e385-e484.
- Ackerman M.J., Khositseth A., Tester D.J. et al. Epinephrine-induced QT interval prolongation: a gene-specific paradoxical response in congenital long QT syndrome//Mayo Clin. Proc. -2002. -Vol. 77. -P. 413-421.
- Rautaharju P.M., Surawicz B., Gettes L.S. AHA/ACCF/HRS Recommendations for the standardization and interpretation of the electrocardiogram. Part IV: The ST segment, T and U waves, and the QT interval a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society endorsed by the International Society for Computerized Electrocardiology//J. Am. Coll. Cardiol. -2009. -(Published online Feb. 19, 2009).
- Aizawa Y., Ueda K., Scornik F et al. Novel mutation in KCNQ1 associated with a potent dominant negative effect as the basis for the LQT1 form of the long QT syndrome//J. Cardiovasc. Electrophysiol. -2007. -Vol. 18(9). -P. 972-977.
- Antzelevitch C. The role of spatial dispersion of repolarization in inherited and acquired sudden cardiac death syndromes//Am. J. Physiol. Heart Circ. Physiol. -2007. -Vol. 293(4). -P. H2024-H2038.
- Bazett H.C. An analysis of the time-relations of electrocardiograms//Heart. -1920. -Vol. 7. -P. 353-370.
- Berul C.I. Congenital long QT syndromes: who’s at the risk for sudden cardiac death?//Circulation. -2008. -Vol. 117. -P. 2178-2180.
- Besana A., Wang D.W., George A.L. et al. Nadolol block of Nav1.5 does not explain its efficacy in the long QT syndrome//J. Cardiovasc. Pharmacol. -2012. -Vol. 59. -P. 249-253.
- Bos J.M., Bos K.M., Johnson J.N. et al. Left cardiac sympathetic denervation in long QT syndrome: analysis of therapeutic nonresponders//CIRCEP.112.000102. -2013. -292 p.
- Chatrath R., Bell C.M., Ackerman M.J. Beta-blocker therapy failures in symptomatic probands with genotyped long-QT syndrome//Pediatr. Cardiol. -2004. -Vol. 25. -P. 459-465.
- Chockalingam P., Girardengo G., Johnson J.N. et al. Not all betablockers are equal in the management of long QT syndrome types 1 and 2: higher recurrence of events under metoprolol//J. Am. Coll. Cardiol. -2012. -Vol. 60. -P. 2092-2099.
- Crotti L., Celano G., Dagradi F et al. Congenital long QT syndrome//Orphanet Journal of Rare Diseases. -2008. -Vol. 3. -P. 18.
- Crotti L., Spazzolini C., De Ferrari G.M. et al. Is the implantable defibrillator appropriately used in the long QT syndrome? Data from the European Registry//Heart Rhythm. -2004. -Vol. 1. -S82.
- Crotti L., Spazzolini C., Schwartz PJ. et al. The common Long QT Syndrome mutation KCNQ1/A341V causes unusually severe clinical manifestations in patients with different ethnic backgrounds: toward a mutation-specific risk stratification//Circulation. -2007. -Vol. 116. -P. 2366-2375.
- Dessertene F La tachycardie ventricularie a deux foyer opposes variables//Arch. Mal. Cooeur. -1966. -Vol. 59. -P. 263-272.
- Donger C., Denjoy I., Berthet M. et al. KVLQT1 C-terminal missense mutation causes a forme fruste long-QT syndrome//Circulation. -1997. -Vol. 96. -P. 2778-2781.
- Expert consensus document on β-adrenergic receptor blockers. The Task Force on Beta-Blockers of the European Society of Cardiology//Eur. Heart J. -2004. -Vol. 25. -P. 1341-1362.
- Goldenberg I., Moss A.J., Peterson D.R. et al. Risk factors for aborted cardiac arrest and sudden cardiac death in children with the congenital long-QT syndrome//Circulation. -2008. -Vol. 117. -P. 2184-2191.
- Hobbs J.B., Peterson D.R., Moss A.J. et al. Risk of aborted cardiac arrest or sudden cardiac death during adolescence in the long-QT syndrome//JAMA. -2006. -Vol. 296. -P. 1249-1254.
- Kim J.A., Lopes C.M., Moss A.J. et al. Trigger-specific risk factors and response to therapy in long QT syndrome type 2//Heart Rhythm. -2010. -Vol. 7(12). -P. 1797-1805.
- Moss A.J., Goldenberg I. Importance of knowing the genotype and the specific mutation when managing patients with long QT syndrome//Circ. Arrhythm. Electrophysiol. -2008. -Vol. 1. -P. 219-226.
- Moss A.J., McDonald J. Unilateral cervicothoracic ganglionectomy for the treatment of long QT interval syndrome//N. Engl. J. Med. -1971. -Vol. 285. -P. 903-904.
- Moss A.J., Schwartz P.J., Crampton R.S. et al. The long QT syndrome. Prospective longitudinal study of 328 families//Circulation. -1991. -Vol. 84. -P. 1136-1144.
- Moss A.J., Shimizu W., Wilde A.A. et al. Clinical aspects of type-1 long-QT syndrome by location, coding type, and biophysical function of mutations involving the KCNQ1 gene//Circulation. -2007. -Vol. 115. -P. 2481-2489.
- Moss A.J., Shimizu W., Wilde A.A. et al. Clinical aspects of type-1 long-QT syndrome by location, coding type, and biophysical function of mutations involving the KCNQ1 gene//Circulation. -2007. -Vol. 115. -P. 2481-2489.
- Moss A.J., Zareba W., Hall W.J. et al. Effectiveness and limitations of beta-blocker therapy in congenital long QT syndrome//Circulation. -2000. -Vol. 101. -P. 616-623.
- Moss A.J., Zareba W., Kaufman E.S. et al. Increased risk of arrhythmic events in long-QT syndrome with mutations in the pore region of the human ether-a-gogo-related gene potassium channel//Circulation. -2002. -Vol. 105. -P. 794-799.
- Noda T., Shimizu M., Satomi K. et al. Classification and mechanism of Torsades de Pointes initiation in patients with congenital long QT syndrome//Eur. Heart J. -2004. -Vol. 25. -P. 2149-2154.
- Piippo K., Swan H., Pasternack M. et al. A founder mutation of the potassium channel KCNQ1 in long QT syndrome: implications for estimation of disease prevalence and molecular diagnostics//J. Am. Coll. Cardiol. -2001. -Vol. 37. -P. 562-568.
- Priori S.G., Antzelevitch C. Inherited arrhythmogenic diseases//Sudden Cardiac Death/edited by S.G. Priori, D.P. Zipes. -Wiley, 2005. -292 p.
- Priori S.G., Bloise R., Crotti L. The long QT syndrome//Europace. -2001. -Vol. 3. -P. 16-27.
- Priori S.G., Napolitano C., Diehl L., Schwartz P.J. Dispersion of the QT interval: a marker of therapeutic efficacy in the idiopathic long QT syndrome//Circulation. -1994. -Vol. 89. -P. 1681 1689.
- Priori S.G., Napolitano C., Schwartz P.J. et al. Association of long QT syndrome loci and cardiac events among patients treated with beta blockers//JAMA. -2004. -Vol. 292. -P. 1341-1344.
- Priori S.G., Schwartz P.J., Napolitano C. et al. Risk stratification in the long QT syndrome//N. Engl. J. Med. -2003. -Vol. 348. -P. 1866-1874.
- Roden D.M., Lazzara R., Rosen M. et al. Multiple mechanisms in the long-QT syndrome. Current knowledge, gaps and future direcrions//Circulation. -1996. -Vol. 94. -P. 1996-2012.
- Schwartz P.J. Idiopathic long QT syndrome: progress and questions//Am. Heart J. -1985. -Vol. 109. -P. 399-411.
- Schwartz P.J., Priori S.G., Cerrone M. et al. Left cardiac sympathetic denervation in the management of high-risk patients affected by the long QT syndrome//Circulation. -2004. -Vol. 109. -P. 1826-1833.
- Schwartz P.J., Priori S.G., Locati E.H. et al. Long QT syndrome patients with mutations of the SCN5A and HERG genes have differential responses to Na+ channel blockade and to increases in heart rate//Circulation. -1995. -Vol. 92. -P. 3381-3386.
- Schwartz P.J., Priori S.G., Spazzolini C. et al. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias//Circulation. -2001. -Vol. 103. -P. 89-95.
- Schwartz P.J., Spazzolini C., Priori S.G. et al. Who are the long-QT syndrome patients who receive an implantable cardioverter-defibrillator and what happens to them? Data from the European Long-QT Syndrome Implantable Cardioverter-Defibrillator (LQTS ICD) Registry//Circulation. -2010. -Vol. 122. -P. 1272-1282.
- Schwartz P.J., Verrier R.L., Lown B. Effects of stellectomy and vagotomy on ventricular refractoriness//Circ. Res. -1977. -Vol. 40. -P. 536-540.
- Shimizu W., Noda T., Takaki H. et al. Epinephrine unmasks latent mutation carriers with LQT1 form of congenital long-QT syndrome//J. Am. Coll. Cardiol. -2003. -Vol. 41. -P. 633-642.
- Stramba-Badiale M., Crotti L., Goulene K. et al. Electrocardiographic and genetic screening for long QT syndrome: results from a prospective study on 44,596 neonates//Circulation. -2007. -Vol. 116 (Abstr. Suppl.). -P. II377.
- Swan H., Viitasalo M., Piippo K. et al. Sinus node function and ventricular repolarization during exercise stress test in long QT syndrome patients with KvLQT1 and HERG potassium channel defects//J. Am. Coll. Cardiol. -1999. -Vol. 34. -P. 823-829.
- Takenaka K., Ai T., Shimizu W. et al. Exercise stress test amplifies genotype-phenotype correlation in the LQT1 and LQT2 forms of the long-QT syndrome//Circulation. -2003. -Vol. 107(6). -P. 838-844.
- Towbin J.A., Keating M.T., Priori S.G. et al. Increased risk of arrhythmic events in long-QT syndrome with mutations in the pore region of the human ether-a-go-go-related gene potassium channel//Circulation. -2002. -Vol. 105. -P. 794-799.
- Vincent G.M., Fox J., Zhang L. et al. Beta-blockers markedly reduce risk and syncope in KVLQT1 long QT patients//Circulation. -1996. -Vol. 94 (Suppl. I). -Vol. I-204.
- Vincent G.M., Zhang L., Timothy K.W. et al. Long QT syndrome patients with normal to borderline prolonged QTc intervals are at risk for syncope, cardiac arrest and sudden death//Circulation. -1999. -Vol. 100. -P. 1272-1282.
- Wehrens X.H., Abriel H., Cabo C. et al. Arrhythmogenic mechanism of an LQT-3 mutation of the human heart Na(+) channel б-subunit: a computational analysis//Circulation. -2000. -Vol. 102. -P. 584-590.


