Современные контролируемые миниинвазивные методы диагностики и лечения острого деструктивного панкреатита
Автор: Борсуков Алексей Васильевич, Мамошин Андриан Валерьевич, Алехнович Алексей Владимирович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 (18), 2014 года.
Бесплатный доступ
В статье рассматриваются современные миниинвазивные методики диагностики и лечения острого деструктивного панкреатита и его осложнений. Описаны такие перспективные мининвазивные методики, как мининвазивная многочастотная биоимпедансометрия, кристаллография. Применялись различные по объему контролируемые миниинвазивные вмешательства в определенной последовательности в зависимости от клинико-морфологической формы патологического процесса. Перспективным направлением в развитии миниинвазивных методов при деструктивном панкреатите представляется эндокавитальное ультразвуковое исследование.
Ультразвуковая томография, миниинвазивные вмешательства, миниинвазивная биоимпедансометрия, кристаллографический метод, эндокавитальное ультразвуковое исследование
Короткий адрес: https://sciup.org/14338483
IDR: 14338483
Текст научной статьи Современные контролируемые миниинвазивные методы диагностики и лечения острого деструктивного панкреатита
Острый деструктивный панкреатит (ОДП) является одной из важнейших проблем неотложной хирургии органов брюшной полости. Это обусловлено, прежде всего, неуклонным ростом заболеваемости, увеличением частоты осложнений и высокой летальностью [1, 2, 3]. При ОДП летальность составляет 20-45% без дифференциации клинических форм, достигая при инфицированном панкреонекрозе 85%, а при фульминантном течении заболевания – 100% [1].
Анализ данных литературы позволяет признать, что клиника не располагает четкими критериями и методами дифференциального диагноза клинико-морфологических форм ОДП и его постнекротических осложнений. Ни один из существующих сегодня методов диагностики сам по себе не может быть признан абсолютно точным для раннего распознавания панкрео-некроза и его осложнений. Следовательно, требуется комплексный подход в диагностике данного заболевания с учетом клинических и лабораторных данных, ультразвуковой томографии (УЗТ), лапароскопии, рентгенологических методов исследования, компьютерной томографии (КТ) и магнитно-резонансной томогра-фии[1, 2, 3]. По нашему мнению, для ранней дифференциальной диагностики экссудативных образований, осложняющих течение ОДП, общепринятые методики обследования могут быть эффективно дополнены миниинвазивной многочастотной биоимпедансометрией, способной во время миниинвазивной манипуляции в режиме реального времени определить состояние метаболизма зоны деструкции [4].
На основании имеющихся сведений в отечественной и зарубежной литературе, актуальным представляется вопрос о своевременном выявлении инфицированного панкреонекроза и об аргументированном определении показаний к использованию контролируемых мини-инвазивных хирургических методик на различных стадиях развития заболевания [5, 6, 7].
Материалы и методы исследования
Клинические наблюдения содержат анализ 293 больных с различными клинико-морфологическими формами ОДП. Всем больным выполнены малоинвазивные вмешательства под контролем УЗТ и РТВ. Мужчин было 224 (76,5%), женщин – 69 (23,5%). Возраст больных варьировал от 19 до 84 лет. В развитии заболевания алкогольный фактор выявлен у 225 (76,8%) больных, билиарный – у 25 (7,7%), другой этиологии (травма, послеоперационный, идиопатический) – у 42 (14,3%) больных.
В соответствии с классификацией острого панкреатита, принятой на Международном согласительном симпозиуме в Атланте (1992) больные распределены на группы, соответствующие клинико-морфологической форме заболевания. В исследуемой группе пациентов 87 (29,7%) больных были с острыми жидкостными скоплениями, 28 (9,6%) – с панкреатическим некрозом, 79 (26,9%) – с панкреатогенным абсцессом, 99 (33,8%) – с панкреатической ложной кистой.
Всем больным была выполнена комплексная клинико-лабораторная диагностика и инструментальные исследования, основными целями которых были верификация клиникоморфологических форм ОДП, наличия и формы осложнений, абдоминального сепсиса и по-лиорганной недостаточности. Выявленные различия в симптоматике и данных лабораторных методов исследования позволили дифференцировать основные формы ОДП. Лучевые методы диагностики включали рентгенографию органов грудной клетки и органов брюшной полости, ультразвуковое исследование органов брюшной полости в режиме серой шкалы, цветового допплеровского картирования и энергетического допплера, пошаговую КТ. Ведущим методом, играющим основную роль в постановке диагноза, динамическом наблюдении за фазами течения патологического процесса и решении вопроса о применении пунк-ционно-дренирующих технологий, а также в динамическом контроле эффективности проводимого лечения, являлась УЗТ. Для описания диффузных и очаговых поражений поджелудочной железы были использованы стандартизированные ультразвуковые критерии [4]. Эта оценка предполагает стандартизацию в определении значимости качественных признаков описания изображения. КТ в основном выполнялась больным с распространенными гнойными осложнениями перед планируемыми лечебными миниинвазивными манипуляциями для уточнения распространенности патологического процесса и получения информации о состоянии парапанкреатической и забрюшинной клетчатки.
Всем больным были выполнены различные по объему диагностические и лечебные мини-инвазивные вмешательства под контролем УЗТ и РТВ [4, 5, 6, 7]. В целях детализации этапа эволюции заболевания, морфологической и бактериологической верификации диагноза у всех пациентов применялись тонкоигольные диагностические пункции (ТДП) под УЗ-контролем [7, 8]. Показанием к ТДП считали наличие изменений, подозрительных в отношении деструкции или очагового поражения поджелудочной железы, сальниковой сумки и/или забрюшинного пространства. Программа проведения ТДП была мультифокальной: забор производили из 4-х точек не менее 2-х отделов поджелудочной железы и зоны сальниковой сумки иглой типа Chiba и AngiomedG 19-20-21 с тангенциальным расположением биопсийного адаптера на конвексном датчике 3,5-7,5 МГц. Сопоставляли результаты УЗТ, цитологическую и бактериологическую картину заболевания.
Во время выполнения ТДП у 124 (42,3%) больных проведена миниинвазивная многочастотная биоимпедансометрия образования с использованием диэлектрической иглы с многочастотным биоимпедансным томографом «ИМТ», (г. Ярославль). Все показатели импеданса рассматривались относительно поляр- ности (моно- и биполярно) электродов и частоты переменного тока. Измерение электрического импеданса проводилось на трех частотах 1, 10 и 100 кГц. Показатели импеданса, снимаемые в режимах in vivo и in vitro имели свои осо-бенности.Система измерения in vivo состоит из изолированных пункционных игл, электродов и регистрирующего биоимпедансные параметры устройства, последовательно подключенных между собой. Небольшие размеры игл (G22) с диэлектрическим наконечником благодаря ультразвуковому мониторингу предусматривали их точное позиционирование и фиксацию в интересующей зоне исследования. У всех пациентов с очаговым поражением мы исследовали биоимпеданс капсулы очага, периферии и центральной зоны образования (рис.1).
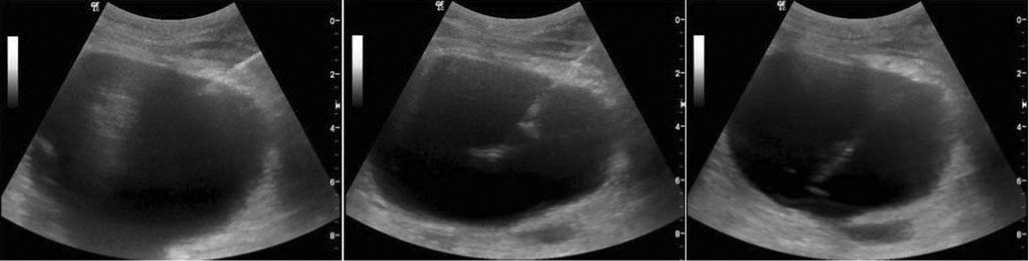
Рис. 1. УЗ-томограммы монополярной мультизональной БИМ жидкостного образования при остром деструктивном панкреатите
Во время биполярной биоимпедансометрии диэлектрические иглы фиксировались таким образом, чтобы максимально охватить исследуемый участок органа, при этом расстояние между ними составляло 10 мм. Исследование аспирата in vivo вовремя миниинвазивного вмешательства позволяет оценить характер жидкости в реальном времени, однако это зачастую дает ложноположительные и ложноотрицательные результаты, при этом использование методики биполярной импедансометрии in vitro позволяет уменьшить количество таких ошибок.
Наряду с другими исследованиями мы применяли метод клиновидной дегидратации аспирата, полученного при проведении миниин-вазивных вмешательств под контролем УЗТ и РТВ [4]. Исследование структурообразующих элементов натурных образцов высушенных капель (фации) проводился с помощью светового микроскопа, бинокулярной лупы при увеличениях х32, х56, х72. Определение параметров фации проводилось путем обработки цифро- вых фотографий с помощью компьютерной программы для морфометрии (рис. 2).
Определялись следующие параметры: радиус периферической зоны, общий радиус, длина трещины (минимальная, максимальная), число трещин, описывалась форма трещин, порядок деления кристаллов, углы кристаллизации, длина осей кристаллизации, а также стабильность указанных параметров в динамике [9].
Показанием к чрескожному дренированию считали экссудативные образования и зоны деструкции, осложняющие течение ОДП при рефрактерности их к комплексной консервативной терапии.
Малокалиберное дренирование осуществляли одноразовыми пункционными нефростоми-ческими дренажными наборами Rush (Teleflex Medical) по двухмоментной методике Сельдин-гера и одномоментной методике с помощью стилет-катетера с установкой дренажа с памятью формы типа "pigtail".
При крупнокалиберном дренировании опе-

Рис. 2. Кристаллографическое исследование фации острого жидкостного скопления (а), ложной кисты (б), панкреатогенного абсцесса (в).
рационный доступ осуществляли с помощью известной техники телескопической дилятации дренажного канала от 8Fr до36Fr (рис. 3).
У 61 (20,8%) пациента с гнойно-некротичес- кими осложнениями ОДП использованы возможности эндосонографии для интракавиталь-ной ультразвуковой оценки состояния гнойных полостей.
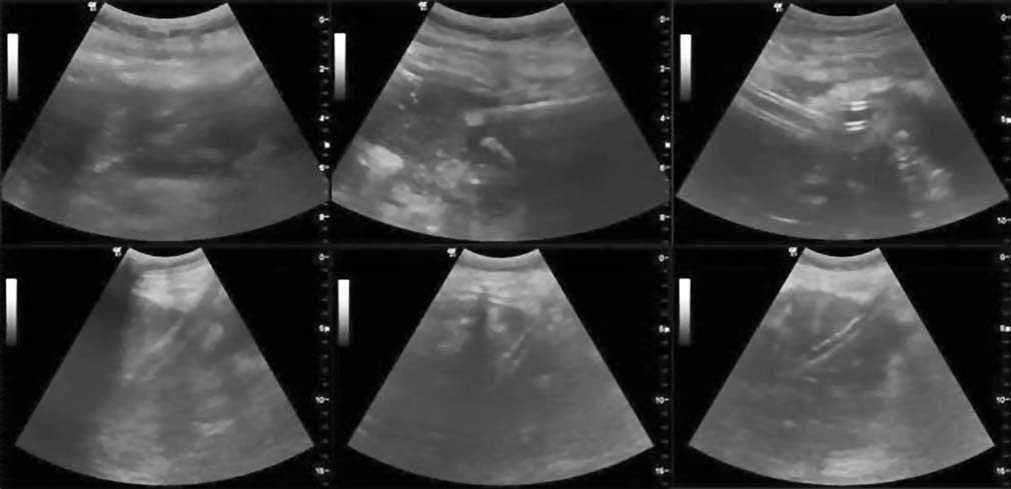
Рис. 3. Крупнокалиберное дренирование зоны деструкции.
С целью повышения точности оценки динамики патологического процесса, прогнозирования дальнейшего течения заболевания производилась интракавитальная УЗТ патологического очага с определением структуры капсулы, эхоструктуры стенки очага и его ультразвуковой пальпации. УЗТ выполнялась с использованием конвексного эндоскопического ультразвукового датчика (5,0 МГц) на аппарате Aloka SSD-630 и линейного лапароскопического датчика частотой 7.5Мгц, сопряженного со сканером SonoScape S8, MyLab 50 (рис. 4).
Статистическая обработка данных проводи- лась с указанием числа наблюдений для каждого признака, с вычислением уровня достоверности, доверительного интервала (для основных результатов исследования) и частоты выявления признака. Описательная статистика представлялась следующими показателями M±SD, Me (LQ;UQ), % (n/N). Проверка статистических и корреляционных гипотез осуществлялась на уровне значимости =0,05.
Результаты исследования и их обсуждение
У больных, поступивших в клинику, наблюдались различные клинические формы течения
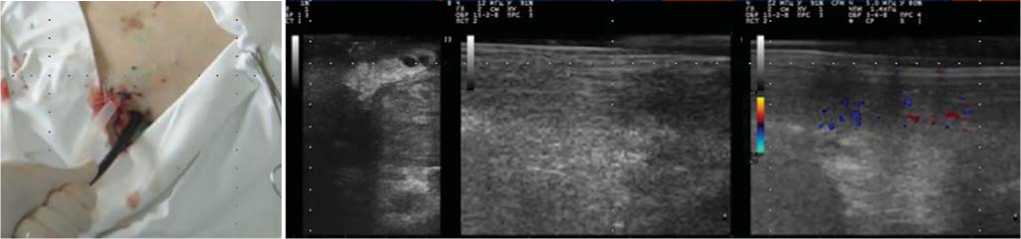
Рис. 4. Интракавитальная УЗТ гнойной полости.
ОДП. Обращала на себя внимание зависимость выраженности и характера клинической картины заболевания от фазы патологического процесса. Так, на ранних стадиях деструктивного процесса превалировали признаки ферментной токсемии (83,7%). Клиническая картина более позднего периода заболевания характеризовалась развитием гнойно-септических осложнений (95,2%).
Изменения при лабораторном исследовании крови (красная кровь, развернутая лейкоцитарная формула, лейкоцитоз, повышение СОЭ) не были специфичными и являлись вспомогательными признаками заболевания. При биохимическом исследовании определялись нарушения функции поджелудочной железы и печени разной степени в зависимости от стадии патологического процесса.
Миниинвазивные вмешательства под контролем УЗТ и РТВ осуществляли в определенной последовательности: в виде сочетания разных по кратности пункционных и дренажных вмешательств с постановкой дренажей различного диаметра и типа. Выбор вмешательства определялся этапом развития патологического процесса в соответствии с современной классификацией острого панкреатита преимущественно на основании эхографической картины [10, 11].
Острое жидкостное скопление характеризовалось наличием одного или нескольких анэхо-генных или гипоэхогенных образований неправильной формы с четкими или нечеткими, чаще неровными контурами, однородной структуры, расположенных внутри железы, в парапанкреа-тическом, забрюшинном пространствах и брюшной полости (64%). При инфицированном характере острого жидкостного скопления внутренняя структура образования была неоднородной, с эхопозитивными включениями на стенках или в его просвете (36%). Учитывая то, что острые жидкостные скопления у больных острым деструктивным панкреатитом возникают рано, в фазе токсемии, а пациенты поступали в стационар в разные сроки от начала заболевания, ультразвуковая картина изменений со стороны поджелудочной железы и окружающих тканей характеризовалась спектром изменений, характерных для некротической, инфильтративно-некротической форм и асептической секвестрации.
При панкреатическом некрозе гнойное расплавление тканей панкреатического инфильтрата сопровождалось появлением в его структуре большого количества мелких эхонегативных неправильно расположенных структур с нечеткими контурами. При динамическом наблюдении отмечалось их слияние с исходом в более крупные включения неоднородной плотности. Распространение процесса на окружающие ткани сопровождалось потерей четкости визуализации их структуры [10, 11].
При абсцессах брюшной полости и забрюшинного пространства выявлялся единичный очаг неправильной формы, пониженной эхогенности. Внутренняя структура гнойника неоднородная с единичными равномерно или беспорядочно рассеянными мелкими эхопозитивными включениями. Позади очага имелась полоса отражений повышенной интенсивности [10, 11].
При формировании кистозных образований в паренхиме железы и/или парапанкреатичес-кой клетчатке определялось кистозное образование с однородной гипоэхогенной структурой, до 20-25 см в диаметре. Паренхима железы, окружающая кисту, имела неоднородную структуру [10, 11].
Чувствительность, специфичность и диагностическая эффективность ультразвукового исследования составила соответственно 85,47%, 90,4% и 89,6%.
Следующим этапом диагностики у всех больных было проведение ТДП зон деструкции в поджелудочной железе, сальниковой сумке и забрюшинном пространстве. ТДП с целью ранней микробиологической и морфологической верификации природы очаговых изменений проводились по диагностическим пункционным схемам [1]. Эти схемы заключались в последовательном применении различных игл, изменении кратности выполнения ТДП.
При статистической обработке результатов цитологических заключений аспирата из острых жидкостных скоплений выявлены различные сочетания элементов воспаления, элементов крови, скопления некротических масс в зависимости от преобладания некротических, инфильтративно-некротических изменений или асептической секвестрации. В мазке-отпечатке аспирата гнойно-некротической формы наблюдались преимущественно некротические массы. Аспират, полученный из полости абсцессов, содержал в большом количестве элементы некротических масс и микробные тела, значительное количество элементов воспаления (нейтрофильные и разрушенные лейкоциты) и единичные измененные клеточные элементы крови. При кистозных образованиях в мазке-аспирате визуализировались элементы кистозной полости (слущенный неизмененный низкопризматический и уплощенный эпителий с дистрофическими изменениями) и жировой компонент в виде кристаллов на фоне умеренного количества элементов воспаления (макрофаги и многоя-ядерные клетки) и некротических масс. При всех клинико-морфологических формах ОДП в мазке-аспирате встречались неизмененные эритроциты и клетки мезотелия брюшины, появление которых обусловлено повреждением мелких кровеносных сосудов и прохождением иглы через брюшную полость при проведении пункции. Чувствительность, специфичность и диагностическая эффективность цитологического исследования в работе составила соответственно 87,7%, 95,4% и 91,6%.
У 126 (43%) пациентов бактериологический посев аспирата был отрицательным. У 167 (57%) пациентов результаты микробиологического исследования оказались положительными. В 75% случаев бактериальная флора была представлена условно-патогенными энтеробактериями грамотрицательного спектра. Частота инфицирования грамположительными возбудителями составила 25%. Чувствительность, специфичность и диагностическая эффективность микробиологического исследования по нашим данным составила соответственно 87,7%, 94,3% и 90,7%.
При проведении миниинвазивной биоимпе-дансометрии у всех пациентов с ОДП наблюдалась зависимость величины импеданса от частоты переменного тока, глубины измерения. Величины импеданса корригировали в зависимости от структурной организации содержимого жидкостного образования. При всех экссудативных образованиях биоимпеданс уменьшался с увеличением частоты. В зависимости от глубины измерения наблюдалось уменьшение величины импеданса. При проведении биоимпедансомет-рии аспирата при остром скоплении жидкости и псевдокисте со временем отмечается рост импеданса, а при абсцессе – вначале падение, а затем рост. Показатели биоимпеданса, в зависимости от зоны очага (периферия, центр), были статистически значимо различимы при ложной кисте и панкреатогенном абсцессе железы. При остром скоплении жидкости наибольший рост импеданса отмечался до 20 минуты после пункции, а при псевдокисте и абсцессе – после 20 минуты. Цифры импеданса в 2 раза выше у аспирата из острого скопления жидкости по сравнению с псевдокистой. В результате была получена диагностическая система, позволяющая на раннем этапе дифференцировать характер очагового поражения при ОДП.
Сущность кристаллографического исследования заключается в исследовании параметров капли аспирата (фации), в процессе дегидратации которой формируются фиксированные структуры, вид и локализация которых определяется комплексом количественных и качественных параметров присутствующих веществ и характером их взаимосвязей [9]. При этом формируется соответствующая кристаллографическая картина, структура и степень выраженности параметров которой зависит от характера биожидкости – ложная киста, острое скопление жидкости и панкреатический абсцесс. У пациентов с панкреатогенным абсцессом среднее значение коэффициента Sбелк/Sобщ на 47,4% больше, чем в группах с острым скоплением жидкости и ложной кистой (ϕ*эмп=2,78, р<0,05). При исследовании аспирата, полученного у больных с острым скоплением жидкости и ложной кистой коэффициент Sбелк/Sобщ в большинстве случаев (76,9 и 67,6% соответственно) находился в области минимальных значений, т.е. отношение было менее 0,4. У пациентов с панкреатогенным абсцессом установлено достоверное увели- чение длины и уменьшение количества трещин по сравнению с данными при других экссудативных осложнениях ОДП (р<0,05). При панкреатическом абсцессе у 37,5% больных количество трещин изменялось при повторном исследовании, тогда как у больных с ложной кистой и острым скоплением жидкости данный признак был стабильным. В группах больных с панкреатогенным абсцессом и ложной кистой преобладало деление кристаллов до ветвей 1 порядка (68,7% и 61,8%), в фациях больных с острыми скоплениями жидкости деление кристаллов в большинстве случаев достигало 2 порядка (69,2%). На основании анализа и сопоставления результатов кристаллографического исследования аспирата, клинической картины, результатов УЗТ, данных цитологического и бактериологического исследования полученного материала были выявлены наиболее информативные кристаллографические признаки фаций при ОДП, осложненном развитием различных экссудативных образований. Чувствительность, специфичность и точность кристаллографического метода исследования аспирата составили соответственно 91,8%, 93,3% и 92,3%.
Основой лечебных миниинвазивных манипуляций при осложненном течении ОДП являлись комбинации пункционного лечения (диа-певтические) и установка дренажей (лечебные). Точкой приложения для выполнения дренирующих вмешательств являлся ограниченный деструктивный процесс с преобладанием экссудативного компонента при наличии адекватного акустического окна. Манипуляции проводились в определенной последовательности: в виде сочетания пункционных игл и дренажей различного диаметра, типа, а также кратности проведения вмешательств. Всего выполнено 518 миниинвазивных вмешательств под контролем УЗТ и РТВ с лечебной целью. В 92,8% случаев выполнение лечебных миниин-вазивных вмешательств на фоне активной комплексной консервативной терапии позволило купировать патологический процесс и избежать открытых оперативных вмешательств.
Трансабдоминальная УЗТ является быстрым и неинвазивным высокоинформативным методом прямой диагностики при развитии очаговых гнойно-некротических осложнений ОДП. Однако традиционные ультразвуковые признаки (контуры, размеры, эхогенность и т.д.) не несут принципиально новой информации о характере и динамике патологического процесса. При проведении эндокавитального ультразвукового исследования гнойной полости наблюдалось изменение информативности таких ультразвуковых признаков как структура капсулы, эхост-руктура стенки очага и его ультразвуковая пальпация, которые менее значимы при трансабдоминальной ультразвуковой томографии. Качественно важным являлась комбинация традиционного и нового динамического признака: эхоструктура-подвижность; размер включения-степень фиксации к капсуле; эхооднородность содержимого-быстрота вымываемости из полости по дренажу. Именно они обладали минимальной вероятностью возникновения диагностической ошибки: 0,114, доверительный интервал [0,098-0,12] по сравнению с трансабдоминальным ультразвуковым исследованием – 0,876, доверительный интервал [0,859-0,92].
Выводы
ОДП в зависимости от фазы развития патологического процесса имеет полиморфную эхографическую картину. Диагностическая точность неинвазивной УЗТ в верификации стадии развития ОДП и характера его осложнений не превышает 89,6%, что определяет необходимость выполнения ТДП. ТДП под контролем УЗТ с последующим микробиологическим и цитологическим исследованием аспирата является высокоинформативным методом диагностики характера поражения тканей и детализации фазы развития патологического процесса. Проведение методов миниинвазивной био-импедансометрии и кристаллографии может быть использовано в решении вопросов ранней уточняющей дифференциальной диагностики, прогнозирования течения экссудативных образований при ОДП и определения дальнейшей лечебной тактики. Перкутанные диапевтичес-кие технологии представляются эффективным миниинвазивным методом санации экссудативных и гнойных осложнений панкреонекроза. Использование возможностей эндокавитально-го ультразвукового исследования в клинике позволило оценить топографо-анатомические особенности органов в векторе изображения, направленном изнутри кнаружи со сравнительным анализом ультразвуковой семиотики в комбинации количественных и динамических ультразвуковых признаков. Это дает качественно новую информацию о стадировании патологического процесса, что позволяет адекватно изменить дальнейшую диагностическую и лечебную тактику.
Список литературы Современные контролируемые миниинвазивные методы диагностики и лечения острого деструктивного панкреатита
- Ермолов А.С., Иванов П.А., Благовестнов Д.А., Гришин А.В., Андреев В.Г. Диагностика и лечение острого панкреатита. М.: Видар, 2013. 382 с.
- Затевахин И.И., Цициашвили М.Ш., Будурова М.Д., Алтунин А.И. Панкреонекроз. М., 2007.
- В.С. Савельев, М.И. Филимонов, С.З. Бурневич. Панкреонекрозы. М.: ООО "Медицинское информационное агентство", 2008. 264 с.
- Борсуков А.В., Шолохов В.Н. Малоинвазивные технологии под ультразвуковой навигацией в современной клинической практике. Смоленск, 2009. 248 с.
- Нестеренко Ю.А., Лаптев В.В., Михайлусов С.В. Диагностика и лечение деструктивного панкреатита. М.: ООО "Бином-Пресс", 2004. 304 с.
- Kam A., Markson G., WongK., et al. Inappropiate use of percutaneous drainage in the management of pancreatic necrosis//J Gastroenterol Hepatol. 1999. V. 14. P. 699-704.
- Paye F., Rotman N., Radier C., et al. Percutaneous aspiration for bacteriological studies in patients with necrotizing pancreatitis//Br J Surg. 1998. Vol. 85, N6. P. 755-9.
- Rau B., Pralle U., Mayer J.M., Beger H.G. Role of ultrasonographically guided fine needle aspiration cytology in diagnosis of infected pancreatic necrosis//Br J Surg. 1998. Vol. 85. P. 179-84.
- Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека. М., 2001. 304 c.
- Охотников О.И., Григорьев С.Н., Яковлева М.В. Эхо-семиотика деструктивного панкреатита//Актуальные вопросы хирургической гастроентерологии. Курск, 2003. С. 30-32.
- Практическое руководство по ультразвуковой диагностике. Общая ультразвуковая диагностика. Изд-е 2-е. Под ред. В.В. Митькова. М.: Издательский дом Видар, 2011. 720 с.


