Современные методы ранней дифференциальной диагностики острого нарушения мезентериального кровообращения
Автор: Гаджимурадов Р.У., Дибиров М.Д., Парфенов И.П., Халидов О.Х., Сидорова Д.И., Фомин В.С., Струценко М.В., Осипов И.Ю., Гусейнов Г.М.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 1 (91), 2025 года.
Бесплатный доступ
Введение. Острая форма мезентериальной ишемии остаётся актуальной и серьёзной проблемой в современной медицине. Использование КТ-ангиографии и селективной мезентерикографии в современных условиях ургентной хирургии, к сожалению, трудноосуществимо в большинстве районных и сельских больницах. В связи с необходимостью максимального сокращения времени диагностики ведутся исследования, направленные на создание и оценку эффективности новых диагностических маркеров. Подобными характеристиками кишечная форма белка, связывающего жирные кислоты (Intestinal Fatty-Acid Banding Protein, (I-FABP).Цель. Оценить диагностическую эффективность и значимость I-FABP как важного параметра дифференциальной диагностики некроза кишечной стенки.Материалы и методы. В одноцентровое клинико-лабораторное сравнительное исследование включено 162 пациента, поступивших в период с 2022 по 2023 года в ГБУЗ г. “ГКБ им. В.В. Вересаева ДЗМ” г. Москвы. Помимо комплекса обследований в соответствии со стандартами оказания медицинской помощи, исследуемым выполняли определение концентрации белка I-FABP.Результаты. Значимые различия выявлены между медианами концентрации I-FABP у основной группы пациентов и группы сравнения I и основной группы и группы сравнения II. Концентрация I-FABP в сыворотке крови более 308,42 пг/мл у пациентов с подозрением на ОМИ может свидетельствовать о начавшемся некрозе тонкой кишки.Заключение. Лабораторное определение в сыворотке крови кишечной формы белка, связывающего жирные кислоты является перспективным методом ранней дифференциальной диагностики острого нарушения мезентериального кровообращения, он имеет шансы стать частью алгоритма диагностики пациентов с подозрением на ОНМзК.
Острое нарушение мезентериального кровообращения, кишечная форма белка, связывающего жирные кислоты, лабораторный маркер мезентериальной ишемии
Короткий адрес: https://sciup.org/142244686
IDR: 142244686 | УДК: 617.5 | DOI: 10.17238/2072-3180-2025-1-76-86
Текст научной статьи Современные методы ранней дифференциальной диагностики острого нарушения мезентериального кровообращения
Острая форма мезентериальной ишемии остаётся актуальной и серьёзной проблемой в современной медицине, особенно когда речь идёт о ранней диагностике. По данным Росстата продолжительность жизни в России в 2022 году повысилась рекордным в истории Российской Федерации темпом – на 2,7 года, почти до 72,8 года. Вместе с этим растет и число пациентов с сердечно-сосудистыми, эндокринными заболеваниями, тромбофилией, в связи с этим количество пациентов, сталкивающихся с острым нарушением мезентериального кровообращения (ОНМзК), постоянно увеличивается [1]. По данным прямой ангиографии, МСКТ-ангиографии, а также оперативным данным и данным аутопсий, частота острой мезентериальной ишемии в России составляет 12,9 случаев на 100000 человек в год [4]. Это, в свою очередь, приводит к росту количества операций при острой мезентериальной ишемии (ОМИ). За последние 13 лет число таких операций выросло в 2–3 раза [3]. Согласно последним литературным данным, ОМИ встречается у одного-двух пациентов на 1000 человек, госпитализированных в общехирургический стационар. Такие пациенты составляют 0,8 % от всех пациентов, госпитализированных в экстренном порядке, или 0,5 % от общего числа пролеченных хирургических больных [6, 7]. Анализ реестров Network Information System показал, что заболеваемость ОМИ составляет 6,7 человека на 100 тысяч человек в год (данные для США за 2010 год). В период с 2009 по 2013 год уровень заболеваемости ОМИ в Финляндии составлял 7,3 случая на 100 тысяч жителей в год. В городе Мальмё (Швеция) этот показатель был равен 12 случаям на 100 тысяч жителей [9].
Тенденция к снижению показателей летальности от этой формы заболевания отсутствует, на протяжении многих лет она составляет 65–95 %. Это объясняется несколькими факторами: во-первых, интестинальную ишемию часто диагностируют слишком поздно, во-вторых, в до- и послеоперационных периодах у пациентов могут возникать тяжёлые системные расстройства, кроме того, высока частота легочных, кардиальных и инфекционных послеоперационных осложнений [5].
Не способствуют ранней диагностике заболевания данные об известных этиологических формах ОНМзК: артериальная эмболия, артериальный тромбоз, венозный тромбоз и неокклюзионная мезентериальная ишемия, имеющих разные патофизиологические и клинические особенности. В течение первых 6–12 часов от начала сосудистой “катастрофы” – стадии ишемии, процесс носит обратимый характер, далее же происходит необратимое повреждение кишечного эпителия и, это именно те “золотые” часы, которые, как правило, теряются при дифференциальной диагностике различных форм ОНМзК от других острых заболеваний брюшной полости [5].
Мультифазная компьютерная томография (КТ) с внутривенным контрастным усилением – основной неинвазивный метод диагностики ОНМзК [5, 6]. Он очень эффективен и позволяет получить результаты с чувствительностью более 90 %, а в некоторых случаях – до 100 % [8]. Аортография с последующей селективной мезентерикографией может подтвердить диагноз в 85–95 % случаев. Однако это инвазивная процедура, поэтому её не рекомендуется использовать как единственный метод диагностики. Эта методика не позволяет оценить состояние уже повреждённой кишечной стенки и достоверно не позволяет оценить адекватность кровообращения кишки при неокклюзионном поражении висцеральных сосудов. К сожалению, в большинстве районных и сельских больницах в современных условиях ургентной хирургии сложно использовать вышеперечисленные методы диагностики из-за нехватки специалистов и оборудования, на данный момент подобные радиологические методы исследования доступны только в крупных областных клиниках нашей страны.
Хотелось бы отметить, что лабораторная диагностика большинства стационаров нашей страны при наличии возможности в проведении сложных биохимических тестов ограничивается проведением рутинных клинических анализов крови и мочи, исследованием амилазы крови, что зачастую выявляет выраженный лейкоцитоз и при столь скудной клинической симптоматике на ранних этапах заставляет хирурга госпитализировать пациентов в отделение и использовать наблюдательную тактику с дальнейшим проведением диагностического поиска, что является губительным для пациента [2].
В последние годы врачебное сообщество стремимся улучшить результаты лечения пациентов с нарушениями мезентериального кровообращения и его осложнениями. Для этого разрабатывают и внедряют новые методы ранней диагностики и способы завершения оперативных вмешательств. В связи с необходимостью максимального сокращения времени диагностики мезентериальной ишемии ведутся исследования, направленные на создание и оценку эффективности новых диагностических маркеров, которые могли бы изменением своей концентрации указывать на ишемию кишечной стенки и давать возможность выполнить оперативное лечение в наиболее ранние сроки.
Согласно литературным данным подобными характеристиками обладает новый клинико-лабораторный показатель – кишечная форма белка, связывающего жирные кислоты (Intestinal Fatty-Acid Banding Protein, I-FABP), чувствительность и специфичность которого при мезентериальной ишемии со- ставляет 80 % и 85 %, [10] и 79 % и 91,3 % [11] соответственно. Этот белок имеет низкую молекулярную массу (14–15 кДа) и участвует в поглощении и использовании жирных кислот в клетках кишечного эпителия для обеспечения их энергетической потребности. При нарушении целостности мембраны клеток-энтероцитов I-FABP из внутриклеточного пространства попадает в венозную систему [10, 11]. При развитии ОМИ и, как следствие, повреждении энтероцитов пороговые значения I-FABP резко увеличиваются, в анализах мочи и крови их уровень становится значительно выше по сравнению с таковым у здоровых лиц [9]. Средняя концентрация I-FABP в крови у здоровых лиц согласно данным литературы, составляет от 69±14 до 172,7 пг/мл [8].
Цель. Оценить диагностическую эффективность и значимость нового лабораторного показателя сыворотки крови – I-FABP как важного параметра при проведении дифференциальной диагностики некроза кишечной стенки у больных с абдоминальным болевым синдромом не сосудистого генеза, пациентов с острой и хронической абдоминальной ишемией.
Материалы и методы
Для оценки диагностической эффективности нового лабораторного показателя сыворотки крови – белка I-FABP, связывающего жирные кислоты как первичного маркера ишемического поражения тонкой кишки был проведен клинико-лабораторный сравнительный проспективный анализ данных, которые были получены при обследовании и в ходе проводимого лечения пациентов, поступивших в стационар в период с 2022 по 2023 года в ГБУЗ “ГКБ им. В.В. Вересаева ДЗМ” г. Москвы, в экстренном порядке с клиникой острого нарушения мезентериального кровообращения, с клиникой “острого живота” и в плановом порядке больных, проходящих обследование и подготовку перед плановыми сердечно-сосудистыми операциями в сосудистом и кардиохирургическом отделениях, имеющих признаки мультифокального атеросклероза.
Таблица 1
Распределение пациентов по полу
Table 1
Distribution of patients by gender
|
Группы пациентов/ Patient groups |
Пол/ gender |
Всего/ Total |
||||
|
Мужчины/Men |
Женщины/ Women |
абс. /abs. (n) |
относ./ relative (%) |
|||
|
Количество/ Quantity |
||||||
|
абс./ abs. (n) |
относ. / relative (%) |
абс./ abs. (n) |
относ. / relative (%) |
|||
|
Основная/ Main |
7 |
22,6 |
24 |
77,4 |
31 |
100 |
|
Сравнения I / Comparisons I |
44 |
72,1 |
17 |
27,9 |
61 |
100 |
|
Сравнения II / Comparisons II |
32 |
45,7 |
38 |
54,3 |
70 |
100 |
Средний возраст пациентов основной группы составил 73 года, группы сравнения I – 66 лет, группы сравнения II – 59 лет. Большинство пациентов, а именно 73 человека, были пожилого возраста (60–74 года), что соответствует 45 % от всего количества участников исследования, 29 пациентов – старческого возраста (75–90 лет), составили 18 % от общего числа, долго-летов (90 и более лет) было 4 (2 %). Распределение больных в исследуемых группах по возрасту представлено на рисунке 1.
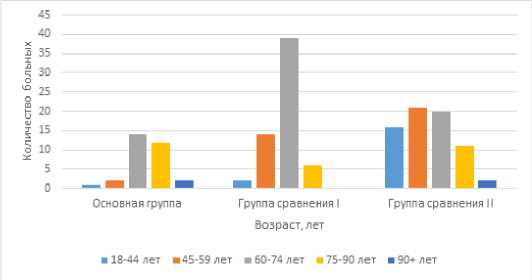
Рис . 1. Распределение пациентов по возрасту в группах
Fig. 1. Distribution of patients by age in groups
Все пациенты были комплексно обследованы в соответствии со стандартами оказания медицинской помощи. Исследуемым группам пациентов производили забор сыворотки крови для определения нового лабораторного маркера мезентериальной ишемии – белка, связывающего жирные кислоты, образцы хранили при температуре –25°C в полипропиленовых пробирках в морозильной камере, определение I-FABP проводили одномоментно у всех исследуемых образцов. Определение I-FABP человека в сыворотке крови проводилось с помощью коммерческого набора для иммуноферментного анализа Human I-FABP ELISA TEST KIT компании Hycult Biotechnology (Нидерланды). Время анализа составило 3,5 часа. Минимальная измеряемая концентрация 0 пг/мл, измеряемый диапазон 0–3000 пг/мл.
Статистический анализ проводили, используя пакет программ SPSS (версия 17.0; SPSS Inc., Чикаго, США). Тип распределения данных оценивали с помощью теста Шапиро-Вилка. Данные представлены в виде средней величины ± среднеквадратичного отклонения, медианы (25-го–75-го процентиля), количества больных, частотные характеристики представлены в виде процентов от общего. Межгрупповые различия частотных показателей и качественных данных оценивали, используя тест хи-квадрат или точный критерий Фишера. Межгрупповые различия в количественных непрерывных данных оценивали с помощью t-теста Стьюдента или U-критерия Манна-Уитни при сравнении двух групп, либо теста Крускала-Уоллиса при сравнении более двух групп, с последующим попарным сравнением, используя U-критерий Манна-Уитни с поправкой на множественные сравнения. Оценка корреляционных взаимосвязей между изучаемыми количественными непрерывными показателями в зависимости от типа распределения данных выполнялась путем вычисления коэффициента корреляции r Пирсона или rho Спирмана. Для корреляционного анализа и при сравнении двух групп значение p <0,05 считали статистически значимым. При попарном сравнении трех групп использовалась поправка Бонферрони и статистически значимым считали значение p <0,017.
Межвузовским Комитетом по этике на заседании от 17.02.2022 протокол № 02-22 одобрено проведение клинического исследования по определению лабораторного маркера I-FABP сыворотки крови у пациентов в рамках диссертационной работы под названием “Совершенствование ранней диагностики нарушений мезентериального кровообращения”.
Результаты.
Средний вес пациентов основной группы составил 74,0 ±12,8 кг, группы сравнения I – 83,6 ±17,4 кг, группы сравнения II – 80,8 ±20,9 кг. Мы не выявили значимых различий между средним временем от начала заболевания до обращения за медицинской помощью у пациентов основной и группы сравнения II 2 (1,0–4,0) и 2 (1,00–5,00) суток соответственно (p=0,669). Анализируя направительные диагнозы пациентов основной группы , мы выявили, что в 29 % (n=9) случаев ОНМзК расценивается как острая кишечная непроходимость, в 22,6 % (n=7) как острый панкреатит, в 12,9 % (n=4) маскируется под ишемическую болезнь сердца/острый коронарный синдром, а так же в 12,9 % (n=4) ОМИ расценивали под маской гипертонического криза и, только в 9,7 % (n=3) случаях диагноз был определен верно – “Острые сосудистые болезни кишечника”, в единичных случаях присутствовали направительные диагнозы – “Хроническая ишемия головного мозга”, “Перитонит”, “Острый аппендицит”, “Колит”.
Сравнивая частоту встречаемости основных жалоб у пациентов при поступлении в стационар, определено, что больные группы сравнения II чаще отмечали боли в животе, чем больные основной группы 93 % и 71 % соответственно (p=0,009), в группе сравнения I 6,6 % пациентов жаловались на абдоминальную боль. Не менее важным для постановки верного диагноза остается сбор анамнестических данных пациента. Наличие у лечащего врача информации про атеросклеротическое поражение периферических, коронарных и/ или церебральных сосудов, аритмию, перенесенный острый инфаркта миокарда (ОИМ) и/или острое нарушение мозгового кровообращения (ОНМК) в анамнезе у больного, даст возможность выбрать правильную тактику дальнейшей диагностики. В таблицах 2 и 3 представлен характер сопутствующих заболеваний и перенесенных состояний в анамнезе у исследуемых групп больных.
Мы сравнили средние значения основных лабораторных показателей крови, которые рутинно определяли при поступлении в стационар, кишечной формы белка, связывающего жирные кислоты у больных основной группы с таковыми показателями больных группы сравнения I и группы сравнения II (таблицы 4, 5).
Таблица 2
Характер сопутствующих заболеваний и перенесенных состояний в анамнезе у пациентов основной и группы сравнения I
Table 2
The nature of concomitant diseases and previous medical conditions in patients of the main and comparison groups I
|
Заболевание/ перенесенное состояние в анамнезе/ Disease/previous condition in the anamnesis |
Количество больных основной группы/ Number of patients in the main group |
Количество больных группы сравнения I/ Number of patients in the comparison group I |
p |
||
|
абс./ abs. (n) |
относ./ relative (%) |
абс./ abs. (n) |
относ. / relative (%) |
||
|
Перенесенный ОИМ/ Transferred OIM |
9 |
29 % |
15 |
24,6 % |
0,802 |
|
Перенесенный ОНМК/ Transferred ONMC |
9 |
29 % |
8 |
13,1 % |
0,088 |
|
Аритмии (трепетание/ фибрилляция предсердий)/ Arrhythmias (atrial flutter/ fibrillation) |
11 |
35,5 % |
7 |
11,5 % |
0,011 |
|
Мультифокальный атеросклероз (поражение периферических/ коронарных/ церебральных сосудов)/ Multifocal atherosclerosis (damage to peripheral/ coronary/ cerebral vessels) |
16 |
51,6 % |
50 |
82,0 % |
0,003 |
|
Сахарный диабет 2 типа/ Type 2 diabetes mellitus |
13 |
41,9 % |
18 |
29,5 % |
0,252 |
|
Гипертоническая болезнь/ Hypertension |
27 |
87,1 % |
47 |
77,0 % |
0,283 |
Таблица 3
Характер сопутствующих заболеваний и перенесенных состояний в анамнезе у пациентов основной и группы сравнения II
Table 3
The nature of concomitant diseases and previous medical conditions in patients of the main and comparison groups II
|
Заболевание/перенесенное состояние в анамнезе/Disease/previous condition in the anamnesis |
Количество больных основной группы/Number of patients in the main group |
Количество больных группы сравнения II/ Number of patients in the comparison group II |
p |
||
|
абс./ abs. |
относ./ relative (%) |
абс./ abs. |
относ./ relative (%) |
||
|
Перенесенный ОИМ/Transferred OIM |
9 |
29 % |
5 |
7 % |
0,009 |
|
Перенесенный ОНМК/ Transferred ONMC |
9 |
29 % |
4 |
6 % |
0,003 |
|
Аритмии (трепетание/фибрилляция предсердий)/ Arrhythmias (atrial flutter/fibrillation) |
11 |
35,5 % |
5 |
7,1 % |
0,001 |
|
Мультифокальный атеросклероз (поражение периферических/ коронарных/ церебральных сосудов)/ Multifocal atherosclerosis (damage to peripheral/ coronary/cerebral vessels) |
16 |
51,6 % |
11 |
15,7 % |
< 0,001 |
|
Сахарный диабет 2 типа/ Type 2 diabetes mellitus |
13 |
41,9 % |
7 |
10,0 % |
0,001 |
|
Гипертоническая болезнь/ Hypertension |
27 |
87,1 % |
33 |
47,1 % |
< 0,001 |
Таблица 4
Сравнение лабораторных данных пациентов основной и группы сравнения I
Table 4
Comparison of laboratory data of patients of the main and comparison group I
|
Показатель/Indicator |
Основная группа/ Main group |
Группа сравнения I/ Comparison group I |
p |
|
I-FABP, пг/мл/I-FABP, pg/ml |
401,6 (70,3–3000,0) |
195,0 (42,9–260,6) |
0,006 |
|
Лейкоциты, × 109/Leukocytes, × 109 /l |
15,8 (10,8–18,8) |
7,6 (6,4–8,5) |
< 0,001 |
|
Тромбоциты, × 109 /л/ Platelets, × 109/l |
209 (166–268) |
231 (200–288) |
0,231 |
|
Гемоглобин, г/л/ Hemoglobin, g/l |
149 (131–160) |
141 (121–156) |
0,361 |
|
Гематокрит, %/ Hematocrit, % |
45,9 (37,9–48,2) |
41,2 (35,8–46,4) |
0,182 |
|
Фибриноген, г/л/ Fibrinogen, g/l |
4,7 (4,1–7,0) |
3,3 (2,9–3,9) |
< 0,001 |
|
ПТИ, %/ PTY, % |
84,0 (49,0–97,0) |
88,0 (79,5–95,5) |
0,135 |
|
МНО/MNO |
1,2 (1,1–1,6) |
1,1 (1,0–1,2) |
0,001 |
|
АЧТВ, сек/ ACTV, sec |
28,0 (22,4–31,8) |
30,9 (29,2–33,2) |
0,005 |
|
Абсолютное кол-во лимфоцитов, × 109 /л/ Absolute number of lymphocytes, × 109 /l |
1,3 (0,7–3,8) |
2,1 (1,7–2,5) |
0,028 |
|
СРБ, мг/л/ CRP, mg/l |
146,9 (35,4–254,8) |
5,3 (3,4–7,9) |
< 0,001 |
|
АЛТ, ЕД/л/ ALT, UNITS/l |
37,2 (18,2–68,2) |
23,4 (16,7–33,0) |
0,012 |
|
АСТ, ЕД/л/ AST, UNITS/l |
46,7 (23,0–123,6) |
26,8 (21,3–32,0) |
0,001 |
|
Амилаза, ЕД/л/ Amylase, UNITS/lл |
66,1 (36,2–225,2) |
52,9 (37,2–70,3) |
0,107 |
Таблица 5
Сравнение лабораторных данных пациентов основной и группы сравнения II
Comparison of laboratory data of patients of the main and comparison group II
Table 5
|
Показатель/Indicator |
Основная группа/ Main group |
Группа сравнения II/ Comparison group II |
p |
|
I-FABP, пг/мл/I-FABP, pg/ml |
401,6 (70,3–3000,0) |
65,6 (29,6–264,9) |
0,001 |
|
Лейкоциты, × 109 Leukocytes, × 109 /l |
15,8 (10,8–18,8) |
9,1 (7,2–11,7) |
< 0,001 |
|
Тромбоциты, × 109 /л/ Platelets, × 109/l |
209 (166–268) |
262 (225–328) |
0,004 |
|
Гемоглобин, г/л/ Hemoglobin, g/l |
149 (131–160) |
140 (127–148) |
0,107 |
|
Гематокрит, %/ Hematocrit, % |
45,9 (37,9–48,2) |
40,6 (36,6–43,6) |
0,007 |
|
Фибриноген, г/л/ Fibrinogen, g/l |
4,7 (4,1–7,0) |
4,2 (3,5–5,7) |
0,233 |
|
ПТИ, %/ PTY, % |
84,0 (49,0–97,0) |
91,0 (78,0–101,0) |
0,163 |
|
МНО/ |
1,2 (1,1–1,6) |
1,2 (1,1–1,3) |
0,163 |
|
АЧТВ, сек/ ACTV, sec |
28,0 (22,4–31,8) |
30,8 (28,6–34,0) |
0,016 |
|
Абсолютное кол-во лимфоцитов, × 109 /л/ Absolute number of lymphocytes, × 109 /l |
1,3 (0,7–3,8) |
1,6 (1,2–2,1) |
0,268 |
|
СРБ, мг/л/ CRP, mg/l |
146,9 (35,4–254,8) |
12,0 (4,1–38,5) |
< 0,001 |
|
АЛТ, ЕД/л/ ALT, UNITS/l |
37,2 (18,2–68,2) |
19,6 (13,8–33,9) |
0,015 |
|
АСТ, ЕД/л/ AST, UNITS/l |
46,7 (23,0–123,6) |
27,8 (21,5–45,1) |
0,041 |
|
Амилаза, ЕД/л/ Amylase, UNITS/l/л |
66,1 (36,2–225,2) |
45,0 (34,5–63,0) |
0,023 |
При сравнении данных всех трех групп, значимые различия выявлены между средними значениями I-FABP у основной группы пациентов – 401,6 (70,3–3000,0) пг/мл и группы сравнения I – 195,0 (42,9–260,6) пг/мл (p=0,006) и основной группы и группы сравнения II – 65,6 (29,6-264,9) пг/мл (p=0,001), статистически не значимое различие (p=0,137) выявлено между средним значением I-FABP группой сравнения I и группой сравнения II (рис. 2).
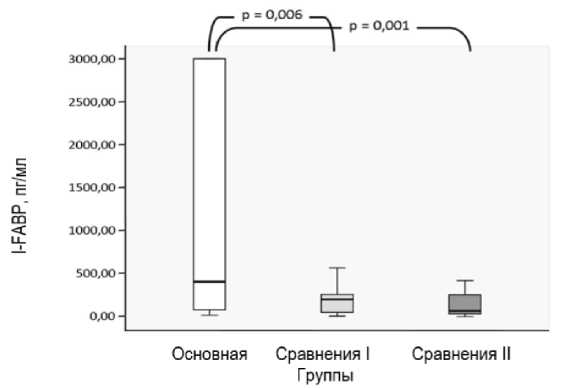
Рис. 2. Концентрация I-FABP у пациентов исследуемых групп
Fig. 2. Concentration of I-FABP in patients of the studied groups
ROC анализ продемонстрировал, что при значениях I-FABP > 308,42 пг/мл можно дифференцировать ОМИ от абдоминального болевого синдрома при мультифокальном атеросклерозе и при патологии несосудистого генеза с AUC 0,644, чувствительностью 35,0 % и специфичностью 92,9 % (p = 0,049).
Изучая распределение концентраций маркера I-FABP в зависимости от сроков от момента появления симптомов заболевания до взятия образцов крови в основной группе, мы можем сделать вывод, что максимальные концентрации выявляются на 2–3 сутки от начала “сосудистой катастрофы” (рис. 3).
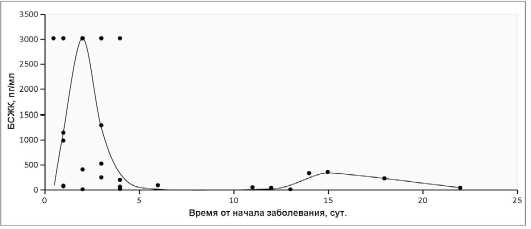
Рис. 3. Распределение концентраций БСЖК (кишечной формы белка, связывающего жирные кислоты) у пациентов основной группы в зависимости от сроков от момента появления клинических проявлений до взятия образцов крови
Fig. 3. Distribution of concentrations of BCFAS (the intestinal form of fatty acid binding protein) in patients of the main group, depending on the timing from the moment of clinical manifestations to blood sampling
Корреляционный анализ лабораторных данных у пациентов основной группы выявил наличие значимой положительной взаимосвязи времени от начала заболевания до обращения за медицинской помощью с уровнем гематокрита (rho=0,355; p=0,05), значимой отрицательной взаимосвязи времени от начала заболевания до обращения за медицинской помощью с величиной: лактата (rho= – 0,375; p=0,049), уровнем лимфоцитов крови (rho= – 0,463; p=0,034) и аспартатаминотрансферазой (АСТ) (rho= – 0,361; p=0,046). У пациентов с ОМИ выявлена положительная корреляционная зависимость между концентрацией I-FABP и уровнем АСТ (rho= 0,361; p=0,046).
Во всех наблюдениях причиной ОНМзК являлись тромбозы. Мезентериальный артериальный тромбоз как причина ОМИ занимал ведущее место, составив 71% случаев (n = 22), тогда как венозный мезентериальный тромбоз диагностирован у 29% пациентов (n = 9). По данным КТ – ангиографии у 13 (59%) больных (среди пациентов с артериальным тромбозом) выявили окклюзию I сегмента ВБА, у 1 (5%) пациента окклюзию III сегмента ВБА, а у 8 (36%) – отсутствие контрастирования терминальных ветвей ВБА. Значение I-FABP у пациентов с артериальным тромбозом был ненамного выше значения маркера у пациентов с венозной формой ОМИ: 460,1 (68,8-3000,0) пг/мл и 330,5 (121,7–3000,0) пг/мл соответственно (p=0,789). Концентрация I-FABP при локализации тромба в дистальных ветвях ВБА была значительно ниже, чем при локализации в I сегменте ВБА: 61,5 (14,6–450,6) пг/мл и 1277,9 (378,8–3000,0) пг/мл соот- ветственно (p=0,01). Сравнение среднего значения I-FABP крови у пациентов с тромбозом дистальных ветвей ВБА и у больных с венозным мезентериальным тромбозом не дало статистически значимого различия (p = 0,119). Незначимыми получились различия и у групп больных с тромбозом I сегмента ВБА против группы исследуемых с венозным тромбозом (p = 0,381). ROC анализ продемонстрировал, что при значении I-FABP > 330,46 пг/мл можно верифицировать острую окклюзию I сегмента ВБА относительно окклюзии иной локализации с AUC 0,835, чувствительностью 71,4% и специфичностью 92,3% (p = 0,001).
Наиболее высокая летальность – 75% прогнозировалась у пациентов с тромбозом I сегмента ВБА, летальность в 55 % оценивалась у пациентов венозным тромбозом и 40 % при локализации тромба в дистальных отделах ВБА согласно шкале оценки APACHE II.
Выявлена значимая отрицательная корреляция концентрации I-FABP и времени от начала заболевания до взятия образцов крови на анализ у пациентов с венозной формой ОНМзК (rho= – 0,809; p=0,008), подобной зависимости же для артериального тромбоза при локализации в I сегменте ВБА и ее дистальных отделов – не выявлено.
Длительность госпитализации пациентов основной группы составила в среднем – 7 (2–11) суток, при чем пациенты с венозным тромбозом провели в стационаре около 10 (4,5–14,5) суток, против 3,5 (2–10) суток, проведенных в клинике пациентами с артериальным тромбозом. Пациенты группы сравнения I провели в стационаре в среднем 7 (5,5–8,5) суток, группы сравнения II - 2 (1-4) суток (p < 0,001 в сравнении с основной группой и p < 0,001 в сравнении с группой сравнения II).
Медиана срока пребывания в отделении реанимации и интенсивной терапии (ОРИТ) больных основной группы составила – 3 (2–10,5) суток, наибольшая медиана длительности лечения в условиях ОРИТ была у пациентов с венозным тромбозом и с тромбозом дистальных ветвей ВБА и составила – 4 (2,5–7,5) и – 4 (3–5) суток соответственно. Определена значимая отрицательная корреляция концентрации I-FABP и длительности госпитализации (rho= - 0,625; p < 0,001), а также значимая отрицательная зависимость величины кишечной формы белка, связывающего жирные кислоты и сроков лечения в ОРИТ (rho= - 0,62; p < 0,001) для больных в основной группе.
В основной группе выписаны домой на амбулаторное лечение 11 (35,5%) пациентов, умерло 20 (64,5%) человек. Медиана концентрации I-FABP умерших пациентов основной группы значительно превышала данный показатель у выживших основной группы – 1057,5 (124,3–3000,0) пг/мл и 197,8 (45,1–3000,0) пг/мл соответственно (p=0,163), медиана величины лактата умерших больных так же превалирует над таковой у выживших – 6,75 (3,38-12,85) ммоль/л и 2,75 (1,45-3,63) ммоль/л соответственно (p=0,013), медиана показателя С-реактивного белка умерших более чем в 5 раз превышает медиану аналогичного показателя у выживших пациентов – 208,0 (99,2-305,1) мг/л и 38,9 (8,6-163,1) мг/л соответственно (p=0,032).
Заключение
Исходя из наших наблюдений следует отметить ряд отличительных анамнестических особенностей, которые позволяют заподозрить ОНМзК у пациента с острой хирургической патологией: средний возраст больных основной группы выше возраста пациентов группы сравнения II - 73 года, против 59 лет (p<0,001); наличие сопутствующих диагнозов: нарушение сердечного ритма в виде трепетания или фибрилляции предсердий (p=0,001), перенесенных ОИМ (p=0,009) и/или ОНМК (p=0,003), гипертонической болезни (p<0,001), мультифокального атеросклероза (p<0,001), сахарного диабета 2 типа (p=0,001). Отмечен более высокий процент встречаемости пациентов с сердечными аритмиями в основной группе против числа таковых в группе сравнения II 35,5% и 11,5% соответственно (p= 0,011).
В рутинно проводимых лабораторных исследованиях так же выявлены значимые различия между показателями пациентов с ОМИ и больных с другой острой хирургической патологией: более чем в 1,5 раза количество лейкоцитов было больше у исследуемых основной группы, чем у больных группы сравнения II 15,8 (10,8 – 18,8) × 109 /л и 9,1 (7,2 – 11,7) × 109 /л соответственно (p< 0,001); уровень амилазы у больных ОНМзК был выше, чем у пациентов группы сравнения II 66,1 (36,2 – 225,2) ЕД/л и 45,0 (34,5 – 63,0) ЕД/л соответственно (p= 0,023), концентрация С-реактивного белка в 12 раз превышала значения в основной группе, чем в группе сравнения II (p< 0,001), значимое уменьшение количества тромбоцитов у больных ОМИ 209 (166 – 268) × 109 /л против 262 (225 – 328)× 109 /л у пациентов группы сравнения II (p= 0,004).
В проведенном одноцентровом проспективном клиниколабораторном исследовании пациентов с острой хирургической патологией, включая ОНМзК и больных с мультифокальным атеросклерозом мы получили новые данные о маркере кишечной ишемии – кишечной форме белка, связывающего жирные кислоты (I-FABP), который показал большой потенциал для применения его в ранней дифференциальной диагностике ОМИ. На 2-3 сутки от начала клинической симптоматики при ОМИ происходит максимальное повышение концентрации маркера, что совпадает со сроками обращения пациентов за медицинской помощью при ухудшении самочувствия. Сравнивая средние значения I-FABP между тремя исследуемыми группами, мы выявили его превышение более чем в 6 раз у пациентов с ОМИ – 401,6 (70,3-3000,0) пг/мл против концентрации I-FABP больных с другой острой абдоминальной хирургической патологией несосудистого генеза – 65,6 (29,6264,9) пг/мл (p=0,001), так же значимые различия выявлены между значениями I-FABP у пациентов с ОМИ и больных с мультифокальным атеросклерозом без острой хирургической патологии – 195,0 (42,9-260,6) пг/мл (p=0,006). Концентрация I-FABP в сыворотке крови более 308,42 пг/мл у пациентов с подозрением на ОМИ может свидетельствовать о начавшемся некрозе тонкой кишки.
Концентрация I-FABP при локализации тромба в дистальных ветвях ВБА была значительно ниже, чем при локализации тромба в I сегменте ВБА, что объясняется протяженностью некротических изменений кишки, соответственно и массой погибших энтероцитов, содержащих исследуемый белок, а так же наличием коллатерального кровотока. Значение I-FABP сыворотки крови более 330,46 пг/мл является критерием диагностики острой окклюзии I сегмента ВБА, что связано с обширностью ишемии кишки.
Корреляционный анализ показал значимую отрицательную зависимость величины I-FABP и длительности госпитализации, а также значимую отрицательную зависимость величины маркера и сроков лечения в ОРИТ, подобное явление предполагает наличие массивных и протяженных деструктивных изменений кишечной стенки и неблагоприятного исхода лечения больных.
Длительность лабораторного определения нового маркера составляет 3,5 часа, что дает возможность за этот промежуток времени выполнить необходимые диагностические исследования в силу оснащенности стационара и выбрать дальнейшую тактику лечения.
Перспективным методом ранней дифференциальной диагностики острого нарушения мезентериального кровообращения является лабораторное определение в сыворотке крови кишечной формы белка, связывающего жирные кислоты, чувствительность метода 35,0 %, специфичность 92,9 % (p = 0,049). Этот метод имеет все шансы стать частью алгоритма диагностики пациентов с подозрением на острое нарушение мезентериального кровообращения. Таким образом мы сможем сократить время диагностики данной патологии, в особенности, в отдаленных от областных центров больницах, выбрать оптимальную тактику лечения и, соответственно, улучшить результаты лечения больных и их качество жизни в послеоперационном периоде.


