Современные представления о лабораторных маркерах метаболического синдрома
Автор: Айрапетян С. А., Шишкин А. Н.
Журнал: Juvenis scientia @jscientia
Рубрика: Обзорные статьи
Статья в выпуске: 2 т.11, 2025 года.
Бесплатный доступ
Метаболический синдром широко распространён среди людей во всём мире. Неблагоприятное воздействие практически на все органы и ткани организма наряду с высокой встречаемостью делает метаболический синдром актуальной проблемой современности. Начиная со второй половины 1990-х годов, международные сообщества в области здравоохранения предлагали свои критерии диагностики метаболического синдрома. Однако все предложенные критерии обладали высокой вариабельностью и не позволяли проводить раннюю диагностику синдрома. Оценка новых лабораторных маркеров метаболического синдрома может оказаться более эффективным методом ранней диагностики. В данном обзоре мы постарались систематизировать известные к настоящему времени маркеры и показать значимость каждого из них для диагностики метаболического синдрома.
Метаболический синдром, лабораторная диагностика, маркеры, ожирение, сахарный диабет
Короткий адрес: https://sciup.org/14133135
IDR: 14133135 | DOI: 10.32415/jscientia_2025_11_2_5-20
Текст обзорной статьи Современные представления о лабораторных маркерах метаболического синдрома
На протяжении последних 100 лет учёные во всём мире пытались выяснить, существует ли патогенетическая связь между такими заболеваниями как гипертоническая болезнь, дислипидемия, ожирение и сахарный диабет. Понятием, объединяющим в себе патогенетические механизмы этих заболеваний, стал «метаболический синдром». Всемирная организация здравоохранения (ВОЗ) характеризует метаболический синдром (МС) как патологическое состояние, включающее в себя наличие абдоминального ожирения, инсулинорезистент-ности, повышения артериального давления (АД) и гиперлипидемии [1]. По данным MG Saklayen, около 1 миллиарда людей на планете имеют метаболический синдром [1]. В связи с высокой распространённостью МС и неблагоприятным влиянием его компонентов практически на все органы и ткани организма не вызывает сомнений повышенный исследовательский интерес к нему. К настоящему времени в базе данных PubMed содержится более 115 000 научных исследований на тему МС.
Многими международными сообществами в области здравоохранения были предложены критерии диагностики МС. Каждое сообщество вносит свои индивидуальные рекомендации по диагностике, а те критерии, которые являются общими, варьируют в зависимости от возраста, пола, расы, социальноэкономического статуса и региона проживания. Так, в различных странах мира распространённость МС оценивается в пределах от 0,9% до 66,9% [2]. В городах Российской Федерации встречаемость МС составляет 35,3–53,1% [3].
Тот факт, что существующие к настоящему времени критерии МС обладают высокой вариабельностью и позволяют диагностировать МС, когда клинически наличие большинства его компонентов уже не вызывает сомнений, приводит к необходимости поиска новых методов более ранней диагностики. Согласно исследованиям последних лет, таким альтернативным методом может оказаться оценка лабораторных маркеров МС.
МЕТАБОЛИЧЕСКИЙ СИНДРОМ.СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯИ КРИТЕРИИ ДИАГНОСТИКИ
Представления о метаболическом синдроме (синдроме X, синдроме инсулинорезистентности) сильно менялись на протяжении последних десятилетий. Хотя связь между увеличением уровня глюкозы плазмы, повышением АД и абдоминальным ожирением обсуждалась, начиная с первой половины XX века [4–7], только в 1998 году ВОЗ было предложено первое унифицированное описание МС, которое включало в себя ряд метаболических нарушений: нарушение толерантности к глюкозе / сахарный диабет 2 типа / инсулино-резистентность в сочетании с двумя и более критериями: повышение АД, увеличение уровня триглицеридов, микроальбуминурия или увеличение альбумин-креатининового соотношения в моче и абдоминальное ожирение [8]. Исследовательской группой ВОЗ было подчёркнуто, что инсу-линорезистентность (ИР) является обязательным компонентом МС. В последствии различные медицинские сообщества предлагали свои критерии МС, например, в 2001 году была опубликована Национальная образовательная программа США по снижению холестерина (National Cholesterol Education Program — Adult Treatment Panel III — NCEP ATP III), в которой ИР больше не являлась доминирующим фактором диагностики МС, вместо этого для подтверждения синдрома требовалось наличие 3 из 5 предложенных критериев [9]. В 2005 году Международная федерация диабета (International Diabetes Federation — IDF), а также Американская кардиологическая ассоциация (American Heart Association — AHA) совместно с Национальным институтом сердца, лёгких и крови США (The National Heart, Lung, and Blood Institute — NHLBI) попытались сформулировать собственные критерии МС [10, 11]. В этих критериях имелись расхождения, связанные с показателями окружности талии. Так в критериях IDF отсутствовал рекомендованный ВОЗ фактор ИР, однако абдоминальное ожирение стало одним из 5 факторов, необходимых для верификации МС, с особым акцентом на измерении окружности талии как удобном инструменте скрининга; остальные же критерии были практи- чески идентичны критериям NCEP ATP III. Исследователи из AHA и NHLBI внесли свои корректировки в подходы NCEP ATP III, но не включили абдоминальное ожирение в число обязательных критериев. Остальные 4 критерия были идентичны критериям IDF. Споры, касающиеся пороговых значений окружности талии, заключались в том, что IDF рекомендовала значения ≥94 см для мужчин и ≥80 см для женщин как показатели абдоминального ожирения у людей европеоидного происхождения; AHA/NHLBI, напротив, рекомендовали пороговые значения ≥102 и ≥88 см, соответственно, для мужчин и женщин. С AHA/NHLBI солидарны исследователи из Национальных институтов здравоохранения США (National Institutes of Health — NIH) [12].
Наконец, в 2009 г. при сотрудничестве IDF, NHLBI, AHA, Всемирной федерации сердца (WHF), Международного общества атеросклероза (IAS) и Между- народной ассоциации по изучению ожирения (IASO) были сформированы единые критерии диагностики МС, такие как: наличие абдоминального ожирения (пороговые значения разделены по странам и популяциям), повышение уровня триглицеридов, снижение уровня липопротеидов высокой плотности (ЛПВП), повышение артериального давления или приём антигипертензивных препаратов и повышение уровня глюкозы натощак или приём сахароснижающих препаратов (табл. 1) [13].
С 2009 года и в Российской Федерации были разработаны рекомендации по диагностике МС, их представили эксперты Всероссийского научного общества кардиологов (ВНОК) [14]. Преимущественно критерии ВНОК были сходны с международными критериями 2009 года, однако имелись и некоторые отличия, например, одним из критериев МС стало повышение уровня липопротеи-
Таблица 1 / Table 1 Единые критерии метаболического синдрома, сформированные при сотрудничестве IDF, NHLBI, AHA, WHF, IAS и IASO в 2009 году / Unified Criteria for Metabolic Syndrome, Established through Collaboration of IDF, NHLBI, AHA, WHF, IAS, and IASO in 2009
|
Единые критерии метаболического синдрома от 2009 года (сформированы при сотрудничестве IDF, NHLBI, AHA, WHF, IAS и IASO) Unified Criteria for Metabolic Syndrome from 2009 (established through collaboration of IDF, NHLBI, AHA, WHF, IAS, and IASO) |
|
дов низкой плотности (ЛПНП), глюкоза венозной плазмы оценивалась не только по её уровню натощак, но также и по данным перорального глюкозотолерантного теста и др. Рекомендации были пересмотрены в 2013 году, изменения затронули пороговый уровень артериального давления (вместо 130/85 мм рт. ст. было установлено значение в 140/90 мм рт. ст.) [15].
ЛАБОРАТОРНЫЕ МАРКЕРЫМЕТАБОЛИЧЕСКОГО СИНДРОМА
Известные к настоящему времени группы критериев МС отличаются друг от друга количеством входящих в них показателей, их значениями с учётом региона проживания, пола, возраста и расы. Кроме того, все вышеуказанные критерии сообщают нам об уже случившемся МС и не позволяют предпринять профилактические мероприятия, направленные на предотвращение развития синдрома.
В современных исследованиях возникла тенденция к оценке лабораторных маркеров, отражающих метаболические нарушения в организме. Эти работы показывают выраженную корреляцию между изменением уровня лабораторных маркеров и рисками развития патологических состояний, входящих в состав МС [16–18]. Например, в множестве работ показана корреляция между снижением уровня адипонектина и повышением риска развития сердечно-сосудистых заболеваний (ССЗ) и сахарного диабета 2 типа [19]. В последние годы особое внимание учёных привлёк белок, связывающий жирные кислоты 4 (FABP4) и его прогностическая ценность для ранней диагностики сахарного диабета 2 типа, ожирения и других метаболических нарушений [20].
С каждым годом становится известно о появлении всё новых диагностических маркеров, и практикующий врач более не в состоянии отслеживать последние тенденции в области лабораторной
Таблица 2 / Table 2
Перечень лабораторных маркеров метаболического синдрома / List of Laboratory Markers of Metabolic Syndrome
|
Лабораторные маркеры метаболического синдрома / Laboratory Markers of Metabolic Syndrome |
|||
|
Провоспалительные маркеры / Pro-inflammatory Markers |
Адипокины / Adipokines |
Маркеры нарушений углеводного и липидного обменов / Markers of Carbohydrate and Lipid Metabolism Disorders |
Ферменты / Enzymes |
|
|
|
|
Сокращения: СРБ — C-реактивный белок, ИЛ-6 — интерлейкин-6, ФНО- α — фактор некроза опухоли- α , PAI-1 — ингибитор активатора плазминогена-1, FABP-4 — белок, связывающий жирные кислоты 4, ЛПВП — липопротеиды высокой плотности, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ЩФ — щелочная фосфатаза, ГГТП — гамма-глутамилтранспептидаза / Abbreviations: CRP — C-reactive protein, IL-6 — Interleukin-6, TNF- α — Tumor Necrosis Factor- α , PAI-1 — Plasminogen Activator Inhibitor-1, FABP-4 — Fatty Acid-Binding Protein 4, HDL — High-Density Lipoproteins, ALT — Alanine Aminotransferase, AST — Aspartate Aminotransferase, ALP — Alkaline Phosphatase, GGT — Gamma-Glutamyl Transferase.
диагностики МС. В данном обзоре мы представляем известные к настоящему времени лабораторные маркеры МС (табл. 2).
ПРОВОСПАЛИТЕЛЬНЫЕ МАРКЕРЫ
Провоспалительные биомаркеры показали высокую чувствительность к заболеваниям, входящим в состав метаболического синдрома [21–23].
Высокий уровень С-реактивного белка (СРБ) коррелирует с риском развития ишемической болезни сердца (ИБС), атеросклероза и сахарного диабета 2 типа [24, 25]. В ходе 8-летнего проспективного наблюдения за 14719 женщинами уровень высокочувствительного СРБ более 3 мг/л у пациенток с МС предсказывал риск сердечно-сосудистых событий в будущем [26]. В другом проспективном исследовании велось наблюдение за 6447 мужчинами среднего возраста в течение 5 лет. Уровень высокочувствительного СРБ выше или равный 3 мг/л предсказывал риск развития ИБС у пациентов, разделённых по наличию/отсутствию МС [27].
В нескольких крупных метаанализах была выявлена взаимосвязь между высоким уровнем ферритина и наличием отдельных компонентов МС [28–29]. Наиболее показательно уровень ферритина коррелирует с уровнем глюкозы плазмы натощак и триглицеридами [30]. Одним из механизмов влияния ферритина на уровень глюкозы может быть гиперинсулинемия, вызванная отложением больших объёмов железа в печени [31]. Этот же механизм может способствовать развитию дислипидемии из-за повышения уровня триглицеридов [31].
Мочевая кислота — это конечный метаболит, образующийся при расщеплении пуринов — химических веществ, которые попадают в кровь при переваривании пищи или в результате нормального распада некоторых клеток организма [32]. Высокий уровень мочевой кислоты коррелирует с заболеваниями, входящими в состав МС: ожирением, сахарным диабетом 2 типа и ССЗ [33, 34]. По данным метаанализа, проведённого исследователями из Испании, из 43 отобранных исследований 26 напрямую указывали на взаимосвязь МС и уровня мочевой кислоты, а в 17 работах имелись косвенные данные в пользу этого. У всех этих ис- следований имелись свои ограничения, но в целом они показали достаточную степень методологической надёжности и качества, из чего можно сделать вывод, что мочевая кислота является важным маркером МС [35].
Не вызывает сомнений наличие взаимосвязи между МС и системной воспалительной реакцией [36–38]. V. Elgazar-Carmon et al. показали, что при высокожировой диете происходит усиленная инфильтрация жировой ткани нейтрофилами, а нейтрофилы, в свою очередь, инициируют привлечение других иммунных клеток [39]. Китайскими учёными разработан новый маркер — индекс системного иммунного воспаления, который включает себя подсчёт нейтрофилов, лимфоцитов и тромбоцитов [40]. Этот маркер отражает наличие системной воспалительной реакции в организме, а также он способен эффективно предсказывать развитие МС [41]. Как показывают исследования, практическую пользу также представляет оценка отдельных цитокинов — маркеров МС, в первую очередь, интерлейкина-6 (ИЛ-6) и фактора некроза опухоли- α (ФНО- α ) [42].
Витамин D — это жирорастворимый прогормон, выполняющий эндокринные, аутокринные и паракринные функции и играющий ключевую роль в метаболизме костной ткани [43]. Рецепторы к витамину D присутствуют практически во всех иммунных клетках [44]. Это обусловлено важной функцией витамина D как участника иммунных реакций [45, 46]. В рамках рассмотрения МС следует отметить, что витамин D способствует снижению выработки провоспалительных цитокинов, например, ФНО- α и интерлейкина-12, внося вклад в патогенетическое лечение МС [47]. В то же время, дефицит витамина D может являться фактором риска развития ИР, сахарного диабета 2 типа и ССЗ [48]. Таким образом, витамин D является важным лабораторным маркером МС.
АДИПОКИНЫ
За последние несколько десятилетий наше представление о жировой ткани кардинально изменилось: из инертной ткани, накапливающей липиды, она превратилась в сложно организованную эндокринную систему [49]. Жировая ткань способна вы- генетическая предрасположенность
+
профицит поступления калорий с пищей малоподвижный образ жизни
↓ витамин D
↑ СРБ
↑ ферритин
↑ мочевая кислота
↑ ИЛ-6
↑ ФНО - α
↑ индекс системного иммунного воспаления
висцеральное ожирение
↑ ОХ
↑ ЛПНП ↑ глюкоза
↑ ТГ ↑ инсулин
↓ ЛПВП
↑ лептин
↓ адипонектин
↑ висфатин
↑ резистин
↑ PAI-1
↑ FABP-4
↑ АЛТ, АСТ
↑ ГГТП
↑ ЩФ
инсулинорезистентность ↓ поглощения глюкозы
хроническое системное воспаление
нарушение нейрогуморальной регуляции
+ инсулинорезистентность
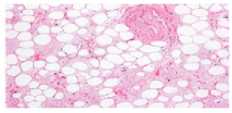
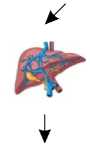
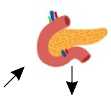
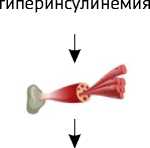
Рисунок 1. Патогенез развития метаболических нарушений при метаболическом синдроме
Сокращения: СРБ — C-реактивный белок, ИЛ-6 — интерлейкин-6, ФНО- α — фактор некроза опухо-ли- α , PAI-1 — ингибитор активатора плазминогена-1, FABP-4 — белок 4, связывающий жирные кислоты, ОХ — общий холестирин, ЛПНП — липопротеиды низкой плотности, ЛПВП — липопротеиды высокой плотности, ТГ — триглицериды, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ЩФ — щелочная фосфатаза, ГГТП — гамма-глутамилтранспептидаза.
делять сигнальные молекулы, которые напрямую влияют на метаболические процессы в организме (рис. 1). Эти сигнальные молекулы называются адипокинами. Во многих работах показана корреляция между уровнем адипокинов и рисками развития таких метаболических заболеваний, как ожирение, сахарный диабет 2 типа, дислипидемия и ССЗ [50, 51].
Лептин — это адипокин, участвующий в регуляции энергетического обмена путём воздействия на чувство голода, а также регуляции объёма жировой ткани [52]. У пациентов с ожирением были выявлены высокие концентрации лептина и резистентность к нему на уровне рецепторов, что может являться причиной неудовлетворительного эффекта адипокина по уменьшению аппетита и снижению массы тела [53]. В исследовании, рассматривающем полиморфизм гена лептина,
G2548A, у пациентов с МС был зарегистрирован более высокий уровень лептина [54]. Повышенный уровень лептина коррелировал с компонентами МС, включая высокий уровень триглицеридов и низкий уровень ЛПВП [54].
Адипонектин — важнейший адипокин, выделяемый жировой тканью человека. Адипонектин регулирует метаболизм глюкозы, а также снижает резистентность к инсулину благодаря активации процесса фосфорилирования и работе 5’-адено-зинмонофосфат-активируемой протеинкиназы в скелетных мышцах и печени [55]. Адипонектин блокирует образование жировых клеток в костном мозге и дифференцировку преадипоцитов [56]. Кроме того, адипонектин, связываясь со своими рецепторами AdipoR1 и AdipoR2 в скелетных мышцах и печени, способствует окислению жирных кислот и расходу энергии [57]. Уровень адипонектина в крови имеет тенденцию к снижению у пациентов с ожирением, причём более явная корреляция наблюдается у пациентов с наличием большого количества висцеральной жировой ткани [58]. Вышеперечисленные данные позволяют использовать адипонектин как маркер МС. Также рекомендуется расчёт соотношения лептина и адипонектина, как более показательного маркера МС, чем каждое из этих веществ в отдельности [59]. Целесообразность оценки этого соотношения показана и в подростковом возрасте. Лептин-адипонектиновое соотношение показало более высокую диагностическую ценность в качестве предиктора ИР у мальчиков и девочек 12–18 лет [60].
Висфатин — ещё один адипокин, вырабатываемый висцеральной жировой тканью. Висфатин является провоспалительным белком, индуцирующим продукцию таких цитокинов, как ИЛ-1 β , ИЛ-6 и ФНО-альфа [61]. Уровень висфатина выше 7,244 нг/мл обладает высокой чувствительностью и специфичностью для предсказания инфаркта миокарда [62]. В недавнем метаанализе Y. Jiang et al. было показано, что уровень висфатина был значимо выше у пациентов с МС, чем у пациентов в контрольной группе без МС, что позволяет считать его маркером метаболических нарушений [63].
В 2001 году исследователи продемонстрировали прямую зависимость между уровнем адипо-кина резистина и гиперинсулинемией у пациентов с ожирением [64]. Предполагалось, что именно резистин является звеном, связывающим сахарный диабет 2 типа и ожирение [65]. Однако в метаанализе 2019 г. значение этой взаимосвязи было частично опровергнуто. Действительно, уровень резистина реагирует на резистентность к инсулину у пациентов с гиперрезистинемией (≥14,8 нг/мл), однако у пациентов с нормальным уровнем резистина в крови ( < 14,8 нг/мл) при наличии сахарного диабета 2 типа и ожирения такой корреляции выявлено не было [66]. В то же время многие исследования подтверждают возможность использования резистина в качестве маркера ССЗ [67].
Ингибитор активатора плазминогена-1 (Plasminogen Activator Inhibitor-1, PAI-1) — представитель семейства ингибиторов сериновых протеаз с антипротеазной активностью, который является основным физиологическим ингибитором активаторов плазминогена тканевого типа (tPA) и урокиназного типа (uPA) [68]. Помимо его непосредственного участия в фибринолизе, PAI-1 играет существенную роль в течении ССЗ, процессах канцерогенеза и воспаления [69–71]. A. Vecchiola et al. показали наличие корреляции между PAI-1 и большинством компонентов МС после корректировки с учётом пола, возраста, индекса массы тела (ИМТ) и суточной экскреции натрия с мочой [72].
Адипоцитарный белок-переносчик жирных кислот (FABP-4) — внутриклеточный белок, участвующий в метаболизме жирных кислот, их накоплении и транспортировке [73]. В дополнение к своим внутриклеточным эффектам FABP-4 циркулирует в кровотоке и оказывает гормональное действие на жировую ткань и эндотелий [74]. В последние годы высказывается предположение о том, что FABP-4 может служить маркером ожирения, сахарного диабета 2 типа, диабетической нефропатии и гестационного сахарного диабета [25, 75]. Более того, препараты, оказывающие воздействие на FABP-4, были предложены в качестве потенциальных средств для лечения нарушений липидного обмена, острой болезни почек, ожирения и сахарного диабета 2 типа [76, 77].
МАРКЕРЫ, СВИДЕТЕЛЬСТВУЮЩИЕО НАРУШЕНИЯХ МЕТАБОЛИЗМАУГЛЕВОДОВ И ЛИПИДОВ
Нарушения метаболизма углеводов и липидов являются главными патогенетическими звеньями развития МС [17]. Например, при ожирении избыток углеводов вместо сохранения в виде гликогена преобразуется в триглицериды, которые откладываются в печени, скелетных мышцах, β -клетках поджелудочной железы и других тканях [78]. Отложение триглицеридов влияет на метаболическую регуляцию в поражённых тканях, в них развиваются так называемые процессы липотоксичности, одним из результатов которых является ИР [79, 80]. В связи с этим представляется оправданной оценка таких лабораторных маркеров, как глюкоза, триглицериды, индекс инсулинорезистентности и др.
Уровень глюкозы венозной плазмы — это один из наиболее распространённых и доступных крите- риев диагностики МС, который включён практически во все международные рекомендации [8–14]. Однако уровень глюкозы в критериях различен в зависимости от популяции. Кроме того, высокая вариабельность уровня глюкозы в крови у пациентов часто приводит к диагностическим ошибкам [81]. В связи с этим в качестве альтернативы уровню глюкозы венозной плазмы рассматривается гликированный гемоглобин. Гликированный гемоглобин (HbA1c) — продукт неферментативного гликозилирования β-цепи гемоглобина, повышающийся пропорционально повышению уровня глюкозы в крови [82, 83]. Анализ крови на HbA1c имеет больше технических преимуществ, чем измерение уровня глюкозы в плазме крови, а также меньшую биологическую вариативность и более удобен с клинической точки зрения [84]. Исследование, проведённое учёными из США, доказывает, что уровень HbA1c может использоваться для диагностики МС вместо оценки гликемии или вместе с ней [85]. Глюкоза плазмы натощак ≥80 мг/дл и HbA1c ≥5,5% [81] показательнее предсказывали наличие МС вместе, чем по отдельности.
Высокий уровень инсулина в крови — часто встречающаяся тенденция у пациентов с ожирением. Более того, гиперинсулинемия — явление более распространённое, чем резистентность к инсулину и может предшествовать ей [86]. Не вызывает сомнений роль гиперинсулинемии в развитии нарушения толерантности к глюкозе и сахарного диабета 2 типа [87].
Подходя к обсуждению такого понятия, как ин-сулинорезистентность, нельзя не упомянуть о его сложной и неоднозначной роли в качестве фактора развития МС. В настоящее время существует 2 противоположные точки зрения на роль ИР: с одной стороны, ИР длительно рассматривалась как объединяющий фактор и общее патофизиологическое звено МС, с другой стороны, ИР называют адаптивной реакцией, следствием избыточного поступления питательных веществ в организм [88]. Учитывая тот факт, что ИР является следствием, а не причиной гиперинсулинемии, учёные всё больше склоняются к мнению о преимущественно адаптивной роли ИР в развитии МС [88]. Это делает ИР незаменимым маркером МС. Для оценки ИР может использоваться индекс инсулинорезистент-ности (Homeostasis Model Assessment of Insulin Resistance — HOMA-IR) [89]. Он рассчитывается по формуле: HOMA-IR = инсулин натощак (мкЕД/ мл) x глюкоза натощак (ммоль/л)/22,5. По данным метаанализа 2022 г., включающего 38 исследований (215 878 участников), HOMA-IR коррелирует с рисками развития сахарного диабета 2 типа, артериальной гипертензией и нефатальными ССЗ [90].
Дислипидемия — нарушение обмена липидов в крови, определяется, как концентрация в сыворотке крови ЛПВП менее 1,0 ммоль/л у мужчин и менее 1,2 ммоль/л у женщин, триглицеридов более 1,7 ммоль/л, общего холестерина (ОХ) более 5,2 ммоль/л или/и ЛПНП более 3,3 ммоль/л (для людей, проживающих на территории Российской Федерации) [91]. Неоднократно была показана зависимость между дислипидемией, в т.ч. в виде нарушений в отдельных фракциях липидов, и наличием других компонентов МС. В данном обзоре мы ограничимся лишь несколькими примерами. Частота развития патологических состояний, входящих в состав МС, увеличивалась в китайской популяции тем сильнее, чем ниже был уровень ЛПВП [92]. L. A. Leiter et al. в своём исследовании продемонстрировали, что до 50% пациентов с сахарным диабетом 2 типа имеют повышенный уровень триглицеридов в крови [93]. Также было показано, что приём аторвастатина в дозе 80 мг снижал риск серьёзных сердечно-сосудистых осложнений на 29% [94].
В настоящее время отмечается тенденция к поиску соотношений известных ранее маркеров метаболических нарушений. Так, соотношение триглицеридов и ЛПВП показало корреляцию с ИР, ИБС, ССЗ и ожирением [95]. Достаточно простым показателем для оценки ИР выступает тригли-церид-глюкозный индекс [96]. Многочисленные исследования доказывают, что данный индекс стабильно или лучше, чем HOMA-IR, предсказывает наличие ИР [97–98].
ФЕРМЕНТЫ
Печень выполняет важную роль в метаболизме глюкозы и жирных кислот [99]. Метаболизм глюкозы в печени влияет на чувствительность к инсу- лину, в то время как периферическая ИР и липолиз способствуют накоплению жира в печени [99]. Таким образом, прослеживается связь между МС и неалкогольной жировой болезнью печени [100]. Оценка функциональных тестов печени: аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ) и гамма-глутамилтранспептидазы (ГГТП) позволяет получить представление о состоянии печени и определить риски развития метаболических нарушений, согласно данным исследователей из Ирана [101]. Действительно, по данным метаанализа 2023 г., в котором сравнивались концентрации ферментов печени у 76 686 человек с МС и у 201 855 человек без МС, уровни ферментов печени были значимо выше у пациентов с МС, чем в контрольной группе [102]. Полученные данные свидетельствуют о важнейшей роли ферментов печени как лабораторных маркеров МС.
ЗАКЛЮЧЕНИЕ
Современные критерии МС, учитывающие клинические и рутинные лабораторные показатели, являются важнейшими инструментами диагностики данного синдрома. Однако существующие критерии обладают высокой вариабельностью и не позволяют проводить раннюю диагностику компонентов МС. Более эффективной альтерна- тивой является оценка новых лабораторных маркеров, которая может способствовать не только ранней диагностике МС, но выявлению риска развития тех или иных компонентов МС у пациентов в будущем. В связи с огромным количеством лабораторных показателей, претендующих на роль маркеров МС, в данном обзоре мы постарались систематизировать известные к настоящему времени потенциальные маркеры и показать значимость каждого из них. Тем не менее, с каждым годом мы узнаём о всё новых открытиях в этой области. Отслеживание последних тенденций в диагностике МС и постепенное внедрение их в клиническую практику позволит нам выявлять на раннем этапе и профилактировать такие опасные заболевания, как сахарный диабет, гипертоническая болезнь, ИБС, дислипидемия, ожирение и др.
Финансирование: Авторы заявляют об отсутствии финансирования.


