Современные тенденции совершенствования конструкций пленочных аппаратов для фотоавтотрофного биосинтеза светозависимых микроорганизмов
Автор: Шевцов А. а, Дранников А.В., Пономарев А.В., Шабунина Е.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Процессы и аппараты пищевых производств
Статья в выпуске: 3 (69), 2016 года.
Бесплатный доступ
Современные тенденции совершенствования конструкции пленочных аппаратов для фотоавтотрофного биосинтеза светозависимых микроорганизмов направлены на значительное увеличение производительности ценных продуктов из биомассы микроскопических водорослей и получение на их основе отдельных полезных веществ (препаратов), используемых в различных отраслях народного хозяйства и медицине. В пленочных аппаратах эффективно протекают процессы тепло- и массообмена при контакте газа с культуральной жидкостью, стекающей в виде пленки по прозрачной пленкообразующей поверхности при ее интенсивном освещении, а автотрофный биосинтез развивается только в присутствии смеси воздуха с углекислым газом. При этом полностью исключается накапливание продуктов метаболизма за счет их непрерывного отвода из пленки культуральной жидкости с отходящим газом, что не характерно для аппаратов других типов. Небольшие габариты пленочных биореакторов позволяют увеличить степень насыщения жидкости углекислым газом с возможностью изменения концентрации газа в культуральной жидкости и обеспечить культивирование микроорганизмов с заданным выходом биомассы. В настоящее время разработано значительное количество способов обеспечения контакта газа с жидкостью (барботажный, газлифтный, механическое перемешивание, струйный, пленочный и др.), на основе которых созданы промышленные биореакторы, обладающие различным «стрессовым» эффектом. Считается, что для проведения культивирования наиболее оптимальными являются биореакторы с механическим перемешиванием жидкости, которые позволяют обеспечить наибольшую производительность по биомассе. Однако применяемые в них типовые механические перемешивающие устройства создают в рабочей полости биореактора хаотичное, неорганизованное перемешивание, что способствует к возникновению слабого массообмена, недостаточного для жизнеобеспечения клеток культур и микроорганизмов. Анализ способов взаимодействия газа с жидкостью в пленочных аппаратах показал необходимость создания биореакторов нового поколения с интенсивным массопереносом без вероятности лимитирования продуктивности биотехнологических систем. В работе показано последовательное изменение конструктивных элементов пленочных биореакторов, направленные на повышение эффективности их эксплуатации.
Пленочный аппарат, фотоавтотрофный биосинтез, биореактор, светозависимые микроорганизмы, культуральная жидкость, пленкообразующая поверхность, тепломассообмен
Короткий адрес: https://sciup.org/140229627
IDR: 140229627 | DOI: 10.20914/2310-1202-2016-3-68-76
Текст научной статьи Современные тенденции совершенствования конструкций пленочных аппаратов для фотоавтотрофного биосинтеза светозависимых микроорганизмов
В настоящее время для получения суспензии фотоавтотрофных микроорганизмов (Spirulina, Chlorella, Dunaliella и др.) используют биореакторы плёночного типа, позволяющие снабжать микроводоросли в необходимом объеме углекислым газом, световой энергией и питательными веществами [2].
Большие перспективы имеют аппараты со стекающей турбулентной пленкой жидкости по внутренней поверхности трубы с винтовой шероховатостью (рисунок 1). Скорость переноса газа в пленочных биореакторах и поверхностный коэффициент массоотдачи на порядок выше, чем в других биореакторах [1]. Коэффициент теплоотдачи в турбулентной пленке, при высоких нагрузках по жидкости, в 2–3 раза превышает значения, полученные в барботажных и газлифтных аппаратах. При этом достигается равномерное распределение температуры в объеме культуральной жидкости по причине пропускания всей ее массы через теплопередающую поверхность, что исключает образование застойных зон. Отвод тепла организуется непосредственно в зоне биохимической реакции, что не требует дополнительных конструктивных решений и не влияет на процесс интенсификации тепло- и массообмена.
В пленочных биореакторах исключается накапливание продуктов метаболизма в культуральной жидкости благодаря их интенсивному отводу из пленки с отработанным газом.
Проведение процесса ферментации в пленочных биореакторах возможно при низких расходах газа, так как в этих аппаратах газ не участвует в создании поверхности контакта фаз и турбулизации жидкости. При этом снижаются потери газа в окружающую среду, вследствие его размещения в зоне контакта с пленкой. Из-за высокой скорости подвода газа, отвода тепла и продуктов метаболизма пленочные биореакторы способны перерабатывать концентрированные питательные среды и получать высокую производительность и в несколько раз уменьшить габариты биореактора.
Небольшие габариты пленочного биореактора при высокой его производительности обеспечивают процесс ферментации при избыточном давлении, что увеличивает степень насыщения жидкости газом и позволяет легко изменять концентрацию газа в культуральной жидкости в процессе ферментации. В пленочном биореакторе исключается эффект флотации биомассы и пенообразования, что позволяет увеличить рабочий объем аппарата и обеспечить равномерное распределение микроорганизмов и питательной среды.
Пленочные биореакторы по конструктивному оформлению можно разделить на одноступенчатые (рисунок 1, а, в) и многоступенчатые (рисунок 1, б).
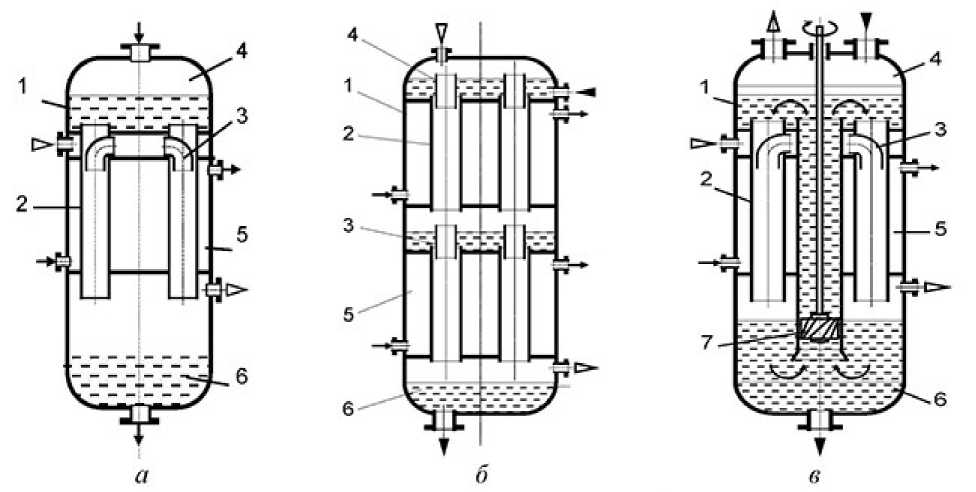
Рисунок 1. Схемы пленочных трубчатых биореакторов: 1 – корпус; 2 – контактная труба; 3 – газовый патрубок; 4 – камера для ввода газа; 5 – теплообменная секция; 6 – камера для культивирования; 7 – насос
Figure 1. Schemes of film tubular bioreactors: 1 – the case; 2 – contact tube; 3 – the gas pipe; 4 – gas injection camera; 5 – the heat exchange section; 6 – cell culturing; 7 – pump
В многоступенчатом биореакторе на каждой ступени осуществляется насыщение жидкости газом и его исчерпывание микроорганизмами. Это позволяет уменьшить расход перекачиваемой жидкости через аппарат, разместить большее количество культуральной жидкости в рабочей зоне биореактора.
Известные аппараты не могут быть использованы для культивирования автотрофных микроорганизмов, так как в конструкции не предусмотрена установка источника световой энергии для освещения суспензии, а цилиндрические трубы в зоне освещения выполнены непрозрачными.
Кроме этого эти аппараты не позволяют эффективно проводить процесс культивирования микроорганизмов с высоким выходом готовой биомассы, так как в них не предусмотрены различные виды истечения суспензии и оптимальные условия для роста автотрофных микроорганизмов уже на первом цикле культивирования.
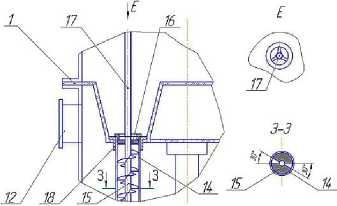
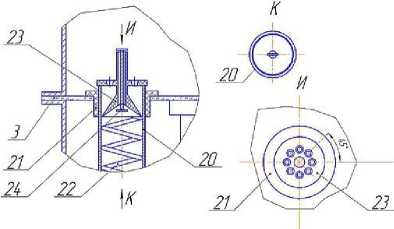
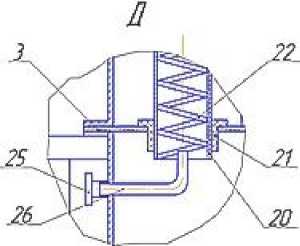
В пищевой, комбикормовой и других отраслях промышленности все большую актуальность приобретает алголизация – введение биомассы микроводорослей в состав продукта [8]. Для ввода в материал свежей суспензии микроводорослей ее целесообразно получать в условиях производства, включая в основную технологическую линию участок культивирования, ядром которого является фотобиореактор. Разработанный пленочный фотобиореактор (рисунок 2) предназначен для культивирования фотоавтотрофных микроорганизмов, в частности, микроводоросли хлорелла [3].
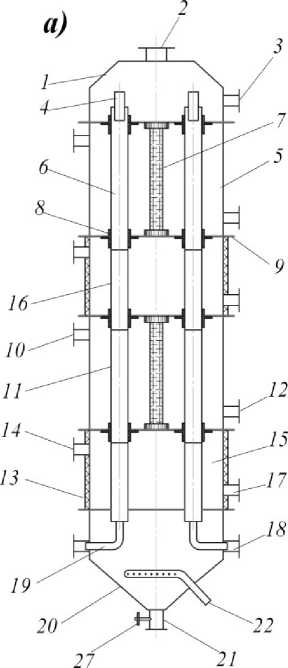
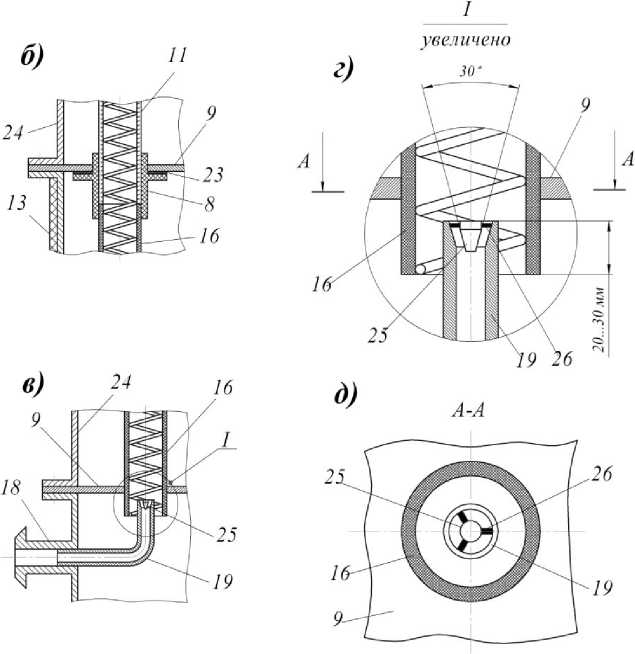
Рисунок 2. Фотобиореактор пленочного типа: а – общий вид; б – увеличенное соединение прозрачного и непрозрачного элементов цилиндрических трубок; в, д – увеличенная зона ввода смеси воздуха с углекислым газом в цилиндрические трубки
-
Figure 2. Photobioreactor film types: a – general view; b –- increased connection of transparent and opaque elements of cylindrical tubes; c, e – increased air mixture entering the zone with carbon dioxide in the cylindrical tube
Пленочный фотобиореактор состоит из корпуса 24, на котором размещены штуцеры для ввода и вывода суспензии автотрофного организма 3 и 21, штуцера для ввода и вывода охлаждающего воздуха 10 и 12, штуцера для ввода и вывода охлаждающей воды 14 и 17, штуцера для ввода и вывода смеси углекислого газа с воздухом 18 и 2. Корпус аппарата разделен горизонтальными перегородками 9 на секции ввода 1, вывода 20, секцию теплообмена 15 и секцию освещения 5. В горизонтальных перегородках установлены цилиндрические трубки 11 с распределителями жидкости 4. Внутрь цилиндрических трубок вставлена коаксиально винтовая спираль, представляющая собой проволоку круглого сечения. Прозрачные элементы трубок установлены в секции освещения, а непрозрачные – в секции теплообмена. Прозрачные и непрозрачные элементы соединены муфтами 8, снабженными уплотнениями 23. В центре секции освещения установлена цилиндрическая люминесцентная лампа 7, а внутренняя боковая поверхность этой секции выполнена зеркальной. Теплообменная секция пленочного аппарата снабжена наружной тепловой изоляцией 13. В секции вывода имеется барботажное устройство 22, а к штуцерам для ввода смеси углекислого газа с воздухом 18 присоединены изогнутые патрубки 19. Внутри изогнутых патрубков, на выходе, на трех штырях 26 установлена коническая пробка 25. В штуцере 21 для вывода суспензии предусматривается установка вентиля 27.
Предлагаемый фотобиореактор позволяет культивировать фотоавтотрофные микроорганизмы; интенсифицировать процесс теплоотвода от пленки суспензии в цилиндрических трубках; создать в камере вывода дополнительное насыщение суспензии углекислым газом посредством барботажа; обеспечить рациональное распределение потока газовоздушной смеси внутри цилиндрических трубок; создать оптимальные условия для компоновки аппарата в зависимости от требуемого выхода биомассы с использованием более одного комплекта чередующихся секций; повысить на 35…45% точность распределения потока ГВС по цилиндрическим трубкам.
Для интенсификации процесса культивирования была разработана конструкция фотобиореактора с комбинированным истечением жидкости (рисунок 3), которая представляет собой корпус, разделённый прозрачными горизонтальными перегородками 1, 2, 3 на пять герметичных секций: ввода суспензии 4, кольцевого истечения суспензии 5, промежуточную 6, плёночного истечения суспензии 7 и вывода суспензии 8 [4]. В секции 4 установлен штуцер для ввода суспензии 9, спиральный нагреватель 10 с термореле, регулятор давления 11. Между секциями ввода суспензии 4 и кольцевого истечения суспензии 5 закреплена прозрачная горизонтальная перегородка 1 секции ввода суспензии 4, выполненная с углублениями.
В секции кольцевого истечения суспензии 5 расположены штуцеры для ввода и вывода газа-теплоносителя 11 и 12, две лампы накаливания типа ДНаТ 13 в верхней и нижней частях секции и по окружности на одинаковом расстоянии друг от друга прозрачные цилиндрические трубки 14 с закреплёнными внутри них винтообразными насадками 15, выполненными из полой ПФХ трубки, на поверхности которой зафиксирована лента в виде секторов через каждые 30 градусов.
Однако этот биореактор имеет следующие недостатки:
─ невысокий выход биомассы, поскольку отсутствует рециркуляционная труба, обеспечивающая интенсивное перемещение культуральной жидкости;
─ низкое качество получаемой биомассы в связи с тем, что не созданы условия для более равномерного освещения культуральной жидкости при ее рециркуляции посредством коаксиального размещения лампы;
─ компоновочное решение аппарата нельзя признать оптимальным, т. к. в центральной зоне рабочего объема аппарата расположены лампы для освещения культуральной жидкости, а не рециркуляционная труба, обеспечивающая многократный возврат жидкости с последующим культивированием до достижения заданной концентрации биомассы культуральной жидкости с требуемым выходом;
─ сложность конструкции аппарата из-за чередующихся секций при культивировании суспензии с учетом чередования участков освещения и охлаждения делает её части труднодоступными при профилактическом обслуживании, а также непосредственно связана с увеличением габаритных размеров аппарата;
─ высокие удельные энергозатраты на получение биомассы, поскольку не используется кинетическая энергия газового субстрата на входе в биореактор;
─ не позволяет обеспечить рациональное распределение потока газа, так как в конструкции не используется кольцевой коллектор по всему сечению аппарата;
Перечисленные недостатки исключаются в предлагаемой авторами конструкции фотобиореактора.
Вид А
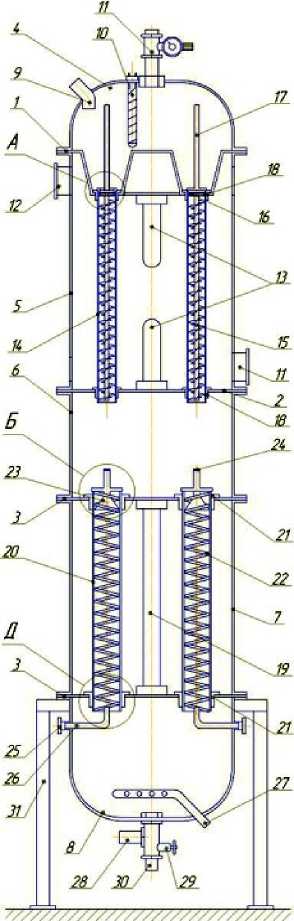
Рисунок 3. Конструкция фотобиореактора с комбинированным истечением жидкости
Вид Б
участок образования кольцевого истечения суспензии the plot of ring formations on the expiry of the suspension
участок образования плёночного истечения суспензии the site of the formation of a film of expiry of the suspension
участок подвода ГВС / Gas supply portion
-
Figure 3. Construction of photobioreactor with combined expiration of the liquid
Фотобиореактор состоит из корпуса 1, который разделен горизонтальными перегородками 2 на секции ввода культуральной жидкости 3, вывода культуральной жидкости 4, и дополнительную секцию 5 с внутренней зеркальной поверхностью, предназначенную для освещения суспензии автотрофных микроорганизмов. В горизонтальных перегородках 2 вертикально установлены прозрачные цилиндрические трубки 6 с пленкообразующим устройством 7, и прозрачная рециркуляционная труба 8, расположенная вертикально по оси симметрии аппарата в дополнительной секции 5. По длине прозрачных цилиндрических трубок на их внутренней поверхности нанесена винтовая спираль из проволоки 9.
В дополнительной секции 5 коаксиально установлена лампа накаливания 10 с возможностью освещения прозрачных цилиндрических трубок 6 и прозрачной рециркуляционной трубы 8.
В секции вывода культуральной жидкости 4 размещено барботажное устройство 11, выполненное в виде кольцевого коллектора по всему сечению аппарата, с патрубком 12 подачи смеси углекислого газа и воздуха. Внутри рециркуляционной трубы 8 по всей высоте аппарата установлен вал 13 в подшипниках 14 и 15. Корпус 16 подшипника 14 с крышкой 17 и сальником 18 закреплен в верхней части аппарата. Корпус подшипника 15 с крышкой 20 и сальником 21 расположен в патрубке барботажного устройства 11.
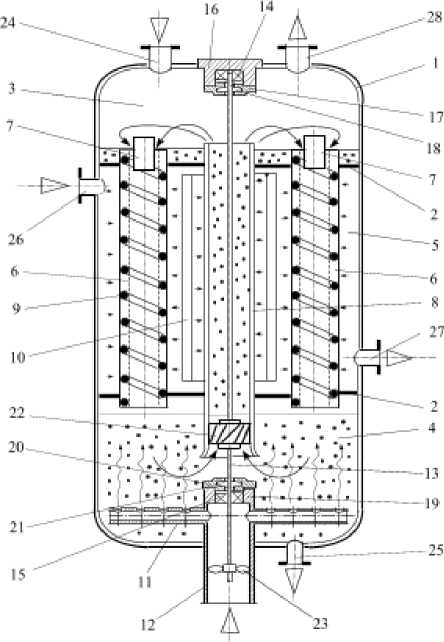
Рисунок 4. Конструкция фотобиореактора
выполненных в виде канавки полукруглого сечения на внутренней стороне прозрачных цилиндрических трубок 6, жидкостная пленка в противотоке со смесью углекислого газа и воздуха, интенсивно взаимодействуют.
Винтовая спираль 9 обеспечивает вращательно-поступательное движение жидкости и позволяет удержать большое количество культуральной жидкости на внутренней поверхности трубок 6. Наличие центробежной силы, вызванной вращательным движением пленки жидкости, предотвращает ее срыв и обеспечивает равномерное распределение по высоте прозрачных цилиндрических трубок 6.
Величину газожидкостного слоя, стекающего по пленкообразующей поверхности во впадине винтовой спирали определяли по зависимости [1]:
вп
1- 5 вп
I 2R J
h ) hs +
2R J ( s + e )
Г 2 (1 - h/R ) X e s
P 2 g 8( s + e ) 4 Vn^ (s + e)
1/3
-
Figure 4. Photobioreactor construction
На валу 13 внутри рециркуляционной трубы 8 в зоне вывода жидкости 4 закреплен роторный нагнетатель 22, направляющий культуральную жидкость из секции вывода культуральной жидкости 4 через рециркуляционную трубу 8 в секцию её ввода 3. Нижняя часть вала 13 снабжена крыльчаткой 23, которая расположена в патрубке 12 барботажного устройства 11 с возможностью вращения вокруг своей оси за счет кинетической энергии потока смеси углекислого газа с воздухом, подаваемой в секцию вывода культуральной жидкости 4.
На корпусе аппарата 1 размещены штуцера для ввода культуральной жидкости (суспензии автотрофного организма) 24 и вывода культуральной жидкости (готовой биомассы) 25, штуцера для ввода и вывода охлаждающего воздуха 26 и 27, штуцера для вывода отработанной смеси углекислого газа с воздухом 28.
Аппарат для культивирования автотрофных микроорганизмов работает следующим образом. Суспензия автотрофного микроорганизма поступает через штуцер 24 в камеру для ввода культуральной жидкости 3, проходит через кольцевой зазор пленкообразующих устройств 7 и в виде жидкостной пленки стекает по внутренней поверхности прозрачных цилиндрических трубок 6. Обтекая витки винтовых спиралей 9, где рсм - плотность газожидкостной смеси, кг/м3; e, h – ширина и высота выступа винтовой спирали, м; 5вп - толщина пленки газожидкостной смеси, м; Г = G /nd - массовая плотность орошения, кг / (с-м); R - радиус трубчатой насадки, м; s – расстояние между витками спирали, м; о = 8 - эмпирическая поправка.
Плотность газожидкостной смеси определяли с учетом плотности жидкости р ж , плотности газа р г и газосодержания ф :
р = р ж (1- ф) + р гф, (2)
При этом подача смеси углекислого газа с воздухом в аппарат осуществляется через патрубок 12 барботажного устройства 11, которое обеспечивает дополнительное насыщение жидкости углекислым газом в секции 4 и равномерное распределение потока газовоздушной смеси в прозрачных цилиндрических трубках 6.
За счет кинетической энергии потока смеси углекислого газа с воздухом, подаваемого в секцию вывода культуральной жидкости 4 через патрубок барботажного устройства 12, крыльчатка 23 приводится во вращательное движение и заставляет вращаться вал 13, установленный в подшипниках 14 и 15, а вместе с ним и роторный нагнетатель 22, направляющий культуральную жидкость из секции вывода 4 через рециркуляционную трубу 8 в секцию её ввода 3.
Для определения изменения концентрации СО 2 , растворенного в жидкой фазе по высоте рабочей зоны реактора с учетом кинетических закономерностей использована однопараметрическая диффузионная модель:
dCd v—L = Dl dzdz
C, k,aAC - aco2 и ----Lx
Lm
KCO2 + CL
где v – скорость потока, м/с; z – продольная координата, м; C – рабочая концентрация СО 2 в жидкой фазе; D – коэффициент осевой диффузии; ka – объемный коэффициент массопе-редачи, м/с; a co2 - расходный коэффициент по потреблению СО 2 , клетками кг/кг; A C - разность концентраций СО 2 в газовой и жидкой фазах (движущаяся сила массопереноса); U - максимальная скорость роста биомассы; индексы: G – газовая фаза; L – жидкая фаза; x = 1,13т + 1,59 - концентрация АСБ в суспензии, г/дм3, здесь τ – продолжительность культивирования.
Модель (3) была решена при следующих допущениях:
─ концентрация СО 2 меняется только вдоль оси z , в радиальном направлении она выровнена;
─ движение газовой фазы описывается моделью идеального вытеснения;
─ рассмотрен установившийся режим культивирования;
─ в аппарате отсутствуют застойные зоны и байпасные потоки;
─ концентрация растворенного СО 2 превышает критическую.
─ скорость потребления СО 2 клетками составляет q ( 1,13т + 1,59 ) .
Модель (3) в безразмерной форме принимает вид:
dC G dZ
- a G ( C g - C l ) = 0
1 d 2 C L dC L
Pe dZ 2 dZ
^ (4)
+ aL ( C g - C l ) - b = 0
где Pe = vLL - диффузионный критерий k aH k aH
Пекле; aG = —--- и aL = —--безразмер-фGVGV vl^L ные параметры, определяющие массопередачу
СО 2 из газовой фазы в жидкую;
b = q ( 1,13т + 1,59 ) ^L / ( vLC 0 ) - безразмерный параметр, определяющий скорость потребления СО 2 клетками микроводоросли (Сток СО 2 ); Z = z/H ; Cl = C, W ./C 00 ; Cg = Cr/C r -от-
LG GG носительные длина и концентрации соответственно; H – высота рабочей зоны реактора, м; ф - содержание фазы в рабочей зоне аппарата; C0 – концентрация СО2 в газовой фазе на входе в рабочую зону реактора; w - константа фазового равновесия.
Граничные условия при работе биореактора в режиме противотока:
при Z = 0: ^L = 0;
dZ
1 = C G
dCg при Z = 1: ----= 0;
dZ
C L = C L
dC L
^ (5)
--.----------------
Pe dZ
Расчет диффузионной модели (1–3) на ЭВМ с использованием метода Рунге-Кутта проводили при рациональных значениях параметров культивирования, полученных в ходе исследования кинетических закономерностей процесса квазинепре-рывного культивирования хлореллы.
Проверка адекватности результатов моделирования (рисунок 4) реальному процессу показала, что средняя ошибка аппроксимации по концентрации СО 2 в жидкой фазе составила 13%.
Модель позволяет определить распределение абсорбированного СО 2 в пленке суспензии по высоте рабочей зоны фотобиореактора и проводить масштабирование, то есть нахождение условий, при которых возможен непосредственный переход с экспериментальной установки на промышленный аппарат.
Рециркуляция культуральной жидкости позволяет обеспечить необходимое время культивирования автоавтотрофных микроорганизмов для достижения необходимой концентрации биомассы при заданном расходе смеси углекислого газа с воздухом (газового субстрата) с минимальными энергозатратами на процесс массообмена.
В дополнительной секции 5 суспензия автотрофного микроорганизма подвергается воздействию световой энергии посредством коаксиально установленной лампы накаливания дневного света 10. В процессе освещения лампой накаливания 10 выделяется теплота, которая компенсируется подачей охлаждающего воздуха в секцию 5 через штуцер 26. Отвод охлаждающего воздуха из секции 5 осуществляется через штуцер 27.
Рисунок 5. Влияние параметров диффузионной модели на изменение концентрации CO 2 в жидкой фазе по высоте рабочей зоны фотобиореактора: —□— – влияние параметра а G : 1 – 65; 2 – 30; 3 – 10;
– влияние параметра b : 4 – 1,5; 5 – 2,0; 6 – 3,0.
Figure 5. The influence of parameters diffusion models the change in the concentration of CO2 in the liquid phase along the height of the working area of the photobioreactor: —□— – influence of parameter а G : 1 – 65; 2 – 30; 3 – 10;
– influence of parameter b: 4 – 1,5; 5 – 2,0; 6 – 3,0.
На выходе из цилиндрических трубок 6 насыщенная углекислым газом суспензия автотрофного микроорганизма поступает в секцию для вывода культуральной жидкости 4, где дополнительно насыщается газовоздушной смесью с помощью барботажного устройства 11, при этом повышается суммарный коэффициент массообмена и тем самым интенсифицируется процесс культивирования. Из секции для вывода культуральной жидкости 4 суспензия автотрофного организма выводится в качестве готовой биомассы через штуцер 25.
Предложенный аппарат для культивирования автотрофных микроорганизмов позволяет:
─ повысить выход готовой биомассы, поскольку предусмотрено использование рециркуляционной трубы, обеспечивающей интенсивное перемещение культуральной жидкости;
Список литературы Современные тенденции совершенствования конструкций пленочных аппаратов для фотоавтотрофного биосинтеза светозависимых микроорганизмов
- Войнов Н.А., Жукова О.П., Курганский О.В., Вырина Е.Е. Массообмен в проточном биореакторе с рециркуляцией жидкости//Химия растительного сырья. 2014. № 3. С. 241-247.
- Семенов Г.В., Булкин М.С., Меламед Л.Э., Тропкина А.И. Тепломассообмен в промышленных процессах вакуумного сублимационного обезвоживания с учетом условий контактирования//Вестник Международной академии холода. 2010. № 2. С. 25-33.
- Семенов Г.В., Булкин М.С. Эффективная теплопроводность замороженных дисперсных материалов в процессах вакуумного обезвоживания//Вестник Международной академии холода. 2013. № 3. С. 55-57.
- Пат. № 2458980 РФ, МПК7 С 12 М 1/00, С 12 М 1/06, В 01 D 3/32. Аппарат для культивирования автотрофных микроорганизмов/Шевцов А.А., Дранников А.В., Ситников Н.Ю., Пономарев А.В., Мажулина И.В. № 2011126828; Заявл. 29.06.2011; Опубл. 20.08.2012; Бюл. № 23.
- Васильев В.Н., Куцакова В.Е., Фролов С.В. Кинетика диффузионных процессов при сушке квазиодномерных тел//Вестник Международной академии холода. 2013. № 3. С. 3-5.
- Семенова В.О., Ефремова А.А., Лисина Е.Ю., Тимиреева К.В. Изучение влияния бактериофагов на бактериальную загрязненность фарша, контаминированного гомологичными микроорганизмами//Биотика. 2015. Т. 7. № 6. С. 147-156.
- Пат. № 2577150 РФ, МПК7 С 12 М 1/00, С 12 М 1/06, В 01 D 3/32. Способ производства биомассы фотоавтотрофных микроорганизмов/Шевцов А.А., Тертычная Т.Н., Дранников А.В., Шабунина Е.А. № 2014153348; Заявл. 29.12.2014; Опубл. 11.02.2016.
- Пат. № 2411885 РФ, МПК7 А 23 Р 1/02, А 23 № 17/00. Способ производства крупки по технологии влажного гранулирования с использованием фототрофной биомассы и фуза растительных масел и линия для его осуществления/Шевцов А.А., Пономарев А.В., Шенцова Е.С., Лыткина Л.И., Дранников А.В., Бритиков Д.А., Хорхордин Д.С. № 2009132801/13; Заявл. 31.08.2009; Опубл. 20.02.2011; Бюл. № 23
- Kolesnikova Y.N., Pimenov N.V., Kapustin A.V. The etiology of anaerobic infections of cattle and comparative characteristics of the isolated strains of Clostridium//Russian Journal of Agricultural and Socio-Economic Sciences. 2016. V. 56. № 8. P. 39-48.


