Современные тенденции в лечении локальных хрящевых дефектов коленного сустава
Автор: Егиазарян К.А., Лазишвили Г.Д., Ратьев А.П., Сиротин И.В., Бут-гусаим А.Б., Данилов М.А., Шпак М.А.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 3 (43), 2020 года.
Бесплатный доступ
Статья посвящена актуальному направлению современной ортопедии - хирургическому лечения локальных полнослойных дефектов гиалинового хряща коленного сустава. Эта патология диагностируется у 5-10% больных с заболеваниями и повреждениями коленного сустава.Материалы и методы: Авторами статьи представлена одна из самых современных и доступных технологий восстановления дефектов хряща - технология индуцированного матрицей аутохондрогенеза (AMIC - autologous matrix-induced chondrogenesis). Такая методика операции применена у 63 больных. В статье представлены показания и техника операции, рассмотрены возможные ошибки, осложнения, критерии оценки исходов лечения.Результаты: исходы лечения в сроки до 13 лет изучены у 56 больных. Хорошие результаты лечения отмечены у 53 больных. Во всех случаях достигнута качественная и регенерация хрящевой поверхности мыщелков бедренной кости.Заключение: Анализ исходов лечения больных после имплантации коллагеновых мембран в различных модификациях позволяет авторам статьи рекомендовать эту методику к широкому применению в клинической практике.
Локальные дефекты хряща, коленный сустав, рассекающий остеохондрит, болезнь кенига, костно-хрящевой дефект, коллагеновая мембрана, технология amic
Короткий адрес: https://sciup.org/142230046
IDR: 142230046 | УДК: 616.72-089.843 | DOI: 10.38181/2223-2427-2020-3-65-72
Текст научной статьи Современные тенденции в лечении локальных хрящевых дефектов коленного сустава
Проблема хирургического лечения полнослойных локальных поражений гиалинового хряща коленного сустава (КС) остается актуальным направлением современной травматологии и ортопедии [1]. Из 1 млн. больных с заболеваниями и повреждениями КС, у 5-10% диагностируются локальные хрящевые и костно-хрящевые поражения [2] Ежегодно в Европе выполняется более 200 тыс. операций по коррекции такой патологии. В США у 900 тыс. пациентов с травмами коленного сустава ежегодно диагностируются изменения хряща КС различной степени выраженности. Причем, 5% из них – лица моложе 40 лет. На каждую тысячу пациентов в возрасте 40-60 лет, у 200-250 больных диагностируются локальные поражения хряща [3-6].
К основным причинам нарушения целостности хрящевой ткани многие травматологи [7,8] относят первичные и вторичные механические повреждения (обусловленные как единичными,так и множественными травмами КС), а также хронические дегенеративно-дистрофические заболевания КС (остеоартроз, остеонекроз, рассекающий остеохондрит) [9,10,11,12 и др.].
Отсутствие достаточного количества отечественных публикаций, посвященных проблеме хирургического лечения локальных дефектов хряща (ЛДХ), еще раз доказывает целесообразность и необходимость изучения этой проблемы. До сих пор в отечественной литературе нет единых показаний к хирургическому лечению ЛДХ; отсутствуют четкие рекомендации в отношении выбора методики хирургической коррекции; не определены показания и не изучены результаты использования биотехнологий для восстановления хрящевой ткани и др. Эти и многие другие факторы определяют актуальность темы исследования,что определило целесообразность создания современного и высокоэффективного подхода к лечению локальных полнослойных дефектов гиалинового хряща коленного сустава
Цель исследования
Определение биологического потенциала коллагеновых мембран и эффективности технологии AMIC при восстановлении полнослойных поражений гиалинового хряща.
В своей работе мы использовали 4-х стадийную классификацию поражения хрящевой ткани,утвержденную в 2003 году Международным обществом восстановления хряща – ICRS (International Cartilage Repair Society) в качестве международного стандарта [13]. Все стадии основаны на глубине его поражения: поверхностного слоя (стадия 1); промежуточного и базального слоев, не доходящего до субхондральной кости (стадия 2); промежуточного и базального слоев, доходящего до субхондральной кости без ее поражения (стадия 3) и с ее поражением (стадия 4). В нашей работе мы широко использовали именно эту классификация, считая ее наиболее полной и информативной, значительно облегчающей документирование характера повреждения хрящевой ткани.
Материалы и методы
За период с 2005 по 2020 гг. в ГКБ № 1 им. Н.И.Пиро-гова (клиническая база кафедры травматологии, ортопедии и ВПХ РНИМУ им. Н.И.Пирогова) было оперировано 63 больных с локальными полнослойными (стадия 3-4) дефектами хряща мыщелков бедренной кости и межмыщелковой борозды.Всем этим больным применена современная, наиболее доступная для широкой кли- нической практики технология индуцированного матрицей аутохондрогенеза AMIC (autologous matrix-indused chondrogenesis). Подавляющее большинство больных (81,4%) находились в наиболее активном и трудоспособном возрасте от 21 года до 50 лет, что, несомненно, носит социальную направленность. Давность заболевания оценивалась со слов больных во время сбора анамнеза,а именно с момента появления первых жалоб до постановки диагноза.Наиболее часто встречались дефекты хряща размером 4-6 см². У 53 больных дефект хряща локализовался на медиальном мыщелке бедренной кости, у 10 больных – на латеральном мыщелке бедренной кости и у 1 пациента – в области межмыщелковой борозды. Имплантация коллагеновой мембраны без костной пластики выполнена у 14 пациентов, с костной аутопластикой – у 33 больных, с пластикой дефекта био композитными материалами – в 17 случаях.
В последнее десятилетие стремительно стали развиваться клеточные и биотехнологии для восстановления дефектов гиалинового хряща. К одной из них относится технология индуцированного матрицей аутохондрогенеза – AMIC (autologous matrix indused chondrogenesis) [14,15,16]. Технология AMIC основана на формировании отверстий в субхондральной кости (обеспечивающих транспорт костного мозга на поверхность дефекта) и репаративной способности стромальных клеток костного мозга, поступающего через сформированные отверстия. Образующийся в результате этого суперсгусток из цитокинов и стромальных клеток красного костного мозга стабилизируется коллагеновой мембраной, имплантируемой на субхондральную кость. Естественный клеточный каркас защищает и связывает прогениторные клетки внутри «биологической камеры», стимулируя их дифференциацию для репарации хряща.
Преимущества технологии AMIC очевидны. Это: малоинвазивная одноэтапная процедура, не требующая культивирования хондроцитов; возможность восстановления крупных дефектов хряща; простая хирургическая техника; подтвержденная эффективность в отношении купирования болевого синдрома, восстановления функции КС и удовлетворенности больных исходами лечения.
Несмотря на многочисленные исследования в этой области и широкое использование технологии AMIC в мировой клинической практике, остается много спорных и нерешенных вопросов, таких как: сроки деградации и характер трансформации коллагеновых мембран, степень выдерживаемой ими нагрузки, вид и качество вновь образованной хрящевой ткани и др.
В нашей работе мы использовали 2 вида коллагеновых мембран, синтезированных из животного коллагена (свиного и бычьего) I и III типа, который резорбируется ес- тественным путем. Под действием коллагеназ, желатиназ и протеаз, коллаген мембран разрушается до олигопептидов и, в конечном счете, до свободных аминокислот. Сегодня, коллагеновая мембрана является одним из наиболее востребованных и доступных биологических материалов для восстановления хрящевой ткани.
Обе мембраны имеют двухслойную структуру. Плотный слой имеет гладкую, не проницаемую для клеток поверхность, которая препятствует проникновению клеток костного мозга в полость КС и обеспечивая стабилизацию сгустка костного мозга на поверхности субхондральной кости ( рис. 1А). Пористый слой мембран состоит из рыхлых коллагеновых волокон, способствующих проникновению клеток в мембрану и их адсорбции ( рис. 1Б,В). Структуры мембран имеют высокую устойчивость к растяжению, что препятствует их разрыву.
Имплантацию коллагеновых мембран считали показанной при полнослойных (стадия 3-4) хрящевых дефектах контактных поверхностей мыщелков бедренной кости и межмыщелковой борозды, площадью поражения не более7 см². Обязательными условиями для успешного исхода операции считали наличие неповрежденного окружающего дефект гиалинового хряща, жизнеспособной субхондральной кости и не измененной механической оси нижней конечности.
К противопоказаниям к операции отнесли: наличие множественных локальных повреждений хряща, распространенный остеоартроз КС; системные аутоиммунные заболевания; нестабильность КС,обусловленную повреждением связок и менисков; вальгусную или варусную деформацию голени,требующую выполнения корригирующих операций; аллергию на коллаген.
Остановимся на основных технических особенностях технологии AMIC. Все операции начинали с выполнения артроскопии, позволяющей верифицировать локализацию зоны и стадию повреждения хряща, наличие сопутствую- щих внутрисуставных повреждений. При необходимости выполнялась коррекция обнаруженной патологии (пластика связок, резекция менисков,удалениехондромных тел и др.). Производилась санация дефекта, заключающаяся в иссечении нестабильных, отслоившихся и дегенеративно измененных фрагментов хряща, сглаживании краев дефекта. Оценивались площадьпоражения хряща, состояние субхондральной кости и возможность имплантации коллагеновой мембраны артроскопическим способом (АС). При небольших дефектах хряща (2-3 см²) имплантацию мембраны выполняли под АС контролем.
В тех случаях, когда имелся обширный дефект хряща – 3-7см², артроскопия завершалась и дальнейшие этапы операции выполнялись открытым способом (рис. 2А). Еще раз хотим обратить внимание, что имплантация мембраны допускается только на здоровую и кровоснабжаемую субхондральную кость.
Производилась санация (выравнивание) хряща по краям дефекта и удаление поверхностного слоя измененной субхондральной кости до кровоточащих слоев (рис. 2Б). Спицей диаметром 2,4мм выполняли рассверливание здоровой субхондральной кости на глубину 1-1,5 см (рис. 2В) Успехом этой манипуляции следует считать обильное кровотечение из сформированных отверстий.
Коллагеновая мембрана моделировалась по форме и размеру дефекта хряща. На субхондральную кость по краям дефекта наносили фибриновый клей. Мембрана укладывалась пористой поверхностью на субхондральную кость, расправлялась и плотно прижималась к кости (рис. 2Г). После полимеризации фибринового клея, что занимало 3-5 минут, проверялась прочность и стабильность фиксации коллагеновой мембраны.
Ее также возможно фиксировать с помощью рассасывающихся нитей диаметром 6,0 USP. Этот вариант фиксации более сложный и длительный, требует достаточнойтолщины окружающего дефект здорового гиалиновогохряща. При не-
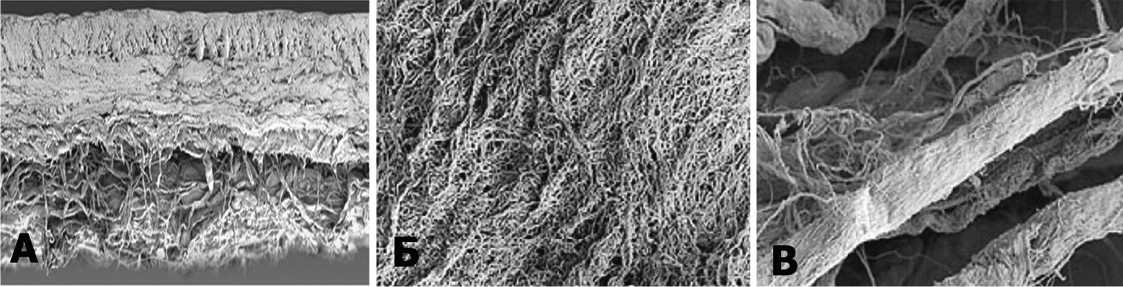
Рис. 1. Микроскопическая структура коллагеновых мембран. А – Двухслойная структура мембраны. Электронная микроскопия. Увеличение в 100 раз. Б – Плотная, не пропускающая клетки поверхность мембраны. Увеличение в 1500 раз. В – Пористая, адгезирующая клетки поверхность мембраны. Увеличение в 1500 раз
Fig. 1. Microscopic structure of collagen membranes. A – Two-layer membrane structure. Electron microscopy. Magnification 100 times. B – Dense, cell-tight membrane surface. The magnification is 1500 times. B – Porous membrane surface adhering to cells. Magnification 1500 times
достаточной толщине гиалиновогохряща, нитимогут «прорезаться» и фиксациямембраны окажется несостоятельной В последнее время, мы чаще выполняем фиксацию мембраны фибриновым клеем. После полимеризации клей приобретает пористую структуру, не препятствующую проникновению клеток костного мозга в мембрану.
Клиническое наблюдение. Больной П., 23 лет, профессиональный игрок баскетбольной команды, обратился в клинику с жалобами на боли в левом коленном суставе возникающие при физических нагрузках и сохраняющиеся в покое. Считал себя больным более 1,5 лет. Отмечал многократные спортивные травмы коленного сустава.
При инструментальном обследовании, включающем рентгенографию, МРТ и МСКТ, диагностирован рассекающий остеохондрит латерального мыщелка левой бедренной кости в области межмыщелковой борозды При предоперационном планировании были оценены размеры костно-хрящевого дефекта мыщелка. Выполнение пластики дефекта артроскопическим способом не представлялось возможным.
В плановом порядке под эпидуральной анестезией больному выполнена артротомия коленного сустава. Обнаружена некротизированнаяхрящевая пластина с желтоватой поверхностью в области латерального мыщелка бедра, которая легко отделилась от своего ложа (рис. 3А) После санации окончательные размеры дефекта мыщелка составили 3х2,5 см с глубиной поражения хряща 0,4 мм (рис. 3Б).
Произведена туннелизация субхондральной кости (рис. 3Б). С помощью аллюминиевого шаблона коллагеновая мембрана смоделирована по форме и размеру дефекта мыщелка (рис. 3В). С использованием фибринового клея в область дефекта имплантирована коллагеновая мембрана. Достигнуто полное замещение хрящевого дефекта стабильной коллагеновой мембраной (рис. 3Г). Реабилитационная программа по стандартным протоколам.
Через 12 месяцев после операции пациент вернулся к прежнему уровню интенсивных физических нагрузок. Через 1,4 года после операции больной во время игры в баскетбол получил повторную травму коленного сустава
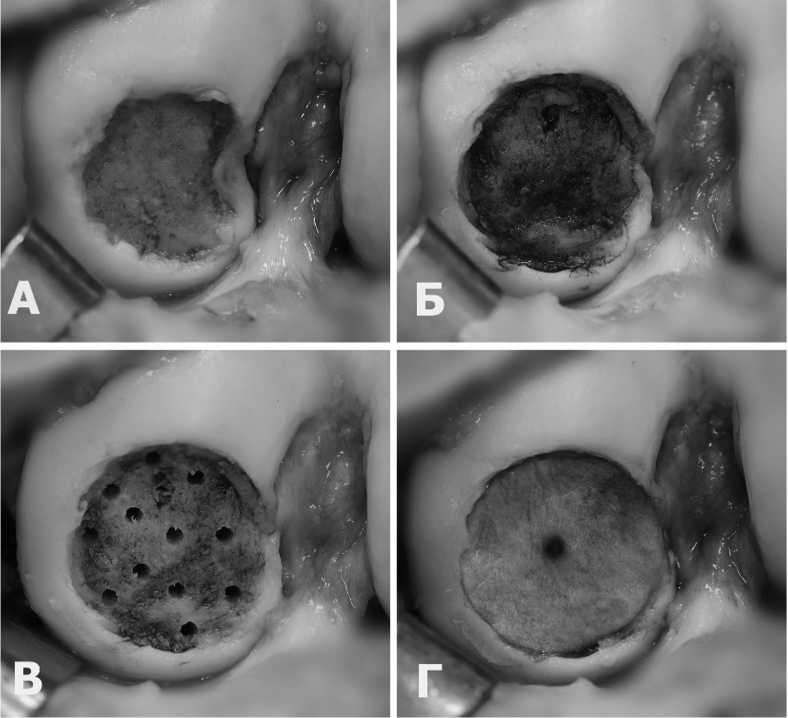
Рис. 2. Этапы операции AMIC. А – дефект до санации. Б – дефект после санации. В – дефект после туннелизации субхондральной кости. Г – имплантирована коллагеновая мембрана
Fig. 2. Stages of AMIC operation. A – defect before sanitation. B – defect after reorganization. Б – defect after tunnelization of the subchondral bone Г – a collagen membrane is implanted
По данным МРТ был диагностирован лоскутный разрыв заднего рога медиального мениска.
При артроскопической операции диагноз «разрыв мениска» подтвердился. Выполнена частичная резекция заднего рога. Исследована зона имплантации коллагеновой мембраны. Дефект латерального мыщелка бедра был полностью укрыт стабильной хрящеподобной тканью прочной и упругой консистенции. Макроскопический результат имплантации коллагеновой мембраны расценен как хороший (рис. 4А).
Гистологическое исследование биоптата из центральной зоны имплантации мембраны выявило активные репаративные процессы, направленные на восстановление резорбированной костной ткани, закрытие дефекта, а также восстановление хрящевого покрова. На месте имплантированной мембраны образовалась стабильная волокнистая хрящевая ткань с множественными участками хондроцитов в толще (рис. 4Б).
Анализ наших клинических наблюдений и гистологиче-скогоматериала позволил нам сделать крайне важный вывод о том, что коллагеновая мембрана может подвергаться полноценному хондрогенезу только при контакте с кровоснабжаемой и стабильной субхондральной костью!
Именно поэтому в последнее время особенное внимание уделяем состоянию субхондральной кости. Выраженный склероз и некроз субхондральной кости указывают на ее нежизнеспособность. В таких случаях считаем показанным удаление нежизнеспособной кости до здоровых кровоточащих слоев, с последующей костной пластикой дефекта и восстановления конгруэнтности суставной поверхности мыщелка. Отсутствие «кровяной росы»после выполнения туннелизации субхондральной кости свидетельствует о ее склерозе и должно насторожить хирурга! В таких случаях имплантацию мембраны без костной пластики считаем бесперспективной
Основываясь на данных гистологических исследований и анализе нашего клинического материала, мы пришли к выводу о необходимости полноценного замещения патологически измененной кости. До 2011 года для этого мы использовали биокомпозитную кость в виде гранул на основе
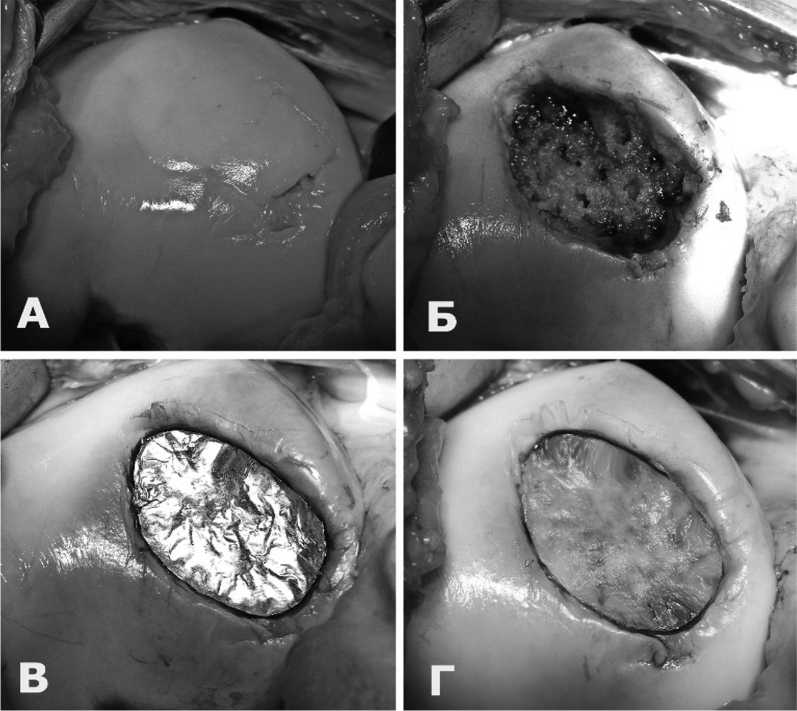
Рис. 3. Этапы операции AMIC у больного П.А. – Некротизированная хрящевая пластина. Б – дефект после санации и туннелизации субхондральной кости. В – моделирование формы и размера дефекта аллюминиевым шаблоном. Г – имплантирована коллагенова мембрана
Fig. 3. Stages of AMIC operation in patient P. A. – Necrotic cartilage plate. Б – defect after debridement and tunnelization of the subchondral bone. B – modeling the shape and size of the defect with an aluminum template. Г – a collagen membrane is implanted
β-трикальцийфосфата (остеокондуктивный материал). После санации дефекта и туннелизации субхондральной кости, дефект мыщелка (чаще кратерообразной формы) заполнялся био костью. На последнюю наносился фибриновый клей и имплантировалась коллагеновая мембрана.
Последующий анализ исходов пластики дефекта био костью показал ошибочность выбраннойтактики. Ревизионные артроскопические операции выявили у 3-х пациентов разрушение мембран, а данные МСКТ – отсутствие перестройки био кости даже через несколько лет послеоперации.
Анализ этих клинических наблюдений позволил сделать вывод о том, что коллагеновая мембрана может подвергаться полноценному хондрогенезу только при контакте с кровоснабжаемой и стабильной аутологичной костью!
Изначально казалось, что отрицательный результат, а именно разрушение мембраны был связан с неполноценной санацией костно-хрящевого дефекта. Однако, анализ литературы показал, что сроки полноценной перестройки применяемой нами био кости достаточно длительные и составляют не менее 2-х лет.
Несколько последующих наблюдений с разрушением коллагеновых мембран на различных сроках после операции (при полноценной санации субхондральной кости) убедили в том,что это осложнение связано с применением именно искусственной кости.Сегодня мы понимаем, что для полноценной регенерации и перестройки коллагеновой мембраны необходима стабильная основа из здоровой, кровоснабжаемой субхондральной кости.
Отказавшись от применения био кости, мы стали использовать аутологичную кость. Полой цилиндрической фрезой, из бокового отдела (неконтактная зона) противоположного мыщелка бедра производили забор костного столбика длиной 20-25 мм. Последний измельчали. После этапа рассверливания субхондральной кости, дефект мыщелка плотно заполняли измельченной ауто- костью. Импактором послойно уплотняли ауто кость создавая костную основу для имплантации матрицы и восстанавливая конгруэнтность мыщелка.
Однако, контрольные МСКТ и МРТ исследования позволили выявить глубокий лизис аутологичной кости (различной степени выраженности) в зоне ее имплантации у 3-х больных. Эти осложнения нам заставили пересмотреть способ костной пластики дефекта мыщелка. Сегодня, в эпицентр костно-хрящевого дефекта мы имплантируем аутологичные костные столбики-трансплантаты в необходимом для полноценной пластики дефекта количестве и уже на эти столбики имплантируется коллагеновая мембрана. Забор цилиндрических спонгиозных столбиков-трансплантатов производили из боковых (неконтактных) зон мыщелков бедренной кости, либо из мыщелков большеберцовой кости. Эта методика получила название «Гибридная костно-хрящевая трансплантация» (Патент № 2692228). Такая методика позволила выполнять полноценную пластику обширных по площади поражения (5-7 см²) костно-хрящевых дефектов мыщелков бедренной кости, не опасаясь дефицита пластического материала. Об этой методике мы уже подробно писали ранее [17, 18].
Анализ исходов лечения в сроки до 13 лет произведен у 56 пациентов, которым была применена технология AMIC вразличных модификациях. Ближайший срок оценки ранних исходов лечения считали 6 месяцев со дня операции. Как правило, у большинства пациентов к этому сроку происходило восстановление функции оперированного КС. Ближайший срок оценки отдаленных исходов лечения считали 12 месяцев со дня операции. К большинства пациентов к этому сроку наступала полная или частичная регенерация зоны пластики КХД.
Клинико-функциональные результаты лечения были разделены нами на 3 группы (хорошие, удовлетворительные, плохие) и оценивались по следующим критериям:
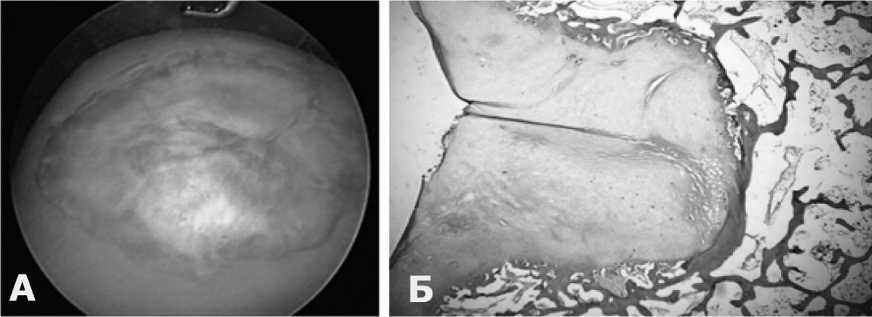
Рис. 4. А – артроскопический результат через 1,5 года после имплантации коллагеновой мембраны. Б – гистологическая картина образования волокнистой хрящевой ткани на месте имплантации коллагеновой мембраны
Fig. 4. A – arthroscopic result 1.5 years after collagen membrane implantation. B – histological picture of the formation of fibrous cartilage tissue at the site of collagen membrane implantation
восстановление амплитуды движений в КС; разница в силе и тонусе четырехглавой мышцы бедра (ЧГМБ) между оперированной и здоровой конечностью; степень гипотрофии ЧГМБ; восстановление трудоспособности за максимально короткий срок;уровень физической активности по ICRS; интенсивность боли по визуально-аналоговой шкале (ВАШ); восстановление функции коленного сустава по шкале WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index).
Для инструментальной оценки характера регенерации хрящевой ткани использовали магнитно-резонансную томографию,а для оценки ремоделирования костной ткани – компьютерную томографию с последующей оценкой минеральной плотности костных тканей.
Анализ исходов лечения показал, что у 53 больных по совокупности описанных выше признаков отмечены хорошие результаты лечения, у 2-х больных реабилитационный период осложнился тугоподвижностью КС, что потребовало интенсивного восстановительного лечения с последующим восстановлением амплитуды движений в КС.У одного пациента послеоперационный период осложнился рецидивирующими синовитами.
Обсуждение. Анализируя технологию AMIC хотим отметить, что с ее помощью возможно восстановление обширных по площади поражения (≤ 7см²) хрящевых и костно-хрящевых дефектов мыщелков бедренной кости и межмыщелковой борозды. Разработанная отечественными учеными коллагеновая мембрана позволит существенно снизить бюджет операции и расширить показания для ее применения. Анализ исходов лечения больных после имплантации коллагеновых мембран позволяет нам рекомендовать эту технологию к широкому применению в клинической практике специализированных стационаров.
Список литературы Современные тенденции в лечении локальных хрящевых дефектов коленного сустава
- Devitt BM, Bell SW, Webster KE, Feller JA, Whitehead TS. Surgical treatments of cartilage defects of the knee: Systematic review of randomised controlled trials. Knee. 2017;24(3):508-17. https://doi.org/10.1016/j.knee.2016.12.002
- Keudell AV, Bryant T, Minas T, Center CR. Radiographic and clinical analysis of autologous chondrocyte transplantation to the patella. Bone. 2012;50:S187. https://doi.org/10.1016/j.bone.2012.02.592
- Anders S, Volz M, Frick H, Gellissen J. A Randomized, Controlled Trial Comparing Autologous Matrix-Induced Chondrogenesis (AMIC®) to Microfracture: Analysis of 1- and 2-Year Follow-Up Data of 2 Centers. Open Orthop J. 2013;7(1):133-43. https://doi.org/10.2174/1874325001307010133
- Bentley G, Bhamra JS, Gikas PD, Skinner JA, Carrington R, Briggs TW. Repair of osteochondral defects in joints - How to achieve success. Inj. 2013;44:S3-10. https://doi.org/10.1016/S0020-1383(13)70003-2
- Bradley, J. Osteochondral autograft transplantation clinical outcome study. Proceedings of the Metcalf Memorial Meeting. 1999.
- Brennan SA, Devitt BM, O’Neill CJ, Nicholson P. Focal femoral condyle resurfacing. Bone Jt J. 2013;95-B(3):301-4. https://doi.org/10.1302/0301-620X.95B3.29998
- Dandy DJ, Eds PM, Airchorth WD, Cannon DV. Chondral and osteochondral lesions of femoral condyles . Knee surgery. Current Practice. 1992:443-448.
- Kraeutler MJ, Belk JW, Purcell JM, McCarty EC. Microfracture Versus Autologous Chondrocyte Implantation for Articular Cartilage Lesions in the Knee: A Systematic Review of 5-Year Outcomes. Am J Sports Medicine. 2018;46(4):995-9. https://doi.org/10.1177/ 0363546517701912
- Bruns J, Werner M, Soyka M. Is vitamin D insufficiency or deficiency related to the development of osteochondritis dissecans? Knee Surg Sports Traumatology Arthrosc. 2016;24(5):1575-9. https://doi.org/10.1007/s00167-014-3413-7
- Hirschmann A, Hirschmann M. Chronic Knee Pain: Clinical Value of MRI versus SPECT/CT. Semin Musculoskel R. 2016;20(01):003-11. https://doi.org/10.1055/s-0036-1579674
- Kim MK, Choi SW, Kim SR, Oh IS, Won MH. Autologous chondrocyte implantation in the knee using fibrin. Knee Surg Sports Traumatology Arthrosc. 2010;18(4):528-34. https://doi.org/10.1007/ s00167-009-0905-y
- Lahner M, Duif C, Ficklscherer A, Kaps C, Kalwa L, Seidl T. Arthroscopic Fixation of Cell Free Polymer-Based Cartilage Implants with a Bioinspired Polymer Surface on the Hip Joint: A Cadaveric Pilot Study. Biomed Res Int. 2014;2014:1-6. https://doi.org/10.1155/ 2014/717912
- Hsu AC, Tirico LEP, Lin AG, Pulido PA, Bugbee WD. Osteochondral Allograft Transplantation and Opening Wedge Tibial Osteotomy: Clinical Results of a Combined Single Procedure. Cartilage. 2018;9(3):248-54. https://doi.org/10.1177/1947603517710307
- Букач Д.В., Эйсмонт О.Л. Восстановление полнослойных повреждений суставного хряща с помощью аутотрансплантации мезенхимальных стволовых клеток. Сборник тезисов III Международного Конгресса АСТАОР в сотрудничестве с ESSKA и ISAKOS. - М.: РНПЦ травматологии и ортопедии, 2016. - С. 63.
- Alsousou J, Ali A, Willett K, Harrison P. The role of platelet-rich plasma in tissue regeneration. Platelets. 2012;24(3):173-82. https://doi.org/10.3109/09537104.2012.684730
- Anders, S. A randomized, controlled trial comparing autologous matrix - induced chondrogenesis (amic(r)) to microfracture: analysis of 1 - and 2 - year follow - up data of 2 centers. The Open Orthopaedics Journal. 2013. Vol. 7. P. 133-143.
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П. Гибридная костно-хрящевая трансплантация - инновационная методика оперативного лечения рассекающего остеохондрита коленного сустава // Кафедра травматологии и ортопедии. 2020. №1 (39). С.59-66. https://doi.org/10.17238/issn2226-2016.2020.1.59-66
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П. Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава // Хирургическая практика. 2019. №4 (40). С.10-18. https://doi.org/ 10.38181/issn2223-2427.2019.4.10


