Современные возможности безынтерфероновой терапии HCV-инфекции опыт реальной клинической практики. Сравнение неинвазивных методов оценки фиброза печени
Автор: Саранская Яна Евгеньевна, Киселева Любовь Михайловна, Ильмухина Лариса Владимировна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2022 года.
Бесплатный доступ
Инфицированность населения вирусом гепатита С в России составляет 2-3 %. Социально-экономический ущерб, обусловленный ростом заболеваемости хроническим гепатитом и такими его последствиями, как цирроз печени, гепатокарцинома, в нашей стране огромен. Цель противовирусной терапии хронического гепатита С - устойчивый вирусологический ответ, который ассоциируется с биохимическим ответом и регрессом фибротизации печеночной ткани, что приводит к снижению развития цирроза печени. Цель работы - определение эффективности безынтерфероновой терапии; сравнение эффективности неинвазивных методов диагностики фиброза печени при хроническом гепатите С. Материалы и методы. Под наблюдением находилось 63 пациента, прошедших курс терапии препаратами прямого противовирусного действия дасабувир и омбитасвир + паритапревир + ритонавир 3D-терапия) в сочетании с рибавирином и без него в зависимости от генотипа вируса гепатита С и стадии фиброза печени. Производилась оценка стадии фиброза печеночной ткани неинвазивными методами - эластографией и вибрационно контролируемой транзиентной эластометрией на аппарате FibriScanCompact 530 (Echosens, Франция), а также расчет индексов APRI, AAR, FIB-4, Forns' index, теста MDA. Результаты. Подтверждена 100 % эффективность дасабувира и омбитасвира + паритапревира + ритонавира как при 8-, так и при 12-недельных курсах терапии у коморбидных пациентов с внепеченочными проявлениями, пациентов, имеющих в анамнезе опыт терапии интерферонсодержащими схемами, вне зависимости от стадии фиброза печени, длительности заболевания. В статье представлена сравнительная характеристика неинвазивных методов оценки фиброза печени у пациентов с хроническим гепатитом С: эластографии, эластометрии и сывороточных показателей фиброза (индексы APRI, AAR, FIB-4, MDA, Forns). Непрямые маркеры фиброза удобны тем, что для подсчетов достаточно рутинных обследований пациента. Маркеры позволяют с высокой достоверностью определить поздние стадии фиброза печени (F3-F4 по шкале METAVIR).
Хронический гепатит с, эластометрия, эластография, 3d-терапия, дасабувир и омбитасвир + паритапревир + ритонавир (викейра пак)
Короткий адрес: https://sciup.org/14123680
IDR: 14123680 | УДК: 616.36-002.2
Текст научной статьи Современные возможности безынтерфероновой терапии HCV-инфекции опыт реальной клинической практики. Сравнение неинвазивных методов оценки фиброза печени
Введение. Вирусный гепатит С является одной из глобальных проблем здравоохранения во всем мире. По данным ВОЗ, около 2 % населения земного шара инфицировано вирусом гепатита С, что составляет не менее 150–170 млн чел., из них 5 млн проживает в России [1].
В нашей стране ежегодно регистрируется около 40 млн случаев инфекционных заболеваний, экономический ущерб от которых составляет более 18 млрд рублей в год. В мире от инфекционных болезней ежедневно умирает до 45 тыс. чел. [2].
Отсутствие данных об истинной распространенности хронических вирусных гепати- тов и смертности от них не позволяет рассчитывать и планировать необходимые объемы финансирования из средств федерального бюджета, бюджетов субъектов Российской Федерации и фондов обязательного медицинского страхования для диагностики, лечения и оказания специализированной медицинской помощи больным, а также затрудняет разработку эффективных программ профилактики парентеральных вирусных гепатитов [3].
Прирост заболеваемости хроническим гепатитом С у пациентов старше 40 лет является неблагоприятным прогностическим фактором в отношении исходов болезни, поскольку с увеличением возраста и длительности заболевания повышаются скорость прогрессирования цирроза печени и частота развития гепатоцеллюлярной карциномы [4, 5].
Социально-экономический ущерб, обусловленный ростом заболеваемости хроническим гепатитом и таких его последствий, как цирроз печени, гепатокарцинома, в нашей стране огромен.
С 2018 г. отмечается переход от интерфе-роновых схем лечения к безынтерфероновым (в связи с включением их в перечень ЖНВЛП). Наиболее закупаемыми препаратами прямого противовирусного действия в РФ в 2019 г. стали дасабувир и омбитасвир + паритапре-вир + ритонавир (3D-терапия), предназначенные для лечения только 1-го генотипа, вне зависимости от субтипа вируса [6].
Основная цель терапии – достижение устойчивого вирусологического ответа после курса противовирусной терапии препаратами прямого противовирусного действия, который в различных исследованиях в разных странах мира достигает 97 % случаев [7, 8]. Устойчивый вирусологический ответ соответствует излечению от вирусного гепатита С, поздний рецидив может происходить менее чем в 0,2 % случаев после 24 нед. наблюдения [9]. Устойчивый вирусологический ответ обычно ассоциируется с биохимическим ответом (нормализация ферментов, улучшение функции) и регрессом фибротизации печеночной ткани, что приводит к снижению развития цирроза печени [10–13].
Современная классификация хронических воспалительных заболеваний печени предполагает не только определение этиологического фактора и степени активности некровоспали-тельного процесса, но и указание стадии заболевания, которая определяется фиброзом.
Существует несколько методов определения степени фиброза. Золотым стандартом является инвазивный метод – пункционная биопсия печени. Однако в широкой клинической практике биопсия имеет некоторые ограничения из-за травматичности и дороговизны метода. Как правило, пункционная биопсия проводится однократно с целью первичной диагностики заболевания, и оценка динамики течения болезни в будущем становится затруд- нительной. Из-за этого в последние годы активно развивается другое направление – неинвазивные инструментальные методы: эласто-графия, эластометрия и определение сывороточных маркеров фиброза печени (биохимические показатели крови).
Цель исследования. Определение эффективности безынтерфероновой терапии; сравнение эффективности неинвазивных методов диагностики фиброза печени при хроническом гепатите С.
Материалы и методы. Под нашим наблюдением находилось 63 пациента, прошедших курс терапии препаратами прямого противовирусного действия дасабувир и омби-тасвир + паритапревир + ритонавир в сочетании с рибавирином и без него в зависимости от субтипа 1-го генотипа вируса гепатита С и стадии фиброза печени.
До начала противовирусной терапии у всех пациентов оценена стадия фиброза методом эластографии. В основе данного метода лежит механическая компрессия, по результатам которой формируется цветовая картограмма эластичности. После окончания лечения у 27 пациентов выполнена оценка стадии фиброза печеночной ткани методом вибрационно контролируемой транзиентной эласто-метрии на аппарате FibroScan® 530 Compact (Echosens, Франция) с ультразвуковым датчиком (М+ и XL+). Аппарат состоит из компьютерного и аппаратного блоков с вмонтированным сенсорным монитором и двумя датчиками. Два вида датчика разработаны для пациентов с различной массой тела. В ультразвуковом датчике автоматическое движение поршня вызывает однотактный импульс 50 Гц с контролируемой силой нажатия. В зависимости от типа датчика транзиентная сдвиговая деформация распространяется в глубину печени, для датчика М+ глубина проникновения составляет от 25 до 65 мм, для XL+ данный диапазон равен 35–75 мм. Для оценки выраженности фиброза использовались референсные значения эластичности печени, предложенные производителем: до 7,1 кРа – стадия F0-F1 по шкале METAVIR; от 7,2 до 9,4 кРа – стадия F2; от 9,5 до 12,4 кРа – стадия F3; более 12,5 кРа – стадия F4 по шкале METAVIR [14–16].
В качестве сывороточных маркеров фиброза использовались индексы APRI, AAR, FIB-4, MDA и Forns' index – те индексы, значения для расчета которых можно получить в процессе рутинного обследования больного, но их применение после курса противовирусной терапии невозможно [17].
Индекс APRI (aspartate aminotransferase to platelet ratio index) – отношение АСТ к количеству тромбоцитов:
APRI =
АСТ/
/ верхний предел АСТ тромбоциты (1°9/л)
х 100.
Метаанализы показывают, что с помощью этого индекса можно идентифицировать фиброз, связанный с гепатитом С, с умеренной степенью точности [18].
AAR: AST/ALT ratio – отношение уровня АСТ к АЛТ. Определение отношения АСТ/АЛТ используется как метод оценки тяжести не только вирусных гепатитов, но и многих хронических заболеваний печени. В 1988 г. соотношение АЛТ/АСТ было предложено как индикатор тяжести цирроза, при этом утверждалось, что показатели АСТ/АЛТ>1 свидетельствуют уже о циррозе [19]. Вместе с этим AAR применим и для прогнозирования (в течение одного года) течения цирроза, а гистологически определяемое прогрессирование сопровождалось повышением соотношения АСТ/АЛТ [20].
Индекс FIB-4 высчитывают по формуле с использованием уровней АЛТ/АСТ, количества тромбоцитов, возраста пациента:
FIB - 4 =
Возраст (лет)хАСТ
тромбоциты (1°9/л)х^АЛТ
Данный индекс с высокой вероятностью позволяет исключить или подтвердить продвинутые стадии фиброза печеночной ткани [18, 19, 21].
Forns' index рассчитывается по уровням ГГТП, холестерина, количеству тромбоцитов, возрасту пациента [19]:
Индекс Forns = 7.811 — 3.131 х ln тромбоциты + + 0,78 х ln ГГТП + 3,467 х ln возраст — 0,014 х х холестерин (мг/дл).
В качестве основных параметров расчета MDA используются пять стандартных биомаркеров: альбумин, тромбоциты, щелочная фосфатаза, АЛТ, АСТ:
MDA = (0,3 х альбумин(г/л) + 0,05 х х тромбоциты (109/л)) — (0,014 х Щф(МЕ/л) + + 6—+14).
АЛТ 7
Для расчета статистической достоверности динамики биохимических показателей ис- пользовали парный критерий Стьюдента. Достоверными считали результаты при p<0,01.
Благодаря приказу Министерства здравоохранения и социального благополучия Ульяновской области № 216-р от 01.02.2018 мы имели возможность пролечить пациентов с хроническим гепатитом С препаратами прямого противовирусного действия за счет средств ОМС.
Результаты и обсуждение. Было пролечено 63 пациента: 33 мужчины (52,38 %) и 30 женщин (47,62 %).
Среди мужчин преобладали лица 50– 59 лет – 9 чел. (27,27 %), в равном соотношении представлены возрастные группы 30– 39 лет и 40–49 лет – по 8 чел. (по 24,24 % в каждой группе).
Среди женщин также превалировали лица 50–59 лет – 11 чел. (36,67 %), второе место занимала возрастная группа 40–49 лет – 8 чел. (26,6 %), в возрастные группы 30–39 лет и 60–69 лет вошли по 4 чел. (по 13,3 %).
По степени активности процесса большинство пациентов в обеих группах – это больные с умеренной степенью активности: 24 женщины (80 %) и 23 мужчины (69,7 %).
По степени фиброза среди женщин в равном соотношении находились пациентки с выраженной стадией фиброза F3 и F4 по шкале METAVIR – по 7 чел. (по 23,34 % в каждой группе), мужчин со стадией фиброза F4 по шкале METAVIR было 9 чел. (27,27 %) и с умеренной стадией фиброза F3 по шкале METAVIR – 8 чел. (24,24 %). Не ответивших ранее на терапию интерферонами оказалось по 4 чел. как в группе мужчин, так и в группе женщин (12,12 и 13,33 % соответственно).
Мужчин с нормальным индексом массы тела было 12 чел. (36,36 %), избыточный вес и 1-я степень ожирения встретились в одинаковом соотношении – по 9 чел. (27,27 %). Подобная картина наблюдалась у женщин: 13 пациенток с нормальным индексом массы тела (43,3 %) и 7 пациенток с избыточной массой тела (23,33 %).
У 100 % пациентов наблюдались жалобы диспепсического характера, у 28 мужчин (84,85 %) и 30 женщин (100 %) преобладали также жалобы астеновегетативного характера.
По данным эластографии преобладали пациенты с фиброзом F3 по шкале METAVIR – 26 и 23 % среди мужчин и женщин соответственно, а также F4 по шкале METAVIR – по 26 % в обеих группах.
Среднее значение индекса APRI составило 0,77 (диапазон от 0,076 до 3,122). Чувствительность метода для выявления значительного фиброза (F2-F4 по шкале METAVIR) составила 58,33 %, специфичность – 66,67 %. Высоким оказалось положительное предсказывающее значение индекса – 82,35 %.
Среднее значение индекса AAR составило 0,91 (диапазон от 0,4 до 3,031). Значение AAR≥1, являющееся предиктором цирроза печени, было зафиксировано у 17 пациентов. Чувствительность метода составила 35,71 %, специфичность – 74,47 %.
При расчете индекса FIB-4 оказалось, что он более чувствителен как отрицательный предиктор фиброза: значение индекса менее 1,45 доказывало отсутствие значимого фиброза
(F3-F4 по шкале METAVIR) с чувствительностью 87,5 % и специфичностью 70,59 %. С другой стороны, значение более 3,25 определяло фиброз со 100 % специфичностью, однако чувствительность метода составила лишь 11,76 %.
Индекс Forns эффективен как отрицательный предиктор (значение менее 4,2 исключает фиброз стадий F2-F4 по шкале METAVIR с вероятностью 80,95 %). Чувствительность и специфичность метода в целом оказались невысоки.
Эффективность индекса MDA в диагностике также оказалась невысока: метод обладал точностью всего 50 %. С другой стороны, достаточно высоким было его отрицательное предсказывающее значение – 84,21 % [22]. Следовательно, индекс достаточно достоверен как предиктор отсутствия цирроза печени, но в случае получения значения, соответствующего циррозу, его необходимо перепроверять.
При проведении эластометрии было обнаружено, что средние показатели были меньше, чем при проведении эластографии (6,71 и 8,34 кРа соответственно). Предполагается, что это связано с проведенной у пациентов противовирусной терапией (рис. 1).
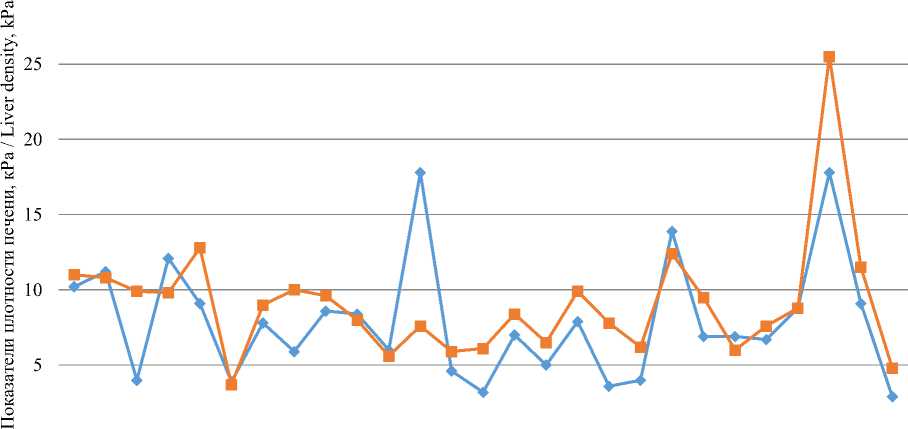
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27
Количество пациентов / Number of patients
—♦— Эластометрия / Elastometry —■— Эластография / Elastography
Рис. 1. Динамика эластометрии и эластографии
Fig. 1. Elastometry and elastography dynamics
Непрямые маркеры фиброза удобны тем, что для их подсчетов достаточно рутинных обследований пациента. Точность этих маркеров невысока, но они позволяют с высокой достоверностью определить поздние стадии фиброза печени (F3-F4 по шкале METAVIR), поэтому они подходят для первичного суждения о состоянии пациента. Для получения наиболее достоверных результатов необходимо использовать комплексный подход – проводить расчет индексов и использовать эластометрию или эластографию.
У пролеченных пациентов преобладала сопутствующая патология сердечно-сосудистой системы (29 %), желудочно-кишечного тракта (14 %), опорно-двигательного аппара- та (13 %), а также нервной и мочеполовой систем (по 8 %). Патология сердечно-сосудистой системы была представлена следующими заболеваниями: артериальная гипертензия (65 %), хроническая сердечная недостаточность и мерцательная аритмия (по 9 %), пороки (5 %), протезирование клапанов, фибрилляция предсердий, ишемическая болезнь сердца и стенокардия (по 4 %).
После проведенной терапии с высокой степенью доказательности был получен биохимический ответ – снижение уровня трансаминаз у мужчин и женщин, увеличение уровня протромбина, снижение общего билирубина (табл. 1).
Таблица 1
Table 1
Биохимический ответ у мужчин и женщин, прошедших курс противовирусной терапии препаратами прямого противовирусного действия
Biochemical response in men and women treated with direct antiviral therapy
|
Показатель Parameter |
Старт Starting therapy |
Завершение терапии Ending therapy |
р |
||
|
Женщины Women |
Мужчины Men |
Женщины Women |
Мужчины Men |
||
|
АЛТ, ед./л ALT, u/l |
57,37 |
69,24 |
15,83 |
21,86 |
p<0,001 |
|
АСТ, ед./л AST, u/l |
54,77 |
60,06 |
19,35 |
24,78 |
p<0,001 |
|
Общий билирубин, мкмоль/л Total bilirubin, mcmol/L |
24,7 |
15,62 |
19,91 |
14,74 |
p<0,01 |
|
ГГТП ед./л GGT, u/l |
47,71 |
75,13 |
17,92 |
22,28 |
p<0,001 |
|
Протромбин, % Prothrombin, % |
95,48 |
88,52 |
97,72 |
90,66 |
p<0,01 |
Был получен вирусологический ответ: на 4-й нед. у мужчин в 3,2 % случаев определялась вирусная нагрузка ниже 150 коп./мл с полной эрадикацией вируса по завершении терапии, у женщин на 4-й нед. в 3,5 % случаев определялась вирусная нагрузка ниже 750 коп./мл с полной эрадикацией вируса по завершении курса терапии. Получен 100 % вирусологический ответ. Отмечен регресс по степени фиб-ротизации печеночной ткани.
Схема 3D-терапии имеет хороший профиль безопасности: не было отмечено нежелательных явлений терапии, приводивших к ее отмене или досрочному прекращению, все пациенты удовлетворительно перенесли терапию, несмотря на тяжесть коморбидной патологии.
Заключение. Применение препаратов прямого противовирусного действия («Ви-кейра Пак») привело к существенному улуч- шению результатов лечения хронического гепатита С, обеспечив достижение устойчивого вирусологического ответа у всех пациентов с 1-м генотипом.
Ни у одного из пациентов при приеме «Викейра Пак» не было серьезных нежелательных явлений, у всех пролеченных пациентов терапия не была окончательно отменена в связи с нежелательными явлениями. Устойчивый вирусологический ответ составил 100 %. Был получен биохимический ответ со значимым снижением аминотрансфераз.
Наиболее специфичным и чувствительным индексом для определения фиброза пече- ночной ткани был Fib-4, в особенности для исключения продвинутых стадий фиброза. Также диагностическая ценность установлена у индекса APRI. Индексы Forns и MDA оказались малоинформативны.
Внедрение новых безынтерфероновых схем позволяет оптимизировать оказание медицинской помощи пациентам с HCV-инфекцией, что в реальной жизни будет приводить к эрадикации вируса, благоприятно сказываться на психологическом здоровье пациентов, снимать стигматизацию с данной группы населения, что с социально-этиологической, экономической точки зрения выгодно государству.
Список литературы Современные возможности безынтерфероновой терапии HCV-инфекции опыт реальной клинической практики. Сравнение неинвазивных методов оценки фиброза печени
- Global hepatitis report, 2017. World Health Organization; 2017. URL: http://www.who.int/hepatitis/pub-lications/global-hepatitis-report2017/en/ (дата обращения: 15.03.2021).
- Жданов К.В., Сбойчаков В.Б., Захаренко С.М., Финогеев Ю.П., Крумгольц В.Ф., Яременко М.В. Где лечить инфекционного больного? Инфекция и иммунитет. 2012; 2 (4): 757-764. DOI: https://doi.org/10.15789/2220-7619-2012-4-757-764.
- Пименов Н.Н., Вдовин А.В., Комарова С.В., Мамонова Н.А., Чуланов В.П., Покровский В.И. Актуальность и перспективы внедрения в России единого федерального регистра больных вирусными гепатитами В и С. Терапевтический архив. 2013; 85 (11): 4-9.
- Hamada H., Yatsuhashi H., Yano K., Daikoku M., Arisawa K., Inoue O., KogaM., Nakata K., Eguchi K., Yano M. Impact of aging on the development of hepatocellular carcinoma in patients with posttransfusion chronic hepatitis C. Cancer. 2002; 95: 331-339. DOI: https://doi.org/10.1002/cncr.10662.
- Пименов Н.Н., Комарова С.В., Карандашова И.В., Цапкова Н.Н., Волчкова Е.В., Чуланов В.П. Гепатит С и его исходы в России: анализ заболеваемости, распространенности и смертности до начала программы элиминации инфекции. Инфекционные болезни. 2018; 16 (3): 37-45. DOI: 10.20953/1729-9225-2018-3-37-45.
- Кляритская И.Л., ШелиховаЕ.О., Мошко Ю.А., Семенихина Е.В. Лечение хронического вирусного гепатита С согласно новым рекомендациям Европейского общества по изучению печени 2020 г. (EASL recommendations on treatment of hepatitis C, 2020). Крымский терапевтический журнал. 2020; 3: 21-30.
- Teti E., Ricciardi A., Antinori A., Galli M., Rizzardini G., Di Biagio A., Angarano G., Bruno R., Mussini C., De Luca A., Cattelan A., Lazzarin A., Taliani G., D'Arminio Monforte A., Mastroianni C.M., Di Perri G., Maggiolo F., Puoti M., Castelli F., Gori A., Boffa N., Cacopardo B., Giacometti A., Par-ruti G., Vullo V., Chirianni A., Pennica A., Pasquazzi C., Sighinolgi L., Gentilotti E., Sarmati L., Andreo-ni M. Dasabuvir and Ombitasvir/Paritaprevir/Ritonavir with or without Ribavirin in Patients with HIV-HCV Coinfection: Real Life Interim Analysis of an Italian Multicentre Compassionate Use Program. J. Hepatol. 2016; 64 (2): 763.
- Christensen S., Ingiliz P., Schewe K., Rockstroh J., Hueppe D., Baumgarten A., Lutz T., Schmutz G., Simon K. G., Busch H., Kimhofer T., Mauss S. Relapse and Treatment-Emergent RAVS with DAA-Based Regimens in Hepatitis C Virus (HCV) Mono- or Human Immunodeficiency Virus (HIV)-HCV Co-Infected Patients - a Real Concern in Clinical Practice? Results from the German Hepatitis C Cohort (GECCO). J. Hepatol. 2016; 64 (2): 821.
- Sarrazin C., Isakov V., Svarovskaia E.S., Hedskog C., Martin R., Chodavarapu K., Brainard D.M., Miller M.D., Mo H., MolinaM.J., Sulkowski M.S. Late relapse versus hepatitis C virus reinfection in patients with sustained virologic response after sofosbuvir-based therapies. Clin. Infect. Dis. 2017; 64: 44-52. DOI: 10.1093/cid/ciw676.
- Odena G., Bataller R. Liver fibrogenesis: physiopathology. Gastroenterol. Hepatol. 2012; 35 (suppl. 2): 3. DOI: 10.1016/S0210-5705(12)70043-2.
- Carrat F., Fontaine H., Dorival C., Simony M., Diallo A., Hezode C., Ledinghen V.D., Larrey D., Haour G., Bronowicki J.-P., Zoulim F., Asselah T., Marcellin P., Thabut D., Leroy V., Tran A., Habersetzer F., Samuel D., Guyader D., Chazouilleres O., Mathurin P., Metivier S., Alric L., Riachi G., Gournay J., Abergel A., Cales P., Ganne N., Loustaud-Ratti V., D'Alteroche L., Causse X., Geist C., Minello A., Rosa I., Gelu-Simeon M., Portal I., Raffi F., Bourliere M., Pol S. Clinical outcomes in patients with chronic hepatitis C after direct-acting antiviral treatment: a prospective cohort study. Lancet. 2019; 393 (10179): 1453-1464. DOI: 10.1016/S0140-6736(18)32111-1.
- Mandorfer M., Kozbial K., Schwabl P., Chromy D., Semmler G., Stattermayer A.F., Pinter M., Hernández-Gea V., Fritzer-Szekeres M., Steindl-Munda P., Trauner M., Peck-Radosavljevic M., García-Pagán J.C., Ferenci P., Reiberger T. Changes in hepatic venous pressure gradient predict hepatic decompensation in patients who achieved sustained virologic response to interfer- on-free therapy. Hepatology. 2020; 71 (3): 1023-1036. DOI: 10.1002/hep.30885.
- Mauro E., Crespo G., Montironi C., Londono M.C., Hernandez-Gea V., Ruiz P., Sastre L., Lombardo J., Mariño Z., Díaz A., Colmenero J., Rimola A., Garcia-Pagán J.C., Brunet M., Forns X., Navasa M. Portal pressure and liver stiffness measurements in the prediction of fibrosis regression after sustained virolog-ical response in recurrent hepatitis C. Hepatology. 2018; 67 (5): 1683-1694. DOI: 10.1002/hep.29557.
- FibroScan & FibroMeter Clinical Handbook. Main publications by etiologies & applications, 2017. 49. URL: www.echosens.com (дата обращения: 16.01.2020).
- Морозов С.В., Кучерявый Ю.А., Стукова Н.Ю., Краснякова Е.А. Непрямая ультразвуковая эласто-графия печени: от диагностики фиброза печени к контролю над лечением. Доказательная гастроэнтерология. 2013; 2: 31-37.
- Глушенков Д.В., Павлов Ч.С., Коновалова О.Н., Золотаревский В.Б., Ивашкин В.Т. Неинвазивная диагностика фиброза печени на ранних стадиях его развития. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2008; 5 (18), прилож. 32: 83.
- Pawlotsky J-M., Negro F., Aghemo A., Berenguer M., Dalgard O., Dusheiko G., Marra F., Puoti M., Wedemeyer H. EASL recommendations on treatment of hepatitis C: Final update of the series. Journal of Hepatology. 2020; 73 (5). DOI: 10.1016/j.jhep.2020.08.018.
- Бабак О.Я., Кравченко Н.А. Сывороточные биомаркеры и фибротесты в диагностике фиброза печени: недостатки и перспективы. Сучасна гастроентеролопя. 2012; 3 (65): 71-79.
- Вельков В.В. Сывороточные биомаркеры фиброза печени: до свидания, биопсия? Обзор научной литературы. М.: Lomonosoff Print; 2009.
- Giannini E., Risso D., Botta F., Chiarbonello B., Fasoli A., Malfatti F., Romagnoli P., Testa E., Ceppa P., Testa R. Validity and clinical utility of the aspartate aminotransferase-alanine aminotransferase ratio in assessing disease severity and prognosis in patients with hepatitis C virus-related chronic liver disease. Arch. Intern. Med. 2003; 163 (2): 218-224. DOI: 10.1001/archinte.163.2.218.
- Vallet-PichardA., Mallet V., Nalpas B., Verkarre V., Nalpas A., Dhalluin-Venier V., Fontaine H., Pol S. FIB-4: an inexpensive and accurate marker of fibrosis in HCV-infection. comparison with liver biopsy and fibrotest. Hepatology. 2007; 46 (1): 32-36. DOI: 10.1002/hep.21669.
- Attallah A.M., Shiha G.E., Omran M.M., Zalata K.R. A discriminant score based on four routine laboratory blood tests for accurate diagnosis of severe fibrosis and/or liver cirrhosis in Egyptian patients with chronic hepatitis C. Hepatol. Res. 2006; 34 (3): 163-169. DOI: 10.1016/j.hepres.2005.12.004.


