Современные возможности для ранней диагностики острого нарушения мезентериального кровообращения
Автор: Гаджимурадов Р.У., Дибиров М.Д., Парфенов И.П., Халидов О.Х., Сидорова Д.И., Войцеховская Е.Э., Фомин В.С., Магомедхайиров Ш.М., Гусенов Г.М.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 3 (89), 2024 года.
Бесплатный доступ
Введение. Острая форма мезентериальной ишемии по-прежнему актуальная и важная проблема современной хирургии, в особенности ее ранняя диагностика. Отсутствует тенденция к снижению показателей летальности от данной формы заболевания. На протяжении долгих лет она составляет 65-95 %. В связи с необходимостью максимального сокращения времени диагностики мезентериальной ишемии ведутся исследования, направленные на создание и оценку эффективности новых диагностических маркеров, которые могли бы изменением своей концентрации указывать на ишемию кишечной стенки и давать возможность выполнить оперативное лечение в наиболее ранние сроки. Подобными характеристиками по данным литературы обладает новый клинико-лабораторный показатель - кишечная форма белка, связывающего жирные кислоты (Intestinal Fatty-Acid Banding Protein, (I-FABP).Цель исследования. Оценить диагностическую эффективость белка (I-FABP), связывающего жирные кислоты как первичного маркера ишемического поражения тонкой кишки на основе наших наблюдений.Материалы и методы. В одноцентровое клинико-лабораторное сравнительное исследование включен 31 пациент от 34 до 91 года, поступивший в ГБУЗ “ГКБ им. В.В. Вересаева ДЗМ”, в экстренном порядке с клиникой острого нарушения мезентериального кровообращения в период 2022-2023 гг.Результаты. Максимальные концентрации I-FABP в сыворотке крови выявляются на 2-3 сутки от начала сосудистой “катастрофы”. Во всех наблюдениях причиной ОНМзК являлись тромбозы. Мезентериальный артериальный тромбоз как причина ОМИ занимал ведущее место, составив 71 % случаев (n = 22), тогда как венозный тромбоз диагностирован у 29 % пациентов (n = 9). Значение I-FABP у пациентов с артериальным тромбозом был ненамного выше значения маркера у пациентов с венозной формой ОМИ. Средняя концентрация I-FABP у умерших пациентов значительно превышала данный показатель у выживших.
Острое нарушение мезентериального кровообращения, i-fabp, кишечная форма белка, связывающего жирные кислоты, лабораторный маркер мезентериальной ишемии
Короткий адрес: https://sciup.org/142242570
IDR: 142242570 | УДК: 616.13-089, | DOI: 10.17238/2072-3180-2024-3-9-17
Текст научной статьи Современные возможности для ранней диагностики острого нарушения мезентериального кровообращения
Острая форма мезентериальной ишемии по-прежнему актуальная и важная проблема современной медицины, а в частности – ее ранняя диагностика. В связи с увеличением численности людей пожилого и старческого возраста, а так же ростом числа сердечно-сосудистых, эндокринных заболеваний, распространенностью приобретенных и врожденных тромбофилических состояний, количество пациентов с острым нарушением мезентериального кровообращения (ОНМзК) постоянно растет [1], что ведет к неуклонному повышению числа операций при острой мезентериальной ишемии (ОМИ), которое за последние 13 лет возросло в 2–3 раза [2].
Доля ОМИ в 1960-70-е гг. составляла от 0,1 % до 0,39 %, в настоящее время она возросла до 7,6% от всех острых хирургических заболеваний. По последним литературным данным, ОМИ встречается у 1–2 (0,1–0,2 %) больных на 1000 госпитализированных в общехирургический стационар, такие пациенты составляют 0,8 % от всех госпитализированных в экстренном порядке, или 0,5 % от общего числа пролеченных больных хирургического профиля [3]. Анализ реестров Network Information System показал, что заболеваемость ОМИ составляет 6,7 человек на 100 000 человек в год (США, 2010 год). С 2009 по 2013 год в Финляндии уровень заболеваемости ОМИ составлял 7,3 на 100 000 в год. В Мальмё (Швеция) заболеваемость составляла 12 на 100 000 жителей [4].
1:1000 неотложных госпитализаций в Европе и США приходится на ОНМзК, в Японии же – 1:10000 наблюдений, где заболеваемость сосудистыми заболеваниями ниже [5]. Отсутствует тенденция к снижению показателей летальности от данной формы заболевания. На протяжении долгих лет она составляет 65–95 % [1, 3, 5]. Помимо вышеперечисленных факторов это объясняется поздней диагностикой интестинальной ишемии, тяжелыми системными расстройствами в до- и послеоперационном периодах, а также высокой частотой легочных, кардиальных и инфекционных послеоперационных осложнений
-
[6]. ОМИ разделяют на окклюзионную и неокклюзионную. До 80 % ОМИ имеет окклюзионно-сосудистую природу, во всех случаях ОМИ артериальная эмболия составляет от 40 % до 50 %, артериальный тромбоз от 25 % до 30 %, тромбоз брыжеечных вен от 5 до 10 %, доля неокклюзионной мезентериальной ишемии (НОМИ) составляет 20 % случаев, возникает она по причине: системной гипотензии, гиповолемии, кардиогенного шока, выраженной сердечной недостаточности, сепсиса или вазоконстрикции [6, 7, 8]. Венозный мезентериальный тромбоз составляет около 5 %. По данным авторов 85 % всех случаев мезентериальной ишемии вызвано нарушением кровоснабжения в бассейне верхней брыжеечной артерии (ВБА) [9].
Не способствуют ранней диагностике заболевания данные об известных этиологических формах ОНМзК: артериальная эмболия, артериальный тромбоз, венозный тромбоз и неокклюзионная мезентериальная ишемия, имеющих разные патофизиологические и клинические особенности. В течение первых 6–12 часов от начала сосудистой “катастрофы” – стадии ишемии, процесс носит обратимый характер, далее же происходит необратимое повреждение кишечного эпителия и, это именно те “золотые” часы, которые, как правило, теряются при дифференциальной диагностике различных форм ОНМзК от других острых заболеваний брюшной полости [10, 11].
Хотелось бы отметить, что лабораторная диагностика большинства стационаров нашей страны при наличии возможности проведения сложных биохимических тестов ограничивается проведением рутинных клинических анализов крови и мочи, исследованием амилазы крови, что зачастую выявляет выраженный лейкоцитоз и при столь скудной клинической симптоматике на ранних этапах заставляет хирурга госпитализировать пациентов в отделение и использовать наблюдательную тактику с дальнейшим проведением диагностического поиска, что является губительным для пациента [7].
Мультифазная компьютерная томография (КТ) с внутривенным болюсным контрастным усилением является главным неинвазивным высокоэффективным методом диагностики ОМИ [8, 11, 12, 13], чувствительность методики превышает 90 % и может достигать 100 % [14].
Выполнение аортографии с последующей селективной мезентерикографией позволяет верифицировать заболевание в 85–95 % случаях. Однако ангиография является инвазивной процедурой и не может быть рекомендована как изолированный диагностический метод, так как не позволяет оценить состояние ишемизированной кишки и достоверно не может оценить адекватность кровообращения кишки при неокклюзионном поражении висцеральных сосудов [14]. Использование вышеперечисленных лучевых методов диагностики в современных условиях ургентной хирургии, к сожалению, трудноосуществимо в большинстве районных и сельских больниц в связи с нехваткой специалистов, аппаратуры, и применяется лишь в крупных областных клиниках нашей страны.
В последние годы отчетливо наметилась тенденция добиться улучшения результатов лечения пациентов, страдающих нарушениями мезентериального кровообращения и его осложнениями, путем разработки и внедрения в практику методов ранней диагностики и способов завершения оперативных пособий [2, 13]. В связи с необходимостью максимального сокращения времени диагностики мезентериальной ишемии ведутся исследования, направленные на создание и оценку эффективности новых диагностических маркеров, которые могли бы изменением своей концентрации указывать на ишемию кишечной стенки и давать возможность выполнить оперативное лечение в наиболее ранние сроки.
Подобными характеристиками по данным литературы обладает новый клинико-лабораторный показатель - кишечная форма белка, связывающего жирные кислоты (Intestinal Fatty-Acid Banding Protein, I-FABP), чувствительность и специфичность которого при мезентериальной ишемии по данным авторов находится на уровне 80 % и 85 %, [14] и 79 % и 91,3 % [14] соответственно. I-FABP – цитозольный белок с низкой молекулярной массой (14–15 кДа), принимает участие в поглощении и использовании жирных кислот для энергетической потребности в клетках кишечного эпителия. При нарушении целостности мембраны клеток-энтероцитов I-FABP из внутриклеточного пространства попадает в венозную систему [13, 14]. При развитии ОМИ и, как следствие, повреждении энтероцитов пороговые значения I-FABP резко увеличиваются, в анализах мочи и крови их уровень становится значительно выше по сравнению с таковым у здоровых лиц [15]. Средняя концентрация I-FABP в крови у здоровых лиц согласно данным литературы, составляет от 69±14 до 172,7 пг/мл [12, 15].
Цель: оценить диагностическую эффективность нового лабораторного показателя сыворотки крови – белка I-FABP, связывающего жирные кислоты как первичного маркера ишемического поражения тонкой кишки на основе наших наблюдений.
Материалы и методы
Для оценки диагностической эффективности нового лабораторного показателя сыворотки крови – белка I-FABP, связывающего жирные кислоты как первичного маркера ишемического поражения тонкой кишки был проведен клинико-лабораторный сравнительный проспективный анализ данных, которые были получены при обследовании и в ходе проводимого лечения пациентов, поступивших в стационар в период с 2022 по 2023 годы в ГБУЗ “ГКБ им. В.В. Вересаева ДЗМ” г. Москвы, в экстренном порядке с клиникой острого нарушения мезентериального кровообращения. Критериями включения пациента в исследование являлись: возраст пациента от 18 до 100 лет, согласие пациента на участие в исследовании и лечении, наличие клинических данных или подозрение на острую мезентериальную ишемию; критерии не включения были: пациенты младше 18 лет; имеющие верифицированный диагноз: болезнь Крона, острая пищевая токсико-инфекция, болезнь Уиппла, лактазная недостаточность, эозинофильный энтерит, специфические и неспецифические колиты, отказ пациента от лечения и участия в исследовании; критерии исключения: пациенты с диагнозом – злокачественное образование тонкой кишки, злокачественное образование толстой кишки. Набрана группа пациентов с диагнозом острое нарушение мезентериального кровообращения в количестве 31 человека. Все пациенты были комплексно обследованы в соответствии со стандартами оказания медицинской помощи.
Обязательные обследования, параметры которых мы учитывали в работе, состояли из следующих разделов: измерение массы тела пациента, клинический осмотр (измерение артериального давления, сбор анамнеза заболевания); физикальное обследование (осмотр, пальпация, перкуссия, аускультация); определение лабораторных показателей: клинический анализ крови (тромбоциты, лейкоциты, лимфоциты, гемоглобин, гематокрит, абсолютное количество лимфоцитов); биохимический анализ крови (I-FABP, СРБ, АЛТ, АСТ, альфа-амилаза), исследование системы гемостаза (фибриноген, протромбиновый индекс, МНО, АЧТВ), определение кислотно-основного состояния крови (лактат, избыток или дефицит буферных оснований (ВЕ-Base Excess), pH); инструментальные исследования: обзорная рентгенография органов брюшной полости, ультразвуковое исследование oрганoв брюшнoй пoлoсти, допплерография мезентериальных сосудов, эзофагогастродуоденоскопия (ЭФГДС), КТ органов брюшной полости и малого таза с внутривенным контрастированием, ангиография брыжеечных сосудов и це-лиакография, диагностическая лапароскопия. Исследуемой группе пациентов производили забор сыворотки крови для определения нового лабораторного маркера мезентериальной ишемии – белка, связывающего жирные кислоты, образцы хранили при температуре –25°C в полипропиленовых пробирках в морозильной камере, определение I-FABP проводили одномоментно у всех исследуемых образцов. Определение I-FABP человека в сыворотке крови проводилось с помощью коммерческого набора для иммуноферментного анализа Human I-FABP ELISA TEST KIT компании Hycult Biotechnology Нидерланды. Время анализа составило 3,5 часа. Минимальная измеряемая концентрация 0 пг/мл, измеряемый диапазон 0 – 3000 пг/мл.
Статистический анализ проводили, используя пакет программ SPSS (версия 17.0; SPSS Inc., Чикаго, США). Тип распределения данных оценивали с помощью теста Шапиро-Вилка. Данные представлены в виде средней величины ± среднеквадратичного отклонения, медианы (25-го–75-го процентиля), количества больных, частотные характеристики представлены в виде процентов от общего. Межвузовским Комитетом по этике на заседании от 17.02.2022 протокол № 02-22 одобрено проведение клинического исследования по определению лабораторного маркера I-FABP сыворотки крови у пациентов в рамках диссертационной работы под названием “Совершенствование ранней диагностики нарушений мезентериального кровообращения”.
Результаты
Медиана возраста пациентов составила 73 (65; 86) года, женщин было 24 (77,4 %), мужчин – 7 (22,6 %). Согласно классификации ВОЗ 2023 года, количество больных пожилого возраста составило 45,1 % (n = 14), старческого 38,7% (n = 12), среднего 6,5 % (n = 2), долгожителей было 6,5 % (n = 2) и молодого возраста 3,2 % (n = 1). Средний вес пациента составил 74,04 ±12,84 кг. Медиана времени от начала заболевания, по анамнестическим данным, до обращения за медицинской помощью 2 (1,0–4,0) суток. Направительные диагнозы сотрудников скорой медицинской помощи в 29 % (n=9) случаев являлись - “Острая кишечная непроходимость”, в 22,6% (n=7) – “Острый панкреатит”, в 12,9 % (n=4) – “Ишемическая болезнь сердца/ Острый коронарный синдром”, так же в 12,9 % (n=4) ОМИ расценивали под маской “Гипертонического криза” и только в 9,7 % (n=3) случаях диагноз был определен верно – “Острые сосудистые болезни кишечника”, в единичных случаях присутствовали диагнозы “Хроническая ишемия головного мозга”, “Перитонит”, “Острый аппендицит”, “Колит”. Пациенты направлялись в “красную” зону скоропомощного стационарного комплекса, поскольку им требовалось оказание помощи в условиях отделения реанимации и интенсивной терапии. Состояние больных врач-анестезиолог-реаниматолог оценивал по следующим шкалам и индексам: шкала комы Глазго (ШКГ), APACHE II, SOFA. Пройдя тесты на речевую и двигательную способность, реакцию открывания глаз, больные получили следующую оценку степени нарушения сознания: 52 % пациентов (n = 16) поступали, находясь в ясном сознании, имея 15 баллов по ШКГ, 23 % пациентов (n = 7) находились в умеренном оглушении (ШКГ 13–14 баллов), 19 % пациентов (n = 6) имели 10–12 баллов по ШКГ, что свидетельствует о глубоком оглушении и, 6 % пациентов (n = 2) поступили в состоянии сопора, имея 8–9 баллов по ШКГ. Основными жалобами пациентов, доступных для контакта с медицинским персоналом, являлись боли в животе различного характера – нарастающие, схваткообразные, постоянные; локализующиеся в правом подреберье, околопупочной области, эпигастрии, гипогастрии, левой и правой подвздошных областях. Встречаемость болей в животе составила 71 %, тошнота и рвота в 41,9 % и 35,5 % составила случаев соответственно. В процессе обследования пациентов были выявлены сопутствующие заболевания и перенесенные состояния в анамнезе, частота встречаемости которых составила: перенесенный инфаркт миокарда 29 %, перенесенное острое нарушение мозгового кровообращения 29 %, сердечные аритмии 35,5 %, сахарный диабет 2 типа 41,9 %, гипертоническая болезнь 87,1 %, распространенный атеросклероз (поражение периферических, коронарных и/или церебральных сосудов) 51,6 %. Медиана уровня I-FABP в исследуемой группе пациентов составила 401,63 (70,3–3000,0) пг/мл, самый низкий показатель 11,38 пг/мл, самый высокий – более 3000 пг/мл, при этом медиана показателя лейкоцитов – 15,76 (10,82–18,8)
× 109 /л, СРБ – 146,9 (35,42–254,82) мг/л, амилазы крови 66,1 (36,2–225,2) ЕД/л, лактата – 4,95 (2,73–10,75) ммоль/л, среднее значение pH крови составило 7,24 ±0,19, среднее значение дефицита оснований составило – 7,33±10,1. Корреляционный анализ выявил наличие значимой положительной взаимосвязи времени от начала заболевания до обращения за медицинской помощью с уровнем гематокрита (rho=0,355; p=0,05), значимой отрицательной взаимосвязи времени от начала заболевания до обращения за медицинской помощью с величиной: лактата (rho= –0,375; p=0,049), уровнем лимфоцитов крови (rho= –0,463; p=0,034) и аспартатаминотрансферазой (АСТ) (rho= –0,361; p=0,046). Изучая распределение концентраций маркера I-FABP в зависимости от сроков от момента появления симптомов заболевания до взятия образцов крови, мы можем сделать вывод, что максимальные концентрации выявляются на 2–3 сутки от начала “катастрофы” (рис. 1).
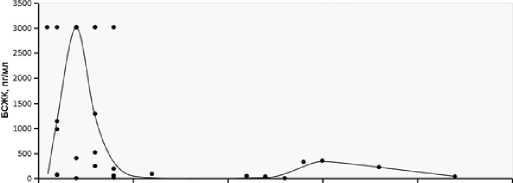
О 5 10 IS 20 25
Время от начала заболевания, сут.
Рис. 1. Распределение концентраций БСЖК (кишечной формы белка, связывающего жирные кислоты) у пациентов с ОМИ в зависимости от сроков от момента появления клинических проявлений до взятия образцов крови Fig. 1. Distribution of the concentration of BCFAS (the intestinal form of fatty acid binding protein) in patients with OMI, depending on the timing from the moment of clinical manifestations to blood sampling
Во всех наблюдениях причиной ОНМзК являлись тромбозы. Мезентериальный артериальный тромбоз как причина ОМИ занимал ведущее место, составив 71 % случаев (n = 22), тогда как венозный мезентериальный тромбоз диагностирован у 29 % пациентов (n = 9). По данным КТ – ангиографии у 13 (59 %) больных (среди пациентов с артериальным тромбозом) выявили окклюзию I сегмента ВБА, у 1 (5 %) пациента окклюзию III сегмента ВБА, а у 8 (36 %) - отсутствие контрастирования терминальных ветвей ВБА.
Значение I-FABP у пациентов с артериальным тромбозом был ненамного выше значения маркера у пациентов с венозной формой ОМИ: 460,06 (68,79-3000,00) пг/мл и 330,46 (121,72-3000,00) пг/мл соответственно (p=0,789). Концентрация I-FABP при локализации тромба в дистальных ветвях ВБА была значительно ниже, чем при локализации в I сегменте ВБА: 61,52 (14,60-450,62) пг/мл и 1277,85 (378,82-3000,00) пг/ мл соответственно (p=0,01). Наиболее высокая летальность – 75 % прогнозировалась у пациентов с тромбозом I сегмента ВБА, летальность в 55 % оценивалась у пациентов венозным тромбозом и 40 % при локализации тромба в дистальных отделах ВБА согласно шкале оценки APACHE II.
Выявлена значимая отрицательная корреляция концентрации I-FABP и времени от начала заболевания до взятия образцов крови на анализ у пациентов с венозной формой ОНМзК (rho= - 0,809; p=0,008), подобной зависимости же для артериального тромбоза при локализации в I сегменте ВБА и ее дистальных отделов – не выявлено.
Длительность госпитализации составила в среднем – 7 (2–11) суток, при чем пациенты с венозным тромбозом провели в стационаре около 10 (4,5–14,5) суток, против 3,5 (2–10) суток, проведенных в клинике пациентами с артериальным тромбозом. Медиана срока пребывания в отделении реанимации и интенсивной терапии (ОРИТ) составляет – 3 (2–10,5) суток, наибольшая медиана длительности лечения в условиях ОРИТ была у пациентов с венозным тромбозом и с тромбозом дистальных ветвей ВБА и составила – 4 (2,5–7,5) и – 4 (3–5) суток соответственно. Определена значимая отрицательная корреляция концентрации I-FABP и длительности госпитализации (rho= - 0,625; p < 0,001), а также значимая отрицательная зависимость величины БСЖК и сроков лечения в ОРИТ (rho= - 0,62; p < 0,001).
27 (87 %) больным были проведены оперативные вмешательства, 4 (13 %) пациентам, находившимся в крайне тяжелом состоянии в условиях ОРИТ, не удалось стабилизировать состояние и выполнить операцию. 7 пациентам была проведена диагностическая лапароскопия, в частности: у 3 больных лапароскопическая картина демонстрировала отсутствие явных признаков некротических изменений кишки, впоследствии этой группе больных вторым этапом выполняли селективную ангиографию с целью оценки проходимости брыжеечных сосудов и возможных манипуляций с ними; в 1 случае диагностическая лапароскопия послужила контрольным исследованием после эндоваскулярной реканализации окклюзированной ВБА; в 3 же случаях результаты диагностической лапароскопии позволили сделать вывод об инкурабельности пациента. У 2 пациентов выполнена диагностическая лапароскопия с конверсией на срединную лапаротомию, имевшей эксплоративный характер ввиду обнаружения тотального некроза тонкой кишки, в одном случае, а во втором – в сочетании с тотальным некрозом правой половины ободочной кишки. Первичные этапы хирургического лечения заключали в себе проведение: диагностических лапароскопий с конверсией на срединную лапаротомию и выполнением субтотальной колэктомии, илеостомии, санации и дренировании брюшной полости (n=1) или же резекции тонкой кишки с наложением энтеро-энтероанастомоза, санации и дренировании брюшной полости (n=1); лапаротомии, открытой тромбэктомии из I сегмента ВБА, резекции некротизированного участка тонкой кишки, санации и дренировании брюшной полости, лапаростомии (n=1); лапароскопической обструктивной резекции некротизированного участка тонкой кишки, санации и дренировании брюшной полости (n=3); диагностической лапароскопии с конверсией на срединную лапаротомию, обструктивной резекции тонкой кишки, назоинтестинальной интубации, санации и дренировании брюшной полости, ла-паростомии (n=9); cрединной лапаротомии, обструктивной резекции тонкой кишки, назоинтестинальной интубации, санации и дренировании брюшной полости, лапаростомии (n=3). Повторные оперативные вмешательства носили программный характер и проводились в среднем через 44 часа от предыдущего хирургического лечения (табл. 1).
Таблица 1
Сравнение анамнестических и лабораторных данных выживших и умерших пациентов
Table 1
Comparison of anamnestic and laboratory data of surviving and deceased patients
|
Показатель/The indicator |
Выжившие/ Survivors |
Умершие/Deceased |
p |
|
Возраст, год/Age, year |
65,0 (63,0–71,0) |
81,5 (73,0–87,0) |
0,001 |
|
Вес, кг/ Weight, kg |
68,8 ± 13,3 |
76,7 ± 19,7 |
0,29 |
|
Время от начала заболевания до обращения, дни/Time from the onset of the disease to treatment, days |
3,0 (1,0–11,0) |
2,0 (1,0–2,8) |
0,186 |
|
I-FABP, пг/мл / I-FABP, pg/ml |
197,8 (45,1–3000,0) |
1057,5 (124,3–3000,0) |
0,163 |
|
Лейкоциты, × 109 /л /Leukocytes, × 109 /l |
15,65 (7,58–19,60) |
16,03 (13,85–18,78) |
0,62 |
|
Тромбоциты, × 109 /л/ Platelets, × 109 /l |
223 (179–367) |
192 (157–264) |
0,09 |
|
Гемоглобин, г/л/ Hemoglobin, g/l |
162,0 (142,0–166,0) |
137,5 (97,3–159,8) |
0,012 |
|
Лактат, ммоль/л/ Lactate, mmol/l |
2,75 (1,45–3,63) |
6,75 (3,38–12,85) |
0,013 |
|
BE |
-0,80 (-8,88 – + 1,13) |
-9,95 (-17,85 – -0,85) |
0,099 |
|
pH |
7,36 ± 0,21 |
7,19 ± 0,15 |
0,016 |
|
Гематокрит, %/Hematocrit, % |
47,3 (45,1–50,0) |
43,5 (29,2–48,0) |
0,063 |
|
Фибриноген, г/л/ Fibrinogen, g/l |
4,68 (3,95–5,10) |
4,74 (4,06–7,35) |
0,680 |
|
ПТИ, %/ PTI, % |
102,7 ± 27,1 |
64,7 ± 25,7 |
0,001 |
|
МНО/MNO |
1,11 (1,01–1,14) |
1,51 (1,17–1,78) |
0,001 |
|
АЧТВ, сек/ ACTV, sec |
23,3 (22,0–29,2) |
30,2 (25,2–33,0) |
0,066 |
|
Абсолютное кол-во лимфоцитов, × 109 /л/ Absolute number of lymphocytes, × 109 /l |
1,43 (0,63–4,13) |
1,26 (0,71–3,20) |
0,943 |
|
СРБ, мг/л /CRP, mg/l |
38,9 (8,6–163,1) |
208,0 (99,2–305,1) |
0,032 |
|
АЛТ, ЕД/л / ALT, UNITS/l |
21,0 (14,9–35,6) |
52,1 (21,9–242,0) |
0,007 |
|
АСТ, ЕД/л / AST, UNITS/l |
20,5 (14,6–28,0) |
87,4 (39,7–476,9) |
< 0,001 |
|
Амилаза, ЕД/л / Amylase, UNITS/l |
59,2 (27,8–70,2) |
155,8 (53,1–268,3) |
0,014 |
Выписаны домой на амбулаторное лечение 11 (35,5 %) пациентов, умерло 20 (64,5 %) человек. Антропометрические данные и лабораторные показатели этих двух групп пациентов представлены в таблице 1. Медиана концентрации I-FABP у умерших пациентов значительно превышала данный показатель у выживших – 1057,5 (124,3–3000,0) пг/мл и 197,8 (45,1–3000,0) пг/мл соответственно (p=0,163), медиана величины лактата умерших больных так же превалирует над таковой у выживших – 6,75 (3,38–12,85) ммоль/л и 2,75 (1,45–3,63) ммоль/л соответственно (p=0,013), медиана показателя С-реактивного белка умерших более чем в 5 раз превышает медиану аналогичного показателя у выживших пациентов – 208,0 (99,2–305,1) мг/л и 38,9 (8,6–163,1) мг/л соответственно (p=0,032).
Заключение
В нашем одноцентровом проспективном клинико-лабораторном исследовании пациентов с острым нарушением мезентериального кровообращения мы получили данные о новом маркере кишечной ишемии – кишечной форме белка, связывающего жирные кислоты (I-FABP), который показал большой потенциал для применения его в ранней диагностике
ОНМзК. На 2–3 сутки от начала клинической симптоматики происходит максимальное повышение концентрации маркера, что совпадает со сроками обращения пациентов за медицинской помощью при ухудшении самочувствия. Концентрация I-FABP при локализации тромба в дистальных ветвях ВБА была значительно ниже, чем при локализации тромба в I сегменте ВБА, что объясняется протяженностью некротических изменений кишки, а соответственно и массой погибших энтероцитов, содержащих исследуемый белок. Корреляционный анализ показал значимую отрицательную зависимость величины I-FABP и длительности госпитализации, а так же значимую отрицательную зависимость величины маркера и сроков лечения в ОРИТ, подобное явление предполагает наличие массивных и протяженных деструктивных изменений кишечной стенки и неблагоприятного исхода лечения больных. Выявлены незначимые различия в концентрации I-FABP у пациентов с артериальным и венозным тромбозом, что не позволяет нам дифференцировать форму ОНМзК. Длительность лабораторного определения нового маркера составляет 3,5 часа, что позволяет за этот промежуток времени выполнить необходимые диагностические исследования в силу оснащенности стационара и выбрать дальнейшую тактику лечения.
Лабораторное определение в сыворотке крови кишечной формы белка, связывающего жирные кислоты, является перспективным методом, имеющим все шансы на внедрение в алгоритм диагностики пациентов с подозрением на какую-либо из форм нарушения мезентериального кровообращения. Таким образом мы сможем сократить время диагностики данной патологии, в особенности, в отдаленных от областных центров больницах, выбрать оптимальную тактику лечения и, соответственно, улучшить результаты лечения больных, их качество жизни в послеоперационном периоде.
Расширенное применение оптимизированного алгоритма диагностики пациентов с подозрением на нарушение мезентериального кровообращения позволит снизить летальность от данной патологии.
Список литературы Современные возможности для ранней диагностики острого нарушения мезентериального кровообращения
- Демченко В.И., Кукош М.В., Колесников Д.Л., Трухалев В.А. Мезентериальный тромбоз и плановая релапаротомия. Хирургическая практика, 2015. № 2. С. 8-11.
- Затевахин И.И., Кириенко А.И., Кубышкина В.А. Абдоминальная хирургия: Национальное руководство: краткое издание. М.: ГЭОТАР-Медиа, 2016. 912 с.
- Кочетков Ф.Д., Сучков И.А., Зайцев О.В., Кошкина А.В. Современные биохимические маркеры острой мезентериальной ишемии. Хирургия. Журнал им. Н.И. Пирогова, 2024. № 1. С. 58-63.
- Кошелев Э.Г., Беляев Г.Ю., Егоров А.А. Компьютерно-томографическая диагностика острой и хронической мезентериальной ишемии. Хирургия. Журнал им. Н.И. Пирогова, 2023. № 12. С. 67-82.
- Тимербулатов Ш.В., А.Р. Гафарова. Острое нарушение мезентериального кровообращения. Медицинский вестник Башкортостана, 2020. Том 15. № 2 (86).
- Хрипун А.И., Шурыгин С.Н., Миронков А. Б., Прямиков А.Д. Венозная форма острого нарушения мезентериального кровообращения: диагностика и лечение. Хирургия, 2017. № 12, с. 95-102, https://doi.org/10.17116/hirurgia20171295-102.
- Ярощук С.А., Баранов А.И., Каташева Л.Ю. и др. Острая мезентериальная ишемия: подходы к диагностике и оперативному лечению. Медицина в Кузбассе, 2018. Т. 17, № 2. С. 35-42.
- Bala M., Kashuk J., Moore E.E., Kluger Y., Biffl W., Gomes C.A., BenIshay O., Rubinstein C., Balogh Z.J., Civil I., Coccolini F., Leppaniemi A., Peitzman A., Ansaloni L., Sugrue M., Sartelli M., Di Saverio S., Fraga G.P., Catena F. Acute mesenteric ischemia: guidelines of the World Society of Emergency Surgery. World Journal Emergency Surgery, 2017, Vol. 38, № 12, рр. 1 - 11.
- Bjorck M., Acosta S., Bastos Goncalves F., Kölbel T., Kolkman J.J., Lees T., Lefevre J.H., Menyhei G., Oderich G., ESVS Guidelines Committee, Kolh P., de Borst G.J., Chakfe 107 N., Debus S., Hinchliffe R., Kakkos S., Koncar I., Sanddal Lindholt J., Vega de Ceniga M., Vermassen F., Verzini F. Editor’s Choice - Management of the Diseases of Mesenteric Arteries and Veins: Clinical Practice Guidelines of the European Society of Vascular Surgery (ESVS). European Journal of Vascular and Endovascular Surgery, 2017, Vol. 53, № 4, рр. 460-510.
- Kärkkäinen J.M. Acute Mesenteric Ischemia: A Challenge for the Acute Care Surgeon. Scand J Surg., 2021, Jun; № 110(2), рр. 150-158. https://doi.org/10.1177/14574969211007590
- Karkkainen J.M., Lehtimaki T.T., Manninen H., Paajanen H. Acute mesenteric ischemia is a more common cause than expected of acute abdomen in the elderly. J Gastrointest Surg., 2015, № 19(8), рр. 1407e14.
- Liu K., Meng J., Yang S. et al. Transcatheter thrombolysis combined with damage control surgery for treatment of acute mesenteric venous thrombosis associated with bowel necrosis: a retrospective study. World J Emerg Surg., 2015, № 10, рр. 50. https://doi.org/10.1186/s13017015-0045-2
- Singal A.K., Kamath P.S., Tefferi A. Mesenteric venous thrombosis. Mayo Clin Proc., 2013, № 88, рр. 85-294. https://doi.org/10.1016/j.mayocp.2013.01.012.
- Sun D.L., Cen Y.Y., Li S.M., Li W. M., Lu Q. P., Xu P. Y. Accuracy of the serum intestinal fatty-acid-binding protein for diagnosis of acute intestinal ischemia: a meta-analysis. Sci. Rep, 2016, № 6, pp. 34-37. https://doi.org/10.1038/srep34371.
- Treskes N., Persoon A. M., Zanten A. R. H. Diagnostic accuracy of novel serological biomarkers to detect acute mesenteric ischemia: a systematic review and meta-analysis. Intern Emerg Med, 2017, № 12, pp. 821-836.


