Современные возможности лечения новообразований головного мозга: интраоперационные технологии в нейроонкологии
Автор: Нафиков Артур Ильнурович, Миннигалеев Радмир Ильгамович, Яруллина Элина Револьевна, Магомедова Эминат Магомедмуратовна, Соболева Карина Геннадьевна, Соболев Максим Максимович, Эгамова Оишахон Рустамовна, Кириллова Юлия Алексеевна, Арутюнян Арут Андраникович, Тохова Фатимат Артуровна, Аббасова Нурлана Арифовна, Саадуева Ханипат Хабибовна, Ярмеев Ильшат Файзуллович
Журнал: Клиническая практика @clinpractice
Рубрика: Научные обзоры
Статья в выпуске: 1 т.16, 2025 года.
Бесплатный доступ
Основополагающий принцип нейроонкологии заключается в том, чтобы максимально удалить опухоль, одновременно минимизировав воздействие на здоровые структуры головного мозга. В случае злокачественных глиом объём резекции продолжает оставаться критическим параметром, который существенно влияет на прогноз болезни. Результаты многочисленных исследований показывают, что увеличение объёма удалённой опухоли коррелирует с улучшенными показателями выживаемости. В данном обзоре представлены инновационные интраоперационные терапевтические технологии, созданные для улучшения исходов лечения пациентов с опухолями головного мозга. Важно отметить, что каждая из этих технологий имеет свои преимущества и ограничения. Например, лазерная интерстициальная термотерапия обеспечивает высокоточную деструкцию опухолевых клеток с минимальным повреждением окружающих здоровых тканей, однако требует специального оборудования и квалифицированного персонала. Фотодинамическая терапия отличается избирательным воздействием на опухоль, но её эффективность зависит от типа используемого фотосенсибилизатора и глубины проникновения света. Брахитерапия, в свою очередь, предоставляет возможность локального облучения опухоли, минимизируя воздействие на окружающие структуры, но может требовать длительного периода наблюдения за пациентом после процедуры. Таким образом, применение современных интраоперационных методов открывает новые перспективы в нейроонкологии, обеспечивая более точную и щадящую деструкцию опухолей при сохранении функциональной активности здоровых структур мозга. Однако успех их применения зависит от дальнейшего развития технологий, повышения квалификации специалистов и тесного взаимодействия научного сообщества, индустрии и регуляторов.
Нейрохирургия, онкология, технологии, лазерная интерстициальная термоабляция, фотодинамическая терапия, брахитерапия, инновации, глиома, глиобластома
Короткий адрес: https://sciup.org/143184138
IDR: 143184138 | DOI: 10.17816/clinpract643543
Текст обзорной статьи Современные возможности лечения новообразований головного мозга: интраоперационные технологии в нейроонкологии
Нафиков А.И., Миннигалеев Р.И., Яруллина Э.Р., Магомедова Э.М., Соболева К.Г., Соболев М.М., Эгамова О.Р., Кириллова Ю.А., Арутюнян А.А., Тохова Ф.А., Аббасова Н.А., Саадуе-ва Х.Х., Ярмеев И.Ф. Современные возможности лечения новообразований головного мозга: интраоперационные технологии в нейроонкологии. Клиническая прак тика. 2025;16(1):64–75. doi:
Основополагающий принцип нейроонкологии заключается в том, чтобы максимально удалить опухоль, одновременно минимизировав воздействие на здоровые структуры головного мозга. В случае высокозлокачественных глиом (high-grade gliomas, HGG) объём резекции продолжает оставаться критическим параметром, который существенно влияет на прогноз болезни. Многочисленные исследования показывают, что увеличение объёма удалённой опухоли коррелирует с улучшенными показателями выживаемости [1–3]. Однако важно
Лицензия CC BY-NC-ND 4
The article can be used under the CC BY-NC-ND 4 license
REVIEW
MODERN POSSIBILITIES OF TREATING BRAIN TUMORS:INTRAOPERATIVE TECHNOLOGIES IN NEUROONCOLOGY
-
1 Bashkir State Medical University, Ufa, Russia;
-
2 Dagestan State Medical University, Makhachkala, Russia;
-
3 Kuban State Medical University, Krasnodar, Russia;
-
4 Rostov State Medical University, Rostov-On-Don, Russia;
-
5 Astrakhan State Medical University, Astrakhan, Russia
The fundamental principle of neurooncology is the maximal removal of the tumor, simultaneously minimizing the effects on the healthy brain structures. In cases of malignant gliomas, the extent of resection still remains a critical parameter, which significantly affects the prognosis of the disease. The results from numerous trials show that the increase of the resected tumor volume correlates with improved survival rates. This review provides the data on the innovative intraoperative therapeutic technologies, developed for improving the treatment outcomes among the patients with brain tumors. It is important to note that each of these technologies has its benefits and limitations. For example, laser interstitial thermotherapy provides the ability of highly precise destruction of tumor cells with minimal damaging of the surrounding healthy tissues, however, it requires special equipment and qualified personnel. Photodynamic therapy is distinguished by selective affecting the tumor, but its efficiency depends on the type of photosensibilizing agent used and on the depth of light penetration. Brachytherapy, in turn, provides the possibility of local tumor irradiation, minimizing the effects on the surrounding structures, but it can require a long-term following up the patient after the procedure. Thus, the use of modern intraoperative methods gives access to new perspectives in neurooncology, providing a more precise and sparing destruction of tumors with preserving the functional activity of the healthy brain structures. However, the success of their use depends on further development of technologies, on increasing the qualification of specialists and on the close interactions of the scientific community with the industry and with the regulating authorities.
Nafikov AI, Minnigaleev RI, Yarullina ER, Magomedova EM, Soboleva KG, Sobolev MM, Egamova OR, Kirillova YuA, Arutyunyan AA, Tokhova FA, Abbasova NA, Saadueva KhKh, Yarmeev IF. Modern possibilities of treating brain tumors: intraoperative technologies in neurooncology. Journal of Clinical Practice. 2025;16(1):64–75. doi:
Submitted 29.12.2024 Accepted 21.01.2025 Published online 01.02.2025
учитывать, что излишне агрессивный подход к операции может привести к возникновению новых неврологических нарушений у пациента, что в свою очередь отрицательно скажется на общей выживаемости, особенно когда речь идёт об опухолях, расположенных в функционально значимых областях мозга [4]. Даже несмотря на прогресс в хирургических методиках, риск рецидивов остаётся высоким из-за наличия остаточных инфильтративных клеток на границах опухоли и за её пределами. Это обусловливает необходимость постоянного поиска и внедрения новых интраоперационных технологий, способных повысить точность визуализации опухоли и обеспечить возможность обнаружения и элиминации микроскопически малых остатков опухолевых клеток вдоль краёв операционной полости после основного этапа удаления новообразования. В этой связи особое значение приобретают современные методы интраоперационной диагностики, такие как флуоресцентная навигация, спектроскопия и молекулярная визуализация, которые позволяют хирургу лучше ориентироваться

kV ГА
в операционном поле и точнее определять границы между здоровой и опухолевой тканью. Эти подходы способствуют снижению риска повреждения здоровых тканей и увеличению радикальности оперативного вмешательства, что потенциально может улучшить долгосрочные результаты лечения.
С целью профилактики продолженного роста клеток HGG, активно инвазирующих нормальную нервную ткань, исключительную важность приобретают методы интраоперационной терапии, такие как лазерная интерстициальная термотерапия, интраоперационная брахитерапия, фотодинамическая и сонодинамическая терапия.
Анализ современной литературы, выполненный в данной статье, позволил охарактеризовать новейшие технологии интраоперационной терапии, рассмотреть их текущее состояние и оценить клинические результаты применения в нейроонкологии.
Методология поиска исследований
Поиск в электронных базах данных PubMed, Google Scholar и eLibrary проводился на русском и английском языках по следующим ключевым словам и их сочетаниям: «нейрохирургия»; «онколо- гия»; «глиомы»; «глиобластома»; «лазерная интерстициальная термоабляция»; «фотодинамическая терапия»; «брахитерапия».
Алгоритм отбора источников состоял из нескольких этапов (рис. 1). В процессе скрининга авторы независимо друг от друга анализировали названия и аннотации отобранных статей, проверяя их соответствие теме обзора; затем полнотекстовые рукописи оценивали на соответствие критериям включения (публикация на русском или английском языках; статья является обзором литературы или клиническим исследованием; статья опубликована в рецензируемом научном журнале; в статье описывается применение интраоперационных технологий в нейроонкологии). В конечном итоге в настоящий обзор включено 63 исследования.
ЛАЗЕРНАЯ ИНТЕРСТИЦИАЛЬНАЯ ТЕРМОТЕРАПИЯ
Лазерная интерстициальная термотерапия (ЛИТТ) — малоинвазивная методика абляции, использующая тепловую энергию для уничтожения опухолевой ткани [5]. Процедура выполняется стереотаксически, обычно под контролем магнит-
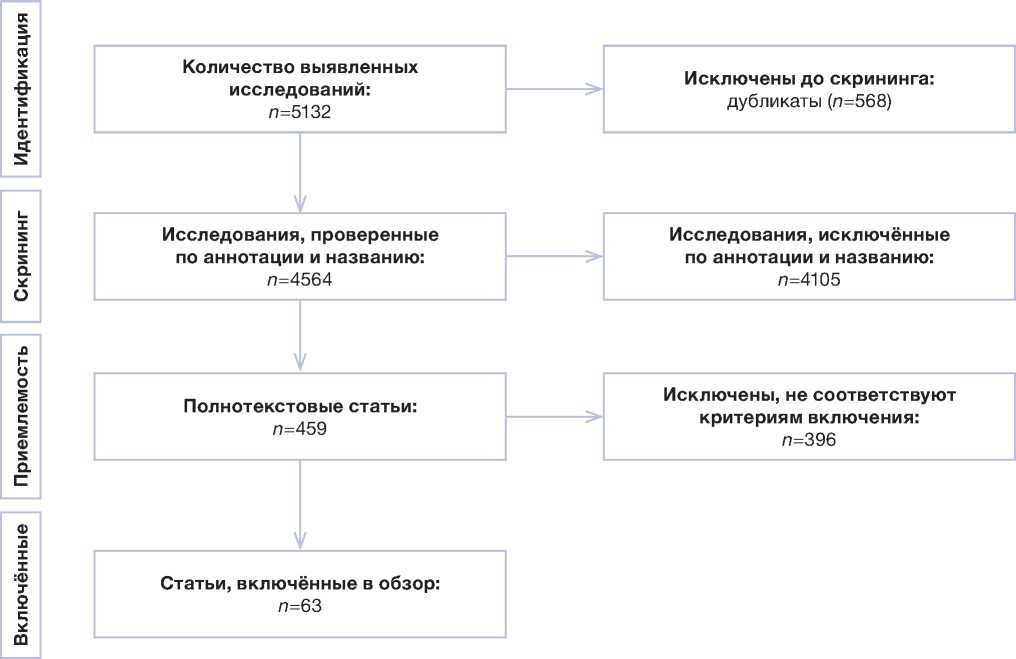
Рис. 1. Алгоритм поиска исследований.
но-резонансной томографии, под наркозом. Для введения оптического волокна формируется небольшое отверстие, через которое в течение 3–4 часов подаётся низкоэнергетическое лазерное излучение [6]. Возникающее при этом тепло разрушает гематоэнцефалический барьер (ГЭБ), улучшая на время (до 4–6 недель после процедуры) проникновение лекарственных препаратов [7]. Иммуноопосредованная гибель опухолевых клеток, индуцированная гипертермией от ЛИТТ, в комбинации с иммунотерапией может способствовать преодолению гематоэнцефалического барьера и стимуляции клеточного противоопухолевого иммунитета, в частности благодаря использованию ингибиторов иммунных контрольных точек [7, 8]. На данный момент завершена лишь I фаза исследования, посвящённого сочетанному применению ЛИТТ и моноклонального антитела против лиганда программированной клеточной смерти 1 (programmed death-ligand 1, PD-L1) авелумаба, ожидается проведение дополнительных исследований [9, 10].
На сегодняшний день активно применяются две системы ЛИТТ — NeuroBlate (преимущественно в нейроонкологии) и Visualase (чаще для лечения фармакорезистентной эпилепсии) [11–13]. Оба устройства могут применяться по различным показаниям.
Система NeuroBlate, одобренная в 2009 году Управлением по контролю качества пищевых продуктов и медикаментов США (Food and Drug Administration, FDA), представляет собой управляемый магнитно-резонансный прибор для проведения ЛИТТ, использующий лазерную гипертермию для локального нагрева мишеней in situ [14]. Первая фаза клинических испытаний с участием пациентов с рецидивирующей HGG была проведена в 2013 году на группе из 10 пациентов, средняя продолжительность жизни которых составила 10,5 месяца [15]. LAANTERN (Laser Ablation of Abnormal Neurological Tissue Using Robotic NeuroBlate System; NCT02392078) — масштабное исследование, поддержанное компанией Monteris, в котором за 5 лет, начиная с 2015 года, приняли участие до 3000 пациентов из разных медицинских центров. Одними из первых эффективность ЛИТТ при впервые выявленной и рецидивирующей глиобластоме дикого типа изучили J.F. de Groot и соавт. [16]. Согласно результатам их исследования, включившего 29 пациентов с впервые установленным диагнозом и 60 пациентов с рецидивирующей опухолью, медиана общей выживаемости среди пациентов с впервые диагностированным заболеванием оказалась сопоставимой с результатами стандартной хирургической резекции. Опубликованы также данные по эффективности лечения метастатических поражений мозга и эпилепсии [17, 18]. Кроме того, NeuroBlate проходит испытания в рамках рандомизированного контролируемого исследования REMASTER (REcurrent Brain Metastases After SRS Trial; NCT05124912), изучающего метастазы в головной мозг, а также в международном исследовании PENSAR (NCT05075850), посвящённого оценке нейропсихологических исходов, результаты которого демонстрируют среднюю общую выживаемость 16,4 месяца, выживаемость без прогрессирования заболевания — 11,93 месяца.
Система Visualase, получившая разрешение FDA в 2008 году, изначально разрабатывалась для лечения фармакорезистентной височной эпилепсии и с тех пор стала предметом многочисленных исследований [19, 20]. Текущие исследования, такие как SLATE, оценивают безопасность и эффективность Visualase при лечении мезиальной височной эпилепсии [21]; проводятся работы по применению Visualase в лечении опухолей головного мозга [22, 23]. Так, P.R. Jethwa и соавт. [22] сообщили о серии случаев с участием 20 пациентов с опухолями головного мозга, 17 из которых ранее прошли другие виды лечения. Авторы отметили, что во всех процедурах достигалась высокая точность лазерного воздействия (83,9%), и большинство пациентов смогли покинуть больницу уже на следующий день после операции.
Несмотря на то, что прямые сравнения между системами NeuroBlate и Visualase отсутствуют, обе демонстрируют положительные результаты и продолжают оцениваться в текущих клинических исследованиях.
ИНТРАОПЕРАЦИОННАЯ БРАХИТЕРАПИЯ
Интраоперационная брахитерапия — введение радиоактивных материалов непосредственно в зону опухоли или рядом с ней перед локальной лучевой терапией. Этот подход может применяться как внутри полостей организма, так и в межтканевых пространствах [24]. Благодаря направленному воздействию высоких доз радиации на опухоль с минимальным повреждением соседних здоровых тканей повышается эффективность лечения [25].
Ш1ТАТ ж ГАТАТ
Первоначально брахитерапию разрабатывали как дополнительное средство борьбы с раком органов брюшной полости, но на современном этапе технология широко используется в лечении различных видов опухолей, включая новообразования центральной нервной системы, простаты, молочной железы, женских половых органов и глаз [26–29]. Существуют два основных типа брахитерапии — высокодозная (high-dose rate, HDR) и низко-дозная (low-dose rate, LDR).
При HDR радиоактивный источник вводится в область опухоли на короткий период времени (несколько минут), после чего извлекается. В случае LDR радиоактивный материал остаётся в зоне воздействия как минимум несколько дней, как максимум — на длительный (постоянный) срок [30]. После основного хирургического вмешательства в образовавшуюся полость часто вводят гранулы с радиоактивными изотопами, такими как цезий-131 (Cs-131), йод-125 (I-125) и иридий-192 (Ir-192), период полураспада которых составляет от нескольких дней до нескольких недель [31, 32].
В ряде клинических исследований были подтверждены безопасность и эффективность использования брахитерапии для лечения опухолей головного мозга. Так, S.T. Magill и соавт. [32] применили брахитерапию с использованием I-125 у 42 пациентов с атипичными или рецидивирующими менингиомами. Результаты показали, что средняя продолжительность безрецидивно-го периода составила 20,9 месяца для атипичных и 3,3 года для рецидивирующих менингиом. E. Dagnew и соавт. [33] получили схожие данные в исследовании с участием 26 пациентов с метастазами в головном мозге, где локальный контроль над опухолью достигал 96%, а медиана общей выживаемости составляла 17,8 месяца. Однако в обоих исследованиях наблюдались осложнения, связанные с некрозом ткани мозга вследствие радиационного повреждения, что, вероятно, было связано с высокой начальной дозировкой I-125, характеризующейся относительно высокой энергией распада (35 кэВ) и продолжительным периодом полураспада (59,4 дня) [31]. Именно поэтому Cs-131, имеющий оптимальное соотношение энергии (30 кэВ) и периода полураспада (9,7 дней), стал рассматриваться в качестве наиболее предпочтительного радиоизотопа для низкодозной брахитерапии.
В проведённом A.G. Wernicke и соавт. [34] клиническом исследовании I/II фазы процедуру постоянной имплантации гранул Cs-131 прошли 24 пациента с впервые выявленными метастазами в головном мозге. Через год авторы зафиксировали 93,8% локальный контроль опухолей без серьёзных побочных эффектов, связанных с облучением. Аналогичные результаты по контролируемой токсичности были получены и в рамках другого исследования I/II фазы с участием 15 пациентов [35].
После успешного применения Cs-131 в режиме низкодозной брахитерапии было создано устройство Gammatilе (США), представляющее собой гранулы Cs-131, заключённые в коллагеновый носитель, который предназначен для внутриполост-ной имплантации после операции. Эффективность этого устройства была проверена в исследовании STaRT (Surgically Targeted Radiation Therapy), в котором участвовали 11 пациентов с 16 опухолевыми очагами HGG (12 рецидивирующих и 4 ранее не леченых) [36]. Применение Gammatile обеспечило локальную ремиссию 83% опухолей через 12 месяцев, причём среди ранее не леченых опухолей этот показатель составил 100%. В настоящее время ведётся клиническое исследование III фазы ROADS, которое сравнивает результаты использования Gammatile с результатами послеоперационной стереотаксической радиохирургии (stereotactic radiosurgery, SRS). Завершение данного исследования запланировано на 2027 год [37].
Среди последних достижений в онкорадиологии необходимо отметить системы для интраоперационной баллонной электронной брахитерапии Xoft Electronic Brachytherapy System, Axxent (США), которые доставляют миниатюрный источник рентгеновского излучения непосредственно к ложу опухоли, избегая необходимости применения радиоактивных изотопов и дорогостоящего оборудования [25]. Источники излучения доставляются через аппликаторы, обеспечивая высокую дозу излучения в окружающие ткани. Система Intrabeam от Zeiss (Германия) работает как миниатюрный линейный ускоритель, создавая высокодозное излучение для немедленной лучевой терапии после операции с минимальным воздействием на здоровые ткани. Многоцентровое исследование M. Huss и соавт. [38] с использованием этих систем показало улучшение общей выживаемости пациентов на 25% через 3 года после вмешательства.
Система Xoft Axxent от iCAD, оснащённая компактной рентгеновской трубкой с вольфрамовой мишенью, обладает высокими показателями точности и безопасности излучения. Её способность быстро снижать дозу помогает минимизировать воздействие радиации на окружающие здоровые ткани, что особенно ценно при работе с чувствительными областями, такими как головной мозг. Изначально разработанная для лечения рака молочной железы и кожи система Axxent благодаря своему гибкому программному обеспечению может генерировать мощность дозы, сравнимую с такими радиоизотопами, как Ir-192, без дополнительных нормативных и логистических сложностей, связанных с использованием радиоактивных материалов [39].
Elekta Esteya (Швеция) также является эффективным электронным решением для брахитерапии, первоначально разработанным для лечения немеланомных форм рака кожи, но расширенным впоследствии для применения в интраоперационном лечении HGG благодаря его компактной конструкции и продвинутым возможностям управления дозой облучения. Используя вольтаж 69,5 кВ, система Esteya способна обеспечивать высокую мощность при использовании низкоэнергетического рентгеновского луча, что повышает безопасность как для пациентов, так и медицинского персонала. Дизайн системы Esteya позволяет проводить точно направленное лечение, минимизируя воздействие облучения на нецелевые области, делая её привлекательной для использования в нейроонкологии [39].
ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ
Фотодинамическая терапия (ФДТ) представляет собой метод лечения, который сочетает использование источника света и нетоксичного фотосенсибилизирующего соединения для уничтожения опухолевых клеток [40]. Свет направляется непосредственно к опухоли через оптические волокна, размещённые внутри или в полости после удаления опухоли [41]. Под действием света определённой длины волны и интенсивности активизируется фотосенсибилизатор, который затем производит активные формы кислорода [7, 42]. Эти соединения реагируют с клеточными компонентами, вызывая свободнорадикальную гибель опухолевых клеток [42]. В настоящее время наиболее используемым фотосенсибилизатором для ФДТ при HGG является 5-аминолевулиновая кислота (5-Aminolevulinic acid, 5-ALA) [7, 43] — предшественник фотоактивных порфиринов (флуоресцирующий агент и источник активных форм кислорода одновременно) в опухолевой ткани. Комбинированная с ФДТ флуоресцентная навигация, опосредованная 5-ALA, стала предметом изучения многих текущих клинических испытаний.
Эффективность ФДТ в значительной степени обусловлена селективным накоплением фотосенсибилизаторов в злокачественных клетках, что связано с их способностью связываться с липопротеидами низкой плотности — важным компонентом клеточных мембран [42, 44]. В результате опухолевые клетки, которые делятся быстро и имеют повышенные биосинтетические потребности, поглощают липопротеиды низкой плотности и фотосенсибилизаторы гораздо быстрее, чем здоровые клетки.
Противоопухолевое действие ФДТ многосторонне. Помимо прямого уничтожения опухолевых клеток через окислительное повреждение, ФДТ вызывает также ишемию опухоли, повреждая её сосудистую сеть и подавляя образование новых кровеносных сосудов [45]. Кроме того, ФДТ стимулирует как врождённые, так и адаптивные иммунные реакции, что открывает интересные перспективы для клинических исследований [45].
Компанией Hemerion (Франция) разработаны фотосенсибилизатор Пенталафен (Pentalafen) и устройство Heliance, которые вводятся в опухоль соответственно перед операцией и интраоперационно [46]. Целью проводимого на базе Университетской больницы Лилля клинического исследования INDYGO (INtraoperative photoDYnamic Therapy for GliOblastomas; NCT03048240) являлась оценка безопасности и эффективности интраоперационной 5-ALA-опосредованной ФДТ после флуоресцентной навигационной хирургии [47]. В исследовании участвовало всего 10 пациентов с впервые диагностированным HGG в период с мая 2017 по июнь 2018 года [47]. По завершении испытания в апреле 2021 года предварительный анализ результатов не выявил существенных побочных эффектов, а показатели общей выживаемости и выживаемости без прогрессирования за 12 месяцев составили 60% и 80% соответственно [48]. Следующим этапом INDYGO является исследование DOSINDYGO (Dose Finding for Intraoperative Photodynamic Therapy of Glioblastoma;

kV ГА
NCT04391062) — многоцентровое клиническое исследование II фазы по определению максимальной переносимой дозы 5-ALA-опосредованной ФДТ [49]. В настоящее время идёт активный набор участников, завершение исследования планируется на сентябрь 2025 года.
В исследовании А.Ю. Рында и соавт. [50] оценивалась эффективность интраоперационной ФДТ у пациентов с HGG супратенториальной локализации ( n =161). Когорта пациентов была разделена на основную группу с ФДТ ( n =80) и группу сравнения без ФДТ ( n =81). Применение интраоперационной технологии в структуре комплексного лечения злокачественных глиом достоверно увеличивало медиану общей выживаемости у пациентов с Grade III до 39,1±5,5 месяца, с Grade IV — до 20,7±4,7 месяца, а также увеличивало межрецидивный период. Серьёзных осложнений, связанных с использованием фотосенсибилизатора, не наблюдалось.
Таким образом, применение интраоперационной ФДТ в структуре комплексного лечения злокачественных глиом способствует увеличению общей выживаемости и межрецидивного периода, что делает этот метод перспективным направлением в нейроонкологии.
СОНОДИНАМИЧЕСКАЯ ТЕРАПИЯИ ФОКУСИРОВАННЫЙ УЛЬТРАЗВУК
Сонодинамическая терапия (СДТ) является альтернативным методом лечения, который использует нетоксичное соносенсибилизирующее соединение вместе с фокусированным ультразвуком для уничтожения опухолевых клеток [51]. Фокусированный ультразвук передаёт акустическую энергию через ультразвуковой преобразователь в целевые области ткани с высокой пространственной точностью. Подобно ФДТ, сенсибилизирующее вещество концентрируется в основном в опухолевых клетках, что позволяет проводить целенаправленную абляцию. Основной механизм действия фокусированного ультразвука включает создание эффекта кавитации (от лат. cavitas — пустота), при котором индукция ультразвуковых волн приводит к чередующимся циклам высокого и низкого давления, вызывая образование и последующую имплозию (от англ. implosion — взрыв) микропузырьков с нагревом окружающих тканей [51]. Микропузырьки механически разрушают ГЭБ, временно увеличивая его проницае- мость, что облегчает локализованную доставку лекарств [52].
В настоящее время две ведущие компании занимаются разработкой технологий, использующих фокусированный ультразвук для нарушения целостности ГЭБ при лечении глиом: InSightec Ltd. (Израиль) разработали усовершенствованную систему фокусированного ультразвука под контролем магнитно-резонансной томографии, а CarThera (Франция) — низкоинтенсивную контактную ультразвуковую систему SonoCloud. В клиническом исследовании I фазы, в котором участвовали 17 пациентов с рецидивирующей глиобластомой, A.M. Sonabend и соавт. [53] продемонстрировали безопасность и эффективность преходящего нарушения проницаемости ГЭБ с помощью устройства SonoCloud, а также улучшенную доставку связанных с альбумином паклитаксела и карбоплатина через ГЭБ. Одним из наиболее исследованных сенсибилизаторов для СДТ является тот же 5-ALA. В настоящее время компания SonALAsense (США) проводит одноцентровое клиническое исследование 0-й фазы, оценивающее безопасность и эффективность повышения доз СДТ в сочетании с 5-ALA (SONALA-001) при лечении HGG (NCT04559685).
Технологии, такие как СДТ и фокусированный ультразвук, предлагают инновационные решения для лечения труднодоступных опухолей. Использование нетоксичных соединений и ультразвука для целенаправленного уничтожения опухолевых клеток представляет собой многообещающую стратегию, которая поможет улучшить результаты лечения и снизить риск побочных эффектов.
СОВРЕМЕННЫЙ АКЦЕНТ НАУЧНЫХ РАЗРАБОТОК
Совокупность новейших интраоперационных методов лечения свидетельствует о значительном прогрессе в нейрохирургии опухолей головного мозга, предлагая специализированные инструменты для преодоления высокой частоты рецидивов и решения сложных вопросов терапии HGG. Методы, такие как ЛИТТ, ФДТ, СДТ, фокусированный ультразвук и брахитерапия, демонстрируют синергический эффект по сравнению с классической резекцией, способствуя сохранению большего объёма здоровой ткани и улучшению качества жизни пациентов. Параллельно с эти- ми физическими воздействиями разрабатываются локальные химиотерапевтические подходы, обеспечивающие максимальную эффективность непосредственно в очаге поражения. К примеру, кармустин (Bischlorethylnitrosourea, BCNU) — алкилирующий препарат, производимый из нитрозомочевины, изначально использовался для лечения глиом посредством внутривенной инъекции, впоследствии его стали внедрять в виде биоразлагаемых пластин, содержащих кармустин (Gliadel), в полость после удаления опухоли [54]. Пластинчатый формат, предназначенный для уменьшения системной токсичности, одновременно обеспечивает локализованную терапию на границах резецированной области [54]. В метаанализе, проведённом L. Zhao и соавт. [55], сочетание хирургического удаления опухоли с установкой кармустиновых пластин продлевало общую выживаемость у пациентов с вновь диагностированными глиобластомами на 2–4 месяца. Тем не менее, несмотря на положительные результаты, применение кармустиновых пластин по ряду причин пока не стало стандартом лечения глиобластом, в том числе из-за значительной технической сложности процедуры. К тому же в метаанализе A. Bregy и соавт. [56] частота осложнений при использовании кармустиновых пластин превышала 42% (наиболее часто — судороги и отёк мозга), и это с учётом установленного уменьшения числа системных побочных эффектов при использовании пластиночной формы кармустина.
Современный акцент научных разработок направлен преимущественно на HGG, которые представляют собой серьёзную проблему ввиду их широкой распространённости, устойчивости к существующим методам лечения и неблагоприятного прогноза. Показатели выживаемости остаются крайне низкими, несмотря на многолетние исследования и технологический прогресс [57]. Две ключевые биологические особенности HGG — гетерогенность опухоли и её способность распространяться за пределы контрастируемой зоны — требуют комплексной интеграции различных технологий и терапевтических стратегий [58]. Сегодня всё чаще применяются комбинации различных высокотехнологичных методов, таких как хирургия под флюоресцентным контролем вместе с экзоскопией и рамановской спектроскопией в сочетании с ЛИТТ, ФДТ, СДТ и фокусированным ультразвуком. Эти методы сочетаются с иммуно- терапией с помощью ингибиторов контрольных иммунных точек и традиционным химиолучевым лечением. Для дальнейшего усовершенствования терапии необходимы более точные модели in vitro и in vivo, способные воспроизводить гетерогенную природу HGG [59, 60]. Ограниченная репрезентация существующих доклинических моделей затрудняет проведение трансляционных исследований [60].
Как отмечается в рекомендациях STARD-CNS [61], особое внимание следует уделять возможным ошибкам при проектировании клинических исследований, особенно касающихся новых флуорофоров. Эти ранние стадии испытаний критически важны для оценки безопасности, выполнимости и предварительной эффективности новых технологий, открывая дорогу более масштабному тестированию перспективных методов лечения на последующих этапах. Важным аспектом широкого внедрения новых методов интраоперационной диагностики и терапии является получение разрешения на клиническое применение от регуляторных органов (например, FDA), что само по себе представляет длительный и сложный процесс. В этой связи опыт регистрации препарата Глиолан на основе 5-ALA может служить ценным уроком [62]. В рамках данного процесса 5-ALA получила одобрение FDA, что позволило исследователям переориентировать её использование с терапии на инструмент интраоперационной визуализации. Этот пример демонстрирует значимость гибкости и инновационности в процессе перевода лабораторных достижений в клиническую практику.
ЗАКЛЮЧЕНИЕ
Активное развитие новых технологий и методов лечения в нейроонкологии служит ярким примером человеческой изобретательности с целью повышения эффективности терапии малокура-бельных глиом высокой степени злокачественности. Каждая из представленных в обзоре интраоперационных терапевтических технологий вносит важный вклад в улучшение исходов лечения пациентов с опухолями головного мозга. Так, ЛИТТ обеспечивает точную ликвидацию опухолевых клеток, минимально влияя на близлежащие здоровые ткани, однако для проведения этой процедуры требуются специализированное оборудование и опытные специалисты. ФДТ воздействует

kV ГА
целенаправленно на опухоль, но эффективность метода определяется типом применяемого фотосенсибилизатора и глубиной проникновения активирующего светового луча. Брахитерапия, в свою очередь, позволяет осуществлять локальное облучение опухоли, ограничивая воздействие на окружающие области, тем не менее после такой процедуры может понадобиться продолжительный период наблюдения пациента.
Сотрудничество между научным сообществом, индустрией и регулирующими органами сыграет ключевую роль в успешном внедрении рассмотренных технологических инноваций в клиническую практику.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. А.И. Нафиков, Р.И. Миннига-леев — концепция и дизайн исследования, редактирование статьи; Э.Р. Яруллина — сбор и анализ литературных источников, подготовка и написание рукописи; Э.М. Магомедова — сбор и анализ литературных источников, подготовка и написание рукописи; К.Г. Соболева — обзор литературы, сбор и анализ литературных источников, написание текста и редактирование статьи; М.М. Соболев — поиск и анализ литературы, написание рукописи; О.Р. Эгамова , Ю.А. Кириллова , А.А. Арутюнян — сбор и анализ данных, редактирование рукописи; Э.М. Магомедова — сбор и анализ данных, участие в написании рукописи; К.Г. Соболева , Ф.А. Тохова , Н.А. Аббасова , Х.Х. Саадуева , И.Ф. Ярмеев — сбор и анализ данных, написание рукописи. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Источник финансирования. Поисково-аналитическая работа и публикация статьи осуществлены на личные средства авторского коллектива. Обзор выполнен в рамках деятельности межвузовского научного кружка «Патологическая физиология».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
ADDITIONAL INFORMATION
Author contribution. A.I. Nafikov , R.I. Minnigaleev — concept and design of the study, editing of the article;
E.R. Yarullina — collection and analysis of literary sources, preparation and writing of the text of the article; E.M. Magomedova — collection and analysis of literary sources, preparation and writing of the text of the article; K.G. Soboleva — literature review, collection and analysis of literary sources, writing the text and editing the article; M.M. Sobolev — search and analysis of literature, writing the text of the article; O.R. Egamova , Yu.A. Kirillova , A.A. Harutyunyan — data collection and analysis, editing the manuscript; E.M. Magomedova — data collection and analysis, participation in the writing of the manuscript; K.G. Soboleva , F.A. Tokhova , N.A. Abbasova , Kh.Kh. Saadueva , I.F. Yarmeev — data collection and analysis, writing the text of the manuscript. The authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Funding source. The study had no sponsorship. The review was carried out within the framework of scientific interuniversity cooperation in the scientific community “Pathological Physiology”.
Competing interests. The authors declare that they have no competing interests.


