Современные возможности первичной и вторичной профилактики рака молочной железы
Автор: Ноговицина Е.М.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Медицинские науки
Статья в выпуске: 9-2 (72), 2022 года.
Бесплатный доступ
Профилактика рака молочной железы подразделяется на первичную и вторичную. Первая подразумевает генетические и скрининговые исследования, вторая - предотвращение развития повторного рака. Наблюдается усовершенствование оценки систем риска развития рака у женщин с необнаруженными на данный момент злокачественными новообразованиями и повторного их развития после лечения. Постоянно возрастает числом выполнения профилактических хирургических вмешательств (профилактическая мастэктомия, профилактическая аднексэктомия) у пациентов-носителей BRCA-мутации. Однако пока нет определенного ответа на вопрос о причине возникновения рака молочной железы, так как это системное и многофакторное заболевание.
Рак молочной железы, рмж, профилактика, первичная, вторичная, маммография, ммг, химиотерапия, мастэктомия
Короткий адрес: https://sciup.org/170195807
IDR: 170195807 | DOI: 10.24412/2500-1000-2022-9-2-26-34
Текст научной статьи Современные возможности первичной и вторичной профилактики рака молочной железы
Несмотря на десятилетия лабораторных, эпидемиологических и клинических исследований, заболеваемость раком молочной железы (РМЖ) продолжает расти. По данной мировой статистики онкологическая патология обнаруживается у каждой 20 женщины [1]. Возросло число выполнения профилактических хирургических вмешательств в связи их высокой эффективностью у пациентов-носителей BRCA-мутации. Исследование профилактических возможностей для предотвращения РМЖ возрастает. В настоящее время нет определенного ответа на вопрос о причине возникновения РМЖ, так как это системное и многофакторное заболевание [2].
Цель работы - анализ современных возможностей и направлений развития первичной и вторичной профилактики РМЖ.
Обнаружено, что многие клинические и генетические факторы повышают риск развития РМЖ. Современные стратегии снижения риска развития патологии у женщин включают первичную профилактику: отказ от курения, использования экзогенных гормонов и чрезмерного воздействия ионизирующего излучения; поддержание нормального веса, физические упражнения, грудное вскармливание, здо- ровое питание и сведение к минимуму употребления алкоголя. Препараты химиопрофилактики доступны для лиц с высоким риском, хотя они недостаточно используются у таких женщин. Мастэктомия и/или двусторонняя овариэктомия являются разумными стратегиями для женщин с вредными мутациями в генах, резко повышающих риск развития РМЖ. В разработке находится множество стратегий профилактики РМЖ. Разрабатываемые персонализированные подходы сосредоточены на достижениях точной медицины, знаниях об иммунной системе и микроокружении опухоли, а также их роли в развитии рака. Успехи в понимании рисков и развития РМЖ позволяют исследователям целенаправленно ориентироваться на группы населения с конкретным анамнезом. Предпринимаются профилактические клинические испытания для оценки подходов к профилактике рака с использованием нескольких агентов в надежде на повышение эффективности по сравнению с отдельными препаратами. Наблюдается также тенденция к расширению использования химиопрофилактики РМЖ с доказанной эффективностью, в частности тамоксифена и ралоксифена [3]. Около 70% злокачественных новообразо- ваний (ЗНО) провоцируются экзогенными факторами, в частности для РМЖ – образ жизни женщины, ее питание и физическая активность. Чрезмерное употребление пи- щи с высоким содержанием жиров, алкоголя, недостаток физической нагрузки, избыточный вес – все это относят к факторам риска (табл. 1) РМЖ [4].
Таблица 1. Влияние на профилактику РМЖ устранения факторов риска образа жизни
|
Устранение фактора риска |
Описание действий |
Уровень снижения распространения РМЖ |
Ссылка |
|
Устранение гиподинамии в пре-и постменопаузальном периодах |
Ежедневные физические упражнения: активные спортивные занятия или умеренная физическая активность (быстрая ходьба ≥7 ч в неделю, прогулки в течение часа в день) |
10-14% и 25% (при высокой физической активности) |
5-7 |
|
Слежение за весом в зрелом возрасте |
Снижение высокого веса на 10 кг и более |
в 2 раза |
8 |
|
Трезвый образ жизни |
По сравнению по сравнению с употреблением спиртных напитков в среднем 3-6 раз в неделю |
15% |
9 |
У женщин менопаузального периода увеличение индекса массы тела на каждые 5 кг/м2 увеличивает риск развития РМЖ в постменопаузе на 12% [10]. Известно, что этанол влияет на концентрацию эстрогена с помощью нескольких механизмов (рисунок) [11]. В результате наблюдается уве- личение сывороточных концентраций эстрогенов в связи с повреждением гепатоцитов ацетальдегидом. Отмечено, накопление гидроксиметаболитов эстрагенов, не-завершение реакций их метилирования. Повышается уровень генотоксичных ка-техолэстрогенов [12].
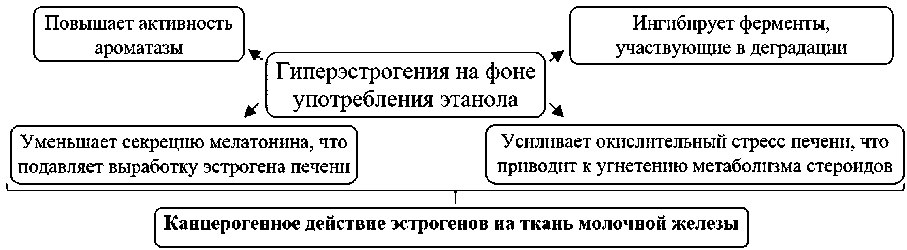
Рисунок. Влияние этанола на метаболизм эстрогенов. Составлено по данным [11]
Ожирение связано с РМЖ в постменопаузе, а физические упражнения, эквивалентные бегу продолжительностью до 8 ч в неделю, снижают риск РМЖ непосредственно и за счет снижения ожирения. В Австралии употребление алкоголя может быть причиной 5,8% случаев РМЖ. Курение также относят к факторам риска развития РМЖ [2]. Избыточная масса тела является установленной причиной РМЖ в постменопаузе. По сравнению с женщинами со стабильным весом (±2 кг) женщины с устойчивой потерей веса ≥9 кг даже с небольшим обратным возвратом килограммов имели более низкий риск РМЖ. Устойчивая потеря веса, даже в небольших количествах, связана с более низким риском РМЖ у женщин в возрасте ≥50 лет [13]. Физическая активность может также снизить частоту рецидивов и увеличить выживаемость пациентов с РМЖ [14]. Выявлено, что большинство женщин имеет недостаточный уровень знаний о факторах риска РМЖ [15]. Необходимо повышать уровень осведомленности населения о возможностях первичной профилактики РМЖ, в том числе посредством коррекции питания, физической активности, вредных привычек [16]. Заболеваемость РМЖ увеличивается, несмотря на разработку и использование современных технологий диагностики и лечения, поэтому нужно по- вышать уровень осведомленности населения о причинах, течении, клинических проявлениях, необратимых последствиях заболевания [17]. Выявлено влияние фак- торов питания на профилактический эффект и уровень риска развития РМЖ (табл. 2).
Таблица 2. Влияние факторов питания на профилактику РМЖ [19, 20]
|
Фактор |
Влияние |
|
Витамин D3 |
Антипролиферативный (ингибирование роста клеток, стимуляция роста рецепторов в ткани МЖ) и проапоптотический эффект, способствующий естественной (нормальной) гибели клеток МЖ. |
|
Кофе |
У носителей мутации BRCA1 коррелирует с повышенной биохимической активностью для обнаружения и восстановления повреждений ДНК. |
|
Генистеин (фитоэстроген) |
Повышение уровня белков BRCA1 и 2, снижение уровня метилирования CpG и снижению аффинности связывания с ариловыми углеводородными рецепторами. |
|
Селен |
У аднексэктомированных женщин с мутациями BRCA1 повышает активность ферментов восстановления от окисленных оснований (в частности, гликозилазы hOGG1) |
|
Овощи и фрукты |
Статус экспрессии BRCA коррелирует с их потреблением. |
|
Соя |
Потребление связано с более низким риском РМЖ у носителей мутации BRCA (особенно BRCA2). |
|
Неочищенный пищевой фолат, кобаламин, метионин |
Уровень фолата и кобаламина обратно пропорционально связаны с метилированным RARB (бета-рецептор ретиноевой кислоты) и BRCA1 (фолат связан в возрасте>48 лет). Фолат увеличивает вероятность зависящей от неметилирования сверхэкспрессии BRCA1 в 3 раза, кобаламин и метионин обратно связаны с экспрессией, опосредованной метилированием. |
|
Зеленый чай |
Среди женщин, несущих по крайней мере один аллель COMT с низкой активностью. |
Выявлено, что поглощение железа было защитным, в то время как потребление сурьмы – фактором риска РМЖ у женщин с мутацией BRCA1 [19].
Выделяют также медицинские и профессиональные факторы риска РМЖ: длительное применение комбинированной заместительной гормональной терапии эст-рогенами/прогестероном и оральных контрацептивов, ионизирующее излучение (диагностическое, терапевтическое, профессиональное, в некоторых случаях их воздействие должно быть уменьшено) [2]. Мастопатия как фактор риска развития РМЖ в связи с общей этиологией нуждается в лечении. Установлено, что риск РМЖ минимален при непролиферативных формах мастопатии и существенно (в 2 и 4 раза) повышается при пролиферативной форме без атипии и с атипией, а также (до 12 раз) при предраковых изменениях (атипическая гиперплазия, карцинома in situ). Для профилактики РМЖ и лечения мастопатии рекомендуют препарат Мамоклам® – негормональный лекарственный препарат с органически связанным йодом [21, 22]. Важность доброкачественных заболе- ваний МЖ как маркера повышенного риска РМЖ остается недооцененной [23].
Профилактика РМЖ должна включать мероприятия, направленные не только на снижение риска рака, но и на выявление заболевания на ранней стадии (первичная и вторичная профилактика). Сегодня можно выявить женщин с высокими риском РМЖ и маммографической плотностью. Им следует предложить индивидуальный скрининг, а для первых – еще и первичные профилактические инициативы [24]. Маммография (ММГ) является наиболее информативным методом обследования молочных желез (МЖ) [25]. ММГ применяется для получения изображений МЖ с высоким разрешением (низкоэнергетические рентгеновские лучи, всего 20 мин. тестирования, не требуется контрастирования). У женщин в возрасте 50-70 лет наблюдалось значительное снижение смертности от РМЖ после скрининга с помощью ММГ, для возраста 40-49 лет показатель был незначительным. Гипердиагностика, несомненно, является серьезной проблемой ММГ, которую нельзя игнорировать во время профилактического скрининга РМЖ. Магниторезонансная томо- графия (МРТ) более чувствительна, чем ММГ, у женщин из группы высокого риска, особенно при выявлении инвазивной протоковой карциномы. Эффективность применения МРТ не зависит от плотности МЖ и имеет преимущества в выявлении скрытого первичного РМЖ, подмышечных узловых метастазов, остаточных опухолей после неоадъювантной химиотерапии или других небольших опухолей. Современные МРТ-сканеры могут измерять ткани размером до 0,5 мм. Нет никаких выявленных преимуществ МРТ в отношении результатов лечения пациентов: частота выявления рецидива ипсилатеральной опухоли МЖ и заболеваемости контралатеральным раком МЖ. Специфичность МРТ намного хуже, чем у ММГ, с частотой выявления 37-100%. Чувствительность МРТ может быть полезным выбором в группах высокого риска, когда результаты маммографии в норме [26]. Посредством ММГ и ультразвукового исследования (УЗИ) можно обнаружить опухоли размером от 3 мм и 5-6 мм соответственно. Метод микроволновой радиотермометрии (РТМ) позволяет выявить зоны риска развития ЗНО за 2-3 года до их появления на ММГ/УЗИ. Тепловые изменения обнаруживаются на стадии, предшествующей злокачественному росту, поэтому метод имеет большой потенциал для онкопрофилактики [25]. Метод используется в качестве дополнительного для визуализации скрытых поражений в пораженной и/или незатронутой контралатеральной МЖ [27]. Хотя традиционная пленочная ММГ имеет ограничения в обнаружении плотных молочных желез, цифровая ММГ может преодолеть этот недостаток. Выявлено, что метод обладает лучшими диагностическими показателями, чем пленочная ММГ, у женщин в пре- и перименопаузе с плотной грудью моложе 50 лет. УЗИ намного точнее, если оператор квалифицирован и опытен [26]. Более интенсивное наблюдение, включая ежегодную ММГ и МРТ МЖ (обычно чередуются каждые 6 месяцев), начиная с 25 лет или индивидуально, исходя из самого раннего возраста начала заболевания в семье, значительно улучшило раннее выявление РМЖ у пациенток с вредными мута- циями BRCA1 [28]. Вторичная профилактика включает самообследование МЖ, а также современные и более точные методы визуализации и профилактическое фармакологическое лечение [29]. Профилактика рецидивов РМЖ у женщин после аугментационной маммопластики с применением имплантов имеет свои трудности по причине наличия силиконового имплантата, приводящего к ухудшению возможностей применения традиционных методов лучевой (снижение уровня визуализации) и инструментальной диагностик [30]. Учитывая тот факт, что количество эстетических операций на МЖ с использованием эндопротезов увеличивается, а выявление новых случаев ЗНО не снижается, некоторые исследователи предполагают наличие связи аугментаци-онной маммопластики с последующим появлением ЗНО по причине неполноценного клинико-инструментального обследования [2]. Основной объем МЖ при выполнении ММГ перекрывает интенсивная тень от имплантата. Наиболее высокая (98,1%) точность для таких женщин отмечалась при исследовании МЖ посредством МРТ [30].
Разработаны препараты для вторичной профилактики, снижающие риск РМЖ, однако при разработке/тестирования новых профилактических средств необходимо учитывать барьеры, препятствующие принятию и соблюдению существующих лекарств для женщин с мутациями зародышевой линии высокого риска и без них [1, 29]. Профилактическая терапия селективными модуляторами рецепторов эстрогена (СМРЭ): тамоксифеном и ингибиторами ароматазы (ИА) существенно снижает риск РМЖ дольше периода активного лечения [21]. В отличие от хорошо зарекомендовавших себя и клинически реализованных программ снижения риска для носителей мутаций BCRA 1 и 2, аналогичные программы для женщин с другими причинами высокого риска затруднительны отчасти из-за менее точных оценок [31]. При выполнении химиопрофилактики рецептор эстрогена (РЭ) является основной мишенью, так как более 70% случаев РМЖ являются РЭ-позитивными формами. СМРЭ являются основным классом антиэстрогенных препаратов и действуют как агонисты, так и антагонисты РЭ [26]. При уровне прогнозируемого пятилетнего абсолютного риска ≥1,66% по инструменту оценки Национального института рака (BCRAT) в связи рекомендациями ASCO (Американское общество клинической онкологии) медицинским работникам рекомендуется обсудить химиопрофилактику РМЖ [31]. Химиопрофилактика тамоксифеном может снизить частоту рака, положительного на рецептор эстрогена (у 51% с высоким риском РМЖ), однако выявлены побочные эффекты применения препарата[2]. В исследовании влияния приема тамоксифена в дозе 20 мг/сут. у женщин с высоким риском развития рака (>1,7%) в течение 5 лет выявлено, что при приеме препарата частота случаев рака была в 1,7 раз ниже по сравнению с плацебо (24,8 и 42,5 случаев на 1 тыс. женщин в год соответственно) со снижением риска на 0,57 для инвазивного рака. Для женщин ≥50 лет статистически значимо при приеме препарата возрастают риски развития рака эндометрия и тром-эмболических осложнений. В другое исследование были включены здоровые женщины с приемом тамоксифена на протяжении 8 лет. Установлено, что слабый эстрогенный эффект препарата влияет на эндометрий, вызывая гиперплазию, полипы, рак эндометрия [32]. Тамоксифен имеет самые обильные клинические данные среди СМРЭ, может снизить риск инвазивного и неинвазивного РМЖ, снижает риск РЭ-положительного РМЖ более чем на 30% после 5 лет лечения, однако не наблюдалось значительного снижения РЭ-негативных опухолей. Риск рака эндометрия, инсульта, тромбоэмболии легочной артерии и тромбоза глубоких вен повышается у пациенток, получающих тамоксифен, особенно среди женщин старше 50 лет. Поэтому препарат следует применять индивидуально, балансируя между его токсичностью и пользой [26]. Ралоксифен, который наряду с тамоксифеном также может уменьшать остеопороз, может использоваться у женщин в постменопаузе для снижения риска РМЖ, но не связан с развитием рака матки [2]. Ралоксифен (СМРЭ второго поколения) с меньшим количеством побочных эффектов был одобрен для лечения инвазивного рака РМЖ у женщин в постменопаузе. Однако препарат не оказывает влияния на протоковую и лобулярную карциномы in situ. Исследование испытаний тамоксифена и ралоксифена показало, что последний менее эффективен, чем первый. Также было обнаружено несколько СМРЭ третьего поколения (оспемифен, арзоксифен, лазофокси-фен, базедоксифен), но только исследования последнего агента достигла клинической стадии [26]. Исследование профилактического действия ИА у женщин в постменопаузе на примере экземестана (25 мг/сут), принимаемого в течение 5 лет показало снижение риска только в отношении эстроген-положительного РМЖ. При исследовании анастрозола (1 мг/сут) в аналогичные сроки приема обнаружено снижение вероятности заболевания эстро-ген-положительных ЗНО МЖ на 50% [31]. ИА (стероидные и нестероидные ингибиторы) снижают уровни эстрогенов в плазме путем ингибирования ароматазы, катализирующей биосинтез эстрогена из андрогена. По сравнению с экземестаном (стероидным ингибитором) нестероидные (анастрозол, летрозол) могут обратимо связываться с активным сайтом фермента. Однако данные ИА не имеют существенных различий с точки зрения эффективности в профилактике РМЖ. В условиях адъювантной терапии ИА более эффективны, чем тамоксифен. Анастрозол вызывает меньше серьезных побочных эффектов, чем тамоксифен, у женщин в постменопаузе с ранним РМЖ. Ограничения ИА заключаются в ингибировании биосинтеза эстрогена, поэтому препараты используются только у женщин в постменопаузе и могут увеличить риск развития остеопороза. Приобретение резистентности раковых клеток к ИА наблюдалось после длительного лечения. Выявлено, что только 4,1% женщин из группы высокого риска готовы принимать препараты для химиопрофилактики [26]. Польза химиопрофилактики для снижения риска недостаточно четко определена, ее стратегии сосредоточены исключительно на профилактике у женщин из группы высокого риска [28].
Большинство наследственных опухолей МЖ чаще (в 1/3 случаев) возникают из-за мутаций в генах BRCA1 и BRCA2. Средний совокупный пожизненный риск РМЖ составляет примерно 72/69% у BRCA1/2 к 80 годам [28]. В связи с высокой эффективностью и возросшим числом выполнения профилактических хирургических вмешательств (мастэктомии и аднексэкто-мии) у пациентов-носителей BRCA-мутации, применение профилактических мастэктомий (ПМ) в группе с умеренным и высоким риском привело к снижению риска РМЖ на 89,5 и 96% [28, 32]. Хирургический метод сопровождался снижением смертности от РМЖ минимум на 90% у пациентов с мутацией BRCA [28, 29]. ПМ технически выполняется различными способами. Сейчас «золотым стандартом», по-видимому, является мастэктомия, способная оптимизировать онкологические и эстетические результаты, с сохранением кожной оболочки и комплекса «сосок-ареола» [28]. По сравнению с тактикой наблюдения хирургические методы профилактики РМЖ позволят дополнительно сохранить 9-88 лет жизни для 100 женщин с мутацией BRCA1/2. Предпочтительной тактикой ведения по клиникоэкономическим параметрам является выполнение двусторонней ПМ (по сравнению с адне-ксэктомией) в возрасте 40 лет, так как позволяет к 70 годам достичь лучших исходов при меньших затратах [33]. РМЖ часто бывает двусторонним и мультицентриче-ским у носителей мутации BRCA [28]. Двусторонняя ПМ снижает риск развития РМЖ на 90% у женщин из группы высокого риска [2, 34]. Двусторонняя сальпинго-офорэктомия может снизить риск у носителей BRCA 2 в пременопаузе [34], рекомендуется для носителей мутации в возрасте 35-40 лет или после завершения деторождения, а также индивидуально в зависимости от возраста начала рака яичников в семье. Метод, по-видимому, обеспечивает относительное снижение риска РМЖ приблизительно на 50% [28]. Сообщалось, что у женщин с ранней РМЖ, перенесших одностороннюю мастэктомию, риск контралатерального РМЖ составляет 4% в течение 10 лет. Несмотря на заметное снижение заболеваемости контралатеральным раком молочной железы в США, женщины все чаще предпочитают проводить контралатеральную ПМ при одностороннем РМЖ с меньшим риском на ранних стадиях. Женщины с мутацией BRCA1/2 имеют повышенный пожизненный риск развития РМЖ в пределах 5687%, а также повышенную вероятность развития второго контралатерального или ипсилатерального первичного РМЖ [27]. ПМ контрлатеральной МЖ с одномоментной реконструкцией уменьшает риск развития РМЖ до 96%. Для женщин с мутацией BRCA2 риск развития РМЖ к 80 годам составляет 69 (в целом) и 26% (для контрлатеральной МЖ) [35]. За последние двадцать лет число случаев контралатеральной ПМ неуклонно росло у женщин всех возрастных групп и стадий РМЖ [36].
Недавно для улучшения качества жизни пациентов с РМЖ была разработана биологическая профилактика (моноклональные антитела к ЗНО МЖ) в основном в отношении HER2 как мишени. Примерно в 20-30% всех случаев РМЖ наблюдается сверхэкспрессия белка HER2 или амплификация его гена. Трастузумаб (Герцептин) и Пертузумаб – гуманизированные моноклональные антитела, которые могут связываться с внеклеточной частью HER2. Однако для при их использовании были обнаружены побочные эффекты: застойная сердечная недостаточность и снижение фракции выброса левого желудочка, диарея и фебрильная нейтропения соответственно [26].
Заключение. В современной медицине достигнуты ключевые успехи в персонализированной терапии РМЖ: доступность генетического тестирования, широкое использование медицинских изображений высокой четкости, программное обеспечение для получения трехмерных изображений. Оценка риска РМЖ у отдельной женщины проводится с использованием проверенных алгоритмов, и их, вероятно, будут продолжать улучшать с учетом новых факторов риска. Достигнуты большие успехи в клинических и теоретических ис- следованиях РМЖ. Смертность от заболевания снизилась, но патология является ведущей причиной смерти от рака среди женщин в возрасте 20-59 лет. Если РМЖ диагностирован как первичная опухоль или на ранней стадии метастазирования, то хирургическое удаление и химиотерапия эффективны. Раннее выявление является краеугольным камнем профилактики РМЖ. Биологическая профилактика и лечение РМЖ пока изучены недостаточно, однако могут быть многообещающими стратегиями в будущем. РМЖ развивается в результате многоступенчатого процесса, и патогенез этого заболевания полностью не выяснен. В последнее десятилетие было выявлено, что на РМЖ влияют генетические факторы и факторы окружающей среды. Адекватные медицинские ресурсы, которые могут защитить от этого заболевания, включают ежегодный маммографический скрининг и применение химиопре- паратов. Если женщины осведомлены о РМЖ, то самообследование груди может быть простым, экономичным и мотивированным методом профилактики заболевания. Благодаря снижению стоимости секвенирования ДНК, исследование может быть доступным для представителей среднего класса. Если у женщины есть семейная история РМЖ, целесообразно провести скрининг, особенно на наследственные гены предрасположенности к раку, такие как BRCA1 или BRCA2. Для минимизации риска РМЖ следует избегать таких факторов окружающей среды, как потребление экзогенных эстрогенов, злоупотребление алкоголем и избыточное потребление пищевых жиров. У физически активных женщин риск развития РМЖ в среднем на 25% ниже, чем у менее активных женщин. Регулярные физические упражнения могут быть удобным и недорогим способом профилактики РМЖ.
Список литературы Современные возможности первичной и вторичной профилактики рака молочной железы
- Britt, K.L., Cuzick, J., Phillips, K.A. Key steps for effective breast cancer prevention // Nature reviews. Cancer. - 2020. - V. 20 (8). - P. 417-436. - DOI: 10.1038/s41568-020-0266-x.
- Olver I.N. Prevention of breast cancer // The Medical journal of Australia. - 2016. -V. 205 (10). - P. 475-479. - DOI: 10.5694/mja16.01007.
- Sauter E.R. Breast Cancer Prevention: Current Approaches and Future Directions // European journal of breast health. - 2018. - V. 14(2). - P. 64-71. - DOI: 10.5152/ejbh.2018.3978.
- Выхристюк Ю.В., Ройтберг Г.Е., Дорош Ж.В., Карасёва Н.В., Акобова Р.А. Профилактика развития рака молочной железы // Южно-российский онкологический журнал. -2021. - №1. - С. 50-56.
- Wu Y., Zhang D., Kang S. Physical activity and risk of breast cancer: a meta-analysis of prospective studies // Breast Cancer Res. Treat. - 2013. - V. 137 (3). - P. 869-882. - DOI: 10.1007/s10549-012-2396-7.
- Hildebrand J.S., Gapstur S.M., Campbell P.T., et al. Recreational physical activity and leisure-time sitting in relation to postmenopausal breast cancer risk // Cancer Epidemiol Bi-omarkers Prev. - 2013. - V. 22 (10). - P. 1906-1912. - DOI: 10.1158/1055-9965.EPI-13-0407.
- Eliassen A.H., Colditz G.A., Rosner B., et al. Adult weight change and risk of postmenopausal breast cancer // JAMA. - 2006. - V. 296 (2). - P. 193-201. -DOI: 10.1001/jama.296.2.193.
- Teras L.R., Patel A.V., Wang M., et al. Sustained Weight Loss and Risk of Breast Cancer in Women 50 Years and Older: A Pooled Analysis of Prospective Data // J. Natl. Cancer Inst. -2020. - V. 112 (9). - P. 929-937. - DOI: 10.1093/jnci/djz226.
- Key T.J., Appleby P.N., Reeves G.K., et al. Body mass index, serum sex hormones, and breast cancer risk in postmenopausal women // J. Natl. Cancer Inst. - 2003. - V. 95 (16). -P. 1218-1226. - DOI: 10.1093/jnci/djg022.
- Renehan A.G., Tyson M., Egger M., et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies // Lancet. - 2008. -V. 371 (9612). - P. 569-578. - DOI: 10.1016/S0140-6736(08)60269-X.
- Liu Y., Nguyen N., Colditz G.A. Links between alcohol consumption and breast cancer: a look at the evidence // Womens Health (Lond). - 2015. - V. 11 (1). - P. 65-77. - DOI: 10.2217/whe.14.62
- Чагай Н.Б., Мкртумян А.М. Метаболизм эстрогенов, прижизненные нарушения процессов метилирования и рак молочной железы // Проблемы эндокринологии. - 2019. -№ 65 (3). - С. 161-173.
- Teras L.R., Patel A.V., Wang M., et al. Sustained Weight Loss and Risk of Breast Cancer in Women 50 Years and Older: A Pooled Analysis of Prospective Data. J Natl Cancer Inst. -2020. - V. 112 (9). - P. 929-937. DOI: 10.1093/jnci/djz226.
- de Boer M.C., Worner E.A., Verlaan D., van Leeuwen P.A.M. The Mechanisms and Effects of Physical Activity on Breast Cancer // Clin Breast Cancer. - 2017. - V. 17 (4). - P. 272278. - doi: 10.1016/j.clbc.2017.01.006.
- Шертаева А.Б., Оспанова Д.А., Гржибовский А.М., Аубакирова А.С., Фазылов Т.Р. Факторы риска развития рака молочной железы // Вестник КазНМУ. - 2022. - №1. -С. 192-200.
- Чураков И.В., Кудрина Е.А. Эффективность мероприятий по первичной профилактике рака молочной железы на территории Удмуртской Республики // Современные проблемы здравоохранения и медицинской статистики. - 2019. - № 4. - С. 1-13.
- Юдинцева А.О., Мильчаков Д.Е. Экономическая целесообразность профилактики рака молочной железы // МНИЖ. - 2018. - №4 (70). - С. 89-91.
- Таракова Б.К., Култаев А.С., Есентаева С.Е., Жакенова Ж.К. Витамин Д3 в профилактике рака молочной железы: миф или реальность (обзор литературы) // Вестник КазН-МУ. - 2021. - № 3. - С. 285-290.
- Sellami M., Bragazzi N.L. Nutrigenomics and Breast Cancer: State-of-Art, Future Perspectives and Insights for Prevention // Nutrients. - 2020. - V. 12 (2). - P. 512. - DOI: 10.3390/nu12020512.
- Pirouzpanah S., Taleban F.A., Mehdipour P., Atri M. Association of folate and other one-carbon related nutrients with hypermethylation status and expression of RARB, BRCA1, and RASSF1A genes in breast cancer patients // J Mol Med (Berl). - 2015. - V. 93 (8). - P. 917-934. DOI: 10.1007/s00109-015-1268-0.
- Беспалов В.Г. Патогенетическое лечение мастопатии и профилактика рака молочной железы // РМЖ. Мать и дитя. - 2018. - №2. - C. 141-147.
- Халикова Ф.Ш., Мукхидова Г.Х. Мастопатия и профилактика рака молочной железы как междисциплинарна проблема // ORIENSS. - 2022. - № 5-2. - С. 114-127.
- Kolak A., Kaminska M., Sygit K., et al. Primary and secondary prevention of breast cancer // Ann. Agric. Environ. Med. - 2017. - V. 24 (4). - P. 549-553. - DOI: 10.26444/aaem/75943.
- Hall P., Hammarstrom M., Hellgren R. Det ar dags att skraddarsy brostcancerpreven-tionen [It is time for individual breast cancer prevention] // Lakartidningen. - 2021. - V. 118. -P.21092.
- Трифонова С. А., Куценко Г. А. Комплексная диагностика и профилактика рака молочной железы // Research'n Practical Medicine Journal. - 2018. - № Спецвыпуск 1. - C. 81.
- Sun Y.S., Zhao Z., Yang Z.N., et al. Risk Factors and Preventions of Breast Cancer // Int. J. Biol. Sci. - 2017. - V. 13 (11). - P. 1387-1397. - DOI: 10.7150/ijbs.21635.
- Santosa K.B., Oliver J.D., Momoh A.O. Contralateral prophylactic mastectomy and implications for breast reconstruction // Gland Surg. - 2021. - V. 10 (1). - P. 498-506. - DOI: 10.21037/gs.2020.03.15.
- Franceschini G, Di Leone A, Terribile D, Sanchez MA, Masetti R. Bilateral prophylactic mastectomy in BRCA mutation carriers: what surgeons need to know // Ann. Ital. Chir. - 2019. -V. 90. - P. 1-2.
- Britt K.L., Cuzick J., Phillips K.A. Key steps for effective breast cancer prevention. Nat Rev Cancer. - 2020. - V. 20 (8). - P. 417-436. - DOI: 10.1038/s41568-020-0266-x.
- Ходорович О.С., Солодкий В.А., Калинина-Масри А.А., и др. Рак молочной железы у пациенток после аугментации имплантами // Вопросы онкологии. - 2021. - Т. 67. - № 4. - С. 518-524. - DOI 10.37469/0507-3758-2021-67-4-518-524.
- Borgquist S., Hall P., Lipkus I., Garber J.E. Towards Prevention of Breast Cancer: What Are the Clinical Challenges? // Cancer. Prev. Res (Phila). - 2018. - V. 11 (5). - P. 255-264. -DOI: 10.1158/1940-6207.CAPR-16-0254.
- Портной С.М. Основные риски развития рака молочной железы и предложения по его профилактике // Опухоли женской репродуктивной системы. - 2018. - № 3. - С. 25-39.
- Ходорович О.С., Солодкий В.А., Деркач Е.В. Клинико-экономический анализ методов профилактики рака молочной железы у женщин-носителей мутации BRCA1/2 // Медицинские технологии. Оценка и выбор. - 2016. - № 3 (25). - С. 68-77.
- Thorat M.A., Balasubramanian R. Breast cancer prevention in high-risk women // Best. Pract. Res. Clin. Obstet. Gynaecol. - 2020. - V. 65. - P. 18-31. - DOI: 10.1016/j.bpobgyn.2019.11.006.
- Трегубова А.В., Сухотько А.С., Масри А.А. Необходимость выполнения профилактической мастэктомии у больных с генетически обусловленным раком молочной железы // Research'n Practical Medicine Journal. 2018. - № Спецвыпуск 1. - C. 79-80.
- Scheepens J.C.C., Veer L.V., Esserman L., et al. Contralateral prophylactic mastectomy: A narrative review of the evidence and acceptability. Breast. - 2021. - V. 56. - P. 61-69. DOI: 10.1016/j.breast.2021.02.003.


