Создание биоинформационной матрицы молекулярных маркеров для прогнозирования риск-ассоциированных нарушений здоровья
Автор: Землянова Марина Александровна, Зайцева Нина Владимировна, Кольдибекова Юлия Вячеславовна, Пескова Екатерина Владимировна, Булатова Наталья Ивановна
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 2 (38), 2022 года.
Бесплатный доступ
Одним из приоритетных факторов, формирующих медико-демографические потери, является долговременное непрерывное загрязнение атмосферного воздуха селитебных территорий химическими компонентами. Актуальным является повышение точности прогнозных оценок риска изменений гомеостаза на ранних обратимых стадиях (молекулярный уровень), которые с достаточно высокой степенью вероятности могут трансформироваться в патологические процессы в зрелом возрасте при сохраняющихся условиях экспозиции. Исследование ставило целью создание биоинформационной матрицы молекулярных маркеров для прогнозирования риск-ассоциированных нарушений здоровья (на примере маркера экспозиции). Предложен поэтапный алгоритм исследований, включающий применение протеомной технологии для выделения экспрессированных белков, выявление: причинно-следственных связей белков с факторами; молекулярно-клеточных и функциональных взаимоотношений в системе «фактор экспозиции - ген - белок - негативный исход» для прогнозирования риск-ассоциированных нарушений здоровья. Реализация алгоритма выполнена на примере исследования белкового профиля плазмы детей в возрасте 3-6 лет, подвергающихся длительной аэрогенной экспозиции фторсодержащих соединений. Показано изменение белковой композиции плазмы крови экспонированных детей относительно неэкспонированных по 27 идентифицированным белкам. На примере белка катепсина L1, с изменением уровня которого установлена причинно-следственная связь концентрации фторид-иона в моче, построена биоинформационная матрица. Качественный синтез молекулярно-клеточной локализации, функциональной и тканевой принадлежности показал, что экспрессия катепсина L1, обусловленная повышенным содержанием фторид-иона в моче, может инициировать нарушение ремоделирования внеклеточного матрикса, деградацию и посттрансляционную модификацию белков в клетках легких, толстого кишечника, поджелудочной железы, в кардиомиоцитах, подоцитах почечных клубочков, опосредует процессинг расщепления субъединицы спайкового белка S1 SARS-CoV-2, необходимого для проникновения в клетку и репликации вируса. Созданная биоинформационная матрица на примере белка катепсина L1, позволила спрогнозировать развитие риск-ассоциированных негативных эффектов у экспонированных лиц в виде кардиомиопатии, колита, гломерулонефрита, сахарного диабета, атеросклероза, коронавирусной инфекции. Полученные прогнозные оценки позволяют повышать эффективность раннего выявления и разработки профилактических превентивных мер, направленных на минимизацию негативных последствий.
Протеомный профиль, детское население, клеточно-молекулярная и тканевая принадлежность, молекулярные маркеры, экспрессия гена, негативные эффекты, фторид-ион в моче, катепсин l1, биоинформационные ресурсы
Короткий адрес: https://sciup.org/142235265
IDR: 142235265 | УДК: 57.044, | DOI: 10.21668/health.risk/2022.2.16
Текст научной статьи Создание биоинформационной матрицы молекулярных маркеров для прогнозирования риск-ассоциированных нарушений здоровья
Кольдибекова Юлия Вячеславовна – кандидат биологических наук, старший научный сотрудник, заведующий лабораторией метаболизма и фармакокинетики отдела биохимических и цитогенетических методов диагностики (e-mail: ; тел: 8 (342) 237-18-15; ORCID: .
Пескова Екатерина Владимировна – младший научный сотрудник лаборатории биохимической и наносен-сорной диагностики отдела биохимических и цитогенетических методов диагностики (e-mail: ; тел: 8 (342) 237-18-15; ORCID: .
Сохранение и укрепление здоровья, повышение продолжительности жизни населения, снижение смертности от болезней, в том числе сердечнососудистой системы, злокачественных и хронических респираторных заболеваний и др., обозначены в качестве национальных государственных приоритетов в области социально-экономического и демографического развития Российской Федерации на период до 2024 г.
Одним из ведущих факторов риска формирования дополнительных ущербообразующих последствий здоровью, по мнению экспертов ВОЗ, является длительное и постоянное воздействие загрязнений атмосферного воздуха, питьевых вод и почв селитебных территорий химическими компонентами1 [1]. В целом бремя болезней, обусловленных комплексной химической нагрузкой, оценивается на уровне 15–35 %. Для снижения потерь здоровья у подверженного химическому воздействию населения (в первую очередь, наиболее чувствительные контингенты – дети, подростки, молодые люди) актуальным является повышение точности прогнозных оценок риска формирования изменений гомеостаза на ранних обратимых стадиях (на молекулярном уровне), которые с достаточно высокой степенью вероятности могут трансформироваться в патологические процессы в зрелом возрасте при сохраняющихся условиях экзогенного поступления химических веществ.
Одним из инструментов поиска потенциальных молекулярных маркеров нарушения динамического равновесия может являться применение высокоинформативной протеомической технологии, позволяющей на основании исследований белковой композиции идентифицировать изменения, происходящие в результате экспрессии генов, кодирующих целевые белки (взаимоотношения по типу «ДНК – РНК – белок»), в условиях негативного воздействия факторов, в том числе химического генеза [2–5]. Использование данного подхода является предпочтительным, поскольку основную функциональную нагрузку при взаимодействии любого организма с внешней средой несут белки (либо непосредственно, либо посредством своих ферментативных активностей). Выявление молекулярных белковых и пептидных мишеней, определение их структуры и функций, тканевой принадлежности, вовлеченности в патогенез функциональных нарушений с применением существующих биоинформационных и токсикогенетических ресурсов [6–10] обеспечивает эффективное предположение ожидаемых негативных исходов со стороны здоровья. Установление при этом ассоциативных патогенетических связей между воздействием факторов экспозиции и экспрессией белковых молекулярных маркеров позволяет прогнозировать риск-ассоциированные негативные эффекты, что приобретает особую значимость для решения задач повышения эффективности раннего (клеточно-молекулярного) выявления нарушений состояния здоровья экспонированного населения.
На основании вышеизложенного представляется целесообразным уточнение подходов к проведению исследований по выявлению экспрессированных белков, ассоциированных с экспозицией химических факторов, биологическая и биохимическая интерпретация клеточно-функциональной принадлежности для детализации молекулярно-клеточных механизмов и повышения точности оценок возможного развития негативных эффектов, участвующих в патогенезе риск-ассоциированных неинфекционных заболеваний, что явилось основанием для определения цели настоящего исследования.
Цель исследования – создание биоинформа-ционной матрицы молекулярных маркеров для прогнозирования риск-ассоциированных нарушений здоровья (на примере маркера экспозиции).
Материалы и методы. Создание биоинфор-мационной матрицы молекулярных маркеров для прогнозирования риск-ассоциированных нарушений здоровья возможно посредством поэтапного алгоритма исследований:
– формирование выборок из числа экспонированных и неэкспонированных лиц, относящихся к наиболее чувствительным к негативному воздействию химических факторов (группа наблюдения и группа контроля);
– установление факта экспозиции на основании определения повышенного содержания в биосредах химических веществ, доказанно связанных с экспозицией (идентификация маркеров экспозиции);
– построение протеомного профиля, идентификация, сравнительный анализ и выделение статистически различающихся по интенсивности белковых пятен в группе наблюдения относительно контроля;
– выявление причинно-следственных связей идентифицированных экспрессированных белков с факторами экспозиции (по содержанию маркеров экспозиции в биосредах);
– качественный синтез и построение филогенетического древа, отражающего молекулярно-клеточные и функциональные взаимоотношения в системе «фактор экспозиции – ген – белок – негативный исход» для прогнозирования риск-ассоциированных нарушений здоровья.
Реализация предложенного алгоритма выполнена на примере исследования протеомного профиля плазмы детей в возрасте 3–6 лет, подвергающихся длительной аэрогенной экспозиции фтористых газообразных и твердых соединений, формирующей неканцерогенный риск здоровью, в 1,5–2 раза превышающий приемлемый уровень. Критерием формирования выборок детей группы наблюдения явилось повышенное в 1,5 раза и более относительно референтного значения2 содержание фторид-иона в моче (маркера экспозиции фтористых соединений в соответствии с установленными причинно-следственными связями). У детей группы контроля уровень изучаемого химического вещества соответствовал референтной величине или являлся близким ему. Обследование детей выполнено с соблюдением этических принципов Хельсинкской декларации (WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects, 2013) и одобрено Комитетом по биомедицинской этике ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» с обязательным получением информированного добровольного согласия законного представителя.
Исследование протеомного профиля выполнено по технологии двухмерного электрофореза в полиакриламидном геле. Полученные электрофорео-граммы плазмы крови визуализировали методом окраски серебром и документировали с помощью системы для гель-документирования (BioRad, США). Сравнительный анализ полученных протеомных карт проводили с помощью программного комплекса PDQuest (BioRad, США), выделяли значимые белковые пятна по их интенсивности и осуществляли последующий анализ методом жидкостной хроматографии в сочетании с масс-спектрометрическим анализом (на хроматографе UltiMate 3000 (Германия) и тандемном масс-спектрометре AB Sciex 4000 QTRAP с источником ионизации Nanospray 3 (Кана- да)). Данные тандемных исследований обрабатывали программой ProteinPilot, версия 4.5 (AB Sciex), c идентификацией по базе данных UniProt_sprot_fasta (от 24.11.2017), с выборкой по таксону Homo Sapience (пептидный фингерпринт). Основную часть информации о полученных белках экстрагировали из баз данных Gene Ontology Resource и UniProt3. Установление генов, кодирующих экспрессию идентифицированных белков, выполнено с помощью базы данных HGNC database of human gene name4.
Статистическую обработку полученных данных осуществляли с помощью пакета программ Statistica 10. Сравнительную оценку полученных значений относительного объема белковых пятен у детей группы наблюдения выполняли относительно аналогичных показателей у детей группы контроля. Результаты проведенных исследований представлены в виде среднего значения ( X ), ошибки среднего ( SEM ). Статистическую значимость различий переменных между группами определяли по критерию Манна – Уитни ( U ≤ U кр ) при заданном уровне значимости p ≤ 0,05.
Выявление и оценку причинно-следственных связей между изменением статистически отличающихся белковых пятен и концентрацией в моче фторид-иона проводили с помощью построения математической модели линейной регрессии. Достоверность и адекватность полученных моделей оценивали на основе дисперсионного анализа с использованием F -критерия Фишера, коэффициента детерминации ( R 2), t -критерию Стьюдента при статистической значимости p ≤ 0,05.
Классификация белков по классам, биологическим и молекулярным функциям выполнена с помощью баз данных Panther Classification System и Gene Ontology and GO Annotations5. Для установления экспрессии белков в тканях организма применяли информацию, содержащуюся на платформах Tissue expression database и The Human Protein Atlas6. Описание отношений в системе «фактор экспозиции (маркер экспозиции) – ген – белок – заболевание» производили с использованием информационного ресурса Comparative Toxicogenomics7.
Результаты и их обсуждение. Сравнительный анализ результатов денситометрического измерения протеомных карт плазмы крови обследуемых детей позволил выявить наличие достоверных различий относительного объема 27 белковых пятен у детей группы наблюдения и группы сравнения (табл. 1).
Таблица 1
Белки, достоверно отличающиеся от таковых группы сравнения, выделенные в протеомном профиле плазмы крови детей
|
№ п/п |
Наименование белка |
Идентификатор UniProt |
Кодирующий ген |
Средний объем белкового пятна, X̅ ± SEM |
|
|
Группа наблюдения |
Группа сравнения |
||||
|
1 |
Кератин 9 |
P35527 |
KRT9 |
1406,3 ± 148,7 * |
2232,5 ± 272,2 |
|
2 |
Band4.1-подобный белок 3 |
Q9Y2J2 |
EPB41L3 |
1890,6 ± 56,2 * |
2833,8 ± 135,7 |
|
3 |
Инозитол 1,4,5-трисфосфатный рецептор взаимодействующий белокоподобный 1 |
Q6GPH6 |
ITPRIPL1 |
1736,9 ± 56,2* |
2743,4 ± 304,4 |
|
4 |
Бета субъединица гемоглобина |
P68871 |
HBB |
2350,7 ± 161,6* |
1447,9 ± 253,0 |
|
5 |
Субъединица ламинина альфа-3 |
Q16787 |
LAMA3 |
2435,4 ± 148,4* |
66,5 ± 61,5 |
|
6 |
Аполипопротеин A-I |
P02647 |
APOA1 |
66,5 ± 12,5* |
2435,4 ± 148,4 |
|
7 |
Фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B |
Q8IYD1 |
GSPT2 |
2547,5 ± 118,0* |
94,0 ± 81,0 |
|
8 |
J-цепь иммуноглобулина |
P01591 |
JCHAIN |
1785,0 ± 86,0* |
101,0 ± 34,0 |
|
9 |
THO комплексная субъединица 2 |
Q8NI27 |
THOC2 |
3157,56 ± 65,4* |
2983,4 ± 61,1 |
|
10 |
Nck-ассоциированный белок 5 |
Q9HCH0 |
NCKAP5L |
2586,6 ± 105,1* |
2840,3 ± 92,5 |
|
11 |
GRB10-взаимодействующий GYF-белок 1 |
O75420 |
GIGYF1 |
2340,7 ± 183,3* |
95,4 ± 61,4 |
|
12 |
Кельч-подобный белок 4 |
Q9C0H6 |
KLHL4 |
1806,6 ± 78,0* |
100,5 ± 76,9 |
|
13 |
Протромбин |
P00734 |
F2 |
1893,7 ± 117,3* |
1724,6 ± 47,4 |
|
14 |
Нуклеофосмин |
P06748 |
NPM1 |
469,0 ± 120,0* |
94,0 ± 26,0 |
|
15 |
Дополнение C4-B |
P0C0L5 |
C4B |
2749,8 ± 56,0** |
1821,2 ± 259,7 |
|
16 |
Катепсин L1 |
P07711 |
CTSL |
1712, 0 ± 123,7* |
518,5 ± 125,5 |
|
17 |
Анкирин-1 |
P16157 |
ANK1 |
1765,6 ± 91,0* |
454,2 ± 505,1 |
|
18 |
Транспортный холиноподобный белок 3 |
Q8N4M1 |
SLC44A3 |
1715,2 ± 123,0 * |
72,7 ± 71,0 |
|
19 |
Обонятельный рецептор 8А1 |
Q8NGG7 |
OR8A1 |
1712,1 ± 123,7 * |
518,5 ± 248,0 |
|
20 |
Транстиретин |
P02766 |
TTR |
3966,9 ± 189,3 * |
2344,4 ± 300,2 |
|
21 |
Витронектин |
P04004 |
VTN |
3568,8 ± 233,2 * |
1844,1 ± 142,6 |
|
22 |
Тирозин-протеинфосфатаза нерецепторного типа 14 |
Q15678 |
PTPN14 |
1639,1 ± 156,8 * |
99,5 ± 95,63 |
|
23 |
Фактор терминации транскрипции 1 |
Q15361 |
TTF1 |
3109,5 ± 75,2* |
3342,2 ± 118,7 |
|
24 |
Аполипопротеин C-III |
P02656 |
APOC3 |
4249,6 ± 250,1* |
3027,4 ± 250,1 |
|
25 |
Миотубулярин |
Q13496 |
MTM1 |
4408,1 ± 263,9* |
3228,0 ± 335,8 |
|
26 |
Аполипопротеин C-II |
P02655 |
APOC2 |
3802,7 ± 272,0* |
2326,7 ± 295,1 |
|
27 |
Сывороточный амилоидный белок А-1 |
P0DJI8 |
SAA1 |
2326,3 ± 154,1* |
61,8 ± 5,9 |
П р и м е ч а н и е : * - достоверность межгруппового различия по средним для р = 0,0001; ** - достоверность межгруппового различия по средним для р = 0,009.
У детей группы наблюдения относительно соответствующих данных группы сравнения установлено достоверное увеличение в 1,4–37,6 раза объема порядка 75 % выявленных белковых пятен от общего количества, а также уменьшение в 1,5–36,6 раза объема 25,0 % белков ( р = 0,0001–0,009).
На рис. 1 представлен фрагмент двумерной электрофореграммы для установления количественных различий белка катепсина L1 в плазме крови обследованных детей.
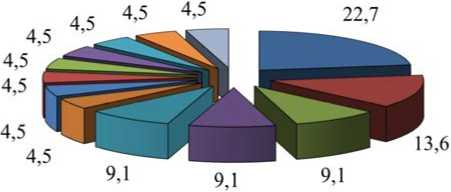
Биоинформационный анализ локализации идентифицированных белков, выполненный с помощью системы классификации Panther, позволил установить, что большинство из них (57,7 %) входят в состав клеточных структур (GO: 0110165), и 15,4 % белков локализованы в протеиновых комплексах (GO: 00032991). В зависимости от участия в жизненном цикле белки классифицированы следующим образом: 22,7 % белков относятся к протеинам, участвующим в передаче сигналов (PC00219), 13,6 % -
к метаболитам взаимосвязи ферментов (PC00262), по 9,1 % - к ферментативным модуляторам (PC00260), белкам цитоскелета (PC00085) и белкам-адаптерам (PC00226) (табл. 2, рис. 2).
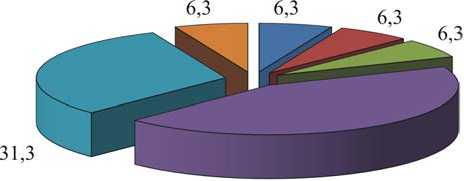
Анализ классификационных признаков по молекулярным процессам показал, что большинство белков осуществляют функции связывания с другими молекулами (GO: 0005488; 44,8 %) и каталитической активности (GO: 0003824; 31,3 %) (табл. 3, рис. 3).
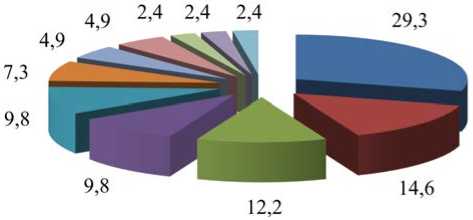
Исследование и оценка классификации биологических функций показали, что основная часть белков обеспечивает клеточные (GO: 0009987; 30 %) и метаболические процессы (GO: 0008152; 15 %), а также биологическое регулирование (GO: 0065007; 12 %) (табл. 4, рис. 4).
Установленные классификационные признаки (локализация, участие в жизненном цикле, биологические функции) идентифицированных белков у детей группы наблюдения аналогичны таковым белков группы контроля.

а б
Рис. 1. Фрагмент двумерной электрофореграммы плазмы крови детей: а - индивид группы наблюдения; б - индивид группы сравнения
Таблица 2
Классы выделенных белков плазмы крови детей в зависимости от участия в жизненном цикле
|
Класс белков* |
Наименование белка |
|
Ферментативные модуляторы |
Тирозин-протеинфосфатаза нерецепторного типа 14, протромбин, катепсин L1 |
|
Белок адаптер |
Анкирин-1, Кельч-подобный белок 4 |
|
Белок передачи |
Аполипопротеин A-I, АПОЛИПОПРОТЕИН C-II, аполипопротеин C-III, бета субъединица гемоглобина |
|
Белок цитоскелета |
Band4.1-подобный белок 3, Кератин 9 |
|
Метаболит взаимосвязи ферментов |
Транстиретин, инозитол 1,4,5-трисфосфатный рецептор взаимодействующий белокоподобный 1, миотубулярин |
|
Транспортер |
Транспортный холиноподобный белок 3 |
|
Шаперон |
Нуклеофосмин |
|
Молекула клеточной адгезии |
Субъединица ламинина альфа-3 |
|
Модулятор активности белкового связывания |
Дополнение C4-B |
|
Трансмембранный сигнальный рецептор |
Обонятельный рецептор 8А1 |
|
Белок защиты |
J-цепь иммуноглобулина |
|
Регулятор специфичной генной транскрипции |
THO-комплексная субъединица 2 |
|
Белок трансляции |
Фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B |
П р и м е ч а н и е : * – согласно данным The PANTHER Classification System8.
-
■ Белок передачи
-
■ Метаболит взаимосвязи ферментов
-
■ Белковый модифицирующий фермент
-
■ Белок адаптер
-
■ Белок цитоскелета
-
■ Тренспортер
-
■ Шаперон
-
■ Клеточная адгезия молекулы
-
■ Модулятор активности белкового связывания
-
■ Трансмембранный сигнальный рецептор
-
■ Белок защиты
-
■ Регулятор специфичной генной транскрипции
-
■ Трансляционный белок
Рис. 2. Классы выделенных белков плазмы крови детей в зависимости от участия в жизненном цикле, %
-
8 The PANTHER Classification System [Электронный ресурс]. – URL: http://www.pantherdb.org/ (дата обращения: 19.03.2022).
43.8
Таблица 3
Молекулярные функции выделенных белков плазмы крови детей
|
Молекулярная функция* |
Название белка |
|
Активность молекулярного преобразователя |
Обонятельный рецептор 8А1 |
|
Активность молекулярного адаптера |
Анкирин-1 |
|
Активность транспорта |
Транспортный холиноподобный белок 3 |
|
Регуляторная активность |
Фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B |
|
Связи с другими молекулами |
Обонятельный рецептор 8А1; THO-комплексная субъединица 2; бета-субъединица гемоглобина; фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B; нуклеофосмин; анкирин-1; витронектин |
|
Каталитическая активность |
Фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B; тирозин-протеинфосфатаза нерецепторного типа 14; протромбин; бета-субъединица гемоглобина; миотубулярин; катепсин L1 |
П р и м е ч а н и е * – согласно данным The PANTHER Classification System8.
-
■ Регуляторная активность
-
■ Активность молекулярных преобразователей
-
■ Активность молекулярного адаптера
-
■ Связи с другими молекулами
-
■ Каталитическая активность
-
■ Активность транспорта
Рис. 3. Молекулярные функции выделенных белков плазмы крови детей, %
Таблица 4
Биологические функции выделенных белков плазмы крови детей
|
Биологическая функция |
Название белка |
|
Биологическая адгезия |
Витронектин |
|
Процессы роста |
Протромбин |
|
Процессы иммунной системы |
Дополнение C4-B; катепсин L |
|
Биологическое регулирование |
Протромбин; обонятельный рецептор 8А1; нуклеофосмин; дополнение C4-B; GRB10-взаимодействующий GYF-белок 1; миотубулярин |
|
Клеточные процессы |
Nck-ассоциированный белок 5; протромбин; THO-комплексная субъединица 2; обонятельный рецептор 8А1; бета-субъединица гемоглобина; транспортный холиноподобный белок 3; фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B; нуклеофосмин; анкирин-1; транстери-тин; миотубулярин; витронектин; GRB10-взаимодействующий GYF-белок 1; катепсин L1 |
|
Процессы развития |
Тирозин-протеинфосфатаза нерецепторного типа 14; протромбин; миотубулярин; |
|
Локализация |
THO-комплексная субъединица 2; транспортный холиноподобный белок 3; нуклеофосмин; анкирин-1; миотубулярин |
|
Метаболический процесс |
THO-комплексная субъединица 2; бета-субъединица гемоглобина; фактор высвобождения пептидной цепи эукариот GTP-связывающая субъединица ERF3B; нуклеофосмин; транстеритин; дополнение C4-B; миотубулярин; катепсин L1 |
|
Многоклеточный процесс организма |
Тирозин-протеинфосфатаза нерецепторного типа 14; протромбин; обонятельный рецептор 8А1 |
|
Ответ на стимул |
Протромбин; обонятельный рецептор 8А1; дополнение C4-B; GRB10-взаимодействующий GYF-белок 1; катепсин L1 |
|
Сигнальная функция |
Обонятельный рецептор 8А1; GRB10-взаимодействующий GYF-белок 1 |
-
■ Клеточные процессы
-
■ Метаболический процесс
-
■ Биологическое регулирование
-
■ Ответ на стимул
-
■ Локализация
-
■ Многоклеточный процесс орагнизма
-
■ Процессы развития
-
■ Сигнальная функция
Биологическая адгезия
-
■ Процессы иммунной системы
-
■ Процессы роста
Рис. 4. Биологические процессы выделенных белков плазмы крови детей, %
Анализ причинно-следственных связей между изменением уровня экспрессированных 27 белков и концентрацией фтор-иона в моче позволил выявить достоверную прямую зависимость только для белка катепсина L1 ( R2 = 0,45; b 0 = 764,23; b 1 = 51,47; р = 0,016), что согласуется с данными экспериментальных исследований, свидетельствующих, что
экспозиция соединений фтора приводит к увеличению экспрессии катепсина L1 [11].
На примере белка катепсина L1 построена биоинформационная матрица функциональной принадлежности (рис. 5), полученная на биоин-формационной платформе Gene Ontology and GO Annotations9.
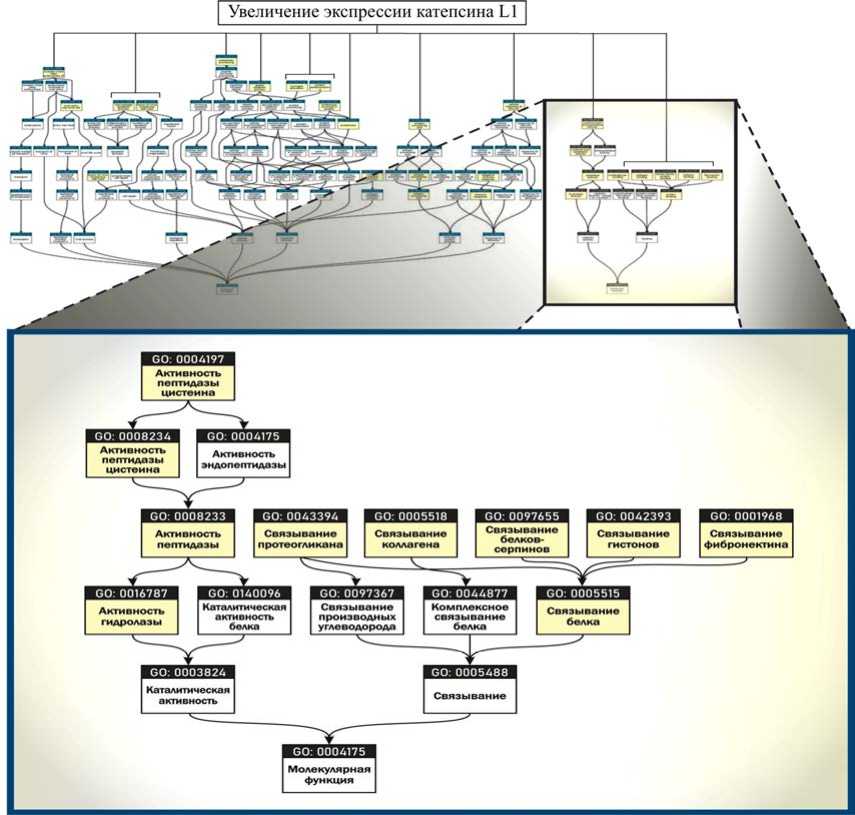
Рис. 5. Схема функциональной принадлежности белка катепсина L1 (база данных Gene Ontology and GO Annotations, 2022)
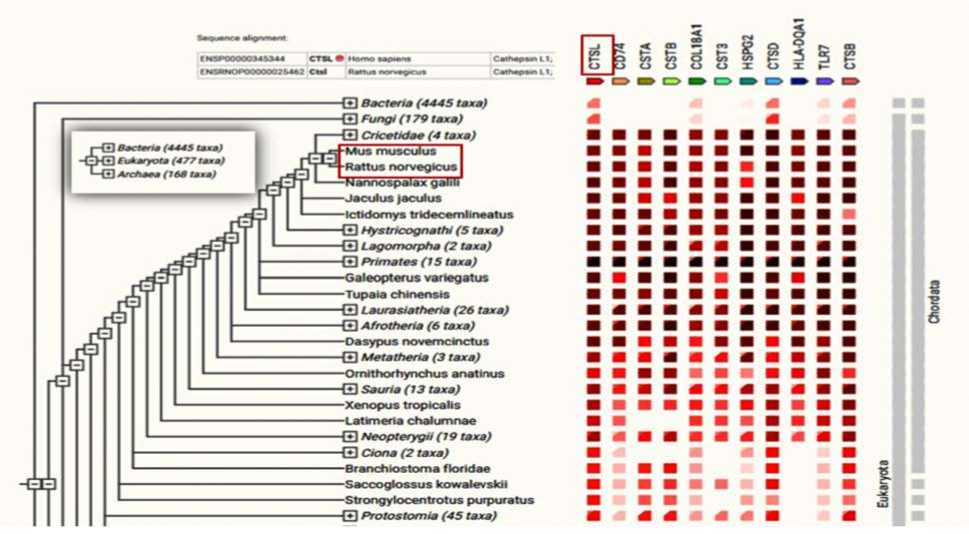
Рис. 6. Фрагмент филогенетического древа ортологичных генов катепсина L1 (база данных STRING Consortium10, 2022)
Экспрессия белка катепсина L1 осуществляется в тканях респираторного тракта, эндокринной системы, желудочно-кишечного тракта, поджелудочной железы, почках и мышечной ткани. К этому подсемейству белков, согласно филогенетическому древу, относится 477 ортологичных генов, принадлежащих к различным таксонам, в том числе Rattus norvegicus (крысы) и Mus musculus (мыши) (рис. 6).
Биоинформационный анализ локализации, функциональной и тканевой принадлежности показал, что белки семейства катепсинов являются лизосомальными цистеиновыми протеиназами, участвующими в процессах, связанных с гибелью клеток, деградацией и посттрансляционными модификациями белков, ремоделированием внеклеточного матрикса, аутофагией и передачей иммунных сигналов. Конкретно с увеличением уровня катепсина L1 связаны деградация и нарушение ремоделирования внеклеточного матрикса в макрофагах легких и толстого кишечника; нарушение баланса «трипсиноген – трипсин» с развитием воспаления в паренхиме поджелудочной железы; нарушение передачи сигналов пути митоген-активируемых протеинкиназ (MAPK) в кардиомиоцитах, повреждение подоцитов почечных клубочков [12–17]. Кроме этого, катепсин L1 опосредует процессинг расщепления субъединицы спайкового белка S1 SARS-CoV-2, необходимого для проникновения в клетку и последующей репликации вируса [18–20]. При сохраняющихся условиях экспозиции
фторсодержащими соединениями увеличивается вероятность развития таких риск-ассоциированных негативных исходов со стороны здоровья, как прогрессирующая дилатационная кардиомиопатия, атеросклероз, панкреатит и сахарный диабет, гломерулонефрит, колит, коронавирусная инфекция.
Выводы. В результате реализации предложенного алгоритма и сравнительного анализа протеом-ных карт плазмы крови детей, экспонированных и не экспонированных фторсодержащими соединениями, идентифицировано 27 экспрессированных белков. На примере белка катепсина L1, экспрессия которого достоверно связана с повышенным содержанием фтор-иона в моче (маркера экспозиции), создана биоинформационная матрица, позволившая спрогнозировать развитие риск-ассоциированных негативных эффектов у экспонированных лиц, в том числе в виде кардиомиопатии, колита, гломерулонефрита, сахарного диабета, атеросклероза, коронавирусной инфекции. Полученные прогнозные оценки позволяют повышать эффективность раннего выявления и разработки профилактических превентивных мер, направленных на минимизацию негативных последствий.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Создание биоинформационной матрицы молекулярных маркеров для прогнозирования риск-ассоциированных нарушений здоровья
- План действий по профилактике и борьбе с неинфекционными заболеваниями в Европейском регионе ВОЗ [Электронный ресурс] // ВОЗ. - 2017. - URL: https://www.euro.who.int/__data/assets/pdf_file/0019/346330/NCD-ActionPlan-RU.pdf (дата обращения: 02.03.2022).
- Биомониторинг человека: факты и цифры [Электронный ресурс]. - Копенгаген: Европейское региональное бюро ВОЗ, 2015. - URL: https://apps.who.int/iris/bitstream/handle/10665/164589/WHO-EURO-2015-3209-42967-60041-rus.pdf?sequence=3&isAllowed=y (дата обращения: 02.03.2022).
- Мирошниченко И.И., Птицина С.Н. Биомаркеры в современной медико-биологической практике // Биомедицинская химия. - 2009. - Т. 55, № 4. - С. 425-440.
- Anderson N.L., Anderson N.G. The human plasma proteome: history, character, and diagnostic prospects // Mol. Cell. Proteomics. - 2002. - Vol. 1, № 11. - P. 845-867. DOI: 10.1074/mcp.r200007-mcp200
- Baer B., Millar A.H. Proteomics in evolutionary ecology // J. Proteomics. - 2016. - Vol. 135. - P. 4-11. DOI: 10.1016/jjprot.2015.09.031
- Dynamic Proteomics: a database for dynamics and localizations of endogenous fuorescently-tagged proteins in living human cells / M. Frenkel-Morgenstern, A.A. Cohen, N. Geva-Zatorsky, E. Eden, J. Prilusky, I. Issaeva, A. Sigal, C. Cohen-Saidon [et al.] // Nucleic Acids Res. - 2010. - Vol. 38, Suppl. 1. - P. D508-D512. DOI: 10.1093/nar/gkp808
- Mi H., Muruganujan A., Thomas P.D. PANTHER in 2013: modeling the evolution of gene function, and other gene attributes, in the context of phylogenetic trees // Nucleic Acids Res. - 2003. - Vol. 41. - P. D377-D386. DOI: 10.1093/nar/gks1118
- Bioinformatic-driven search for metabolic biomarkers in disease / C. Baumgartner, M. Osl, M. Netzer, D. Baumgartner // J. Clin. Bioinforma. - 2011. - Vol. 1, № 1. - P. 2. DOI: 10.1186/2043-9113-1-2
- TISSUES 2.0: an integrative web resource on mammalian tissue expression / O. Palasca, A. Santos, C. Stolte, J. Gorodkin, L.J. Jensen // Database. - 2018. - Vol. 2018. - P. 1-12. DOI: 10.1093/database/bay003
- Large-scale gene function analysis with the PANTHER classification system / H. Mi, A. Muruganujan, J.T. Casagrande, P.D. Thomas // Nat. Protoc. - 2013. - Vol. 8, № 8. - P. 1551-1566. DOI: 10.1038/nprot.2013.092
- Alterations in epididymal proteomics and antioxidant activity of mice exposed to fluoride / Z. Sun, S. Li, Y. Yu, H. Chen, M.M. Ommati, R.K. Manthari, R. Niu, J. Wang // Arch. Toxicol. - 2018. - Vol. 92, № 1. - Р. 169-180. DOI: 10.1007/s00204-017-2054-2
- Differential expression of cysteine and aspartic proteases during progression of atherosclerosis in apolipoprotein E-deficient mice / S. Jormsjo, D.M. Wuttge, A. Sirsjo, C. Whatling, A. Hamsten, S. Stemme, P. Eriksson // Am. J. Pathol. -2002. - Vol. 161, № 3. - Р. 939-945. DOI: 10.1016/S0002-9440(10)64254-X
- Lysosomal cysteine peptidase cathepsin L protects against cardiac hypertrophy through blocking AKT/GSK3P signaling / Q. Tang, J. Cai, D. Shen, Z. Bian, L. Yan, Y.-X. Wang, J. Lan, G.-Q. Zhuang [et al.] // J. Mol. Med. (Berl.). - 2008. -Vol. 87, № 3. - P. 249-260. DOI: 10.1007/s00109-008-0423-2
- Roles for cathepsins S, L, and B in insulitis and diabetes in the NOD mouse / L.C. Hsing, E.A. Kirk, T.S. McMillen, S.-H. Hsiao, M. Caldwell, B. Houston, A.Y. Rudensky, R.C. LeBoeuf // J. Autoimmun. - 2010. - Vol. 34, № 2. - Р. 96-104. DOI: 10.1016/jjaut.2009.07.003
- Podocyte migration during nephrotic syndrome requires a coordinated interplay between cathepsin L and alpha3 in-tegrin / J. Reiser, J. Oh, I. Shirato, K. Asanuma, A. Hug, T.M. Mundel, K. Honey, K. Ishidoh [et al.] // J. Biol. Chem. - 2004. -Vol. 279, № 33. - Р. 34827-34832. DOI: 10.1074/jbc.m401973200
- Angiotensin II type-2-receptor stimulation ameliorates focal and segmental glomerulosclerosis in mice / M.C. Liao, K.N. Miyata, S.Y. Chang, X.P. Zhao, C.S. Lo, M.A. El-Mortada, J. Peng, I. Chenier [et al.] // Clin. Sci. (Lond.). - 2022. -Vol. 136, № 10. - Р. 715-731. DOI: 10.1042/CS20220188
- Cathepsin S is activated during colitis and causes visceral hyperalgesia by a PAR2-dependent mechanism in mice / F. Cattaruzza, V. Lyo, E. Jones, D. Pham, J. Hawkins, K. Kirkwood, E. Valdez-Morales, C.H. Ibeakanma [et al.] // Gastroenterology. - 2011. - Vol. 141, № 5. - Р. 1864-1874.e1-3. DOI: 10.1053/j.gastro.2011.07.035
- Glycopeptide Antibiotics Potently Inhibit Cathepsin L in the Late Endosome/Lysosome and Block the Entry of Ebola Virus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), and Severe Acute Respiratory Syndrome Coronavirus (SARS-CoV) / N. Zhou, T. Pan, J. Zhang, Q. Li, X. Zhang, C. Bai, F. Huang, T. Peng [et al.] // J. Biol. Chem. - 2016. -Vol. 291, № 17. - P. 9218-9232. DOI: 10.1074/jbc.M116.716100
- Transcriptomic characteristics of bronchoalveolar lavage fluid and peripheral blood mononuclear cells in COVID-19 patients / Y. Xiong, Y. Liu, L. Cao, D. Wang, M. Guo, A. Jiang, D. Guo, W. Hu [et al.] // Emerg. Microbes Infect. - 2020. -Vol. 9, № 1. - P. 761-770. DOI: 10.1080/22221751.2020.1747363
- Novel inhibitors of severe acute respiratory syndrome coronavirus entry that act by three distinct mechanisms / A.O. Adedeji, W. Severson, C. Jonsson, K. Singh, S.R. Weiss, S.G. Sarafianos // J. Virol. - 2013. - Vol. 87, № 14. - Р. 8017-8028. DOI: 10.1128/JVI.00998-13


