Создание ортотопической модели рака эндометрия
Автор: Франциянц Е.М., Шихлярова А.И., Каплиева И.В., Бандовкина В.А., Погорелова Ю.А., Нескубина И.В., Трепитаки Л.К., Сурикова Е.И., Моисеенко Т.И., Черярина Н.Д., Котиева В.М., Верескунова А.А., Меньшенина А.П., Рогозин М.А., Ишонина О.Г., Ушакова Н.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Цель исследования - создание модели карциномы матки у самок белых беспородных крыс путем трансплантации опухоли Герена непосредственно в рог матки. Материал и методы. Эксперимент был проведен на нелинейных белых крысах (n=15), массой 250 ± 25 гр. Белым беспородным крысам-самкам в условиях ксилазин-золетилового наркоза в асептических условиях скальпелем проводилась срединная лапаротомия. Длина разреза 2 см. В просвет правого маточного рога с помощью внутривенного катетера с инъекционным портом 22G (0,9 × 25 mm) вводили 0,5 мл опухолевой взвеси, содержащей 2,5-3,5×106 клеток. Подсчет опухолевых клеток производился на клеточном анализаторе ADAMII LS (Nano Entek, Korea). Длительность эксперимента - 21 сут. После декапитации животных производилась морфологическая оценка препаратов опухолевого узла, окрашенных гематоксилин-эозином и по Ван-Гизон.
Экспериментальная модель, рак эндометрия, злокачественный рост, карцинома герена, опухолевый узел, крысы-самки, морфологическое исследование
Короткий адрес: https://sciup.org/140308740
IDR: 140308740 | УДК: 618.14-006.6-092.9 | DOI: 10.21294/1814-4861-2024-23-6-70-80
Текст научной статьи Создание ортотопической модели рака эндометрия
Рак эндометрия (РЭ) является вторым по частоте, после рака шейки матки, гинекологическим раком во всем мире и шестым – по частоте среди всех типов злокачественных новообразований у женщин [1, 2]. Несмотря на успехи в лечении женщин с гинекологическими опухолями, достигнутые за последние несколько лет, женщины с высоким риском рецидива, который может возникать после терапии первой линии, по-прежнему имеют ограниченные возможности лечения [3, 4].
В течение многих лет использование клеточных линий злокачественных опухолей было наиболее часто реализуемым подходом, используемым при разработке лекарственных препаратов, однако методы in vitro не отражают всю сложность живого организма [5]. Модели злокачественных опухолей, полученные от пациента, такие как 3D-сфероиды/ органоиды и модели ксенотрансплантата, взятые от пациента (PDX), стали наиболее оптимальными [6]. PDX-модели обеспечивают множество преимуществ, а именно: сохранение экспрессии генов и мутационного статуса, сохранение архитектуры ткани за счет сохранения молекулярных и гистологических особенностей опухоли, а также возможность создания «идентичной» когорты мышей с опухолями, и могут быть применены для разработки доклинических исследований, а также тестирования и прогнозирования специфического ответа пациента на противоопухолевые препараты [7, 8]. Наряду с преимуществами PDX-модели имеют и некоторые недостатки, например, длительное время, необходимое для их разработки, постепенная потеря микроокружения опухоли человека, отсутствие компетентной иммунной системы хозяина и возможность накопления случайных мутаций, отличных от исходных у пациента [9]. Учитывая известные преимущества и недостатки
PDX-моделей в качестве доклинических, очевидно, что все еще не хватает тщательной оценки того, насколько точно PDX-модели представляют и коррелируют с заболеванием пациента, чтобы считать их точным инструментом для разработки персонализированной медицины.
Перевиваемые опухоли имеют ряд значительных преимуществ перед спонтанными и индуцированными [10]. Прежде всего, они делают возможной постановку массовых экспериментов, так как легко и быстро могут быть получены в большом количестве. Другим преимуществом штаммов перевиваемых опухолей является относительное постоянство их строения и биологических свойств [10, 11]. Полагаем, что доклинические методические приемы с использованием таких экспериментальных моделей помогут улучшить понимание развития заболеваний высокого риска и дать оценку новых противоопухолевых методов лечения в доклинических исследованиях, в том числе и для лечения РЭ.
Целью исследования явилось создание модели карциномы матки у самок белых беспородных крыс путем трансплантации опухоли Герена непосредственно в рог матки.
Материал и методы
Работа с животными проводилась в соответствии с правилами «Европейской конвенции о защите животных, используемых в экспериментах» (Директива 86/609/ЕЕС) и Хельсинкской декларации, а также в соответствии с ГОСТ 33044–2014 «Принципы надлежащей международной практики» и утвержденных правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств от 03 ноября 2016 г. № 81. Все животные содержались в одинаковых условиях: в стандартных пластиковых клетках по 5 особей, при естественном освещении, температуре воздуха 22–26°С и свободном доступе к пище и воде. Животные ежедневно получали стандартный рацион и воду, проходили постоянное наблюдение с регулярным осмотром и взвешиванием. Манипуляции с животными производили в боксе с соблюдением общепринятых правил асептики и антисептики.
Подготовка карциномы Герена к перевивке. Инструменты, посуду, руки дезинфицировали обычным способом. После декапитации крысы-самца с растущей под кожей карциномой Герена обрабатывали кожу животного над опухолью 70 % спиртом. Отступив от опухоли 1–2 см, отсепаро-вывали кожу и отгибали ее таким образом, чтобы шерсть не попала внутрь. Выделяли подкожный опухолевый узел карциномы Герена, промывали стерильным физиологическим раствором и разрезали вдоль. Вырезали кусочки жизнеспособной ткани, имеющей серовато-розовый цвет, и переносили в стерильную чашку Петри, после чего иссекали оставшиеся мелкие участки некроза, прослойки соединительной ткани, сгустки крови, наличие которых ухудшает условия последующего приживления; кусочки ополаскивали стерильным физиологическим раствором. Опухолевую ткань измельчали механическим гомогенизатором и разводили стерильным физиологическим раствором. Для перевивки использовали взвесь опухолевых клеток в 0,5 мл физиологического раствора.
В качестве объекта оперативного вмешательства выступали нелинейные белые лабораторные крысы (n=15), массой 250 ± 25 г. Все оперативные вмешательства сопровождались с использованием ксилазин-золетилового наркоза. Ксилазин-золетиловый наркоз применяется для сопровождения крупных оперативных вмешательств, средней продолжительностью от 30 мин до 2 ч. Ксиланит (ЗАО «НИТА-ФАРМ, Россия, г. Саратов) вводили внутримышечно 0,1 мл/100 г веса животного. Далее через 10–15 мин вводили золетил («Virbac» Франция) в дозе 5 мг/100 г веса животного. Через 1–2 мин пропадал рефлекс переворачивания, максимальный эффект достигался через 5–7 мин после инъекции. Наркоз верифицировали по исчезновению реакции на болевые раздражители (укол лапы) и угнетению роговичного рефлекса [12].
Белым беспородным крысам-самкам в условиях наркоза в асептических условиях (удаление шерсти и двукратная обработка дезинфицирующим раствором операционного поля) скальпелем проводилась срединная лапаротомия. Длина разреза – 2 см. Мочевой пузырь, как правило, наполненный, выводился в рану и отклонялся кпереди. Осторожно потягивая за дольки сальника, в рану выводились маточные рога. Правый маточный рог фиксировался мягким пинцетом [13]. В просвет правого маточного рога с помощью внутривенного катетера с инъекционным портом 22G (0,9 × 25 mm) вводили 0,5 мл опухолевой взвеси, содержащей 2,5–3,5×106 клеток. Подсчет опухолевых клеток производился на клеточном анализаторе ADAMIILS (Nano Entek, Korea). Рог матки перевязывали кетгутом для предотвращения излития взвеси в брюшную полость. Затем рана трижды обрабатывалась антисептическим раствором (фурациллин 1:5000). Матка с ее рогами, мочевой пузырь, доли сальника возвращались в брюшную полость. Кетгутом 4/0 на атравматической игле тремя одиночными узловыми швами ушивался дефект брюшины. Таким же способом ушивалась кожа, операционная рана обрабатывалась 2 % раствором Н2O2. Повязка на рану не накладывалась из-за сложности ее фиксации и низкого риска нагноения раны.
Наблюдение за развитием опухолевого процесса проводилось в течение 21 сут. После умерщвления животных под эфирным наркозом по стандартной методике были изготовлены срединные продольные гистологические срезы с опухолевого узла, толщиной 5–7 мкм, окрашенные гематоксилин-эозином. Световая микроскопия осуществлялась на микроскопе «Leica DM L S2» (окуляр ×10, объективы ×10, ×40, ×100) с компьютерным обеспечением программой «Морфотест».
Результаты
Через 10 сут с момента прививки 3 животных были подвергнуты эвтаназии для контроля роста аденокарциномы. В этот срок макроскопически определяется опухолевый узел в области дна правого рога матки крыс диаметром 25,5 ± 2,3 мм.
Через 21 сут у оставшихся животных диагностировано увеличение живота в объеме. Животные были подвергнуты эвтаназии, прививаемость опухоли составила 100 %. При вскрытии: в брюшной полости определялось небольшое количество геморрагического выпота (рис. 1а). Макроскопически в области дна правого рога матки визуализировался опухолевый узел. На брыжейке определялись пораженные опухолевыми отсевами участки – лимфоузлы (рис. 1б), опухолевое поражение печени (рис. 2а, б). В результате у 100 % животных после трансплантации карциномы Герена в матку было зафиксировано развитие опухоли.
При сравнительном микроскопическом исследовании гистологических препаратов: опухоль
Герена в подкожной клетчатке росла в виде мягких узлов, отграниченных очень тонкой соединительнотканой капсулой. Морфологический контроль клеточной структуры карциномы Герена при подкожной перевивке выявил образование низкодифференцированной солидной опухоли с высокой плотностью клеточной популяции с незначительными участками кровоизлияния и некроза и отсутствием железистой структуры (рис. 3).
Световая микроскопия клеточной структуры свидетельствовала о признаках, характерных для карциномы Герена: расположение клеток было в виде мелких хаотичных групп или коротких тяжей, разделенных тонкими, но хорошо выраженными прослойками соединительной ткани, без образования каких-либо железистых структур или их подобия, что согласуется с характеристиками опухоли, описанными ранее [10].
Цитоплазма клеток умеренно развита, с четкими контурами, образует конгломерации с наличием множества вакуолей и цитоплазматических перемычек – тяжей, укрепляющих стромальную основу (рис. 4а-б). Цитоплазматическо-ядерное соотношение приближается к 1:1 за счет развитой цитоплазмы и достаточно крупного ядра. При этом по виду ядра клеток доминирует овоидная форма, однако нередко встречаются ядра округлой,
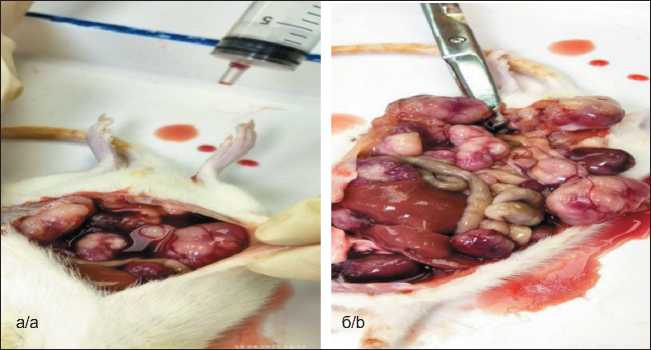
Рис. 1. Макроскопический вид при вскрытии животных: а – геморрагический выпот в брюшной полости животного; б – матка с опухолью, на брыжейке определяются пораженные опухолевыми отсевами участки – лимфоузлы.
Примечание: рисунок выполнен авторами Fig. 1. Macroscopic view during autopsy of animals: a – hemorrhagic effusion in the abdominal cavity of the animal; b – uterus with a tumor, areas affected by tumor deposits – lymph nodes – are determined on the mesentery. Note: created by the autho
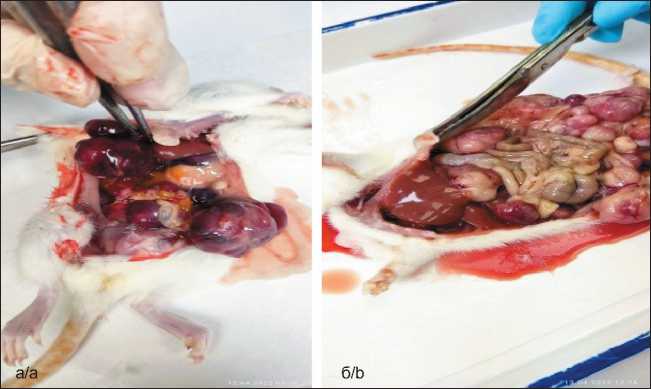
Рис. 2. Макроскопический вид при вскрытии животных: опухолевое поражение печени. Примечание: рисунок выполнен авторами Fig. 2. Macroscopic view during autopsy of animals: tumor lesion of the liver.
Note: created by the authors
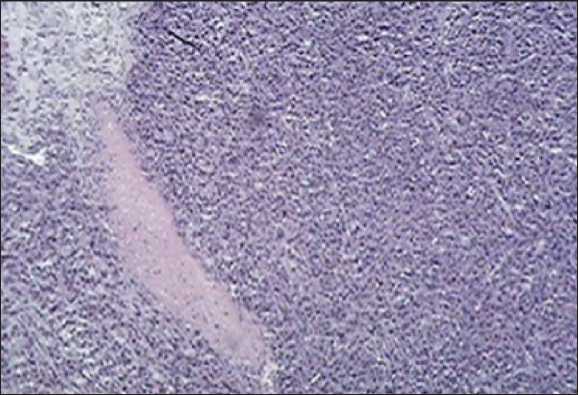
Рис. 3. Микрофото. Фрагмент перевитой под кожу карциномы Герена с высокой плотностью клеточного роста, участками кровоизлияния и некротических изменений. Окраска гематоксилином и эозином, ×100.
Примечание: рисунок выполнен авторами
Fig. 3. Microphoto. Fragment of Guerin’s carcinoma transplanted under the skin with high density of cell growth, areas of hemorrhage and necrotic changes. Hematoxylin and eosin stain, magnification, ×100. Note: created by the authors
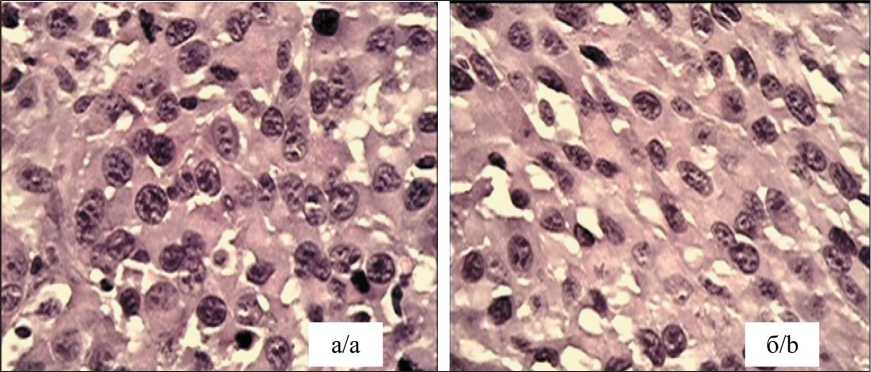
Рис. 4. Микрофото. Фрагменты перевитой под кожу карциномы Герена:
а – конгломерации клеток неправильной овоидной формы с наличием множества вакуолей; б – тяжи опухолевых клеток, полиморфный тип ядер с многочисленными глыбками хроматина, фигуры патологического митоза. Окраска гематоксилином и эозином, ×1000. Примечание: рисунок выполнен авторами
Fig. 4. Microphoto. Fragments of Guerin’s carcinoma transplanted under the skin: a – conglomerations of cells of irregular ovoid shape with the presence of multiple vacuoles; b – strands of tumor cells, polymorphic type of nuclei with numerous chromatin clumps, pathological mitotic figures. Hematoxylin and eosin stain, Microphoto. 1000. Note: created by the authors пластинчатой и даже веретеновидной форм, что, в целом, может характеризовать полиморфный тип ядер. Отмечено множество фигур патологического митоза, что указывает на высокую пролиферативную активность клеток. Наблюдаются и многочисленные участки деградации ядер: пикноз, кариорексис, кариолизис, характеризующие некробиоз клеток. В целом, рост карциномы Герена в подкожной клетчатке по морфологическим признакам сохраняет свой эпителиальный характер с полной утратой железистых структур, даже в рудиментарной форме, напоминающей о маточной форме генеза опухоли у крыс.
Морфологические исследования, проведенные после трансплантации в правый рог матки белых беспородных крыс взвеси карциномы Герена с целью создания ортотопической модели рака эндометрия, выявили следующую картину (рис. 5). На срезе рога матки видны поля нейтрофильной инфильтрации, значительное сужение просвета рога матки с признаками инволютивного поражения призматического эпителия сосочковых структур. При большем увеличении отчетливо проявляется демаркационная зона между участком воспаления и опухолевой тканью с атипичными клетками (рис. 5в). Клетки расположены в виде мелких хаотичных групп или коротких тяжей, вплотную подходящих к реснитчатому эпителию.
Гистологические особенности опухолевых клеток характеризуются типичной для карциномы Герена картиной (рис. 6). Прежде всего, сохраняется цитоплазматическо-ядерное соотношение, близкое к 1:1. Доминирующей формой ядра остается неправильная овоидная, хотя сохраняются вариации вытянутой или лопастной формы. Отмечены глыб-чатость хроматиновой структуры, а также наличие ядер на разных стадиях патологического митоза, что соответствует характерной для карциномы Герена высокой пролиферативной активности. Так же, как и при подкожном росте, наблюдаются цитоплазматические отростчатые соединения, образующие опухолевую конгломерацию.
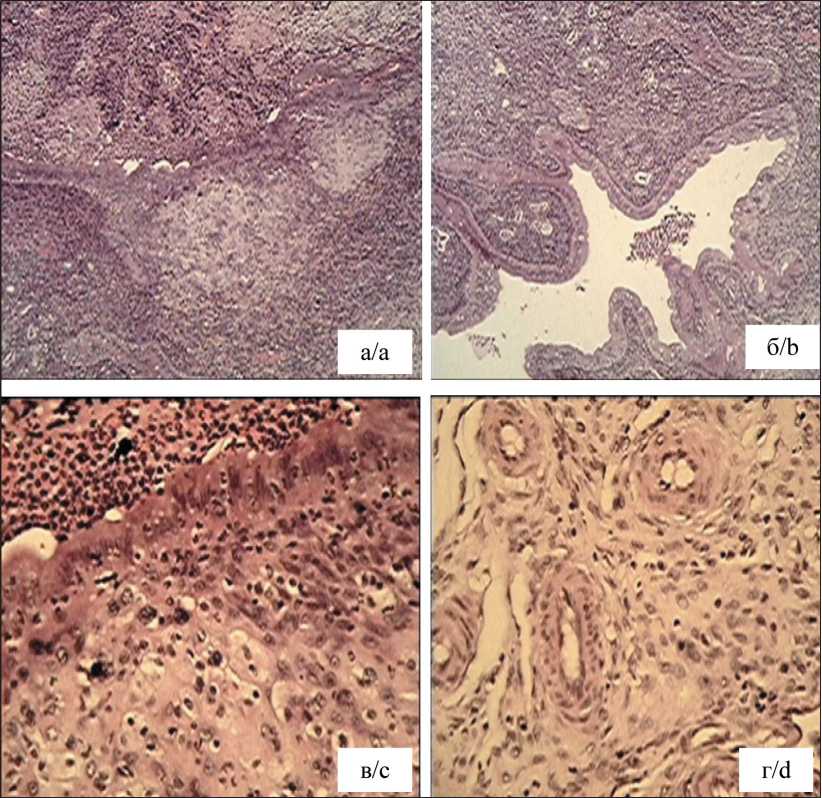
Рис. 5. Микрофото. Фрагмент правого рога матки крысы после трансплантации клеточной взвеси карциномы Герена: а, б – воспалительные и некротические поля с участками нейтрофильной инфильтрации; ×100; в – демаркационная зона между участком воспаления и опухолевой тканью, ×400;
г – ангиогенез на фоне плотного роста опухолевых клеток, ×400. Окраска гематоксилином и эозином. Примечание: рисунок выполнен авторами Fig. 5. Microphoto. Fragment of the right horn of the rat uterus after transplantation of Guerin’s carcinoma cell suspension: a, b – inflammatory and necrotic fields with areas of neutrophilic infiltration; ×100; c – demarcation zone between the area of inflammation and tumor tissue×400; d – angiogenesis against the background of dense growth of tumor cells, hematoxylin and eosin stain, ×400.
Note: created by the authors
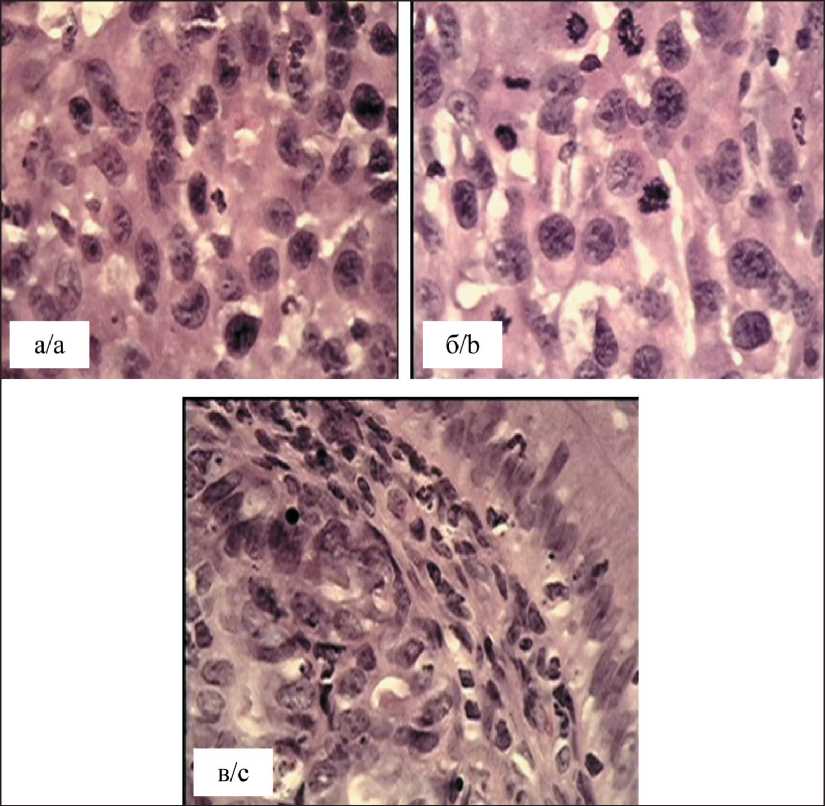
Рис. 6. Микрофото. Фрагмент правого рога матки крысы после трансплантации клеточной взвеси карциномы Герена: а – плотное расположение опухолевых клеток с доминирующей овоидной формой ядер с глыбчатой формой хроматина; б – участки с выраженными отростками цитоплазмы, значительное число фигур патологического митоза;
в – образование опухолевыми клетками сосочкоподобных конгломераций. Окраска гематоксилином и эозином, ×1000. Примечание: рисунок выполнен авторами
Fig. 6. Microphoto. Fragment of the right horn of the rat uterus after transplantation of Guerin’s carcinoma cell suspension: a – dense arrangement of tumor cells with dominant ovoid nuclei with lumpy chromatin; b – areas with pronounced cytoplasmic processes, a significant number of pathological mitotic figures; c – formation of papillary conglomerates by tumor cells. Hematoxylin and eosin stain, ×1000.
Note: created by the authors
Вместе с тем, обращало внимание, что некоторые клеточные структуры аденокарциномы Герена, перевитой в рог матки, имели тенденцию рудиментарного расположения клеток (рис. 6в) в виде закрученных сосочкоподобных конгломераций, отдаленно напоминающих железистую ткань, т. е . отдаленных морфологических признаков изначального генеза опухоли в матке крыс. Подобные рудименты могут служить косвенным подтверждением не только влияния патогенеза исходной карциномы Герена, но и возможности структурного приближения новой ортотопической модели к раку эндометрия.
Обсуждение
Интерес к созданию экспериментальных моделей не ослабевает, что связано с возникновением новых вызовов в борьбе со злокачественными новообразованиями в онкологии. Экспериментальная онкология – важное направление, позволяющее изучать многие патогенетические аспекты злокачественного роста, которые, в силу известных причин, невозможно исследовать в клинике. Базисом экспериментальной онкологии является создание различных экспериментальных моделей злокачественного процесса на животных [14–16].
При изучении механизмов канцерогенеза важно подобрать соответствующую модель. Для исследования онкогенеза на данный момент наиболее часто используют мышиные и крысиные модели [17, 18]. Среди солидных опухолей у крыс в эксперименте наиболее часто используют саркомы и аденокарциномы. Востребованной в экспериментальной онкологии опухолью, поддерживаемой на крысах, является карцинома Герена. Опухоль выделена из матки беспородной белой крысы в 1934 г. П. Герен и М. Герен. В настоящее время по гистологическому строению это низкодифференцированный рак, редко образующий железистоподобные структуры. Карцинома Герена по своим биологическим свойствам и морфологии в значительной мере сохранила свой эпителиальный характер [19, 10]. Прививаемость опухоли колеблется от 50 до 90 %, составляя в среднем, по данным Е.Е. Погосянц, 75 %. Спонтанное рассасывание не наблюдается [10]. Средняя продолжительность жизни – 30–40 дней [19, 10].
Для изучения рака эндометрия доступны пять основных классов экспериментальных моделей:
Список литературы Создание ортотопической модели рака эндометрия
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Concin N., Matias-Guiu X., Vergote I., Cibula D., Mirza M.R., Marnitz S., Ledermann J., Bosse T., Chargari C., Fagotti A., Fotopoulou C., Gonzalez Martin A., Lax S., Lorusso D., Marth C., Morice P., Nout R.A., O’Donnell D., Querleu D., Raspollini M.R., Sehouli J., Sturdza A., Taylor A., Westermann A., Wimberger P., Colombo N., Planchamp F., Creutzberg C.L. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer. 2021; 31(1): 12-39. https://doi.org/10.1136/ijgc-2020-002230.
- Neri M., Peiretti M., Melis G.B., Piras B., Vallerino V., Paoletti A.M., Madeddu C., Scartozzi M., Mais V. Systemic therapy for the treatment of endometrial cancer. Expert Opin Pharmacother. 2019; 20(16): 2019-32. https://doi.org/10.1080/14656566.2019.1654996.
- Kit O.I., Vodolazhskiĭ D.I., Kutilin D.S., Moiseenko T.I., Nikitin I.S., Frantsiyants E.M. Izmenenie ekspressii estrogen-regulyatornykh genov pri malignizatsii tkanei tela matki. Kubanskii nauchnyi meditsinskii vestnik. 2016; (2): 84-90.
- Daniel V.C., Marchionni L., Hierman J.S., Rhodes J.T., Devereux W.L., Rudin C.M., Yung R., Parmigiani G., Dorsch M., Peacock C.D., Watkins D.N. A primary xenograft model of small-cell lung cancer reveals irreversible changes in gene expression imposed by culture in vitro. Cancer Res. 2009; 69(8): 3364-73. https://doi.org/10.1158/0008-5472.CAN-08-4210.
- Tentler J.J., Tan A.C., Weekes C.D., Jimeno A., Leong S., Pitts T.M., Arcaroli J.J., Messersmith W.A., Eckhardt S.G. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 2012; 9(6): 338-50. https://doi.org/10.1038/nrclinonc.2012.61.
- Izumchenko E., Paz K., Ciznadija D., Sloma I., Katz A., Vasquez-Dunddel D., Ben-Zvi I., Stebbing J., McGuire W., Harris W., Maki R., Gaya A., Bedi A., Zacharoulis S., Ravi R., Wexler L.H., Hoque M.O., Rodriguez-Galindo C., Pass H., Peled N., Davies A., Morris R., Hidalgo M., Sidransky D. Patient-derived xenografts effectively capture responses to oncology therapy in a heterogeneous cohort of patients with solid tumors. Ann Oncol. 2017; 28(10): 2595-605. https://doi.org/10.1093/annonc/mdx416.
- Moiola C.P., Lopez-Gil C., Cabrera S., Garcia A., Van Nyen T., Annibali D., Fonnes T., Vidal A., Villanueva A., Matias-Guiu X., Krakstad C., Amant F., Gil-Moreno A., Colas E. Patient-Derived Xenograft Models for Endometrial Cancer Research. Int J Mol Sci. 2018; 19(8): 2431. https://doi.org/10.3390/ijms19082431.
- Guerin M.V., Finisguerra V., van den Eynde B.J., Bercovici N., Trautmann A. Preclinical murine tumor models: a structural and functional perspective. Elife. 2020; 9. https://doi.org/10.7554/eLife.50740.
- Kandir S. Animal Models for Cancer Research: The Choice of the Right Model System. Handbook of Animal Models and its Uses in Cancer Research. Singapore: Springer. 2023. https://doi.org/10.1007/978-981-19-3824-5_3.
- Pobyarzhin V.V., Pashinskaya E.S., Semenov V.M., Goncharov A.E. Metodologicheskie aspekty postanovki onkologicheskikh modelei v usloviyakh eksperimenta. Vestnik VGMU. 2018; 17(6): 32-45. https://doi.org/10.22263/2312-4156.2018.6.32.
- Kadomtsev D.V., Pasechnikova E.A., Golubev V.G. Zoletil-ksilazinovyi narkoz v eksperimentakh u krys. Mezhdunarodnyi zhurnal prikladnykh i fundamental'nykh issledovanii. 2015; (5-1): 56-57.
- Borodin Yu.I., Malygin M.V., Astashov V.V., Marinkin I.O., Larionov P.M., Michurin I.E., Tret'yakova L.V. Sposob modelirovaniya opukholi tela matki dlya issledovaniya ee regionarnogo limfaticheskogo rusla. Patent RF № RU 2220459 C1. Zayavl. 24.06.2002; Opubl. 27.12.2003.
- Kit O.I., Kotieva I.M., Frantsiyants E.M., Kaplieva I.V., Trepitaki L.K., Bandovkina V.A., Neskubina I.V., Surikova E.I., Cheryarina N.D., Pogorelova Yu.A., Nemashkalova L.A. Vliyanie khronicheskoi neiropaticheskoi boli na techenie zlokachestvennogo protsessa melanomy V16/F10 u samtsov myshei. Izvestiya vysshikh uchebnykh zavedenii. Severo-Kavkazskii region. Estestvennye nauki. 2019; 1(201): 106-11.
- Shikhlyarova A.I., Frantsiyants E.M., Nepomnyashchaya E.M., Komarova E.F., Pogorelova Yu.A. Osobennosti strukturnykh izmenenii v legkikh krys-samtsov i samok pri vnutrivennoi perevivke sarkomy-45. Voprosy onkologii. 2010; 56(5): 632-37.
- Frantsiyants E.M., Kaplieva I.V., Bandovkina V.A., Surikova E.I., Neskubina I.V., Trepitaki L.K., Pogorelova Yu.A., Cheryarina N.D., Sheĭko E.A., Kotieva I.M., Shumarin K.A. Modelirovanie pervichno-mnozhestvennykh zlokachestvennykh opukholei v eksperimente. Yuzhno-Rossiiskii onkologicheskii zhurnal. 2022; 3(2): 14-21. https://doi.org/10.37748/2686-9039-2022-3-2-2.
- Onaciu A., Munteanu R., Munteanu V.C., Gulei D., Raduly L., Feder R.I., Pirlog R., Atanasov A.G., Korban S.S., Irimie A., Berindan-Neagoe I. Spontaneous and Induced Animal Models for Cancer Research. Diagnostics (Basel). 2020; 10(9): 660. https://doi.org/10.3390/diagnostics10090660.
- Dvadnenko K.V., Gusev S.A., Fedorenko G.M., Matishov D.G. Ul'trastrukturnye aspekty biologii zlokachestvennogo rosta sarkomy 45. Sibirskii onkologicheskii zhurnal. 2011; 43(1): 25-28.
- Kit O.I., Frantsiyants E.M., Kaplieva I.V., Kotieva I.M., Trepitaki L.K., Neskubina I.V., Bandovkina V.A., Surikova E.I., Ishonina O.G. Sposob modifikatsii razvitiya adenokartsinomy v eksperimente. Patent RF № RU 2743960 C1. Zayavl. 02.07.2020. Opubl. 01.03.2021.
- Zhang W., Fan W., Rachagani S., Zhou Z., Lele S.M., Batra S.K., Garrison J.C. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Sci Rep. 2019; 9(1): 11117. https://doi.org/10.1038/s41598-019-47308-z.
- Vollmer G. Endometrial cancer: experimental models useful for studies on molecular aspects of endometrial cancer and carcinogenesis. Endocr Relat Cancer. 2003; 10(1): 23-42. https://doi.org/10.1677/erc.0.0100023.


