Создание устойчивой к протеолизу пептидной последовательности пищевого рекомбинатного белка GDF-11 и синтез плазмиды для его экспрессии в E. coli
Автор: Валиева Ш. С., Тихонов С. Л., Тихонова Н. В., Тимофеева М. С., Шихалев С. В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биотехнология продуктов питания и биологически активных веществ. Пищевые системы
Статья в выпуске: 2 т.28, 2025 года.
Бесплатный доступ
Белок GDF-11 оказывает положительное воздействие на животных и человека при воспалительных и инфекционных процессах, регенерации и омоложении, его высокая экспрессия наблюдается во многих органах и тканях. Отмечена актуальность проблемы перорального применения многих белков и пептидов, в том числе белка GDF-11, в качестве лекарственных препаратов и в составе продуктов специализированного и функционального назначения. Целью исследований является разработка устойчивой к протеолизу пептидной последовательности белка GDF-11 с виртуальным скринингом ее токсичности, аллергенности, уникальности с последующим синтезом соответствующей плазмиды для экспрессии белка в E. coli. В качестве объектов исследования использовали белок GDF-11, плазмиды pET-25b(+) для экспрессии в E. coli с пептидной последовательностью СTVDСFFEСAFGСWDС. Из олигонуклеотидов методом циклической сборки провели синтез гена белка GDF-11 с последовательностью СTVDСFFEСAFGСWDС. Полученную последовательность плазмиды, кодирующую новый белок GDF-11, обработали эндонуклеазами рестрикции BamHI и XhoI и клонировали в вектор pET-25b(+) для экспрессии E. coli. Клоны отсеквенированы методом Сэнгера. Методом MALDI-TOF MS Ultraflex исследовали распределение и идентификацию праймеров в полученной последовательности. Разработана новая уникальная пептидная последовательность СTVDСFFEСAFGСWDС с циклицизацией по связям С1-С4, С1-С2, С1-С3 белка GDF-11, позволяющая повысить его устойчивость к протеолизу и, соответственно, открывающая возможность перорального применения в составе продуктов питания профилактического назначения. На основании виртуального скрининга установлено, что новая пептидная цепочка СTVDСFFEСAFGСWDС белка GDF-11 не токсична в отношении сердечно-сосудистой и нервной систем, не гепатотоксична, не обладает цитотоксичностью, аллергенностью и характеризуется высоким плазменным клиренсом и средним периодом полувыведения.
Белок, пептидная последовательность, гепатотоксичность, цитотоксичность, аллергенность, протеолиз, protein, peptide sequence, hepatoxicity, cytotoxicity, allergenicity, proteolysis
Короткий адрес: https://sciup.org/142244501
IDR: 142244501 | УДК: 543.645.6 | DOI: 10.21443/1560-9278-2025-28-2-143-150
Текст статьи Создание устойчивой к протеолизу пептидной последовательности пищевого рекомбинатного белка GDF-11 и синтез плазмиды для его экспрессии в E. coli
DOI:
*Уральский государственный аграрный университет, г. Екатеринбург, Россия; e-mail: , ORCID:
Валиева Ш. С. и др. Создание устойчивой к протеолизу пептидной последовательности пищевого рекомбинатного белка GDF-11 и синтез плазмиды для его экспрессии в E. coli. Вестник МГТУ. 2025. Т. 28, № 2. С. 143–150. DOI:
e-mail: , ORCID:
Одним из представителей суперсемейства белков TGF-β является белок GDF-11, известный как фактор роста и дифференцировки – костный морфогенетический белок (BMP-11). Этот белок был открыт в 1999 г. Накасимой и др. ( Nakashima et al., 1999 ). В исследованиях, проведенных Макферроном и др. ( McPherron et al., 1999 ), установлен ген, кодирующий белок. Открытый ген находится в 12 хромосоме (12q13.2). Структура белка GDF-11 включает 136 аминокислот в мономерной форме ( Poggioli et al., 2016 ).
В результате гидролиза молекулы предшественника белка фурином ( Suh et al., 2020 ) образуется зрелая форма белка с нековалентными N-концевыми про- и С-концевыми доменами. За счет дисульфидных и межцепочных мостиков белок GDF-11 является гомодимером с молекулярной массой 32,6 кДа и третичной структурой, которая включает β-лист, цистеиновый узел и α-спираль ( Pepinsky et al., 2017; Padyana et al., 2016 ).
Экспрессируется GDF-11 во многих органах и тканях, в частности, в головном и спинном мозге, кишечнике, селезенке, сердце, крови, скелетной мускулатуре и др. Уровень экспрессии различается в зависимости от типа и происхождения клеток ( Jamaiyar et al., 2017 ). Анализ, проведенный Коузом и др. ( Cox et al., 2019 ), показал высокую экспрессию GDF-11 в костях черепа эмбрионов мышей. Согласно данным, представленным на платформе PeptideAtlas1, высокая экспрессия белка отмечена у взрослого человека в коре головного мозга, надпочечниках и мягких тканях.
Впервые роль GDF-11 как фактора передачи сигналов в клетке при воспалительном процессе, его значение в регенерации и омоложении организма отметили в 1999 г. ( Moses et al., 2016 ). Вместе с тем механизм действия GDF-11 при воспалении в ответной реакции организма на инфекционный процесс, действие токсинов и факторов, повреждающих клетки, полностью не раскрыт. Однако известно, что GDF-11 ослабляет образование воспалительной микросреды путем регуляции высвобождения интерлейкинов, в частности, IL-6, IL-1β, а также снижения накопления активных форм кислорода – H 2 O 2 , NO ( Janakiram et al., 2014; Chen et al., 2018 ).
В эксперименте на лабораторных животных ( Wang et al., 2018 ) установлено, что введение белка в дозе 0,6 мг/кг каждые 2 дня в брюшную полость мышей с экспериментальным колитом снижало потерю веса и клинические симптомы. На гистопрепаратах толстой кишки показано, что GDF-11 ослабляет гистопатологические изменения, в частности, разрушение крипт, потерю бокаловидных клеток, инфильтрацию моноцитов, повреждение слизистой оболочки и некроз, как в контрольной группе мышей без инъекции GDF-11.
Следует отметить, что актуальным остается проблема перорального применения многих белков и пептидов, в том числе белка GDF-11, в качестве лекарственных препаратов и в составе продуктов специализированного и функционального назначения, так как вещества белковой природы, поступая в желудочно-кишечный тракт (ЖКТ), подвергаются протеолитическому гидролизу и их биологическая активность снижается или полностью теряется ( Wang et al., 2022 ).
Повысить устойчивость белков к протеолизу и, соответственно, обеспечить необходимую биодоступность возможно за счет сшивок структуры белка, а именно путем образования дисульфидных мостиков или увеличения их количества ( Qin et al., 2023 ).
Целью исследований является разработка устойчивой к протеолизу пептидной последовательности белка GDF-11 с виртуальным скринингом ее токсичности, аллергенности, уникальности с последующим синтезом соответствующей плазмиды для экспрессии белка в E. coli .
Материалы и методы
В качестве объектов исследования использовали белок GDF-11, плазмиды pET-25b(+) для экспрессии в E. coli с пептидной последовательностью СTVDСFFEСAFGСWDС. Антигенность (аллергенность) пептида оценивали по программе2. Виртуальный скрининг токсичности сшитой пептидной последовательности проводили с помощью платформы Admet ab 33. Уникальность пептидной последовательности определяли на платформе PeptideAtlas4.
Из олигонуклеотидов методом циклической сборки провели синтез гена белка GDF-11 с последовательностью СTVDСFFEСAFGСWDС. Предварительно были синтезированы комплементарные цепи гена олигонуклеотиды, перекрывающиеся участками от 20–30 пар оснований. Для заполнения промежутков между олигонуклеотидами были достроены цепи с использованием ДНК-полимеразы. На последнем этапе сконструированный ген амплифицировался путем стандартной ПЦР. Полученную последовательность плазмиды, кодирующую новый белок GDF-11, обработали эндонуклеазами рестрикции
BamHI и XhoI и клонировали в вектор pET-25b(+) для экспрессии E. coli . Клоны были отсеквенированы методом Сэнгера.
Методом MALDI-TOF MS Ultraflex (Bruker, Германия) исследовали распределение и идентификацию праймеров в полученной последовательности ( Webster et al., 2012 ).
Результаты исследований
Белок GDF-11 характеризуется вогнутой с одной стороны и выгнутой с другой стороны формой (пропеллеобразная), что позволяет ему связываться с рецепторами клеток-мишеней ( Walker et al., 2016 ). Хотя в целом исследуемый белок GDF-11 имеет третичную структуру и дисульфидные связи, повышающие его стабильность к протеолизу, но в его состав входят мономеры, которые не сшиты, т. е. не имеют дисульфидных связей, в частности, TVDFFEAFGWD. Для усиления его структуры нами проведено исследование по сшиванию мономера TVDFFEAFGWD и получения следующей пептидной цепочки: СTVDСFFEСAFGСWDС с циклицизацией по связям С1-С4, С1-С2, С1-С3. Спроектированная последовательность имеет структурную формулу, представленную на рис. 1.
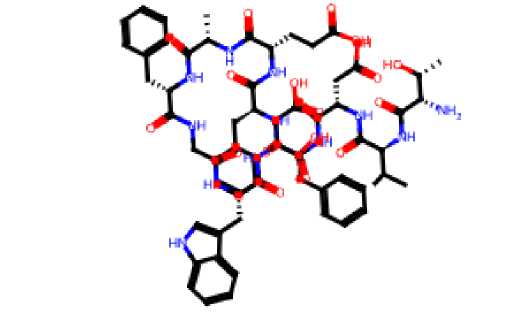
Рис. 1. Структурная формула последовательности СTVDСFFEСAFGСWDС Fig. 1. Structural formula of the sequence СTVDСFFEСAFGСWDС
Но прежде чем создать белок GDF-11 c новой сшитой последовательностью аминокислот, проведена оценка ее токсичности и антигенности.
Результаты исследований токсичности последовательности СTVDСFFEСAFGСWDС представлены в табл. 1.
Таблица 1. Результаты прогнозирования токсичности последовательности
СTVDСFFEСAFGСWDС на платформе ADMETl ab 3
Table 1. Results of toxicity prediction of the sequence
CTVDСFFECAFGСWDС on the ADMETl ab 3 platform
|
Показатель токсичности |
Прогноз |
Обсуждение |
|
hERG-блокаторы, ед. |
0 |
При значении показателя от 0 до 0,3 ед. пептид не является hERG-блокатором |
|
DILI, ед. |
0,035 |
При значении показателя от 0 до 0,3 ед. пептид не гепатотоксичен |
|
Острая токсичность для перорального применения у крыс, ед. |
0,056 |
При значении показателя от 0 до 0,3 ед. пептид не обладает острой токсичностью (> 500 мг/кг) при пероральном применении |
|
Медикаментозная нейротоксичность, ед. |
0,098 |
При значении показателя от 0 до 0,3 ед. пептид не нейротоксичен |
|
Цитотоксичность Hek293, ед. |
0 |
При значении показателя от 0 до 0,3 ед. пептид не цитотоксичен в отношении клеток Hek293 |
|
CL плазма, мл/мин/кг |
0,448 |
При значении показателя от 0 до 5 мл/мин/кг пептид имеет высокий плазменный клиренс |
|
T1/2, ч |
4,206 |
При значении показателя от 4 до 8 ч пептид имеет средний период полувыведения |
Важным исследованием в определении токсичности новых биологически активных веществ является прогнозирование возможности блокировать канал hERG, представляющий собой зависящий от напряжения K+ (Kv) канал, регулирующий сокращение миокарда. Канал hERG играет важную роль в реполяризации потенциала сердечного действия. В сердце каналы hERG открываются во время фазы деполяризации потенциала сердечного действия с последующей быстрой инактивацией. По мере реполяризации мембраны каналы hERG быстро восстанавливаются из инактивированного состояния и поддерживают интервал QT, который представляет собой интервал между началом сокращения желудочка и его полным расслаблением. Блокада канала hERG увеличивает продолжительность сокращения желудочков и задерживает реполяризацию, что приводит к удлинению интервала QT и повышенному риску возникновения смертельной аритмии (Vandenberg et al., 2012). Установлено, что пептидная последовательность СTVDСFFEСAFGСWDС не блокирует канал hERG.
Некоторые препараты вызывают поражение печени, в 32 % случаев это является причиной отзыва лекарств с рынка ( Watkins et al., 2011 ). Такие препараты называют DILI положительными. Гепатотоксичность, как правило, не выявляется до начала клинических испытаний, что создает повышенный риск для добровольцев – участников клинических испытаний. Установлено, что пептидная последовательность СTVDСFFEСAFGСWDС является DILI отрицательной и не вызывает поражение печени.
При прогнозировании острой токсичности на крысах при пероральном применении установлено, что последовательность СTVDСFFEСAFGСWDС не токсична.
Различные исследования показали, что некоторые лекарственные препараты вызывают нейротоксические эффекты и уменьшают объем серого вещества головного мозга ( Vita et al., 2015 ). В результате прогнозирования нейротоксичности последовательности СTVDСFFEСAFGСWDС установлено, что она не вызывает отклонения в деятельности центральной и периферической нервных систем.
Исследуемая аминокислотная последовательность не токсична в отношении клеток эмбрионов почек человека.
Следует отметить, что последовательность аминокислот СTVDСFFEСAFGСWDС характеризуется высоким плазменным клиренсом (CL плазма ), что важно для сохранения стабильности белка GDF-11 в организме при пероральном применении.
Одним из значимых показателей белков считается период полувыведения (T1/2), в основном у пептидов он составляет менее 1 ч. У исследуемой пептидной последовательности T1/2 равен 4,206 ч, что характеризует ее как пептид со средним периодом полувыведения.
Таким образом, спроектированная пептидная последовательность СTVDСFFEСAFGСWDС не обладает токсичностью в отношении сердца, печени, нервной системы, клеток эмбрионов и характеризуется высокой стабильностью в организме человека, что позволяет ее вводить в белок GDF-11 для обеспечения его устойчивости к протеолизу.
Не менее важно, что новое вещество наряду с отсутствием токсичности не должно быть антигенным / аллергенным. Результаты прогнозирования антигенных свойств последовательности СTVDСFFEСAFGСWDС представлены на рис. 2.
ПРОГНОЗИРУЕМЫЕ АНТИГЕННЫЕ ПЕПТИДЫ
Results
Ваша последовательность состоит из 11 остатков
Средняя антигенная активность этого белка составляет 0,9981
Антигенный график последовательности
АС: (11 bases)
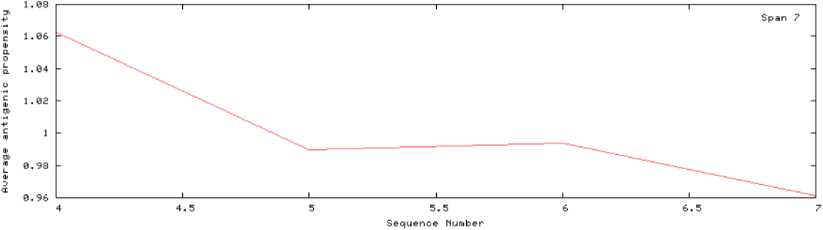
sun ее oct гэ24 at 17149
В вашей последовательности 0 антигенных детерминант:
Рис. 2. Прогнозирование антигенных свойств последовательности СTVDСFFEСAFGСWDС
Fig. 2. Prediction of antigenic properties of the sequence CTVDСFFECAFGСWDС
Пептидная последовательность СTVDСFFEСAFGСWDС не содержит антигенных детерминант и, соответственно, введение ее в белок GDF-11 не делает его аллергенным.
На рис. 3 представлены результаты идентификации пептидной последовательности СTVDСFFEСAFGСWDС на платформе PeptideAtlas.

D|WaD|FFEB|AFGBjWDBi | | QUERY |
Тип сборки: I Human Я ° Tmme Еовпадонио
О Результаты в таблице
® Расширенный поиск
(например. ENSP00000238647.3, IPI00807403, NP_001366. Hs.232375, RBP RBP4, хеликаза, Р06634 МССС2; РАр00000097, AAVEEGIVLGGGCALLR )
В индексе для вашей поисковой строки не было найдено совпадений
Рис. 3. Результаты идентификации пептидной последовательности СTVDСFFEСAFGСWDС на платформе PeptideAtlas Fig. 3. Results of identification of the peptide sequence CTVDСFFECAFGСWDС on the PeptideAtlas platform
Согласно результатов поиска на платформе PeptideAtlas спроектированная пептидная последовательность СTVDСFFEСAFGСWDС уникальна.
Для синтеза белка GDF-11 с новой пептидной последовательностью синтезирован вектор pET-25b(+)_GDF-11. Праймер для синтеза генов белка GDF-11 с заданной пептидной последовательностью представлен в табл. 2.
На рис. 4 представлена хроматограмма праймера GDF Т7 F.
Рис. 4. Хроматограмма праймера GDF Т7 F
Fig. 4. Chromatogram of primer GDF T7 F
Таблица 2. Праймер для синтеза генов белка GDF-11 с заданной пептидной последовательностью Table 2. Primer for the synthesis of GDF-11 protein genes with a given peptide sequence
|
Название праймера |
Последовательность праймера, 5’–3’ |
|
GDF Т7 F |
GCTCTGGCCAGTGCGAGTACATGTTTATGCAGAAATATCCGCACACCCATTTAG |
Хроматограмма праймера GDF Т7 F включает следующую последовательность аминокислот: AGCAAGTCAGCTTCTTTCGGGCTTTGTTAGCAGCCGGATCTCAGTGGTGGTGGTGGTGGTGCTCGA CATCCTCGGGGTCTTCCGGGGCGAGTTCTGGCTGGCTAGCCCGTTTGATCTCGAGACTACATCCGCA TCGATCAACCACCATCCCTGGGATCTTACCATAAATAATCTGTTGTTTGTCATTAAAGTACAGCATG TTAATGGGCGACATCTTGGTAGGTGTGCAGCACGGGCCCGCGCTACAGCGCGGATTGGCCTGCTGT CTAAATGGGTGTGCGGATATTTCTGCATAAACATGTACTCGCACTGGCCAGAGCAATAGTTTGCTTT GTAACGGCGCGGAGCAATGATCCAATCCCAGCCGAACGCTTCGAAATCGACCGTCAGCGGATAAC GACAACAGCGGCTTTCTGAGGAATGTTCATCGCAGTCAAGACCCAAGTTTGGATCCGAATTAATTC CGATATCCATGGCCATCGCCGGCTGGGCAGCGAGGAGCAGCAGACCAGCAGCAGCGGTCGGCAGC AGGTATTTCATATGTATATCTCCTTCTTAAAGTTAAACAAAATTATTTCTAGAGGGGAATTGTTATC CGCTCACAATTCCCCTATAGTGAGTCCGTATTACAA.
Заключение
Создана новая уникальная пептидная последовательность СTVDСFFEСAFGСWDС с циклицизацией по связям С1-С4, С1-С2, С1-С3 белка GDF-11, что позволит повысить его устойчивость к протеолизу и, соответственно, даст возможность перорального применения в составе продуктов питания профилактического назначения. На основании виртуального скрининга установлено, что новая пептидная цепочка СTVDСFFEСAFGСWDС белка GDF-11 не токсична в отношении сердечно-сосудистой и нервной систем, не гепатотоксична, не обладает цитотоксичностью, аллергенностью и характеризуется высоким плазменным клиренсом и средним периодом полувыведения. Полученные данные позволяют ее использовать для рекомбинации белка GDF-11. Вместе с тем согласно Федеральному закону от 3 июля 2016 г.5 № 358-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в части совершенствования государственного регулирования в области генно-инженерной деятельности" производство генно-модифицированных объектов для пищевых целей запрещено, но научные исследования, направленные на создания новых биологически активных рекомбинантных белков, приветствуются в молекулярной биотехнологии.
Полученные данные позволяют расширить новое направление в молекулярной биотехнологии по созданию принципиально новых пищевых ингредиентов с заданной активностью к клеткам-мишеням.


