Спектр соматических мутаций при забрюшинной неорганной лейомиосаркоме: клинический случай и обзор литературы
Автор: Бугав Владислав Евгеньевич, Никулин Максим Петрович, Головина Дарья Андреевна, Сафронова Вера Михайловна, Неред Сергей Николаевич, Любченко Людмила Николаевна, Стилиди Иван Сократович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Забрюшинные неорганные лейомиосаркомы являются высокоагрессивными опухолями и характеризуются неблагоприятным прогнозом, обусловленным низкой чувствительностью к химиотерапии. В настоящее время проводится поиск новых мишеней для лекарственного воздействия. В данной статье мы приводим клинический случай забрюшинной неорганной лейомиосаркомы с агрессивным течением, при которой был выявлен ряд ранее не описанных в литературе активирующих мутаций в генах, играющих важную роль в регуляции клеточной пролиферации. Больной в возрасте 61 года обратился в нашу клинику с жалобами на эпизодические боли в животе, повышение температуры тела. При обследовании был выявлен забрюшинно расположенный многоузловой опухолевый конгломерат, размерами 12*10 см. Пациенту было выполнено радикальное (R0) оперативное вмешательство в объёме удаления забрюшинной опухоли, левосторонней гемиколэктомии, нефрэктомии и адреналэктомии слева, дисталь-ной субтотальной резекции поджелудочной железы. По данным патоморфологического исследования операционного материала опухоль соответствовала лейомиосаркоме III степени злокачественности (по системе FNCLCC). В послеоперационном периоде адъювантная химиотерапия не проводилась. В ранние сроки после операции (безрецидивный период - 3 мес) отмечено прогрессирование заболевания в виде локального рецидива опухоли и появления метастазов в лёгких, проводилась симптоматическая терапия. Спустя 6 мес после операции пациент скончался от прогрессирования заболевания. При иммуногистохимическом исследовании было выявлено, что в опухоли определяется экспрессия PD-L1, уровень которой составил 30 %. Молекулярно-генетическое профилирование позволило выявить ряд соматических мутаций в генах PIK3CA, EGFR, ERBB2, PDGFRA, а также подтвердить стабильную систему репарации (MSS). Изучение мутационного профиля лейомиосарком представляет большой интерес, поскольку это может позволить определить новые механизмы лекарственного воздействия и улучшить результаты лечения.
Лейомиосаркома, мутационный профиль, таргетная терапия
Короткий адрес: https://sciup.org/140254363
IDR: 140254363 | УДК: 616.381-006.363-092.18 | DOI: 10.21294/1814-4861-2020-19-4-152-159
Текст научной статьи Спектр соматических мутаций при забрюшинной неорганной лейомиосаркоме: клинический случай и обзор литературы
Лейомиосаркомы (ЛМС) характеризуются значительной молекулярно-генетической гетерогенностью [1–3]. Результаты лечения забрюшинных неорганных лейомиосарком остаются неудовлетворительными: частота отдалённых метастазов через 5 лет после лечения составляет 50–60 % [4], 5-летняя безрецидивная выживаемость – 20–69 % [5], что диктует необходимость поиска новых методов лекарственного воздействия, в т.ч. применения таргетной терапии. Сигнальный путь PI3K/AKT/mTOR играет важную роль в развитии лейомиосарком [6]. Инактивация данного пути может рассматриваться как потенциальное звено противоопухолевой терапии при забрюшинных ЛМС. Ранее было показано, что комбинированное использование ингибиторов EGFR с химиотерапевтическими препаратами обладает выраженной противоопухолевой активностью как in vitro, так и in vivo [7]. В преклинических исследованиях [8], в которых на клеточных линиях лейомиосарком исследовалась эффективность комбинированных ингибиторов PI3K/mTOR, было показано, что использование комбинации ингибиторов PI3K/ mTOR с ингибиторами МЕК позволяет усилить противоопухолевый эффект и снизить лекарственную резистентность лейомиосарком. В данной статье мы приводим клинический случай пациента с забрюшинной неорганной лейомиосаркомой, у которого были выявлены соматические мутации, ранее не описанные при лейомиосаркомах, и представляем обзорную информацию о функциональном значении данных мутаций при опухолях других локализаций.
Описание случая
Больной А., 61 год, обратился в НМИЦ онкологии им. Н.Н. Блохина в декабре 2017 г. с жалобами на эпизодические боли в животе, повышение температуры тела до 38,5 ºС. При обследовании выявлен забрюшинно опухолевый конгломерат размером до 12×10 см, располагающийся слева от аорты в проекции нижнего края левого надпочечника, между хвостом поджелудочной железы, нисходящей ободочной кишкой, воротами левой почки и поясничной мышцей (рис. 1).
На предоперационном этапе пациенту выполнена core-биопсия образования, по данным которой диагностирована дедифференцированная липосаркома высокой степени злокачественности.
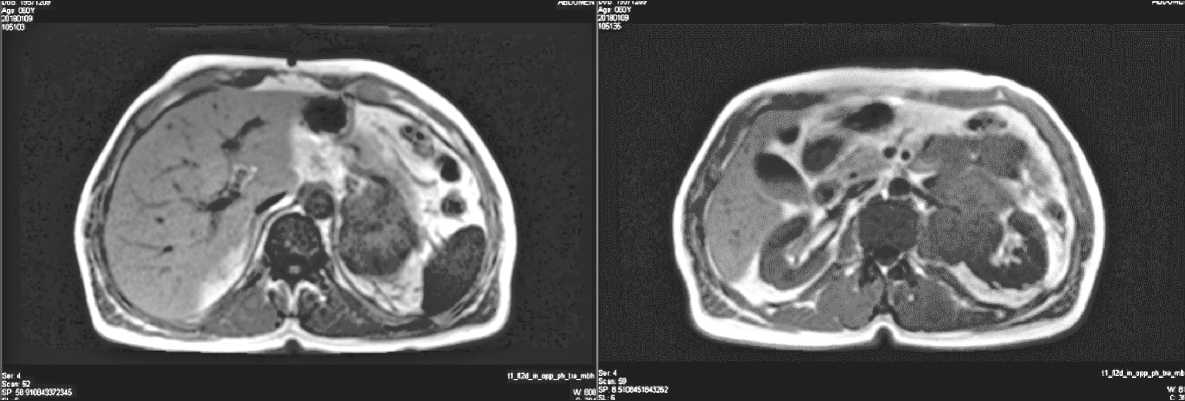
Рис. 1. Данные предоперационной компьютерной томографии.
Забрюшинная многоузловая опухоль, размерами 12×10 см
Fig. 1. Pre-surgical CT shows retroperitoneal tumor measuring 12×10 сm
23.01.18 выполнено радикальное оперативное вмешательство (R0) в объёме удаления забрюшинной опухоли, левосторонней гемиколэктомии, нефрэктомии и адреналэктомии слева, дистальной субтотальной резекции поджелудочной железы. Послеоперационный период осложнился развитием наружного панкреатического свища (grade B по классификации ISGPF). По данным патоморфоло-гического исследования операционного материала опухоль соответствовала лейомиосаркоме III степени злокачественности (по системе FNCLCC).
Адъювантная химиотерапия не проводилась.
В ранние сроки после операции (безрецидивный период – 3 мес) отмечено прогрессирование заболевания в виде локального рецидива опухоли и появления метастазов в лёгких, проводилась симптоматическая терапия. Спустя 6 мес после операции пациент скончался от прогрессирования заболевания.
На образцах опухолевой ткани, фиксированной в формалине и заключённой в парафине (FFPE), проведено иммуногистохимическое исследование уровня экспрессии PD-L1 и полимеразно-цепная реакция для определения микросателлитной неста- бильности. Уровень экспрессии PD-L1 составил 30 % (рис. 2). Опухолевая ткань характеризовалась стабильной системой репарации неспаренных оснований (microsatellite stable, MSS).
Молекулярно-генетическое тестирование проводилось методом высокопроизводительного секвенирования (NGS) с использованием коммерческой панели для целевого обогащения генов GeneReader Actionable Insights Tumor Panel (GRTP – 101X) на платформе QCI Analyser version 1.1 (Qiagen). При молекулярном профилировании был выявлен ряд мутаций в генах PIK3CA, ALK, EGFR, ERBB,ESR1, PDGFRA, играющих важную роль в регуляции клеточной пролиферации, апоптоза и трансформации (таблица).
Обсуждение
Интересной, на наш взгляд, является находка соматической мутации c.3104C>T в гене PIK3CA, которая зарегистрирована в международной базе данных COSMIC как клинически значимый вариант, ассоциированный с чувствительностью к таргетной терапии ингибиторами mTOR [9]. Миссенс-мутация p.A1035V в гене PIK3CA встре-
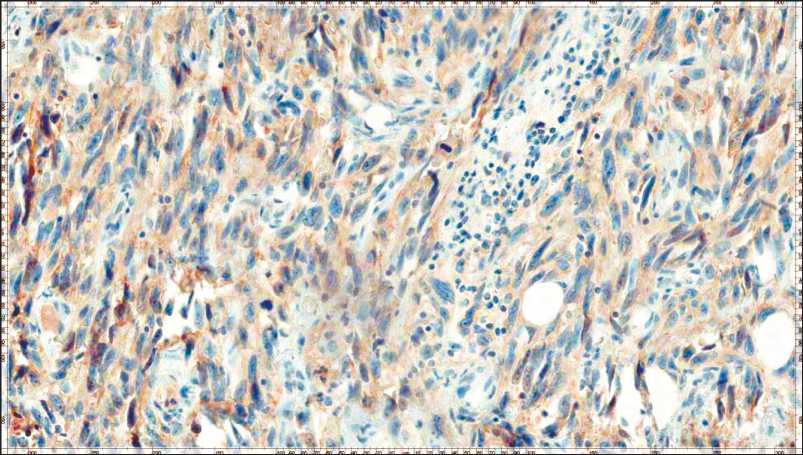
Рис. 2. Микрофото. Лейомиосаркома высокой степени злокачественности (G3), определяется экспрессия PD-L1 в 30 % окрашенных клеток. Интенсивность окраски 1+. Внутренний контроль положительный. Экспрессия PD-L1 в иммунных клетках – 0 %. ×200
Fig. 2. Microphoto. High-grade leiomyosarcoma (G3), PD-L1 expression in 30 % of stained cells. Staining intensity 1+. The internal control is positive. PD-L1 expression on immune cells is 0 %. ×200
таблица/table
Характеристики вывяленных мутаций
Characteristics of identified mutations
Выявленная нами мутация p.R521K (rs2227983) в гене EGFR была описана у больных колоректальным раком (КРР), немелкоклеточным раком лёгкого и глиобластомой [14] и считается фактором благоприятного прогноза. Частота её встречаемости – 29–50 % [15]. У больных с колоректальным раком такой вариант полиморфизма гена связан с более высокими показателями выживаемости при КРР II–III стадии после радикальной операции и более высокой частотой ответа на химиотерапию оксалиплатином [16], а также более низкой частотой локальных рецидивов у больных раком прямой кишки, получивших химиолучевую терапию [17]. Также было показано, что у больных с КРР наличие мутации R521K гена EGFR коррелирует с более высокой частотой ответа на таргетную терапию цетуксимабом и более высокими показателями выживаемости без прогрессирования (р=0,001) и общей выживаемости (р=0,001) [18]. У больных раком молочной железы с наличием мутантного аллеля R521K отмечены низкая частота лимфо- генного метастазирования и тенденция к более благоприятной гистологической дифференцировке опухоли [19].
Мутация p.D994D (rs2293347) в гене EGFR была описана у больных немелкоклеточным раком лёгкого, гепатоцеллюлярным раком, раком мочевого пузыря и раком молочной железы. Частота её встречаемости варьирует в пределах 14–32 % [20]. Наличие мутации p.D994D (rs2293347 GG) в гене EGFR у больных немелкоклеточным раком лёгкого ассоциировано с более высокой частотой ответа на терапию ингибитором EGFR гефитинибом (71,2 % vs 37,5 %, p=0,0043), а также более высокой медианой выживаемости без прогрессирования (11 vs 3 мес, p=0,0018). В других исследованиях было показано, что больные с генотипом rs2293347AA или rs2293347GA, получающие гефитиниб, имели гораздо меньшую медиану общей выживаемости по сравнению с генотипом rs2293347GG (AA vs GG: 2,0 vs 21,0 мес; р=0,036; GA vs GG: 15,0 vs 21,0 мес, р=0,025) [21]. У больных гепатоцеллюлярным раком в исследовании W. Wang et al. [22] не выявлено значимой корреляции между наличием мутации p.D994D (rs2293347) и показателями общей выживаемости и выживаемости без прогрессирования. У больных HER2-положительным раком молочной железы, получающих терапию трастузумабом, было выявлено, что мутация D994D в гене EGFR ассоциирована с более высокими показателями общей выживаемости, что было подтверждено при многофакторном анализе (ОР=3,46, 95 % ДИ=1,10–10,90; p=0,02) [23]. В литературе мы не встретили исследований, в которых у больных с лейомиосаркомой были бы описаны варианты мутаций p.D994D и p.R521K в гене EGFR, тогда как в работе P.J. Lee et al. [24] у больных с лейомиосаркомой были описаны мутации гена EGFR – p.A501T, p.E257K и p.L675V. Влияние данных мутаций на выживаемость или чувствительность к таргетной терапии не оценивалось.
Мутация p.I655V (rs1136201) в гене ERBB2 влияет на функцию трансмембранного домена рецептора HER2/neu [25] и внутриклеточную передачу сигнала [26] путём стабилизации димеризации рецептора, что в итоге приводит к его активации и онкогенной трансформации клетки [27]. Частота её встречаемости – 4,9–32 % [28] – не различается между азиатской и европейской популяциями [23]. Описаны случаи выявления данной мутации у больных раком молочной железы [29], колоректальным раком [30], рабдомиосаркомой [31], гемангиобластомой [32]. У больных раком молочной железы, получающих терапию трастузумабом, наличие мутации I655V с гомозиготным генотипом GG было связано со статистически значимым ухудшением безрецидивной выживаемости (ОР=1,79, 95 % ДИ=1,00–3,19; р=0,78) и общей выживаемости (ОР=0,87, 95 % ДИ=0,29–2,57; р=0,95) [23]. Также было выявлено, что мутация I655V в гене ERBB2 является фактором риска развития кардиотоксичности при терапии трастузумабом [29].
Миссенс-мутация p.P1170A (rs1058808) в гене ERBB2 встречается у больных раком молочной железы [29]. В популяции белых женщин в Великобритании у больных раком молочной железы мутация p.P1170A выявлялась в 33 % случаев, что не отличалось от частоты мутации в общей популяции [29]. Помимо этого в базе данных COSMIC зарегистрированы единичные случаи выявления данной мутации у больных колоректальным раком, раком пищевода и холангиокарциномой [33]. Наличие полиморфизма rs1058808 в китайской популяции связано с двукратным увеличением риска развития остеосаркомы (р=0,02) [34]. У больных раком молочной железы наличие данной мутации приводит к статистически значимому повышению риска развития кардиотоксичности от трастузумаба в 2,6 раза (р=0,04) [28], однако молекулярные причины данной склонности не ясны. Аминокислота, кодируемая кодоном 1170, располагается в цитоплазматическом домене рецептора HER2-neu, не имеющего отношения к домену связывания с ли- гандом, т.е. с трастузумабом [35], и считается, что такая мутация не приводит к изменению варианта кодируемого белка [36]. У больных раком молочной железы, получающих трастузумаб, наличие мутации P1170A не влияло статистически значимо на показатели безрецидивной выживаемости (ОР=0,68, 95 % ДИ=0,23–1,95; р=0,78) и общей выживаемости (ОР=0,87, 95 % ДИ=0,29–2,57; р=0,95) [23]. Случаи выявления мутаций P1170A и I655V в гене ERBB2 среди больных с лейомиосаркомой не были зарегистрированы.
Мутация p.P567P (rs1873778) в гене PDGFRA была описана у больных аденосквамозным [37] и плоскоклеточным раком шейки матки [38], колоректальным раком [39], острым миелобласт-ным лейкозом [40], нейроэндокринной опухолью поджелудочной железы [41], глиобластомой [42]. В последнем исследовании не было выявлено связи между наличием мутации и экспрессией PDGFRα. Частота встречаемости мутации p.P567P (rs1873778) – 4–19 % [43]. В большинстве исследований она встречалась в гомозиготном варианте [39]. Такая мутация является сайлент-мутацией, не изменяющей кодируемой аминокислоты. Данная мутация не была ранее описана у больных с лейомиосаркомой.
Таким образом, выявленная мутация p.A1035V в гене PIK3CA является клинически значимой мутацией у больных с лейомиосаркомами. Мутации в гене EGFR при опухолях других локализаций являются фактором чувствительности к проведению таргетной терапии. Мутация в гене PDGFRA и мутация p.P1170A в гене ERBB2 не влияют значимо на прогноз заболевания, а мутация p.I655V в гене ERBB2 является фактором негативного прогноза у больных раком молочной железы. Молекулярногенетические основы раннего прогрессирования заболевания в данном случае, помимо низкой дифференцировки опухоли, могут быть связаны с наличием положительной экспрессии PD-L1, а также наличием мутации p.I655V в гене ERBB2, при этом выявление мутаций, являющихся предикторами чувствительности к таргетной терапии, повышает актуальность комплексного исследования мутационного профиля ЛМС.
Список литературы Спектр соматических мутаций при забрюшинной неорганной лейомиосаркоме: клинический случай и обзор литературы
- Yang J., Du X., Chen K., Ylipää A., Lazar A.J., Trent J., Lev D., Pollock R., Hao X., Hunt K., Zhang W. Genetic aberrations in soft tissue leiomyosarcoma. Cancer Lett. 2009 Mar 8; 275(1): 1-8. doi: 10.1016/j. canlet.2008.06.013.
- Larramendy M.L., Kaur S., Svarvar C., Böhling T., Knuutila S. Gene copy number profiling of soft-tissue leiomyosarcomas by array-comparative genomic hybridization. Cancer Genet Cytogenet. 2006 Sep; 169(2): 94-101. doi: 10.1016/j.cancergencyto.2006.01.008.
- Guillou L., Aurias A. Soft tissue sarcomas with complex genomic profiles. Virchows Arch. 2010 Feb; 456(2): 201-17. doi: 10.1007/s00428-009-0853-4.
- GronchiA., StraussD.C., MiceliR., Bonvalot S., Swallow C.J., Hohenberger P., Van Coevorden F., Rutkowski P., Callegaro D., Hayes A.J., Honoré C., Fairweather M., Cannell A., Jakob J., Haas R.L., Szacht M., Fiore M., Casali P.G., Pollock R.E., Raut C.P. Variability in Patterns of Recurrence After Resection of Primary Retroperitoneal Sarcoma (RPS): A Report on 1007 Patients From the Multi-institutional Collaborative RPS Working Group. Ann Surg. 2016 May; 263(5): 1002-9. doi: 10.1097/ SLA.0000000000001447.
- Toulmonde M., Bonvalot S., Méeus P., Stoeckle E., Riou O., Isam-bertN., Bompas E., JafariM., Delcambre-Lair C., SaadaE., Le Cesne A., Le Péchoux C., Blay J.Y., Piperno-Neumann S., Chevreau C., Bay J.O., Brouste V., Terrier P., Ranchère-Vince D., Neuville A., Italiano A.; French Sarcoma Group. Retroperitoneal sarcomas: patterns of care at diagnosis, prognostic factors and focus on main histological subtypes: a multicenter analysis ofthe French Sarcoma Group. Ann Oncol. 2014; 25(3): 735-742. doi: 10.1093/annonc/mdt577.
- Hernando E., Charytonowicz E., Dudas M.E., Menendez S., Matushansky I., Mills J., Socci N.D., Behrendt N., Ma L., Maki R.G., PandolfiP.P., Cordon-Cardo C. The AKT-mTOR pathway plays a critical role in the development of leiomyosarcomas. Nat Med. 2007 Jun; 13(6): 748-53. doi: 10.1038/nm1560.
- Ren W., Korchin B., Zhu Q.S., Wei C., Dicker A., Heymach J., Lazar A., Pollock R.E., Lev D. Epidermal growth factor receptor blockade in combination with conventional chemotherapy inhibits soft tissue sarcoma cell growth in vitro and in vivo. Clin Cancer Res. 2008 May 1; 14(9): 2785-95. doi: 10.1158/1078-0432.CCR-07-4471.
- Fourneaux B., Chaire V., Lucchesi C., Karanian M., Pineau R., Laroche-Clary A., Italiano A. Dual inhibition of the PI3K/AKT/mTOR pathway suppresses the growth of leiomyosarcomas but leads to ERK activation through mTORC2: biological and clinical implications. Oncotarget. 2017; 8(5): 7878-90. doi: 10.18632/oncotarget.13987.
- Mohseni M., ParkB.H. PIK3CA and KRAS mutations predict for response to everolimus therapy: now that's RAD001. J Clin Invest. 2010 Aug; 120(8): 2655-8. doi: 10.1172/JCI44026.
- Alvarez K., Orellana P., Villarroel C., Contreras L., Kawachi H., KobayashiM., Wielandt A.M., De laFuenteM., Trivino J.C., Kronberg U., Carvallo P., Lopez-Köstner F. EGFR pathway subgroups in Chilean colorectal cancer patients, detected by mutational and expression profiles, associated to different clinicopathological features. Tumour Biol. 2017 Sep; 39(9): 1010428317724517. doi: 10.1177/1010428317724517.
- Peterson L.M., Kipp B.R., Halling K.C., Kerr S.E., Smith D.I., Distad T.J., Clayton A.C., Medeiros F. Molecular characterization of endome-trial cancer: a correlative study assessing microsatellite instability, MLH1 hypermethylation, DNA mismatch repair protein expression, and PTEN, PIK3CA, KRAS, and BRAF mutation analysis. Int J Gynecol Pathol. 2012 May; 31(3): 195-205. doi: 10.1097/PGP.0b013e318231fc51.
- Hohensee I., Lamszus K., Riethdorf S., Meyer-Staeckling S., GlatzelM., Matschke J., WitzelI., WestphalM., Brandt B.,Müller V., PantelK., Wikman H. Frequent genetic alterations in EGFR- and HER2-driven pathways in breast cancer brain metastases. Am J Pathol. 2013 Jul; 183(1): 83-95. doi: 10.1016/j.ajpath.2013.03.023.
- Abubaker J., BaviP., Al-HarbiS., IbrahimM., Siraj A.K., Al-SaneaN., Abduljabbar A., Ashari L.H., Alhomoud S., Al-Dayel F., Uddin S., Al-Kuraya K.S. Clinicopathological analysis of colorectal cancers with PIK3CA mutations in Middle Eastern population. Oncogene. 2008 Jun 5; 27(25): 3539-45. doi: 10.1038/sj.onc.1211013.
- LassmanA.B., RossiM.R., Raizer J.J., AbreyL.E., LiebermanF.S., Grefe C.N., Lamborn K., Pao W., Shih A.H., Kuhn J.G., Wilson R., Nowak N.J., Cowell J.K., DeAngelis L.M., Wen P., Gilbert M.R., Chang S., Yung W.A., Prados M., Holland E.C. Molecular study of malignant gliomas treated with epidermal growth factor receptor inhibitors: tissue analysis from North American Brain Tumor Consortium Trials 01-03 and 00-01. Clin Cancer Res. 2005 Nov 1; 11(21): 7841-50. doi: 10.1158/1078-0432. CCR-05-0421.
- rs2227983 (SNP) - Explore this variant - Homo sapiens -Ensembl genome browser 96 [Internet]. URL: https://www.en-sembl.org/Homo_sapiens/Variation/Explore?r=7:5 516106255 162062;v=rs2227983;vdb=variation;vf=415993233 (cited 23.04.2019).
- Wang W.S., Chen P.M., Chiou T.J., Liu J.H., Lin J.K., Lin T.C., Wang H.S., Su Y. Epidermal growth factor receptor R497K polymorphism is a favorable prognostic factor for patients with colorectal carcinoma. Clin Cancer Res. 2007 Jun 15; 13(12): 3597-604. doi: 10.1158/1078-0432. CCR-06-2601.
- Zhang W., Park D.J., Lu B., Yang D.Y., Gordon M., Groshen S., Yun J., Press O.A., VallbohmerD., RhodesK., LenzH.J. Epidermal growth factor receptor gene polymorphisms predict pelvic recurrence in patients with rectal cancer treated with chemoradiation. Clin Cancer Res. 2005 Jan 15; 11(2 Pt 1): 600-5.
- Hsieh Y.Y., Tzeng C.H., Chen M.H., Chen P.M., Wang W.S. Epidermal growth factor receptor R521K polymorphism shows favorable outcomes in KRAS wild-type colorectal cancer patients treated with cetuximab-based chemotherapy. Cancer Sci. 2012 Apr; 103(4): 791-6. doi: 10.1111/j.1349-7006.2012.02225.x.
- KallelI., RebaiM., KhabirA., FaridN.R., Rebai A. Genetic polymorphisms in the EGFR (R521K) and estrogen receptor (T594T) genes, EGFR and ErbB-2 protein expression, and breast cancer risk in Tunisia. J Biomed Biotechnol. 2009; 2009: 753683. doi: 10.1155/2009/753683.
- rs2293347 (SNP) - Explore this variant - Homo sapiens -Ensembl genome browser 96 [Internet]. URL: https://www.en-sembl.org/Homo_sapiens/Variation/Explore?r=7:5 5200723-55201723;v=rs2293347;vdb=variation;vf=415996799 (cited 23.04.2019).
- Zhang L., Yuan X., Chen Y., Du X.J., Yu S., Yang M. Role of EGFR SNPs in survival of advanced lung adenocarcinoma patients treated with Gefitinib. Gene. 2013 Mar 15; 517(1): 60-4. doi: 10.1016/j. gene.2012.12.087.
- Wang W., Ma X.P., Shi Z., Zhang P., Ding D.L., Huang H.X., Saiyin H.G., Chen T.Y., Lu P.X., Wang N.J., Yu H., Sun J., Zheng S.L., Yu L., Xu J., Jiang D.K. Epidermal growth factor receptor pathway polymorphisms and the prognosis of hepatocellular carcinoma. Am J Cancer Res. 2014 Dec 15; 5(1): 396-410.
- Toomey S., Madden S.F., Furney S.J., Fan Y., McCormack M., Stapleton C., CremonaM., Cavalleri G.L., MilewskaM., ElsterN., Carr A., Fay J., Kay E.W., Kennedy S., Crown J., Gallagher W.M., Hennessy B.T., Eustace A.J. The impact of ERBB-family germline single nucleotide polymorphisms on survival response to adjuvant trastuzumab treatment in HER2-positive breast cancer. Oncotarget. 2016 Nov; 7(46): 75518-525. doi: 10.18632/oncotarget.12782.
- Lee P.J., Yoo N.S., Hagemann I.S., Pfeifer J.D., Cottrell C.E., Abel H.J., Duncavage E.J. Spectrum of mutations in leiomyosarcomas identified by clinical targeted next-generation sequencing. Exp Mol Pathol. 2017 Feb; 102(1): 156-161. doi: 10.1016/j.yexmp.2017.01.012.
- BocharovE.V., Mineev K.S., VolynskyP.E.,ErmolyukY.S., TkachE.N., SobolA.G., Chupin V.V., KirpichnikovM.P., EfremovR.G., ArsenievA.S. Spatial structure of the dimeric transmembrane domain of the growth factor receptor ErbB2 presumably corresponding to the receptor active state. J Biol Chem. 2008 Mar 14; 283(11): 6950-6. doi: 10.1074/jbc. M709202200.
- Moasser M.M. The oncogene HER2: its signaling and transforming functions and its role in human cancer pathogenesis. Oncogene. 2007 Oct 4; 26(45): 6469-87. doi: 10.1038/sj.onc.1210477.
- Fleishman S.J., Schlessinger J., Ben-Tal N. A putative molecular-activation switch in the transmembrane domain of erbB2. Proc Natl Acad Sci U S A. 2002 Dec 10; 99(25): 15937-40. doi: 10.1073/ pnas.252640799.
- StantonS.E., WardMM., ChristosP., SanfordR., Lam C., CobhamM. V., Donovan D., Scheff R.J., Cigler T., Moore A., Vahdat L.T., Lane M.E., Chuang E. Pro1170 Ala polymorphism in HER2-neu is associated with risk of trastuzumab cardiotoxicity. BMC Cancer. 2015; 15: 267. doi: 10.1186/ s12885-015-1298-6.
- Benusiglio P.R., Lesueur F., Luccarini C., Conroy D.M., Shah M., Easton D.F., Day N.E., Dunning A.M., Pharoah P.D., Ponder B.A. Common ERBB2 polymorphisms and risk of breast cancer in a white British population: a case-control study. Breast Cancer Res. 2005; 7(2): R204-9. doi: 10.1186/bcr982.
- Kong S.L., LiuX., SuhaimiN.M., KohK.J.H., HuM., LeeD.Y.S., Cima I., Phyo W.M., Lee E.X.W., Tai J.A., Foong Y.M., Vo J.H., Koh P.K., Zhang T., Ying J.Y., Lim B., Tan M.H., Hillmer A.M. Molecular characterization of circulating colorectal tumor cells defines genetic signatures for individualized cancer care. Oncotarget. 2017 Jul; 8(40): 68026-037. doi: 10.18632/oncotarget.19138.
- Kohsaka S., Shukla N., Ameur N., Ito T.,Ng C.K., Wang L., Lim D., Marchetti A., Viale A., Pirun M., Socci N.D., Qin L.X., Sciot R., Bridge J., Singer S., Meyers P., Wexler L.H., Barr F.G., Dogan S., Fletcher J.A., Reis-Filho J.S., Ladanyi M. A recurrent neomorphic mutation in MYOD1 defines a clinically aggressive subset of embryonal rhabdomyosarcoma associated with PI3K-AKT pathway mutations. Nat Genet. 2014; 46(6): 595-600. doi: 10.1038/ng.2969.
- Shankar G.M., Taylor-Weiner A., Lelic N., Jones R.T., Kim J.C., Francis J.M., AbedalthagafiM., Borges L.F., Coumans J.V., Curry W.T., Nahed B.V., Shin J.H., Paek S.H., Park S.H., Stewart C., Lawrence M.S., CibulskisK., Thorner A.R., VanHummelenP., Stemmer-Rachamimov A.O., Batchelor T.T., Carter S.L., HoangM.P., Santagata S., Louis D.N., Barker F.G., Meyerson M., Getz G., Brastianos P.K., Cahill D.P. Sporadic hemangioblastomas are characterized by cryptic VHL inactivation. Acta Neuropathol Commun. 2014 Dec 24; 2: 167. doi: 10.1186/s40478-014-0167-x.
- Forbes S.A., Beare D., Boutselakis H., Bamford S., Bindal N., Tate J., Cole C.G., Ward S., Dawson E., Ponting L., Stefancsik R., Harsha B., Kok C.Y., Jia M., Jubb H., Sondka Z., Thompson S., De T., Campbell P.J. COSMIC: somatic cancer genetics at high-resolution. Nucleic Acids Res. 2017 Jan 4; 45(D1): D777-D783. doi: 10.1093/nar/gkw1121.
- Xin D.J., Shen G.D., Song J. Single nucleotide polymorphisms of HER2 related to osteosarcoma susceptibility. Int J Clin Exp Pathol. 2015 Aug; 8(8): 9494-9.
- Wang V, Chuang T.C., Kao M.C., Shan D.E., Soong B.W., Shieh T.M. Polymorphic Ala-allele carriers at residue 1170 of HER2 associated with Parkinson's disease. J Neurol Sci. 2013 Feb; 325(1-2): 115-9. doi: 10.1016/j.jns.2012.12.017.
- Ng P.K., Li J., Jeong K.J., Shao S., Chen H., Tsang Y.H., Sengupta S., Wang Z., Bhavana V.H., Tran R., Soewito S., Minussi D.C., Moreno D., KongK., Dogruluk T., LuH., Gao J., Tokheim C., ZhouD.C., JohnsonA.M., Zeng J., Ip C.K.M., Ju Z, Wester M, Yu S, Li Y, Vellano CP, Schultz N, Karchin R, Ding L, Lu Y, Cheung L.W.T., Chen K., Shaw K.R., Meric-Bernstam F., Scott K.L., Yi S., Sahni N., Liang H., Mills G.B. Systematic Functional Annotation of Somatic Mutations in Cancer. Cancer Cell. 2018 Mar 12; 33(3): 450-462.e10. doi: 10.1016/j.ccell.2018.01.021.
- Longatto-Filho A., Pinheiro C., Martinho O., Moreira M.A., Ribeiro L.F., Queiroz G.S., Schmitt F.C., Baltazar F., Reis R.M. Molecular characterization of EGFR, PDGFRA and VEGFR2 in cervical adenosquamous carcinoma. BMC Cancer. 2009 Jun 29; 9: 212. doi: 10.1186/1471-2407-9-212.
- Taja-ChayebL., Chavez-BlancoA., Martinez-Tlahuel J., Gonzalez-Fierro A., CandelariaM., Chanona-VilchisJ., RoblesE.,Duenas-Gonzalez A. Expression of platelet derived growth factor family members and the potential role of imatinib mesylate for cervical cancer. Cancer Cell Int. 2006 Oct 2; 6: 22. doi: 10.1186/1475-2867-6-22.
- Estevez-Garcia P., Castaño A., Martin A.C., Lopez-Rios F., Iglesias J., Muñoz-Galván S., Lopez-Calderero I., Molina-Pinelo S., Pastor M.D., Carnero A., Paz-Ares L., Garcia-Carbonero R. PDGFRa/p and VEGFR2 polymorphisms in colorectal cancer: incidence and implications in clinical outcome. BMC Cancer. 2012 Nov 12; 12: 514. doi: 10.1186/1471-2407-12-514.
- Trojani A., Ripamonti C.B., Penco S., Beghini A., Nadali G., Di Bona E., Viola A., Castagnola C., Colapietro P., Grillo G., Pezzetti L., Ravelli E., Patrosso M.C., Marocchi A., Cuneo A., Ferrara F., Lazzarino M., Pizzolo G., CairoliR., MorraE. Molecular analysis of PDGFRA and PDG-FRB genes by rapid single-strand conformation polymorphism (SSCP) in patients with core-binding factor leukaemias with KIT or FLT3 mutation. Anticancer Res. 2008; 28(5A): 2745-51.
- Gilbert J.A., Adhikari L.J., Lloyd R.V., Halfdanarson T.R., MudersM.H., AmesM.M. Molecular markers for novel therapeutic strategies in pancreatic endocrine tumors. Pancreas. 2013; 42(3): 411-21. doi: 10.1097/MPA.0b013e31826cb243.
- Martinho O., Longatto-Filho A., Lambros M.B., Martins A., Pinheiro C., Silva A., Pardal F., Amorim J., Mackay A., Milanezi F., Tamber N., FenwickK., Ashworth A., Reis-Filho J.S., Lopes J.M., Reis R.M. Expression, mutation and copy number analysis of platelet-derived growth factor receptor A (PDGFRA) and its ligand PDGFA in gliomas. Br J Cancer. 2009 Sep 15; 101(6): 973-82. doi: 10.1038/sj.bjc.6605225.
- rs1873778 (SNP) - Explore this variant - Homo sapiens -Ensembl genome browser 96 [Internet]. URL: https://www.en-sembl.org/Homo_sapiens/Variation/Explore?r=4:54274388-54275388;v=rs 1873778;vdb=variation;vf=250182332 (cited: 23.04.2019).


