Спектрофотометрическое определение преднизолона и циклофосфана
Автор: Лигостаев А.В., Ивановская Е.А., Кокорина Н.О., Осинцев Д.И., Терентьева С.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.25, 2010 года.
Бесплатный доступ
Разработаны унифицированные методики спектрофотометрического определения преднизолона в растворе и циклофосфана в лиофилизированном порошке. Найдены оптимальные условия определения в модельных ра створах и биожидкостях: для преднизолона - растворитель 0,9%-ный раствор натрия хлорид, аналитическая дли на волны 249 нм; для циклофосфана - растворитель 96%-ный спирт этиловый, аналитическая длина волны 211 нм.
Спектрофотометрия, преднизолон, циклофосфан
Короткий адрес: https://sciup.org/14919195
IDR: 14919195 | УДК: 535.243.25:
Текст научной статьи Спектрофотометрическое определение преднизолона и циклофосфана
В медицинской практике для лечения онкологических заболеваний применяют совместно препараты, обладающие основной терапевтической активностью в сочетании с противовоспалительным эффектом [1].
В настоящее время для комбинированной терапии онкологических заболеваний очень часто в схемах лечения используют циклофосфан, имеющий алкилирующий, иммунодепрессивный, противоопухолевый эффект, в сочетании с преднизолоном, обладающим противовоспалительным, противоаллергическим, антиэксудативным действием, при этом для достижения необходимого терапевтического эффекта крайне важен подбор оптимальной дозы лекарственных препаратов для пациента. Основным методом подбора оптимальной дозы является фармакокинетическое исследование, которое требует использования высокочувствительных и экспрессных методик для определения концентрации лекарственных препаратов в биожидкостях. Для количественного опре- деления преднизолона Государственная фармакопея (ГФ) предлагает методику спектрофотометрического определения в различных лекарственных формах, заключающуюся в нахождении концентрации препарата при длине волны 242 нм в органических растворителях [2]. Существующая методика подразумевает использование дорогостоящих высокотоксичных органических растворителей высокой степени очистки (метанол), что осложняет выполнение исследований по данной методике. Для количественной оценки циклофосфана в ГФ описана методика обратного аргентометрического титрования, которая длительна по времени определения и обладает невысокой чувствительностью [3].
Поэтому цель нашей работы заключалась в разработке простых, точных и недорогих экспресс-методик количественного определения преднизолона и циклофос-фана на модельных растворах с последующим перенесением на биожидкости.
Материал и методы
В качестве объектов исследования были взяты инъекционный раствор преднизолон 25 мг/мл (производитель “Никомед”, Дания) для внутривенного и внутримышечного введения, лиофилизированный порошок циклофос-фана (производитель ОАО “Биохимик”, г. Саранск) и 0,9%-ный раствор натрия хлорида.
Оптическую плотность растворов измеряли на спектрофотометре СФ-56 (Россия) и Shimadzy UV-1202 (Япония) в кюветах 1 см относительно растворителя. Величину рН контролировали с помощью универсального иономера “Анион 4100”. Для методик сравнения использовали хроматограф “МилиХром А-02” и титриметрическую установку, рекомендуемую ГФ.
Все использованные в работе реагенты: спирт этиловый 96%-ный, раствор гексацианоферрата (II) калия, 4⋅10–4 г/мл водный раствор калия гидроксида, 0,5 моль/л спиртовый раствор калия гидроксида, 0,1 моль/л раствор серебра нитрата, раствор железоаммонийных квасцов, 0,1 моль/л раствор аммония роданид и разбавленная азотная кислота имели чистоту ч. или х.ч. Вода дистиллированная.
Результаты и обсуждение
Наиболее распространенным препаратом в совместных схемах лечения онкозаболеваний является цикло-фосфан. Существующая методика, описанная в ГФ, непригодна для целей фармакокинетического исследования особенно в присутствии других биологически активных веществ. Поэтому нами разработана методика определения циклофосфана в модельных растворах на основе спектрофотометрического метода в ультрафиолетовой области.
На начальном этапе осуществили подбор оптимального растворителя для циклофосфана. В результате чего свой выбор остановили на 96,6%-ном спирте этиловом, что отражено на рисунке 1 и на графике зависимости оптической плотности от концентрации (рис. 2).
Статистическая обработка экспериментальных данных показала воспроизводимость результатов исследования, что отражено в таблице 1 и на рисунке 3 зависимости ошибки среднего от концентрации.
Методика количественного определения циклофос-фана в модельных растворах . Предлагаемая нами методика количественного определения циклофосфана в модельных растворах заключается в том, что готовят растворы с различными концентрациями 1⋅10–3 г/мл; 1⋅10–4 г/ мл; 5⋅10–5 г/мл; 1⋅10–5 г/мл; 5⋅10–6 г/мл; 2⋅10–6 г/мл; 1⋅10–6 г/мл; 1⋅10–7 г/мл, путем последовательного разбавления исходного раствора циклофосфана в 96,6% спирте с концентрацией 1⋅10–2 г/мл. Кюветы с толщиной поглощающего слоя 10 мм, обрабатывают 96% этиловым спиртом, либо водно-спиртовой смесью, заполняют растворами с различной концентрацией, раствором сравнения служит кювета с этиловым спиртом. Определяют аналитическую длину волны циклофосфана в режиме “Сканирование” при 211 нм. Затем в “Поточечном” режиме выставляют длину волны λ=211 нм и измеряют оптическую плотность
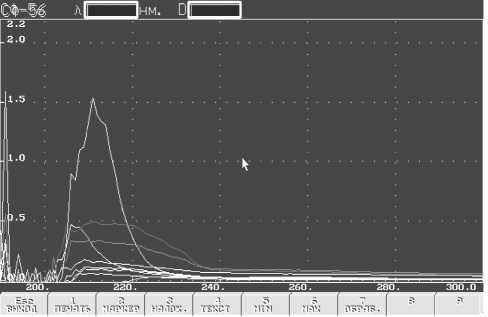
Рис. 1. Аналитическая длина волны циклофосфана в 96,6% спирте этиловом
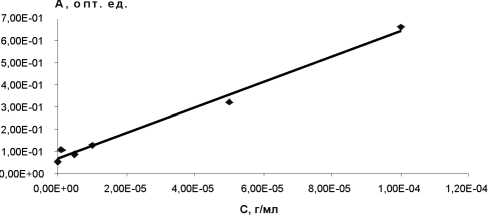
Рис. 2. Зависимость оптической плотности от концентрации
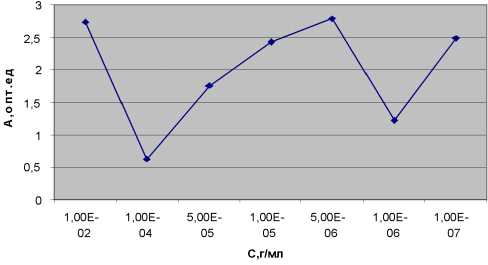
Рис. 3. Зависимость ошибки среднего от концентрации
Таблица 1
Сравнительная характеристика результатов определения циклофосфана различными методами
Для валидации разработанной нами методики определения циклофосфана в модельных растворах использовали фармакопейную методику [3] и ВЭЖХ, описанную в литературе [4].
Результаты валидации методики количественного определения циклофосфана .
-
1. Обратное аргентометрическое титрование [3]: для анализа использовали 5 флаконов циклофосфана одной серии выпуска, содержащих 0,2 г активного вещества в виде лиофилизированного порошка. 0,2 г препарата (точная навеска) переносили в коническую колбу емкостью 250 мл, растворяли в 4 мл 95%-ного спирта, прибавляли 20 мл воды и 20 мл 0,5 моль/л спиртового раствора калия гидроксида. Смесь кипятили в течение 1 ч с обратным холодильником, охлаждали и количественно переносили 20 мл воды в мерную колбу емкостью 100 мл. Прибавляли 5 мл разведенной азотной кислоты, 25 мл 0,1 моль/л раствора нитрата серебра и доводили объем раствора водой до метки. Содержимое колбы хорошо перемешивали и фильтровали через сухой складчатый фильтр в сухую колбу. Первые 15–20 мл фильтрата отбрасывали. К 50 мл фильтрата, прибавляли 10 мл разведенной азотной кислоты, 5 мл раствора железоаммонийных квасцов и титровали 0,1 моль/л раствором аммония роданида. Полученные результаты подвергли статистической обработке (табл. 1).
-
2. ВЭЖХ [4]. Измерение выполняли на приборе Мили Хром А-02. Из раствора циклофосфана в воде с концентрацией 1⋅10–2 г/мл, дозатором отбирали аликвоту 20 мкл и помещали ее в пробирку находящуюся в барабане прибора. Далее, с помощью компьютерной программы прибор производил измерение длины волны и оптической плотности. Длина волны цикло-фосфана составляла 210 нм, при которой оптическая плотность (А) составила 14,1816 (табл. 1).
При исследовании спиртовых растворов циклофос-фана следует строго соблюдать температурный режим (от +2 до +4) при хранении растворов, т.к. в противном случае результаты измерений сильно искажаются.
В практической деятельности для лечения онкозаболеваний в терапевтических схемах чаще всего применяют растворимый препарат преднизолона для инъекций, выпускаемый в ампулах по 1 мл с содержанием водорастворимой соли преднизолона. Исходя из этого предположили, что данная форма преднизолона может быть растворима в солях и буферных растворах.
В результате проведения исследований оптическим методом в растворах калия хлорида, натрия хлорида и буферном растворе Бриттона-Робинсона наилучшие спектры были получены для раствора преднизолона в 0,9% растворе натрия хлорида (рис. 4).
Затем определяли зависимость оптической плотности от концентрации, которая имела прямолинейный характер, что подтверждало правило Бугера-Ламберта-Бера и возможность использования данных при разработке методики (рис. 5). Установлено, что линейная зависимость градуировочного графика сохраняется в широком диа-
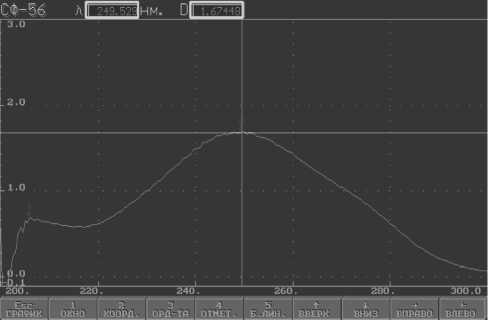
Рис. 4. Аналитическая длина волны преднизолона в изотоническом растворе натрия хлорида
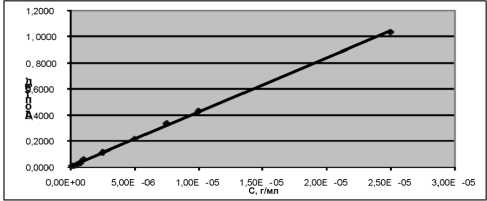
Рис. 5. Зависимость оптической плотности от концентрации
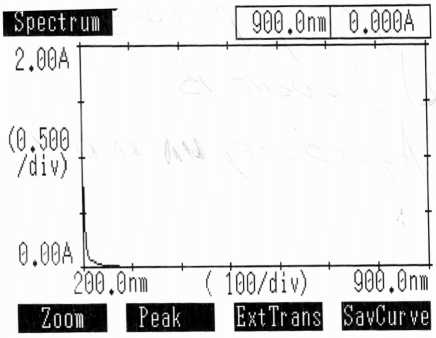
Рис. 6. Спектр изотонического раствора натрия хлорида пазоне определяемых концентраций от 1⋅10–7 до 2,5⋅10–5 г/мл (рис. 5).
Для изучения возможного влияния хлоридов на аналитическую длину волны преднизолона получили спектр изотонического раствора натрия хлорида снятый относительно воды в том же диапазоне что и преднизолон в 0,9% натрия хлориде (рис. 6).
Экспериментальные данные показали, что ионы хлора не оказывают влияние на спектр преднизолона.
Для подтверждения правильности разработанной методики провели эксперимент по методу “введено-найде-но”, результаты отражены в таблице 2 и на рисунке 7, а также статистических данных и зависимости “ошибки среднего от концентрации” (рис. 8).
Таблица 2
Таблица “Введено-найдено”
|
Введено |
Найдено |
сходимость |
правильность |
|
E% |
E% |
||
|
2,5000E–05 |
2,54E–05 |
0,54676 |
1,60 |
|
1,0000E–05 |
1,06E–05 |
0,68201 |
6,00 |
|
7,5000E–06 |
8,26E–06 |
0,51528 |
10,13 |
|
5,0000E–06 |
5,35E–06 |
1,094731 |
7,00 |
|
2,5000E–06 |
2,82E–06 |
1,755072 |
12,80 |
|
1,0000E–06 |
1,54E–06 |
1,529408 |
54,00 |
|
7,5000E–07 |
9,00E–07 |
5,940426 |
20,00 |
|
5,0000E–07 |
5,85E–07 |
5,635831 |
17,00 |
|
2,5000E–07 |
3,40E–07 |
6,998352 |
36,00 |
Таблица 3
Таблица статистических данных
|
Sr |
∆ x |
ε , % |
|
|
0,0039938 |
0,0007523 |
0,0006276 |
15,71% |
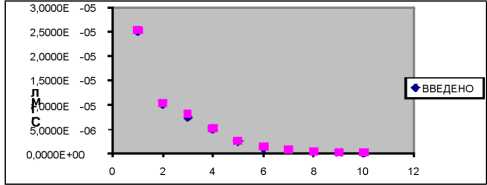
Рис. 7. График “Введено-найдено”
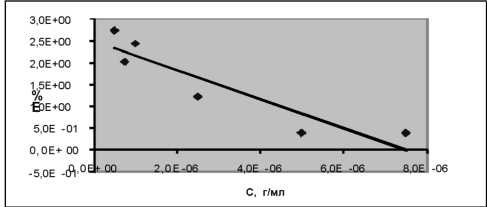
Рис. 8. Зависимость ошибки среднего от концентрации
После нескольких серий измерений рассчитывают статистические данные (табл. 3).
Следует отметить, что разработанные методики менее трудоемки, не требуют токсичных и дорогостоящих реактивов, поэтому следующим этапом нашей работы было перенесение методик на биологические объекты.
Важным этапом при перенесении методик на биологические объекты является установление мешающего влияния компонентов крови на результаты определения лекарственных веществ, поэтому на начальном этапе применили методику без осаждения белков.
Были получены спектры различных концентраций циклофосфана в сыворотке.
Поскольку результаты эксперимента продемонстрировали нечеткие спектры с нестабильной длиной волны, мы решили применить спектрофотометр Shimadzy UV-1202 и методики осаждения [5], где в качестве осадителей использовали:
Раствор А. 10% раствор вольфрамата натрия в воде.
Раствор Б. 0,335М раствор серной кислоты.
Готовили растворы:
-
1. Раствор. К 1 мл сыворотки добавляли 8 мл воды очищенной, 0,5 мл раствора А и 0,5 мл раствора Б. Перемешивали и помещали в центрифугу на 10 мин при 3000 об/мин. Из центрифугата брали аликвоту 0,1 мл и добавляли 2,9 мл 96,6% спирта этилового.
-
2. Раствор 1. К 1 мл сыворотки добавляли 0,1 мл раствора циклофосфана в спирте (С=1⋅102 г/мл), 8 мл воды очищенной, 0,5 мл раствора А, 0,5 мл раствора Б. Перемешивали и центрифугировали 10 мин при 3000 об/мин. Из центрифугата брали аликвоту 0,1 мл и добавляли 2,9 мл 96,6% спирта этилового.
Растворы измеряли на спектофотометре Shimadzy UV-1202 при длине волны 210 нм (рис. 9).
Далее подобрали объем пробы (циклофосфан в спирте) для получения стабильных результатов.
Мы воспроизводили методику с вольфраматом натрия и серной кислотой и вводили в сыворотку следующие объемы циклофосфана в спирте С=1⋅102 г/мл (см. приготовление раствора №1):
Раствор №1 – 0,21 мл (210 мкл);
Раствор №2 – 0,22 мл;
Раствор №3 – 0,23 мл;
Раствор №4 – 0,24 мл;
Раствор №5 – 0,25 мл.
Измеряли растворы и получали спектры.
Все измерения выполнялись в режиме “Получение спектра”.
Затем в сыворотку вводили следующие объемы цик-лофосфана в спирте с С=1⋅10-2 г/мл.
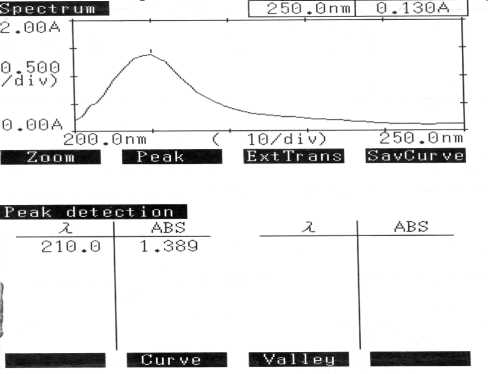
Рис. 9. Спектр циклофосфана в осажденной сыворотке
Таблица 4
Таблица результатов по оптическим плотностям
|
Раствор |
А, опт. ед. |
|
№1 |
0,026 |
|
№2 |
0,061 |
|
№3 |
–0,035 |
|
№4 |
0,136 |
|
№5 |
0,146 |
|
№6 |
1,108 |
Раствор №1 – 0,3 мл;
Раствор №2 – 0,4 мл;
Раствор №3 – 0,5 мл;
Раствор №4 – 0,6 мл;
Раствор №5 – 0,7 мл;
Раствор №6 – 0,8 мл.
Измерения проводили в режиме “Оптическая плотность” при 210 нм.
Полученные результаты представлены в таблице 4.
Эта методика была взята за основу в работе с биологическими объектами и адаптирована для работы с животными (крысами).
Методика количественного определения циклофосфана в сыворотке . Для исследования брали 15 животных из вивария (крыс).
15 крыс массой 400 г, которым был введен циклофос-фан внутрибрюшинно шприцем 1 см3 из расчета 21 мг/ кг (1/5 LD50), что в пересчете на крысу массой 400 г составляло 8,4 мг препарата. Раствор препарата получали растворением порошка циклофосфана в количестве 84 мг в 10 мл воды для инъекций. Вводили по 1 мл препарата. Забор крови осуществлялся по следующей схеме: 1) до введения;
-
2) через 1 ч, после введения;
-
3) через 2 ч;
-
4) через 4 ч;
-
5) через 7 ч;
-
6) через 11 ч.
Кровь забирали из хвостовой вены по 1 мл в эпин-дорфы, центрифугировали в микроцентрифуге при 3000 об/мин 10 мин. Далее отбирали дозатором сыворотку по 0,5 мл в пробирки, таким образом от каждой крысы мы получали по 6 проб сыворотки.
Для осаждения использовали растворы:
Раствор А. 10% раствор вольфрамата натрия в воде.
Раствор Б. 0,335М раствор серной кислоты.
Методика осаждения: В пробирку на 10 мл, содержащую 0,5 мл сыворотки, добавляли 8 мл воды очищенной, 0,5 мл раствора А, перемешивали и прибавляли 0,5 мл раствора Б. Перемешивали и помещали в центрифугу на 10 мин при 3000 об/мин. После осаждения белковой части из центрифугата отбирали 0,1 мл и добавляли 2,9 мл 96,6% спирта этилового, таким образом объем пробы был 3 мл. Данная проба подвергалась исследованию на спектрофотометре Shimadzy.
Процесс измерения на спектрофотометре Shimadzy:
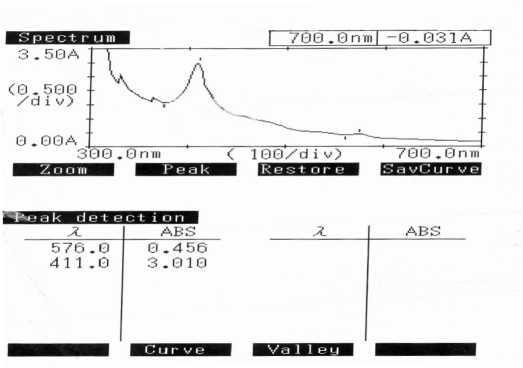
Рис.10. Чистая сыворотка, снятая относительно воды
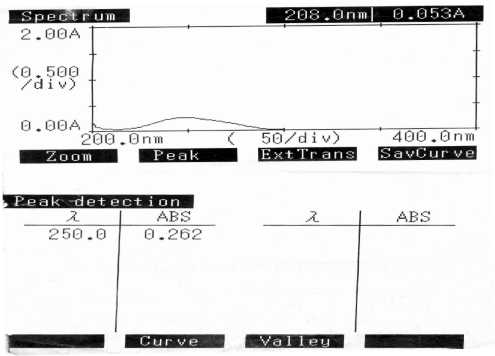
Рис. 11. Спектр преднизолона в сыворотке разбавленной 0,9% натрия хлоридом снятый относительно сыворотки разбавленной 0,9% натрия хлоридом
Включали прибор, выбирали режим “Оптическая плотность”, выставляли длину волны 211 нм и измеряли оптическую плотность растворов. Раствором сравнения служила сыворотка крыс без препарата. Таким образом, на каждую крысу мы получали по 5 значений оптической плотности. Потом полученные результаты подвергались обработке:
-
1) построение графиков;
-
2) расчет фармакокинетических кривых.
Методика количественного определения преднизолона в биологических объектах (модели) . Для начала было необходимо измерить чистую сыворотку (рис. 10), сыворотку с изотоническим раствором натрия хлорида и сыворотку с преднизолоном разведенную 0,9% натрия хлоридом (рис. 11).
После этого мы решили прибегнуть к методике осаждения белков, так как спектры имели не стабильный характер и были не четко выражены. В результате установили, что осаждается мало белка, преднизолон пика не дает.
Из всех проведенных методик мы предпочли методику с использованием в качестве раствора А: 12,5 г цинка сульфата семиводного + 125 мл 0,125М серной кислоты. Общий объем доводили до 1 л и раствора Б: 0,75М на-. трия гидроксида.
Процедура разбавления центрифугата 0,9% натрия хлоридом необходима для снижения фона сыворотки.
Подробная методика с осаждением белков:
Для анализа брали в лаборатории 11 различных сывороток.
-
а) Приготовление раствора сравнения:
К 1 мл сыворотки добавляли 8 мл раствора А и 1 мл раствора Б. Перемешивали и помещали в центрифугу на 10 мин при 3000 об/мин. После осаждения белков, из центрифугата брали 0,1 мл и добавляли 2,9 мл 0,9% натрия хлорида.
-
б) Приготовление анализируемых образцов (10):
К 1 мл сыворотки добавляли 0,1 мл раствора преднизолона (2,5* 102 г /мл), 8 мл раствора А и 1 мл раствора Б. Перемешивали и помещали в центрифугу на 10 мин при 3000 об/мин. Из центрифугата брали аликвоту 0,1 мл и добавляли 2,9 мл 0,9% натрия хлорида. Измеряли раствор на СФ-56 при λ=249 нм.
Оптическая плотность 10 растворов:
-
1) 0,29529;
-
2) 0,28545;
-
3) 0,30145;
-
4) 0,28618;
-
5) 0,30153;
-
6) 0,29275;
-
7) 0,29564;
-
8) 0,26927;
-
9) 0,28456;
-
10) 0,30733.
Мы перенесли методики количественного определения препарата на лабораторных животных.
Применение методики количественного определения преднизолона на сыворотке животных . Для исследования брали 15 животных из вивария (крыс).
Вводили внутрибрюшинно шприцем 1 см3 каждой крысе преднизолон Никомед (25 мг/мл) из расчета 2, 1 мг/кг (1/5 LD50), что в пересчете на крысу массой 300 г составило 0,63 мг препарата или 25,2 мкл раствора преднизолона 25 мг/мл. Забор крови осуществлялся по следующей схеме:
-
1) до введения препарата; вводим препарат;
-
2) через 1 ч после введения;
-
3) через 2 ч;
-
4) через 3 ч;
-
5) через 4 ч;
-
6) через 20 ч.
Кровь забирали из хвоста по 1 мл в эпиндорфы. Откручивали при 3000 об/мин 10 мин. Далее отбирали дозатором сыворотку по 0,5 мл в пробирки, таким образом от каждой крысы мы получали по 6 проб сыворотки Про-боподготовку сыворотки осуществляли путем осаждения:
Для осаждения использовали растворы:
Раствор А. 0,5 г цинка сульфата семиводного + 5 мл 0,125 М серной кислоты
Общий объем раствора доводили водой до 40 мл.
Раствор Б. 0,75 М натрия гидроксид.
Методика осаждения:
В пробирку на 10 мл, содержащую 0,5 мл сыворотки, добавляли 8 мл раствора А, перемешивали и 1 мл раствора Б. Перемешивали и помещали в центрифугу на 10 мин при 3000 об/мин. После осаждения белковой части цен-трифугат подвергали исследованию на спектофотомет-ре Shimadzy.
Процесс измерения производили на приборе спектрофотометр Shimadzy.
Для этого включали прибор, выбирали режим “Оптическая плотность”, выставляли длину волны 249 нм и измеряли оптическую плотность растворов. Раствором сравнения служила сыворотка крыс без препарата. Таким образом, на каждую крысу было получено по 5 значений оптической плотности.
Полученные результаты подвергались обработке:
-
1) построение графиков;
-
2) расчет фармакокинетических кривых.
Заключение
Таким образом, нами были разработаны унифицированные методики спектрофотометрического определения преднизолона в растворе и циклофосфана в лиофилизированном порошке.
Показано, что разработанные методики в модельных растворах можно использовать для фармакокинетических исследований на лабораторных животных.
Список литературы Спектрофотометрическое определение преднизолона и циклофосфана
- Регистр лекарственных средств. Энциклопедия лекарств: ежегодный сборник. -Вып.11. -М.: РЛС 2004, 2004. -997 с.
- Государственная фармакопея СССР. -М., 1968. -C. 557. -(Х издание).
- Государственная фармакопея СССР. -М., 1968. -C. 223. -(Х издание).
- Moffat A.C., Jackson J.V., Moss M.S., Widdop B., Greenfield E.S. Clarke's isolation and identification of drugs. -London: The Pharmaceutical Press, 1986. -503 с.
- Досон Р., Эллиот Д., Элиот У., Джонс К. Справочник биохимика/пер. с англ. -М.: Мир, 1991. -472 с.


