Спленосохранная дистальная субтотальная резекция желудка D2 и корпокаудальная резекция поджелудочной железы после неоадъювантной индукционной химиотерапии и химиолучевой терапии: клиническое наблюдение и обзор литературы
Автор: Скоропад В.Ю., Петров Л.О., Кудрявцев Д.Д., Колобаев И.В., Жаворонкова Е.С., Агабабян Т.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Актуальность. Рак желудка является одним из наиболее распространенных онкологических заболеваний в мире и в Российской Федерации. Отдаленные результаты хирургического лечения местнораспро-страненного рака желудка, особенно с распространением опухоли на соседние структуры, остаются неудовлетворительными. В клинических рекомендациях МЗ РФ в таких случаях предписывается проведение периоперационной химиотерапии по схеме FLOT. В МРНЦ и за рубежом в рамках различных фаз клинических исследований, в том числе многоцентровых рандомизированных, изучается эффективность применения неоадъювантной химиолучевой терапии. Описание клинического случая. Представлено клиническое наблюдение успешного комбинированного лечения больного местнораспространенным раком желудка (сT4bN2M0 - ^А ст.). На первом этапе проведена неоадъювантная терапия в составе индукционной химиотерапии (2 цикла по схеме FLOT) с последующей химиолучевой терапией (СОД 46 Гр на фоне химиотерапии капецитабином и оксалиплатином). Неоадъювантную терапию перенес удовлетворительно, наблюдалась гастроинтестинальная и гематологическая токсичность i степени. Хирургический этап лечения заключался в дистальной субтотальной резекции желудка с лимфодиссекцией D2 и дистальной субтотальной резекцией поджелудочной железы, с сохранением селезенки. Послеоперационный период протекал без осложнений. При морфологическом исследовании операционного материала выявлен полный лечебный патоморфоз первичной опухоли, в том числе в зоне ранее определявшегося прорастания в поджелудочную железу; метастаз в одном лимфатическом узле малого сальника. По данным динамического наблюдения пациент жив без признаков рецидива заболевания более 20 мес после операции. Заключение. Показана возможность безопасного проведения многокомпонентной неоадъювантной терапии и выполнения органосохраняющего лечения у пациента с местно- и регионарнораспространенным раком желудка (сT4bN2M0) в условиях специализированного многопрофильного центра. Применение эффективной неоадъювантной терапии привело к достижению выраженного лечебного патоморфоза, что является значимым фактором благоприятного прогноза.
Местнораспространенный рак желудка, неоадъювантная химиотерапия, неоадъювантная химиолучевая терапия, лечебный патоморфоз, хирургическое лечение
Короткий адрес: https://sciup.org/140296674
IDR: 140296674 | УДК: 616.33-006.6-089:615.28+615.849.1 | DOI: 10.21294/1814-4861-2022-21-5-155-161
Текст научной статьи Спленосохранная дистальная субтотальная резекция желудка D2 и корпокаудальная резекция поджелудочной железы после неоадъювантной индукционной химиотерапии и химиолучевой терапии: клиническое наблюдение и обзор литературы
Клиническое наблюдение
С учетом распространенности опухолевого процесса, после проведения мультидисциплинар-
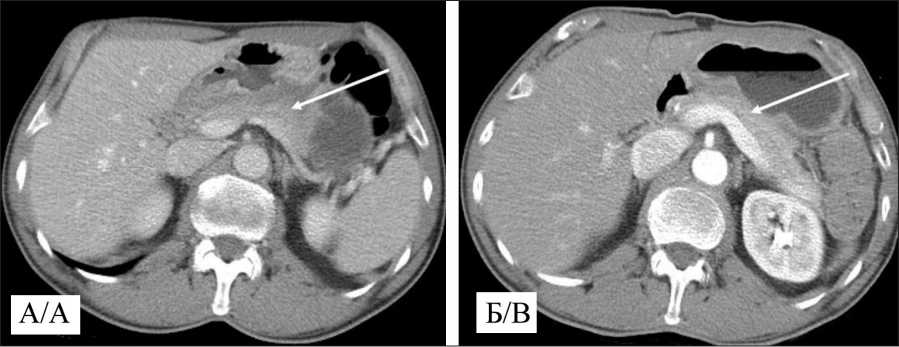
Fig. 1. SСT of the abdominal organs: А. Tumor of the distal third of the stomach with signs of involvement of all layers of the wall and spread to the body of the pancreas (arrow) before treatment; B. Аfter chemoradiation treatment, the tumor size decreased, while the signs of its spread to the body of the pancreas persisted (arrow)
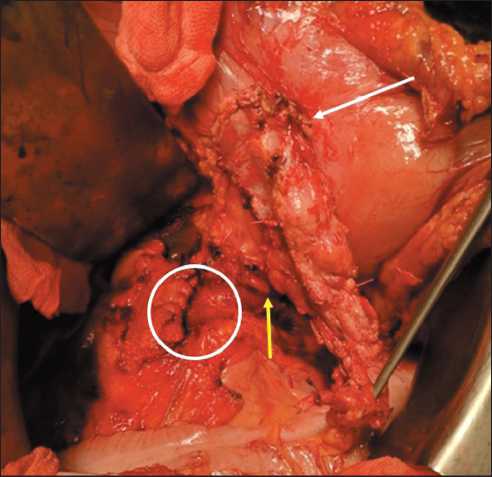
Fig. 2. Photo of the surgical site. The picture shows: the area of growth of the stomach tumor into the pancreas (white arrow); sutured stump of the pancreas head (white circle); preserved splenic vessels (yellow arrow)
ного консилиума и подписания информированного добровольного согласия, больной был включен в локальное проспективное клиническое исследование (одобрено локальным этическим комитетом, утверждено Ученым советом МРНЦ). В соответствии с протоколом на первом этапе комплексного лечения проведен курс неоадъювантной химиотерапии и химиолучевой терапии. С 11.09.20 по 27.09.20 проведенo 2 курса индукционной химиотерапии по схеме FLOT; осложнений не наблюдали. С 19.10.20 по 20.11.20 проведена химиолучевая терапия до СОД 46 Гр, РОД 2 Гр. Применяли 3D-конформную дистанционную лучевую терапию высокоэнергетическими фотонами на аппарате «Elekta Synergy S» с использованием индивидуальных фиксирующих устройств (Wingboard, подголовник F). Химиотерапия проводилась конкурентно препаратами: капецитабин в дозе 1850 мг/м2 per os за 2 приема в течение всего курса ЛТ; оксалиплатин в дозе 85 мг/м2 внутривенно 1 раз в 3 нед. Курс химиолучевой терапии больной перенес удовлетворительно, наблюдалась гастроинтестинальная токсичность I степени (тошнота) и гематологическая токсичность I степени (нейтропения). При контрольном обследовании по данным СКТ отмечена положительная динамика, заключавшаяся в уменьшении размеров первичной опухоли, а также количества и размеров регионарных лимфатических узлов (рис. 1Б).
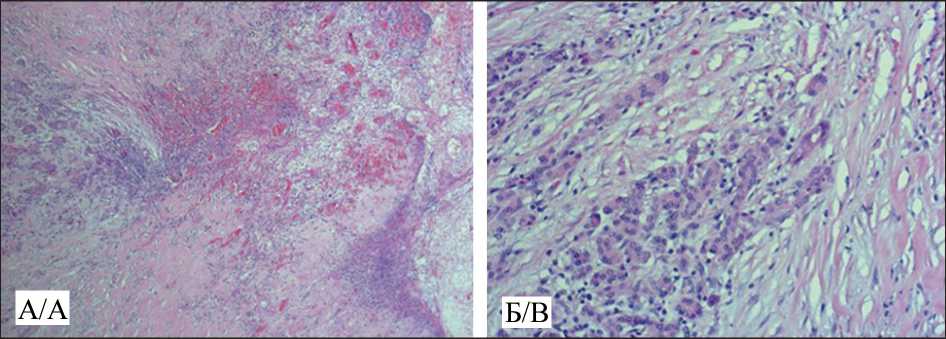
Окраска гематоксилином и эозином, ×20
Fig. 3. Microphoto. А. The gastric mucosa is replaced by organizing granulation tissue with many thin-walled capillary vessels with pronounced lymphocytic and plazmocytic infiltration. On the surface, the altered mucosa is covered with fibrin filaments and detritus. Іn the submucosal layer, the growth of loose fibrous connective tissue with areas of hyalinosis extending through the entire thickness of the stomach wall into the adjacent tissue of the pancreas. Hematoxylin-eosin staining, ×5. B. Greater increase in the tissue of the pancreas adjacent to the stomach wall. Hematoxylin-eosin staining, ×20
правые желудочно-сальниковые сосуды, раздельно перевязаны, пересечены, удалены лимфатические узлы 6-й группы. Рассечена гепато-гастральная связка, выделена у основания правая желудочная артерия, перевязана, пересечена; удалены лимфатические узлы 5-й группы. Двенадцатиперстная кишка пересечена на 1 см дистальнее привратника, ее культя перитонизирована кисетным швом. Выполнена корпокаудальная резекция поджелудочной железы с сохранением селезеночной вены. Мобилизована и смещена к препарату клетчатка вдоль общей печеночной и селезеночной артерии, выделены у основания левые желудочные сосуды, перевязаны раздельно, пересечены; удалены лимфатические узлы 9, 7, 8, 10 и 11-й групп. Препарат удален единым блоком. Сформированы позади-ободочный гастроэнтероанастомоз на петле по Ру и межкишечный анастомоз. Продолжительность операции – 320 мин, объем кровопотери – 100 мл. Послеоперационный период протекал без осложнений.
Больной выписан в удовлетворительном состоянии под наблюдение онколога по месту жительства на 8-е сут после операции. При обследовании через 20 мес (ФГС, СКТ органов грудной и брюшной полостей) данных за рецидив опухоли не получено.
Обсуждение
Список литературы Спленосохранная дистальная субтотальная резекция желудка D2 и корпокаудальная резекция поджелудочной железы после неоадъювантной индукционной химиотерапии и химиолучевой терапии: клиническое наблюдение и обзор литературы
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2020. 252 s.
- Karachun A.M., Sinenchenko G.I., Roman L.D., Samsonov D.V. Rezul'taty khirurgicheskogo lecheniya mestnorasprostranennogo raka zheludka v zavisimosti ot rasprostraneniya opukholi na razlichnye sosednie struktury. Vestnik Natsional'nogo mediko-khirurgicheskogo Tsentra im. N.N. Pirogova. 2012; 7(2): 28-31.
- Bando E., Makuuchi R., Tokunaga M., Tanizawa Y., Kawamura T., Terashima M. Impact of clinical tumor-node-metastasis staging on survival in gastric carcinoma patients receiving surgery. Gastric Cancer. 2017; 20(3): 448-56. https://doi.org/10.1007/s10120-016-0637-x.
- Leong T., Smithers B.M., Haustermans K., Michael M., Gebski V., Miller D., Zalcberg J., Boussioutas A., Findlay M., O’Connell R.L., Verghis J., Willis D., Kron T., Crain M., Murray W.K., Lordick F., Swallow C., Darling G., Simes J., Wong R. TOPGEAR: A Randomized, Phase III Trial of Perioperative ECF Chemotherapy with or Without Preoperative Chemoradiation for Resectable Gastric Cancer: Interim Results from an International, Intergroup Trial of the AGITG, TROG, EORTC and CCTG. Ann Surg Oncol. 2017; 24(8): 2252-8. https://doi.org/10.1245/s10434-017-5830-6.
- Slagter A.E., Jansen E.P.M., van Laarhoven H.W.M., van Sandick J.W., van Grieken N.C.T., Sikorska K., Cats A., Muller-Timmermans P., Hulshof M.C.C.M., Boot H., Los M., Beerepoot L.V., Peters F.P.J., Hospers G.A.P., van Etten B., Hartgrink H.H., van Berge Henegouwen M.I., Nieuwenhuijzen G.A.P., van Hillegersberg R., van der Peet D.L., Grabsch H.I., Verheij M. CRITICS-II: a multicentre randomised phase II trial of neo-adjuvant chemotherapy followed by surgery versus neo-adjuvant chemotherapy and subsequent chemoradiotherapy followed by surgery versus neo-adjuvant chemoradiotherapy followed by surgery in resectable gastric cancer. BMC Cancer. 2018; 18(1): 877. https://doi.org/10.1186/s12885-018-4770-2.
- Skoropad V.Yu., Afanas'ev S.G., Gamayunov S.V., Silant'eva N.K., Agababyan T.A., Sokolov P.V., Ivanov S.A., Kaprin A.D. Mnogotsentrovoe randomizirovannoe klinicheskoe issledovanie 2 fazy: neoad"yuvantnaya khimioluchevaya terapiya s posleduyushchei gastrektomiei D2 i ad"yuvantnoi khimioterapiei u bol'nykh mestnorasprostranennym rakom zheludka. Sibirskii onkologicheskii zhurnal. 2020; 19(1): 5-14. https://doi.org/10.21294/1814-4861-2020-19-1-5-14.
- Qi J., Zhang P., Wang Y., Chen H., Li Y. Does Total Gastrectomy Provide Better Outcomes than Distal Subtotal Gastrectomy for Distal Gastric Cancer? A Systematic Review and Meta-Analysis. PLoS One. 2016; 11(10). https://doi.org/10.1371/journal.pone.0165179.
- Kong L., Yang N., Shi L., Zhao G., Wang M., Zhang Y. Total versus subtotal gastrectomy for distal gastric cancer: meta-analysis of randomized clinical trials. Onco Targets Ther. 2016; 9: 6795-800. https://doi.org/10.2147/OTT.S110828.
- Li Z., Bai B., Xie F., Zhao Q. Distal versus total gastrectomy for middle and lower-third gastric cancer: A systematic review and metaanalysis. Int J Surg. 2018; 53: 163-70. https://doi.org/10.1016/j.ijsu.2018.03.047.
- Panin S.I., Postolov M.P., Kovalenko N.V., Beburishvili A.G., Fedorov A.V., Bykov A.V. Sravnitel'naya otsenka subtotal'noi distal'noi rezektsii i gastrektomii v khirurgicheskom lechenii bol'nykh rakom zheludka. Khirurgiya. Zhurnal im. N.I. Pirogova. 2020; (11): 93-100. https://doi.org/10.17116/hirurgia202011193.
- Brar S.S., Seevaratnam R., Cardoso R., Law C., Helyer L., Coburn N. A systematic review of spleen and pancreas preservation in extended lymphadenectomy for gastric cancer. Gastric Cancer. 2012; 15(1): 89-99. https://doi.org/10.1007/s10120-011-0087-4.
- Sano T., Sasako M., Mizusawa J., Yamamoto S., Katai H., Yoshikawa T., Nashimoto A., Ito S., Kaji M., Imamura H., Fukushima N., Fujitani K.; Stomach Cancer Study Group of the Japan Clinical Oncology Group. Randomized Controlled Trial to Evaluate Splenectomy in Total Gastrectomy for Proximal Gastric Carcinoma. Ann Surg. 2017; 265(2): 277-83. https://doi.org/10.1097/SLA.0000000000001814.
- Boiko V.V., Lazirskii V.A., Savvi S.A., Lykhman V.N. Kombinirovannaya rezektsiya zheludka i podzheludochnoi zhelezy v khirurgicheskom lechenii mestnorasprostranennogo raka zheludka. Mezhdunarodnyi meditsinskii zhurnal. 2012; 1: 68-73.
- Lai K.K., Fang W.L., Wu C.W., Huang K.H., Chen J.H., Lo S.S., Li A.F. Surgical impact on gastric cancer with locoregional invasion. World J Surg. 2011; 35(11): 2479-84. https://doi.org/10.1007/s00268-011-1246-9.
- Tomasello G., Petrelli F., Ghidini M., Pezzica E., Passalacqua R., Steccanella F., Turati L., Sgroi G., Barni S. Tumor regression grade and survival after neoadjuvant treatment in gastro-esophageal cancer: A metaanalysis of 17 published studies. Eur J Surg Oncol. 2017; 43(9): 1607-16. https://doi.org/10.1016/j.ejso.2017.03.001.
- Lee H.H., Kim S.Y., Jung E.S., Yoo J., Kim T.M. Mutation heterogeneity between primary gastric cancers and their matched lymph node metastases. Gastric Cancer. 2019; 22(2): 323-34. https://doi.org/10.1007/s10120-018-0870-6.


