Способ моделирования кожной раны у свиней в эксперименте
Автор: Богданов С.Б., Каракулев А.В., Богданова Ю.А., Сотниченко А.С., Гилевич И.В., Мелконян К.И., Аладьина В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Цель: разработка экспериментальной модели для изучения течения раневого процесса и эффективности применения раневых покрытий как в чистых условиях, так и на гнойной ране у одного животного. Материал и методы. В качестве модели in vivo используется моделирование ран у свиньи. В операционной под общим обезболиванием в положении на боку лабораторному животному выполняют разметку будущей ожоговой поверхности. Раскаленной стальной контактной площадкой выполняется нанесение термического поражения кожи заданных размеров и нужной глубины термического поражения (ШБ и IV степени по классификации Вишневского). После этого производится удаление нежизнеспособных тканей с первичной и отсроченной ауто-дермопластикой и пластикой раневыми покрытиями. В данное исследование in vivo включены четыре свиньи породы Ландрас (масса животного от 18 до 24кг). Результаты. При ожогах ШБ-степени под децеллюляризи-рованными матриксами формировалась рубцовая ткань к 12-м суткам, под рецеллюляризированными — к 8-м суткам происходила эпителизация раны. При IV степени поражения формировалась грануляционная ткань без асептического воспаления к 8-м суткам. Заключение. Разработанный способ моделирования раны в эксперименте позволяет на одном животном проводить анализ приживления раневых покрытий как при раннем, так и при этапном хирургическом лечении ожогов.
Экспериментальная модель, раневые покрытия, ожог
Короткий адрес: https://sciup.org/149134980
IDR: 149134980 | УДК: 616.5–001.1:616–089
Текст научной статьи Способ моделирования кожной раны у свиней в эксперименте
1Введение. По данным Всемирной организации здравоохранения, травматизм от ожогов занимает 2–3-е места среди всех полученных травм. В Российской Федерации, согласно статистике, травмам от ожогов отводится 4-е место: это около 450 тысяч пострадавших за год, 100 тысяч лечатся в условиях стационара [1]. Эти данные подтверждают актуальность в совершенствовании оказания помощи этой категории пациентов. В настоящее время ведется активная разработка новых биологических раневых покрытий, которые позволят более эффективно оказывать помощь пострадавшим с ожогами, совершенствуются способы хирургического лечения [2].
Строгие нормы законодательства нашей страны, регулирующие разработку, безопасность и внедрение новых лекарственных средств и видов лечения в клиническую практику, в последние годы ужесточаются [4, 5]. Получается, для того чтобы достичь внедрения положительных результатов лабораторных исследований в клиническую практику врачей, необходима подходящая и эффективная экспериментальная модель in vivo . Постоянно разрабатываются новые способы экспериментальных моделей на подопытных животных [5–9].
Оптимальным считается пластика кожи полнослойными аутодермотрансплантатами, при которой достигается наиболее положительный косметический результат. Ограничения для выполнения данного вида пластики — гранулирующая рана. Ведутся экспериментальные работы по изучению приживления полнослойных аутодермотрансплантатов [10].
Непрерывно совершенствуются экспериментальные модели, которые помогают более досконально изучить течение процессов в ране [11–15]. Существует метод, который позволяет моделировать ожоговую травму в экспериментальных условиях у подопытных животных небольшого размера (мыши, крысы). Способ состоит в нанесении ожоговой травмы животному посредством погружения дорсальной поверхности туловища в горячую воду, температура которой составляет от 65 до 100 °С. При данном способе формируется влажный некроз. Для изоляции тканей производятся подкожные инъекции от 150 до 200 мл воздуха, который после нанесения термической травмы удаляется .
Еще одним из методов является способ моделирования полнослойной кожной раны у свиней породы Большая Белая, где шесть полнослойных кожных ран защищены от краевой эпителиализации и ретракции пластиковыми камерами диаметром 4 см [16].
Цель создания нового способа — разработка экспериментальной модели для изучения течения раневого процесса и эффективности применения раневых покрытий как в чистых условиях, так и на гнойной ране у одного животного.
Материал и методы. В данное исследование включены четыре свиньи породы Ландрас (масса тела 18–24 кг). Особенностью данной породы является низкое количество подкожно-жировой клетчатки. Содержание подопытных свиней и все манипуляции с животными были проведены в соответствии с положениями Европейской конвенции о защите позвоночных животных, используемых в экспериментах и в других научных целях ETS №123 от 18 марта 1986 г., ГОСТом 34088–2017 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за сельскохозяйственными животными» от 8 января 2018 г., после получения одобрения этическим комитетом.
В качестве раневых покрытий использовали де- и рецеллюляризированную аллофибробласта-ми свиную кожу. Децеллюляризацию проводили по разработанной методике (заявка на патент РФ №2019133278/04 (065726) по детергент энзиматическому протоколу с использованием раствора Трипсина — Версена (Биолот, Россия), 1 %-го раствора тритона Х-100 (Sigma-Aldrich, США) и 4%-го раствора дезоксихолата натрия (Sigma-Aldrich, США) в комбинации с 0,002М Na2-ЭДТА, свиной панкреатической ДНКазой I (Sigma-Aldrich, США). Общая продолжительность процесса составляла 64 часа.
Ферментативным методом из полученных нативных образцов кожи были выделены фибробласты, которые культивировали до 4-го пассажа. Затем проводилась статическая рецеллюляризация децеллю-ляризированных матриксов в 6-луночном планшете клеточной суспензией из расчета 25 000 кл/см2 в течение двух суток в СО2-инкубаторе.
Нанесения термической травмы у животных производят в операционных условиях под эндотрахе-альным наркозом в положении на боку. Линейкой наносят разметку границ будущего ожога. Раскаленной стальной контактной площадкой размерами 20 на 5 см наносится ожог. Контакт от 1 до 3 сек. Время экспозиции зависит от того, какой глубины необходимо достичь (III Б или IV ст. по классификации Вишневского). На 1–3-и сутки после нанесения термической травмы некротомом удаляются все нежизнеспособные ткани, в результате образуется две раневые поверхности: рана, дном которой является сетчатый слой дермы, и раневая поверхность, дном которой является фасция и мышечные волокна (рис. 1). После выполненной некрэктомии, отступив от краев ран на 1–2 см (с целью предотвращения эпителизации с краев), ко дну подшиваются исследуемые раневые покрытия и/или кожные трансплантаты с условием, что расстояние между ними будет составлять 1–2 см (рис. 2). Производится наложение повязки с мазью «Левомеколь». Вывод свиньи из наркоза происходит также при ее положении на боку. Каждые последующие 3–4 дня после проведения операции выполняются серии биопсий под общим обезболиванием. После каждого оперативного вмешательства производят наложение мазевых повязок. После 7–9 суток от первой операции ожоговая рана IV степени по классификации Вишневского начинает гранулировать. После формирования зрелой грануляционной ткани выполняется тангенциальное иссечение грануляций до фиброзного слоя, с последующим подшиванием исследуемых раневых покрытий и/или кожных трансплантатов ко дну раны (рис. 3). Данная методика позволяет оценить эффективность исследуемых покрытий на одной свинье как на «чистой» хирургической ране, так и на гранулирующей. Каждые последующие 3–4 суток выполняются серии биопсий исследуемых покрытий и/или кожных трансплантатов с целью изучения эффективности их приживления на раневых поверхностях различной глубины ожогового поражения в динамике. По завершению эксперимента, через 2–3 недели от нанесения ожогов, на оставшихся ранах, которые не эпителизировались, выполняется свободная кожная пластика расщепленными аутотрансплантатами толщиной 0,3–0,5 мм. Забор донорского материала производится также на пораженном
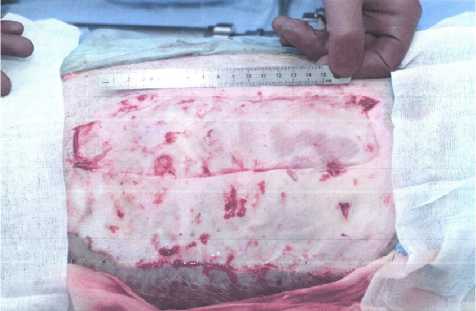
Рис. 1. Некрэктомия. Формирование раневых поверхностей различной глубины
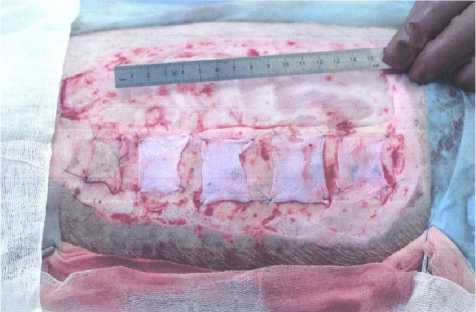
Рис. 2. Наложение и фиксация исследуемых материалов на нижние слои дермы боку (рис. 4). После 5–7 дней от последней операции снимаются все повязки, отмечается полное закрытие ран. Подопытное животное выводится из эксперимента без раневых дефектов (рис. 5).
Для проведения морфологического анализа образцы фиксировали в 10%-м нейтральном формалине, дегидратировали с последующим заключением в парафин при помощи гистопроцессора Leica TP1020 (Германия) по стандартной методике. Срезы
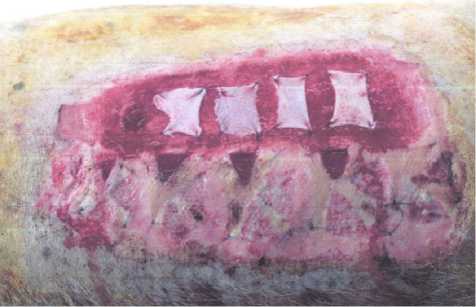
Рис. 3. Наложение и фиксация исследуемых материалов на фиброзный слой грануляционной ткани
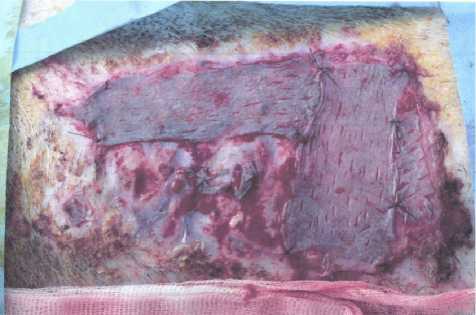
Рис. 4. Аутодермопластическое закрытие раневого дефекта

Рис. 5. Животное без раневых дефектов через три месяца толщиной 5 мкм окрашивали гематоксилином и эозином (Sigma-Aldrich, США) по стандартной методике. Изучение микропрепаратов проводилось на микроскопе Olympus СХ 41 (Япония).
Результаты. Наблюдение подопытного животного в виварии, проведение всех манипуляций под общим обезболиванием (включая нанесение ожога, выполнение хирургических вмешательств и забор биопсийных материалов) позволило сохранить жизнь животного и при выводе из эксперимента выполнить аутодермопластику для полного отсутствия ран.
При исследовании отмечались морфологические отличия дна ран, которые были закрыты де- или ре-целлюляризированными матриксами в ране IIIБ-степени по классификации Вишневского.
После имплантации ацеллюлярной дермы в подлежащих тканях отмечалась слабовыраженная асептическая воспалительная реакция с лимфомакрофагальной инфильтрацией и пропитыванием матрикса фибрином и эритроцитами. На 12-е сутки раневое покрытие, представленное децеллюляризирован-ным материалом, становилось сухим и уплотнялось. В результате происходило открепление раневого покрытия от поверхности раны и формирование на этом месте рубцовой ткани, которая требовала иссечения и выполнения аутодермопластики расщепленным кожным лоскутом на 20-е сутки.
В случае использования рецеллюляризирован-ного аллофибробластами дермального матрикса как раневого покрытия морфологический и клинический результаты существенно отличались. Рецеллю-ляризированный матрикс хорошо адгезировал ко дну раны, пальпаторно брался в складку. Морфологически на 2–5-е сутки также развивалась слабовыражен-ная асептическая воспалительная реакция, но она происходила только в верхних участках раны, граничащих с матриксом.
На 8-е сутки под рецеллюляризированным матриксом начиналась выраженная пролиферация дермальных фибробластов. К этому времени произошло формирование плоского неороговевающего эпидермиса из пролиферирующих придатков кожи. При использовании данного матрикса показания для выполнения аутодермопластики отсутствовали.
Течение раневого процесса в ране IV степени по классификации Вишневского и в случае применения обоих указанных типов раневых покрытий происходило без значимых различий. В ходе заживления раны под матриксами наблюдали рост грануляционной ткани и развитие асептического воспаления. Плотной адгезии как децеллюляризированного, так и рецеллюляризированного матриксов к поверхности не происходило, на 5–8-е сутки раневые покрытия свободно откреплялись, обнажая гранулирующую раневую поверхность.
Разработанный способ моделирования ожоговой кожной раны у свиньи защищен патентом на изобретение RU 2 726600 C1 от 14.07.2020.
Обсуждение. Описанный способ моделирования ожоговой раны у свиней в эксперименте позволяет с большой точностью определить эффективность применения раневых покрытий на раневых поверхностях различной глубины ожогового поражения. Создание раны при изучении различных раневых покрытий с условием отступов на 2 см позволяет полно- стью предотвратить краевую эпителизацию и на ранах одной глубины достоверно изучать течение раневого процесса при различных видах аутопластик и при применении различных покрытий.
Отмечена перспектива де- и рецеллюляризиро-ванных дермальных матриксов в случае применения на неглубоких раневых дефектах. Использование указанных покрытий на гранулирующей ране позволило избежать инфицирования раны, однако не послужило основой для полного восстановления кожного покрова. Мы связываем это с отсутствием придатков кожи, необходимых для регенерации эпидермиса.
Проведение предложенного нами способа возможно при наличии вивария, ветеринарного врача, анестезиолога и комбустиолога. Наблюдение за животным проводится динамически только на протяжении месяца, но это позволяет полностью оценить течение раневого процесса как при раннем хирургическом лечении ожогов, так и при этапном хирургическом лечении, с возможностью на одном животном изучить разные виды лечения ран различной глубины термического поражения.
Сравнивая описанный способ с ближайшими аналогами, стоит выделить ряд недостатков метода создания модели раневых поверхностей при термической травме в эксперименте у лабораторных мышей или крыс путем погружения дорсальной поверхности туловища мыши или крысы в воду, температура которой составляет от 65 до 100 °С, это: 1) сложность применения метода на крупных лабораторных животных, например свиньях; 2) невозможность избежать термического поражения глубоких тканей животного при моделировании ожога кожных покровов; 3) формирование влажного некроза кожных покровов; 4) сложность метода изолирования глубоких тканей от воздействия высоких температур: подкожное введение 150–200 мл воздуха на момент ожоговой травмы с последующим его удалением; данная манипуляция не позволяет в полной мере перенести данную модель к ситуации получения термической травмы у людей; 5) сложность создания раневого дефекта заданного размера [17].
К недостаткам способа моделирования полнослойной кожной раны у самки свиней породы Большая Белая, где шесть полнослойных ран защищены от краевой эпителиализации и ретракции пластиковыми камерами диаметром 4 см, относятся: 1) несовершенство метода защиты от краевой эпителизации пластиковыми камерами; 2) непроизвольная травма-тизация животным сформированных ран; 3) невозможность создания ран разной глубины термического поражения; 4) невозможность объективной оценки эффективности исследуемых биоматериалов на ранах различной глубины термического поражения; 5) расположение раневых поверхностей не на одном участке поверхности тела животного [16].
Заключение. Разработанный нами способ моделирования раны в эксперименте позволяет давать объективную оценку эффективности новых раневых покрытий, проводить сравнительную характеристику течения раневого процесса, при этом метод лишен недостатков, которые имеются у ближайших аналогов.
Список литературы Способ моделирования кожной раны у свиней в эксперименте
- Островский H.B., Куспиц E.B. Проблемы организации первой врачебной помощи и взаимодействия со специализированным ожоговым центром. В кн.: Новые технологии медицинской помощи: материалы науч.-практ конференции. М., 2016; 22-3.
- Богданов СБ., Афаунова O.H. Использование раневых покрытий при хирургическом лечении пограничных ожогов конечностей в функционально активных областях. Врач-аспирант 2016; 79 (6): 4-9.
- Climov М, Medeiros Е, Farkash ЕА, et al. Bioengineered self-assembled skin as an alternative to skin grafts. Plastic and Reconstructive Surgery Global Open 2016; 4 (6): e731.
- MacNeil S. Progress and opportunities for tissue-engineered skin. Nature 2007; 445 (7130): 874-80.
- Burd A, Ahmed K, Lam S, et al. Stem cell strategies in burns care Burns 2007; 33 (3): 282-291.
- Chua A. WC, Khoo YC, Tan BK, et al. Skin tissue engineering advances in severe burns: review and therapeutic applications. Burns Samp; trauma 2016; 4 (1): 3.
- Leclerc T, Thepenier C, Jault P, et al. Cell therapy of burns. Cell proliferation 2011; (44): 48-54.
- Golinski P, Menke H, Hofmann M, et al. Development and characterization of an engraftable tissue-cultured skin autograft: alternative treatment for severe electrical injuries. Cells Tissues Organs 2014; 200 (3-4): 227-39.
- Zeller N, Valesky E, Butting M, et al. Clinical application of a tissue-cultured skin autograft: an alternative for the treatment of non-healing or slowly healing wounds? Dermatology 2014; 229(3): 190-8.
- Богданов СБ., Бабичев P. Г., Марченко Д. Н. и др. Пластика полнослойными кожными ау-тотрансплантатами ран различной этиологии. Инновационная медицина Кубани 2016; (1): 30-7.
- Climov М, Medeiros Е, Farkash ЕА, et al. Bioengineered self-assembled skin as an alternative to skin grafts. Plastic and Reconstructive Surgery Global Open 2016; 4 (6): e731.
- Keck M, Haluza D, Lumenta DB, et al. Construction of a multi-layer skin substitute: simultaneous cultivation of keratinocytes and preadipocytes on a dermal template. Burns 2011; 37 (4): 626-30.
- Wormald JC, Fishman JM, Juniat S. Regenerative medicine in otorhinolaryngology. J Laryngol Otol 2015; 129 (8): 732-9.
- Gallico GG 3rd, O'Connor NE, Compton CC, et al. Permanent coverage of large burn wounds with autologous cultured human epithelium. New England Journal of Meditsine 1984; 311 (7): 448-51.
- Van der Veen VC, van derWal MB, van Leeuwen MC, et al. Biological background of dermal substitutes. Burns 2010; 36 (3): 305-21.
- Шевченко P. В., Джеймс С.Э., Рид М.Дж. и др. Свиная экспериментальная модель как эффективный инструмент переноса научных знаний в клинику для пополнения арсенала комбустиолога. Комбустиология 2007; (30). URL: http://combustiolog.ru/journal/svinaya-e-ksperimental-naya-model-kak-e-ffektivny-j-instrument-perenosa-nauchny-h-znanij-v-kliniku-dlya-popolneniya-arsenala-kombustiologa/(flaTa обращения: 26.01.2020).
- Андреев OB. Моделирование заболеваний. M.: Медицина, 1973; 336 с.


