Способ синтеза нитратов органилтрифенилфосфония из хлоридов органилтрифенилфосфония и азотной кислоты
Автор: Шевченко Дмитрий Павлович, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.14, 2022 года.
Бесплатный доступ
Взаимодействием хлоридов цианометил- и ацетонилтрифенилфосфония с азотной кислотой синтезированы комплексы фосфора [Ph3PCH2CN]NO3 (1) и [Ph3PCH2C(O)Me]NO3 (2) соответственно. Полученные соединения охарактеризованы методом ИК-спектроскопии. Строение соединения 1 установлено методом рентгеноструктурного анализа (РСА). По данным РСА, нитрат цианометилтрифенилфосфония (1) [C20H17N2O3P, M = 364,33; моноклинная сингония, пр. гр. P 21/ n ; параметры ячейки: a = 8,261(9) Å, b = 23,05(2) Å, c = 10,628(10) Å; a = 90,00°, β = 111,32(7)°, g = 90,00°, V = 1886(3) Å3, Z = 4; r(выч.) = 1,283 г/см3; m = 0,167 мм-1; F (000) = 760,0; обл. сбора по 2q: 6,46-56,7°; -11 ≤ h ≤ 11, -30 ≤ k ≤ 30, -14 ≤ l ≤ 14; всего отражений 41975; независимых отражений 4673 ( R int = 0,0607); GOOF = 1,021; R -фактор 4,97 %] имеет ионное строение и состоит из цианометилтрифенилфосфониевого катиона с практически неискаженной тетраэдрической координацией атома фосфора (углы CPC варьируются в пределах 107,17(10)-110,59(11)°; расстояния P-C составляют 1,792(2)-1,820(2) Å) и плоского тригонального нитрат-аниона (сумма углов ONO равна 359,99°). Структурная организация в кристалле 1 обусловлена межионными водородными связями C-H∙∙∙O-NO2 (2,25-2,57 Å), а также слабыми контактами C-H∙∙∙NO3 (2,68 Å). Полные таблицы координат атомов, длин связей и валентных углов нитрата 1 депонированы в Кембриджском банке структурных данных (CCDC 2155177; deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Нитраты органилтрифенилфосфония, синтез, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147238623
IDR: 147238623 | УДК: 546.185+547.53.024+548.312.3 | DOI: 10.14529/chem220307
Текст научной статьи Способ синтеза нитратов органилтрифенилфосфония из хлоридов органилтрифенилфосфония и азотной кислоты
Интерес к фосфорорганическим соединениям (ФОС) обусловлен потенциалом их применения в самых различных областях деятельности человека. ФОС широко используются в качестве смазочных материалов, топливных присадок, антипиренов, пластификаторов, фармацевтических препаратов, реагентов в органическом синтезе; некоторые ФОС обладают свойствами инсектицидов, гербицидов или нервнопаралитических агентов [1–3]. Одними из наиболее исследованных производных ФОС являются комплексы тетраорганилфосфония [R 4 P]X (где R – одинаковые или отличающиеся заместители), получаемые алкилированием/арилированием органофосфинов, а также по реакции соответствующих пентаорганилфосфорных прекурсоров с различными агентами (минеральные кислоты, восстановители) [4, 5]. Важнейшей областью применения солей фосфония можно считать получение из них фосфорных илидов, используемых для синтеза алкенов заданного строения, кроме того, данные соединения широко применяются в качестве объемных катионов для стабилизации различных анионов [6–8], а также в качестве ионных жидкостей [9], межфазных катализаторов [10] и антипиренов [11].
Тем не менее, несмотря на значительный объем накопленных экспериментальных данных по тетраорганилфосфониевым солям, кристаллическое строение и основные физико-химические характеристики нитратных производных [R 4 P]NO 3 известны для достаточно небольшого числа примеров [12–17]. С целью расширения экспериментального материала по данному направлению в настоящей работе нами описан синтез нитратов цианометил- ( 1 ) и ацетонилтрифенилфосфония ( 2 ). Для комплекса 1 приведены результаты рентгеноструктурного исследования, а также рассмотрены основные особенности строения.
Экспериментальная часть
Синтез нитрата цианометилтрифенилфосфония [Ph 3 PCH 2 CN]NO 3 (1) . К раствору 100 мг (0,30 ммоль) хлорида цианометилтрифенилфосфония в воде прибавляли при перемешивании 1 мл азотной кислоты (р-р). Фильтровали раствор от выпавшего в осадок хлорида серебра. После испарения воды из фильтрата получили 101 мг (93 %) бесцветных кристаллов комплекса 1 с т. пл. 182 °С. ИК-спектр (ν, см–1): 3086, 3063, 3030, 2997, 2832, 2787, 2247, 1746, 1487, 1441, 1402, 1383, 1329, 1198, 1163, 1113, 995, 839, 826, 777, 756, 743, 719, 687, 552, 503, 459, 438.
Соединение 2 получали по аналогичной методике.
Нитрат ацетонилтрифенилфосфония [Ph 3 PCH 2 C(O)Me]NO 3 (2) – бесцветные кристаллы, выход 96 %, т. пл. 161 ° С. ИК-спектр ( v , см - 1): 3090, 3049, 3022, 2905, 2860, 2367, 1721, 1585, 1485, 1437, 1385, 1337, 1192, 1159, 1109, 1028, 995, 934, 845, 829, 795, 783, 748, 716, 691, 615, 505, 496, 446, 409.
ИК-спектры соединений 1 и 2 записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S; образцы готовили таблетированием с KBr (область поглощения 4000 - 400 см - 1).
Рентгеноструктурный анализ проводили на автоматическом четырехкружном дифрактометре Bruker D8 QUEST (Mo K « -излучение, X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [18]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [19] и OLEX2 [20]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
1 |
|
Формула |
C 20 H 17 N 2 O 3 P |
|
М |
364,33 |
|
Сингония |
Моноклинная |
|
Пространственная группа |
P 2 1 / n |
|
a , Å |
8,261(9) |
|
b, Å |
23,05(2) |
|
c, Å |
10,628(10) |
|
α, град. |
90,00 |
|
β, град. |
111,32(7) |
|
γ, град. |
90,00 |
|
V , Å3 |
1886(3) |
|
Z |
4 |
|
р (выч.), г/см3 |
1,283 |
|
–1 ц , мм |
0,167 |
|
F (000) |
760,0 |
|
Форма кристалла (размер, мм) |
0,43 × 0,19 × 0,1 |
|
Область сбора данных по 2 0 , град. |
6,46–56,7 |
|
Интервалы индексов отражений |
–11 ≤ h ≤ 11, –30 ≤ k ≤ 30, –14 ≤ l ≤ 14 |
|
Измерено отражений |
41975 |
|
Независимых отражений ( R int) |
4673 (0,0607) |
|
Отражений с I > 2 g ( I) |
4673 |
|
Переменных уточнения |
235 |
|
GOOF |
1,021 |
|
R -факторы по F 2 > 2 g ( F 2) |
R 1 = 0,0497, wR 2 = 0,1183 |
|
R -факторы по всем отражениям |
R 1 = 0,0818, wR 2 = 0,1347 |
|
Остаточная электронная плотность (min/max), e /Å3 |
–0,29/0,31 |
Таблица 2
Длины связей и валентные углы в структуре 1
|
Связь d , Å |
Угол ω, град. |
||
|
P(1)–C(1) |
1,792(2) |
C(1)P(1)C(7) |
107,17(10) |
|
P(1)–C(11) |
1,796(2) |
C(1)P(1)C(11) |
110,49(11) |
|
P(1)–C(21) |
1,800(3) |
C(1)P(1)C(21) |
110,59(11) |
|
P(1)–C(7) |
1,820(2) |
C(11)P(1)C(7) |
109,85(11) |
|
C(7)–C(8) |
1,459(3) |
C(11)P(1)C(21) |
109,79(12) |
|
C(8)–N(2) |
1,138(3) |
C(21)P(1)C(7) |
108,90(11) |
|
N(1)–O(1) |
1,229(3) |
O(1)N(1)O(2) |
120,3(2) |
|
N(1)–O(2) |
1,244(3) |
O(1)N(1)O(3) |
119,8(2) |
|
N(1)–O(3) |
1,233(3) |
O(2)N(1)O(3) |
119,9(2) |
.
Обсуждение результатов
Известно, что реакции обмена галогенид-аниона в галогенидах органилтрифенилфосфония используются для получения комплексов платины, золота и серебра [6, 21, 22]. Интересный случай замещения галогенид-аниона на остаток более сильной кислоты описан авторами работы [23], в которой описываются реакции галогенидов органилтрифенилфосфония с аренсульфоновыми кислотами в воде, приводящие к образованию аренсульфонатов органилтрифенилфос-фония.
В продолжение исследований в области реакций замещения галогенид-аниона в производных фосфора [Ph3PR]Hal нами получены нитраты цианометил- и ацетонилтрифенилфосфония: [Ph 3 PCH 2 CN]NO 3 ( 1 ) и [Ph 3 PCH 2 C(O)Me]NO 3 ( 2 ):
[Ph 3 PCH 2 CN]Cl + HNO 3 [Ph 3 PCH 2 CN]NO 3 + HCl
[Ph 3 PCH 2 C(O)Me]Cl + HNO 3 [Ph 3 PCH 2 C(O)Me]NO 3 + HCl
ИК-спектры полученных соединений содержат характерные для органилтрифенилфосфоние-вых солей полосы поглощения колебаний связей P–CPh в областях 1450-1435 см–1 и 1005–995 см–1: 1441, 995 ( 1 ) и 1437, 995 ( 2 ) см–1. В ИК-спектре комплекса 1 наблюдается полоса валентных колебаний связи C≡N при 2247 см–1; в свою очередь, ИК-спектр комплекса 2 содержит интенсивную полосу поглощения валентных колебаний связи C=O при 1720 см–1. Кроме того, спектры обоих комплексов содержат достаточно интенсивные полосы поглощения при 1329 и 1337 см–1, вероятно, относящиеся к асимметричным валентным колебаниям N–O связи аниона NO 3 –. В ИК-спектре соединения 1 также наблюдается слабоинтенсивная полоса поглощения при 1746 см–1, что характерно для валентных колебаний N=O свободных нитратных анионов; в спектре продукта 2 аналогичная область перекрыта сильной полосой поглощения карбонильной группы. Среди прочих ИК-спектры обоих комплексов содержат типичные полосы поглощения в интервалах 3086–2997 ( 1 ), 3090–2994 ( 2 ) см–1 и 2832–2787 ( 1 ), 2905–2860 ( 2 ) см–1, относящиеся к валентным колебаниям связей C–H Ar и C–H Alk соответственно [24, 25].
В то время как структура нитрата 1 была доказана нами впервые, кристаллическое строение продукта 2 , определенное с низким значением R -фактора, уже было описано ранее [14], и поэтому не будет обсуждаться в данной работе.
Комплекс 1, по данным РСА, состоит из слабо искаженного тетраэдрического цианометилтрифенилфосфониевого катиона и плоского тригонального нитратного аниона (рис. 1). Углы CPC в катионе изменяются в интервале 107,17(10)-110,59(11)°; сумма углов ONO в нитрат-анионе составляет 359,99°. Длины связей P-C варьируются от 1,792(2) А до 1,820(2) А и не превышают суммы ковалентных радиусов атомов фосфора и sp3-гибридизованного углерода (1,88 Å [26]).
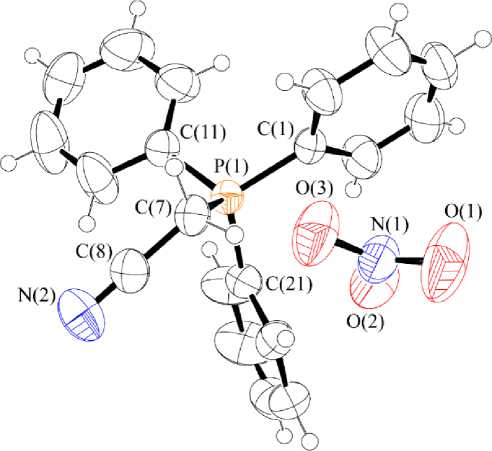
Рис. 1. Строение нитрата [Ph 3 PCH 2 CN]NO 3 (1)
Пространственная организация нитрата 1 в основном обусловлена водородными связями C– H∙∙∙O–NO2 (рис. 2), длины которых варьируются в интервале 2,25–2,57 Å и не превышают суммы ван-дер-ваальсовых радиусов атомов водорода и кислорода (H∙∙∙O 2,62 Å [27]).
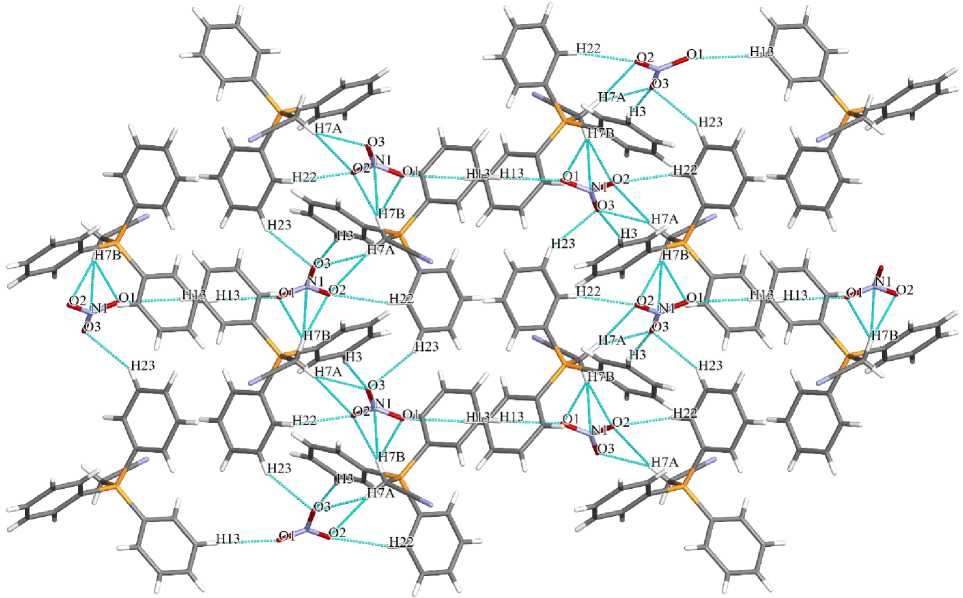
Рис. 2. Структурная организация в кристалле 1 (проекция вдоль оси a )
Стоит отметить, что катионы и анионы в кристалле 1 достаточно плотно упакованы, в результате чего некоторые расстояния (H)C∙∙∙O–NO2 (донор∙∙∙акцептор) имеют достаточно малую длину, не превышающую сумму ван-дер-ваальсовых радиусов атомов углерода и кислорода (C∙∙∙O 3,22 Å [27]). Также примечательно, что CN-группа алкильного радикала катиона фосфония не принимает участия в коротких межионных контактах. Единственным азотсодержащим межионным контактом является C–H∙∙∙NO3, составляющий 2,68 Å, что близко к сумме ван-дер-ваальсовых радиусов атомов водорода и азота (H∙∙∙O 2,65 Å [27]). Дополнительные сведения по водородным взаимодействиям представлены в табл. 3.
Таблица 3
Геометрические параметры водородных связей в кристалле 1
|
D –H∙∙∙ A |
H∙∙∙ A , Å |
D ∙∙∙ A , Å |
D –H∙∙∙ A , град. |
|
C(3)–H(3)∙∙∙O(3) |
2,42 |
3,29 |
156,27 |
|
C(7)–H(7A)∙∙∙O(3) |
2,32 |
3,21 |
151,41 |
|
C(7)–H(7A)∙∙∙O(2) |
2,52 |
3,21 |
151,91 |
|
C(7)–H(7B)∙∙∙O(2) |
2,25 |
3,21 |
171,45 |
|
C(7)–H(7B)∙∙∙O(1) |
2,47 |
3,22 |
133,77 |
|
C(13)–H(13)∙∙∙O(1) |
2,57 |
3,42 |
153,26 |
|
C(22)–H(22)∙∙∙O(2) |
2,49 |
3,30 |
145,08 |
|
C(23)–H(23)∙∙∙O(3) |
2,50 |
3,35 |
151,35 |
|
C(7)–H(7B)∙∙∙N(2) |
2,68 |
3,60 |
158,91 |
Заключение
Таким образом, нами получены нитратные соли цианометил- ( 1 ) и ацетонилтрифенилфосфония ( 2 ); строение нитрата 1 впервые изучено методом рентгеноструктурного анализа. По данным РСА, соединение 1 состоит из слабо искаженных тетраэдрических цианометилтрифенилфосфониевых катионов и плоских тригональных нитрат-анионов. Межионные взаимодействия в кристалле 1 представлены водородными связями C–H∙∙∙O–NO2 и слабыми контактами C–H∙∙∙NO3.
Список литературы Способ синтеза нитратов органилтрифенилфосфония из хлоридов органилтрифенилфосфония и азотной кислоты
- Richardson R.J., Makhaeva G.F. Organophosphorus Compounds // Encyclopedia of Toxicology: 3rd Ed. San Diego: Academic Press Inc., 2014. P. 714-719. DOI: 10.1016/B978-0-12-386454-3.00173-1.
- Phosphorus Compounds: Advanced Tools in Catalysis and Material Sciences, ed. by M. Peruzzi-ni, L. Gonsalvi / New York: Springer, 2011. 470 p. DOI: 10.1007/978-90-481-3817-3.
- Alkyloxy- and Silyloxy-Derivatives of P(V) and Sb(V) / G.A. Razuvaev, N.A. Osanova, T.G. Brilkina, T.I. Zinovjeva, V.V. Sharutin // J. Organomet. Chem. 1975. Vol. 99, no. 1. P. 93-106. DOI: 10.1016/S0022-328X(00)86365-2.
- The Chemistry of Organophosphorus Compounds. Volume 3: Phosphonium Salts, Ylides and Phosphoranes, ed. by F.R. Hartley / New York: John Wiley & Sons, 1994. 442 p. DOI: 10.1002/047003436X.
- Зыкова А.Р. Синтез и строение арильных соединений фосфора // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 4. С. 5-50. DOI: 10.14529/chem200401.
- Синтез и строение комплексов платины с хлоридами органилтрифенилфосфония и ДМСО / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин, А.Р. Ткачева // Журн. общ. химии. 2018. Т. 88, № 7. С. 1165-1170. DOI: 10.1134/S0044460X1807017X.
- Szell P.M.J., Gabidullin B., Bryce D.L. 1,3,5-Tri(iodoethynyl)-2,4,6-trifluorobenzene: Halogen-Bonded Frameworks and NMR Spectroscopic Analysis // Acta Crystallogr. B: Struct. Sci. Cryst. Eng. Mater. 2017. Vol. 73, no. 2. P. 153-162. DOI: 10.1107/S2052520617000944.
- Diop M.B., Diop L., Oliver A.G. Acetonyltriphenylphosphonium 2,3,5-Triphenyltetrazolium Te-trachloridocuprate(II) // Acta Crystallogr. E: Crystallogr. Commun. 2018. Vol. 74, no. 1. P. 69-71. DOI: 10.1107/S205698901701800X.
- Macarie L., Simulescu V., Ilia G. Phosphonium-Based Ionic Liquids Used as Reagents or Catalysts // ChemistrySelect. 2019. Vol. 4, no. 32. P. 9285-9299. DOI: 10.1002/slct.201901712.
- Liu S., Kumatabara Y., Shirakawa S. Chiral Quaternary Phosphonium Salts as Phase-Transfer Catalysts for Environmentally Benign Asymmetric Transformations // Green Chem. 2016. Vol. 18, № 2. P. 331-341. DOI: 10.1039/C5GC02692J.
- Weil E.D., Levchik S.V. Flame Retardants in Commercial Use or Development for Textiles // J. Fire Sci. 2008. Vol. 26, no. 3. P. 243-281. DOI: 10.1177/0734904108089485.
- Effect of Anions on the Solid-State Interplay of Symmetric and Unsymmetric Phosphonium Cations / I. Ling, B.W. Skelton, A.N. Sobolev, Y. Alias, Z.C. Khor, C.L. Raston // New J. Chem. 2020. Vol. 44, no. 25. P. 10220-10228. DOI: 10.1039/D0NJ01975E.
- Understanding the Structural Properties of p-Xylylenebis(triphenylphosphonium) Cation Under Different pH and Anion Conditions / I. Ling, A.N. Sobolev, B.W. Skelton, C.L. Raston // Cryst. Eng. Comm. 2020. Vol. 22, no. 44. P. 7704-7715. DOI: 10.1039/D0CE01274B.
- Acetonyltriphenylphosphonium Nitrate / T. Diop, L. Diop, M. Kuceráková, M. Dusek // Acta Crystallogr. E: Crystallogr. Commun. 2013. Vol. 69, no. 2. P. o303-o303. DOI: 10.1107/S1600536813002110.
- Neumüller B., Dehnicke K. Die Kristallstrukturen von [Ph3PMe]ClCH2Cl2, [Ph4P]NO3CH2Cl2 und [Ph4P]2[SiF6]CH2Cl2 // Z. Anorg. Allg. Chem. 2008. Vol. 634, no. 14. P. 25672571. DOI: 10.1002/zaac.200800357
- Mariyatra M.B., Panchanatheswaran K., Goeta A.E. Triphenyl(benzoylmethyl)phosphonium Nitrate: a Three-Dimensional Hydrogen-Bonded Network // Acta Crystallogr. E: Crystallogr. Commun. 2002. Vol. 58, no. 8. P. o807-o809. DOI: 10.1107/S1600536802011431.
- Li S.-L., Mark T.C.W. Molecular Structures of Some Tertiary Phosphine Betaines in Their Crystalline Adducts // J. Mol. Struct. 1996. Vol. 384, no. 2-3. P. 135-148. DOI: 10.1016/S0022-2860(96)09348-9.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea, J.A.K. Howard, H. Puschmann // J. Appl. Cryst. 2009. V. 42. P. 339-341. DOI: 10.1107/S0021889808042726.
- Попкова М.А., Шарутин В.В. Синтез и строение дицианоаурата цианометилтрифенил-фосфония и дицианоаргентата бензилтрифенилфосфония // Вестник ЮУрГУ. Серия «Химия». 2021. Т. 13, № 4. С. 110-119. DOI: 10.14529/chem210409
- Синтез и строение дицианодииодоауратов тетра(пара-толил)сурьмы [p-ToUSb][Au(CN)2I2] и алкилтрифенилфосфония [Ph3PAlk][Au(CN)2I2], Alk = Me, CH2CN / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов, О.С. Ельцов // Коорд. химия. 2020. Vol. 46, № 9. C. 554-561. DOI: 10.31857/S0132344X20090030.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. Синтез и строение органосульфонатов органилтрифенилфосфония [Ph3PR][OSO2R'], R = Ph, R' = C6H3Cl2-2,5; R = C6Hn-cjc/o, R' = C6H3Cl2-2,5; R = CH2OMe, R' = C6H3(NO2)2-2,4; R = CH2OMe, R' = C6H4COOH-2) // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41-51. DOI: 10.14529/chem220205.
- Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных: пер. с англ. Б.Н. Тарасевича. М.: Мир, 2006. 440 с.
- Lever A.B.P., Mantovani E., Ramaswamy B.S. Infrared Combination Frequencies in Coordination Complexes containing Nitrate Groups in various Coordination Environments. A Probe for the Metal-Nitrate Interaction // Can. J. Chem. 1971. Vol. 49, no. 11. P. 1957-1964. DOI: 10.1139/v71-315.
- Covalent Radii Revisited / B. Cordero, V. Gómez, A.E. Platero-Prats, M. Revés, J. Echeverría, E. Cremades, F. Barragán, S. Alvarez // Dalton Trans. 2008. no. 21. P. 2832-2838. DOI: 10.1039/B801115J.
- Consistent van der Waals Radii for the Whole Main Group / M. Mantina, A.C. Chamberlin, R. Valero, C.J. Cramer, D.G. Truhlar // J. Phys. Chem. A. 2009. V. 113, no.19. P. 5806-5812. DOI: 10.1021/jp8111556.


