Способность агониста к-опиоидных рецепторов U-50,488 имитировать феномен ишемического посткондиционирования сердца
Автор: Мухомедзянов Александр Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.31, 2016 года.
Бесплатный доступ
Была исследована способность агониста к1-опиоидных рецепторов (ОР) U-50,488 в дозах 0,1 и 1 мг/кг имитировать ишемическое посткондиционирование сердца. Продолжительность ишемии составляла 10 или 45 мин, а реперфузии - 10 мин или 2 ч. Показано, что введение U-50,488 в дозе 1 мг/кг как до ишемии, так и за 5 мин до реперфузии оказывало выраженный антиаритмический эффект. Препарат U-50,488 при инъекции за 5 мин до реперфузии способствовал уменьшению соотношения “зона инфаркта/область риска” в 2 раза. Антиаритмический эффект агониста к-ОР зависел от активации к-ОР.
Сердце, реперфузия, к-опиоидные рецепторы, посткондиционирование, к-opioid receptors
Короткий адрес: https://sciup.org/14920088
IDR: 14920088 | УДК: 612.172.1
Текст научной статьи Способность агониста к-опиоидных рецепторов U-50,488 имитировать феномен ишемического посткондиционирования сердца
Госпитальная летальность у пациентов с острым инфарктом миокарда (ОИМ) довольно высока, в Европе она составляет 7,3%, а в России – 13,8% [1], что предопределяет актуальность поиска новых способов защиты сердца от ишемии и реперфузии. До 1986 г. было неизвестно, можно ли радикально повлиять на толерантность сердца к ишемическим и реперфузионным воздействиям. Ситуация изменилась после открытия феномена ишемического прекондиционирования (ischemic preconditioning) [4], суть которого заключается в том, что после одного или нескольких сеансов кратковременной ишемии-реперфузии миокард становится устойчивым к действию длительной ишемии с последующей реперфузией. Семнадцать лет спустя был открыт еще один феномен, на- званный “ишемическим посткондиционированием” (ischemic postconditioning), который заключается в том, что несколько кратковременных сеансов повторной (после снятия лигатуры с коронарной артерии) ишемии и последующей реперфузии способны эффективно уменьшить размер формирующегося затем инфаркта миокарда (ИМ) [9]. Согласно данным литературы, перспективным для защиты миокарда от патогенного действия ишемии-реперфузии является использование фармакологической имитации феномена ишемического прекондиционирования и посткондиционирования (ИП) с помощью агонистов ОР [7].
Цель работы: выяснить, способен ли агонист к-опио-идных рецепторов U-50,488 имитировать феномен ишемического посткондиционирования.
Материал и методы
Исследования были проведены на 118 крысах-самцах линии Вистар массой 250-300 г. Перед моделированием коронароокклюзии крысы были наркотизированы б-хло-ралозой (50 мг/кг, внутрибрюшинно, Sigma) и подключены к аппарату искусственной вентиляции легких “SAR-830 Series” (CWE Inc. США). Коронароокклюзию и реперфузию воспроизводили по методу группы проф. J.E.J. Schultz [8]. Лигатуру на левую нисходящую коронарную артерию накладывали на границе предсердия и желудочка под контролем электрокардиограммы (ЭКГ), для записи которой использовали аппарат для электрофизиологических исследований MP35 (Biopac System Inc., Goleta, США). После 45-минутной ишемии лигатуру ослабляли до появления эпикардиальной гиперемии. Продолжительность реперфузии составляла 2 ч. Выявление зоны инфаркта и зоны риска проводили по методу J. Neckar и соавт. [5]. Для этого после окончания реперфузии сердца извлекали из грудной клетки и промывали с помощью шприца через канюлированную аорту физиологическим раствором, содержащим 125 МЕ/мл гепарина. Для определения области риска лигатуру вновь затягивали, и миокард окрашивали струйно через аорту 5%-м перманганатом калия, затем промывали сердце физиологическим раствором. С помощью слайсера HSRA001-1 (Zivic Instruments, Pittsburgh, США) делали срезы сердца толщиной в 1 мм перпендикулярно к продольной оси. Областью риска принято называть миокард, подвергавшийся воздействию ишемии-реперфузии. Он остается неокрашенным после промывания перманганатом калия. Зону некроза идентифицировали после помещения срезов миокарда в 1%-й раствор 2,3,5-трифенил тет-разолия хлорида на 30 мин при 37 °C. Инфарцирован-ный миокард не окрашивался тетразолия хлоридом, поскольку не содержал дегидрогеназы. После окончания окраски срезы помещали в 10%-й раствор формальдегида на 1 сутки. Размер области риска и зоны инфаркта определяли планиметрическим методом, используя сканер HP Scanjet G4050 (HP Company, США) и программное обеспечение INSTBSL-W компании Biopac System Inc., (Goleta, США). Размер зоны инфаркта выражали в процентах от размера зоны гипоперфузии (области риска) как соотношение “зона инфаркта/область риска” (ЗИ/ОР).
После 45-минутной коронароокклюзии реперфузионные аритмии практически не возникают [4], поэтому для их моделирования мы в отдельной серии экспериментов использовали 10-минутную коронароокклюзию и последующую 10-минутную реперфузию [9].
Агонист к1-опиоидных рецепторов U-50,488 вводили внутривенно в дозах 0,1 и 1 мг/кг за 15 мин до ишемии и в дозе 1 мг/кг за 2 и 5 мин до реперфузии. Неселективный антагонист периферических ОР налоксона ме-тиодид вводили за 25 мин до коронароокклюзии в дозе 5 мг/кг.
Статистическую обработку полученных данных проводили с помощью программы STATISTICA 6.0. Рассчитывали среднее арифметическое (M) и стандартную ошибку среднего (SEM, standarderrorofmean). Гипотезу о равенстве средних значений двух выборок проверяли с помощью критерия Вилкоксона–Манна–Уитни для определения достоверности влияния U-50,488 на соотношение ЗИ/ ОР. Для статистического анализа нарушений сердечного ритма использовали критерий χ 2.
Результаты
Моделирование острой 10-минутной ишемии в контрольной группе животных вызывало следующие нарушения сердечного ритма: у 95% крыс возникали множественные желудочковые экстрасистолы, переходящие в желудочковые тахикардии и фибрилляцию желудочков с пос-
Таблица 1
Антиаритмический эффект U-50,488 при введении за 15 мин до ишемии, n (%)
|
Группы |
Ишемия (10 мин) Реперфузия (10 мин) БЖА МЖЭ ЖТ ЖФ БЖА МЖЭ ЖТ ЖФ |
|
Контроль, n=20 (-)-U-50,488 за 15 мин до ишемии (0,1 мг/кг), n=15 U-50,488 за 15 мин до ишемии (1 мг/кг), n=19 Налоксона метиодид+(-)-U-50,488, n=14 |
1 (5) 19 (95) 18 (90) 2 (10) 1 (5) 19(95) 17 (85) 2 (10) 2(13) 13(87) 8 (57) 1 (7) 2 (13) 13 (87) 11 (73) 3 (20) **9 (47) **10(59) *7 (37) 0 (0) **8 (42) **10 (53) 8 (42) **0 (0) 2 (14) 12 (86) 8 (57) 0 (0) 3 (21) 7 (50) 9 (64) 0 (0) |
Примечание: n – количество животных в группе. В скобках указан процент животных в группе. БЖА – без желудочковых аритмий, МЖЭ – множественные желудочковые аритмии, ЖТ – желудочковая тахикардия, ЖФ – желудочковая фибрилляция. * – р<0,05, ** – р<0,025 – достоверность по отношению к группе контроля.
Таблица 2
Антиаритмический эффект U-50,488 при введении за 2 и 5 мин до реперфузии
|
Группы |
Ишемия (10 мин) Реперфузия (10 мин) БЖА МЖЭ ЖТ ЖФ БЖА МЖЭ ЖТ ЖФ |
|
Контроль, n=20 U-50,488(1 мг/кг) За 2 мин до реперфузии, n=15 U-50,488(1 мк/кг) за 5 мин до реперфузии, n=15 |
1(5) 19(95) 18(90) 2(10) 1(5) 19(95) 17(85) 2(10) 2 (13) 13(87) 13(87) 3(20) 1(7) 14(93) 10(66) 3(20) 2(13) 13(87) 11(73) 2(13) 5(33)* 10(67) 9(60) 2(13) |
Примечание: обозначения те же, что в таблице 1.
ледующим восстановлением синусного ритма соответственно в 90 и 10% случаев (табл. 1). У 5% особей контрольной группы желудочковых нарушений сердечного ритма не развивалось.
В течение 10-минутного периода после восстановления кровотока у 95% животных также были зарегистрированы множественные желудочковые экстрасистолы, которые переходили в желудочковые тахикардии и фибрилляцию желудочков в 85 и 10% случаев соответственно (табл. 1). У 5% животных контрольной группы желудочковые аритмии не развивались. Как показано в таблице 1, предварительное введение селективного агониста к1-ОР U-50,488 в дозе 0,1 мг/кг за 15 мин до ишемии не оказывало антиаритмического действия. В то же время инъекция U-50,488 за 15 мин до ишемии в более высокой дозе (1 мг/кг) способствовала достоверному снижению частоты возникновения желудочковых экстрасистол и желудочковой тахикардии во время острой ишемии. После применения U-50,488 (1 мг/кг) крысы в 47% случаев приобретали устойчивость и к аритмогенному действию в условиях восстановления коронарного кровотока. Так, частота появления реперфузионных желудочковых экстрасистол в этой серии уменьшалась в 1,8 раза, а желудочковая фибрилляция вообще не возникала. Предварительное введение блокатора периферических ОР налоксона метиодида полностью устраняло антиаритмичес-кий эффект U-50,488 (табл. 1). Следовательно, повышение электрической стабильности сердца после инъекции U-50,488 является результатом активации периферических ОР.
Как показано в таблице 2, внутривенное введение U-50,488 в дозе 1 мг/кг за 5 мин до снятия лигатуры с коронарной артерии также оказывало антиаритмическое действие. Количество животных без желудочковых аритмий возрастало с 5% в контроле до 33% в серии с введением опиоида. Вместе с тем этот эффект был слабее, чем при введении агониста к-ОР за 15 мин до коронароокклю-зии. Так, нам не удалось обнаружить достоверного снижения частоты возникновения желудочковых экстрасистол и желудочковой тахикардии. Предварительное введение U-50,488 в дозе 1 мг/кг за 2 мин до реперфузии не оказало влияния на частоту и характер реперфузионных аритмий.
Полученные результаты согласуются с данными J.N. Peart и соавт. [6], которые показали, что введение агониста к-ОР U-50,488 в дозе 0,1 мг/кг за 10 мин до реперфузии оказывает антиаритмический эффект. В нашем случае эффекта удалось добиться в дозе 1 мг/кг. Кроме того, мы смогли показать, что U-50,488 имитирует антиарит-мический эффект посткондиционирования.
Из рисунка 1 видно, что у животных контрольной группы после окончания реперфузии индекс ЗИ/ОР составлял 43%. Внутривенное введение U-50,488 в дозе 1 мг/кг за 5 мин до реперфузии способствовало уменьшению соотношения ЗИ/ОР с 43 до 25% (рис. 1). Эти данные согласуются с результатами, полученными J.N. Peart и соавт. [7] о способности U-50,488 имитировать феномен посткондиционирования сердца. Предварительное введение U-50,488 в дозе 1 мг/кг за 2 мин до реперфузии не повлияло на соотношение ЗИ/ОР.
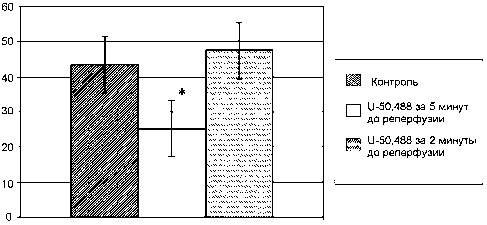
Рис. 1. Кардиопротекторный эффект U-50,488 при введении за 5 мин до реперфузии. Примечание: U-50,488 1 мг/кг за 5 мин до реперфузии, U-50,488 1 мг/кг за 2 мин до реперфузии. * – р<0,05 – достоверность относительно контроля
Как известно, даже при длительной и глубокой ишемии кровоток в зоне инфаркта никогда не падает до нулевых значений [2], то есть во время коронароокклюзии остаточный кровоток в зоне ишемии сохраняется, и лекарственные препараты могут поступать в ишемизированный миокард. Этим можно объяснить тот факт, что введение агонистов к-опиоидных рецепторов за 5 мин до реперфузии оказало защитный эффект. Видимо, препарат, введенный за 2 мин до реперфузии, не успевает накопиться в зоне риска в достаточном количестве, чтобы активировать нужное количество ОР в ткани миокарда. Однако при введении за 5 мин до начала реперфузии нужное количество опиоида накапливается в зоне ишемии, что обеспечивает стимуляцию ОР и повышение толерантности сердца к патогенному действию ишемии.
Заключение
Таким образом, результаты наших исследований свидетельствуют о том, что агонист к-опиоидных рецепторов U-50,488 способен не только оказывать антиаритми-ческий эффект при профилактическом применении, но также может имитировать феномен ишемического посткондиционирования, то есть оказывать инфаркт-лими-тирующий и антиаритмический эффекты после того, как ишемическое повреждение сердца уже произошло. Защитные эффекты U-50,488 связаны с активацией периферических ОР.
Список литературы Способность агониста к-опиоидных рецепторов U-50,488 имитировать феномен ишемического посткондиционирования сердца
- Марков В.А., Рябов В.В., Максимов И.В. и др.//Сибирский медицинский журнал (Томск). -2011. -Т. 26, № 2, вып.1. -C. 8-14.
- Bolli R., Triana J.F., Jeroudi M.O.//Circ. Res. -1990. -Vol. 67, No. 2. -P. 332-343.
- Maslov L.N., Lishmanov Yu.B., Oeltgen P.R. et al.//Life Sci. -2009. -Vol. 84, No. 19-20. -P. 657-663.
- Murry C.E., Jennings R.B., Reimer K.A.//Circulation. -1986. -Vol. 74, No. 5. -P. 1124-1136.
- Neckar J., Szarszoi O., Herget J. et al. Cardioprotective effect of chronic hypoxia is blunted by concomitant hypercapnia//Physiol. Res. -2003. -Vol. 52, No. 2. -P. 171-175.
- Peart J.N., Gross E.R., Gross G.J.//J. Cardiovasc. Pharm. -2004. -Vol. 43(3). -P. 410-415.
- Peart J.N., Gross E.R., Reichelt M.E. et al.//Basic Res. Cardiol. -2008. -Vol. 103, No. 5. -P. 454-463.
- Schultz J.E.J., Hsu A.K., Gross G.J.J.//Mol. Cell. Cardiol. -1997. -Vol. 29, No. 8. -P. 2187-2195.
- Zhao Z.Q., Corvera J.S., Halkos M.E. et al.//Am. J. Physiol. Heart Circ. Physiol. -2003. -Vol. 285, No. 2. -P. H579-H588.


