Способность ооцитов коров к эмбриональному развитию при созревании в разных системах двухфазного культивирования
Автор: Сингина Г.Н., Лебедева И.Ю., Шедова Е.Н., Тарадайник Т.Е., Митяшова О.С., Цындрина Е.В., Данч С.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные биотехнологии
Статья в выпуске: 4 т.52, 2017 года.
Бесплатный доступ
Существующие подходы к двухфазному способу культивирования ооцитов крупного рогатого скота (КРС) не учитывают их специфические потребности в период созревания от метафазы I до метафазы II, в том числе необходимость нормализации профилей половых стероидных гормонов в культуральной среде. Целью представленного исследования было сравнение компетенции к развитию у ооцитов коров ( Bos taurus taurus ), созревших в общепринятой однофазной и различных двухфазных системах. Нами впервые изучена способность яйцеклеток развиваться до стадии бластоцисты и качество полученных эмбрионов при замене стандартной среды на втором этапе культивирования на среду, свободную от фолликулостимулирующего гормона (ФСГ), а также на культуру клеток гранулезы. При использовании однофазной системы ооцит-кумулю-сные комплексы (ОКК) культивировали в течение 24 ч в среде ТС-199, содержащей 10 % фетальной бычьей сыворотки (ФБС), 10 мкг/мл ФСГ и 10 мкг/мл лютеинизирующего гормона (ЛГ). В двухфазной системе ооциты созревали в тех же условиях в течение первых 12 ч. Затем ОКК пересаживали в новую среду (ТС-199, содержащую 10 % ФБС, или эту же среду, дополненную 5 мкг/мл ЛГ) и культивировали 12 ч в присутствии и в отсутствие клеток гранулезы. Через 24 ч созревания проводили оплодотворение ооцитов. В эмбрионах, развившихся до стадий поздней морулы и бластоцисты на 7-е сут культивирования, оценивали степень апоптоза (методом TUNEL) и общее число ядер (окраска DAPI). В средах, собранных после созревания ооцитов, определяли содержание прогестерона и 17b-эстрадиола методом иммуноферментного анализа. Доля ооцитов, вступивших в первое деление дробления (57,6-68,1 %) или развившихся до стадий поздней морулы/бластоцисты (16,7-20,7 %), не была связана со способом или средой культивирования. Перенос ооцитов через 12 ч созревания в среду, лишенную гонадотропных гормонов, приводил к увеличению общего числа ядер в поздних морулах/бластоцистах в 1,3-1,4 раза (p
Ооциты коров, двухфазная система созревания in vitro, эмбриональное развитие, половые стероидные гормоны
Короткий адрес: https://sciup.org/142214070
IDR: 142214070 | УДК: 636.2:591.39 | DOI: 10.15389/agrobiology.2017.4.776rus
Текст научной статьи Способность ооцитов коров к эмбриональному развитию при созревании в разных системах двухфазного культивирования
Использование экстракорпорального оплодотворения в сочетании с технологией трансплантации эмбрионов рассматривается как один из надежных и эффективных способов разведения высокопродуктивных и ценных особей, а также сохранения генетического потенциала редких и исчезающих пород (1). Разработанные к настоящему времени протоколы культивирования и оплодотворения in vitro ооцитов домашней коровы (Bos taurus taurus) позволяют получить достаточно высокий выход морул и бластоцист, однако потенциал к эмбриональному развитию у созревших вне организма яйцеклеток по-прежнему остается значительно более низ- ким, чем у яйцеклеток, созревших in vivo (2).
В организме животных развитие ооцитов происходит в фолликулах яичников, где они естественным образом и последовательно приобретают способность к ядерному созреванию от стадии диплотены до стадии метафазы II. Процессу ядерного созревания ооцитов сопутствует комплекс цитоплазматических преобразований, охватывающих изменения в организации индивидуальных органелл и молекулярные трансформации, которые необходимы для приобретения яйцеклетками компетенции к оплодотворению и последующему эмбриональному развитию (3). Когда незрелые ооциты выделяют из фолликулов и культивируют in vitro, мейоз в них возобновляется спонтанно и преждевременно, что приводит к неполному цитоплазматическому созреванию и снижению способности к развитию (4). При этом условия окружающей среды в культуре становятся одним из ключевых факторов, определяющих качество зрелых ооцитов (2).
В настоящее время существуют различные подходы к повышению полноценности ооцитов в процессе их созревания in vitro (in vitro maturation , IVM). Наиболее интересными представляются попытки смоделировать события, происходящие в естественных условиях. Один из таких подходов сфокусирован на анализе метаболических процессов в созревающих ооцит-кумулюсных комплексах (ОКК) (5, 6). На основании данных этого анализа предполагается модифицировать среду культивирования в соответствии с энергетическими потребностями ооцитов и их метаболической кооперацией с окружающими соматическими клетками. В работах других исследователей сделаны попытки использовать добавки в среду паракринных факторов, которые продуцируются ооцитами и могут поддерживать определенную степень дифференцировки клеток кумулюса (7, 8).
Поскольку в период созревания in vitro ооцитов млекопитающих существует временная несогласованность (асинхронность) между ядерны-ми и цитоплазматическими преобразованиями, более перспективным выглядит дифференцированный подход, предусматривающий использование двухфазной системы культивирования. Целесообразность применения двухфазного протокола созревания in vitro ооцитов крупного рогатого скота (КРС) активно изучается в последние несколько лет. Ведется поиск оптимальных методов ингибирования спонтанного возобновления мейоза (9, 10). Считается, что торможение мейоза может позволить большему числу ооцитов завершить цитоплазматические преобразования и приобрести компетенцию к развитию. Ооциты, выделенные из фолликулов, некоторое время культивируют в среде созревания с добавлением регуляторов мейо-за, главным образом ингибиторов cdk-киназ, способных блокировать переход от диплотены к метафазе I, а затем — в отсутствие этих веществ. Тем не менее, полученные результаты довольно противоречивы и свидетельствуют о необходимости поиска специфических молекул для стимуляции ооцитов во время блокирования мейоза (11-15).
Следует отметить, что основные цитоплазматические преобразования, от которых в конечном итоге зависит способность ооцитов к эмбриональному развитию, происходят не на начальном, а на завершающем этапе созревания, что свидетельствует о необходимости изучать специфические потребности женских гамет именно в этот период. По данным ряда авторов, при созревании ооцитов коров in vitro, как и in vivo, наблюдается повышение концентрации прогестерона и снижение концентрации эстрогенов в среде культивирования. Наиболее значимые изменения в кинетике этих процессов происходят через 8-10 ч с момента начала IVM, что соответствует периоду от метафазы I до метафазы II (16-18). В то же время во многих общепринятых однофазных системах культивирования ооцитов коров, включающих фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны или их аналоги, характер изменений соотношения 170-эстрадиола и прогестерона отличается от такового in vivo (19).
Поэтому представляется целесообразным использовать новый подход к двухфазному культивированию. Он основан на созревании яйцеклеток коров до стадии метафазы I в стандартной системе и последующем переносе в новую среду, модифицированную внесением физиологически уместных веществ, которые оказывают лютеотропное действие, или клеток гранулезы, обладающих большей стероидогенной активностью, чем клетки кумулюса (20).
Нами впервые изучена способность яйцеклеток к развитию до стадии бластоцисты и качество полученных эмбрионов при замене стандартной среды на втором этапе культивирования на среду, свободную от ФСГ (стимулятора синтеза эстрогенов), а также на культуру клеток гранулезы.
Целью представленного исследования было сравнение компетенции к развитию у ооцитов коров, созревших в общепринятой однофазной и различных двухфазных системах.
Методика . Во всех экспериментах, кроме отдельно указанных случаев, были использованы реагенты фирмы «Sigma-Aldrich» (США).
Объектом исследования служили ооцит-кумулюсные комплексы (ОКК) из антральных фолликулов яичников коров ( Bos taurus taurus ) и половозрелых телок. Яичники, отобранные после убоя, доставляли в лабораторию в течение 3-5 ч при 30-35 ° С и многократно отмывали в стерильном физиологическом растворе с антибиотиками (пенициллин — 100 МЕ/мл, стрептомицин — 50 мкг/мл). ОКК выделяли посредством рассечения лезвием стенок фолликулов и промывали 3 раза в среде ТС-199, содержащей 5 % фетальной бычьей сыворотки (ФБС), 10 мкг/мл гепарина, 0,2 мМ пирувата натрия и 50 мкг/мл гентамицина. Для экспериментов отбирали ооциты округлой формы, с гомогенной цитоплазмой, равномерной по ширине зоной пеллюцида, окруженные многослойным компактным куму-люсом. Все манипуляции с ооцитами осуществляли под стереомикроскопом SMZ («Nikon», Япония) на нагревательном столике MATS-OZ («Tokai Hit», Япония) при 37 ° С.
ОКК культивировали в 4-луночных планшетах группами по 3035 шт. в 500 мкл среды при температуре 38,5 ° С в атмосфере с 5 % СО 2 и 90 % влажностью. Для получения созревших ооцитов применяли стандартную однофазную (контроль) и двухфазную системы культивирования. При использовании однофазной системы ОКК культивировали в течение 24 ч в среде ТС-199, содержащей 10 % ФБС, 1 мМ пирувата натрия, 50 мкг/мл гентамицина, 10 мкг/мл ФСГ и 10 мкг/мл ЛГ. В двухфазной системе ооциты созревали в тех же условиях в течение первых 12 ч. Затем ОКК пересаживали в новую среду и культивировали в течение последующих 12 ч в присутствии и в отсутствие клеток гранулезы. На втором этапе двухфазного культивирования применяли среду ТС-199, содержащую 10 % ФБС, 1 мМ пирувата натрия и 50 мкг/мл гентамицина (внутренний контроль) или эту же среду, дополненную ЛГ (5 мкг/мл).
Клетки гранулезы получали посредством аспирации жидкости из фолликулов диаметром 3-5 мм и последующего центрифугирования материала при 250 g в течение 10 мин. После удаления супернатанта клетки дважды отмывали в среде ТС-199, содержащей 5 % ФБС и 50 мкг/мл гентамицина. Конечное число клеток подсчитывали в камере Горяева, долю живых клеток определяли с помощью 0,1 % раствора трипанового синего. 778
Клетки гранулезы (1½106/мл) предварительно культивировали в 4-луночных планшетах в 500 мкл среды ТС-199, содержащей 10 % ФБС, 1 мМ пирувата натрия и 50 мкг/мл гентамицина. Через 12 ч 250 мкл среды заменяли свежей средой, затем вносили в лунки ОКК. Совместное культивирование ооцитов и клеток гранулезы проводили в течение 12 ч.
В конце культивирования среды собирали, замораживали и хранили при - 20 ° С. Содержание прогестерона и 17 р -эстрадиола в образцах сред определяли методом иммуноферментного анализа. Анализы проводили с использованием планшетного спектрофотометра Униплан («Пикон», Россия) и коммерческих наборов реагентов «НВО Иммунотех» (Россия) и «Хема» (Россия) согласно инструкции фирм-производителей. Чувствительность метода составляла 0,4 нмоль/л для прогестерона и 25 пмоль/л для 17 р -эстрадиола. Все анализы выполняли в 2 повторностях, коэффициент вариации внутри анализов не превышал 13 %.
Ооциты оплодотворяли in vitro, как описано ранее (21). ОКК, созревшие в однофазной или двухфазной системе, промывали однократно в среде Fert-TALP, модифицированной внесением 10 мкг/мл гепарина, 20 мкМ пенициламина, 10 мкМ гипотаурина и 1 мкМ эпинефрина, и переносили в 4-луночные планшеты («Nunc», Дания), которые содержали 400 мкл той же среды, покрытой равным объемом минерального масла. Активные сперматозоиды, полученные методом swim-up (22), добавляли в лунки с созревшими ооцитами в конечной концентрации 1½106 спермато-зоидов/мл. Во всех экспериментах для оплодотворения ооцитов использовали заморожено-оттаянную сперму одного быка. Оплодотворение ооцитов, а также культивирование эмбрионов проводили при температуре 38,5 ° С в атмосфере с 5 % СО2 и 90 % влажностью.
Через 18-20 ч совместной инкубации со спермой ооциты осторожно пипетировали и отмывали в среде Fert-TALP для освобождения от клеток кумулюса и налипших сперматозоидов. Предполагаемые зиготы переносили в среду CR1aa (23) и культивировали в течение 4 сут, после чего развивающиеся эмбрионы помещали в ту же среду, содержащую 5 % ФБС. На 2-е сут после оплодотворения ооцитов проводили морфологическую оценку раздробившихся зигот, на 7-е сут определяли число эмбрионов, развившихся до стадий поздней морулы и бластоцисты. Оценку выполняли под стереомикроскопом SMZ («Nikon», Япония) при увеличении ½40.
Полученные морулы и бластоцисты фиксировали 4 % раствором параформальдегида в натрий-фосфатном буфере в течение 60 мин при комнатной температуре. После фиксации эмбрионы пермеабилизировали в течение 30 мин в 0,1 % растворе цитрата натрия, содержащем 0,5 % Тритона Х-100. Степень апоптотических изменений ядерного материала в эмбрионах определяли методом TUNEL с использованием набора In Situ Cell Death Detection Kit, fluorescein («Roche Diagnostics», Швейцария) согласно инструкции компании-производителя. Затем эмбрионы окрашивали в течение 20 мин раствором DAPI (1 мкг/мл) с целью локализации ядер, переносили на сухое обезжиренное стекло и заключали в среду Vectashield («Vector Laboratories», Великобритания). Микрофотографирование и оценку препаратов выполняли под моторизованным микроскопом Axio Imager.M2 («Carl Zeiss», Германия), оснащенным флуоресцентной приставкой, с использованием программы ZEN 2 pro («Carl Zeiss», Германия). Степень апоптоза в бластоцистах оценивали по доле TUNEL-позитивных ядер (зеленая окраска) от общего числа ядер (синяя окраска).
Эксперименты по культивированию ооцитов повторяли не менее 6 раз. Полученные данные обрабатывали методом однофакторного (one- way ANOVA) и двухфакторного (two-way ANOVA) дисперсионного анализа при помощи программы SigmaStat («Systat Software, Inc.», США). Результаты представлены в виде средних значений (X) и стандартных ошибок (±SEM). Достоверность различия сравниваемых средних значений оценивали с использованием критерия Тьюки (Tukey's test).
Результаты . Экстракорпоральное созревание ооцитов — важный этап технологии получения эмбрионов крупного рогатого скота in vitro, моделированием которого можно существенно повысить ее эффективность (7). В представленной работе наряду со стандартным однофазным протоколом IVM мы впервые использовали двухфазное культивирование ооцитов коров, которое предполагало их созревание в течение первых 12 ч в общепринятой системе, содержащей гонадотропные гормоны, и последующих 12 ч — в новой среде без гормонов. Кроме того, была предпринята попытка модифицировать вторую фазу посредством внесения в систему ЛГ и (или) культивирования ооцитов на монослое клеток гранулезы.
На первом этапе работы мы исследовали количественные и качественные характеристики ооцитов коров при эмбриональном развитии in vitro (табл.). Способность ооцитов вступать в первое деление дробления и развиваться до стадий поздней морулы/бластоцисты (рис. 1, А) не зависела от способа культивирования. Присутствие клеток гранулезы во вторую фазу созревания ооцитов существенно не изменяло исследуемые показатели, однако при добавлении ЛГ в эту систему наблюдалась тенденция (p < 0,1) к снижению выхода эмбрионов на продвинутых стадиях развития по сравнению с полученным в однофазной системе.
Способность ооцитов коров ( Bos taurus taurus ) к эмбриональному развитию в разных системах дозревания in vitro ( Х ±SEM, n = 6-7)
|
Система (группа) |
КГ |
Число ооцитов, шт. |
Дробление, % |
Развившиеся до стадии поздней морулы/бластоцисты |
|
|
% от числа |
число ядер |
||||
|
ооцитов эмбрионов |
всего, шт. апоптотических, % |
||||
|
Без КГ ОС - 224 68,1±3,1 19,9±2,2 28,9±2,2 40,4±2,6a 5,4±2,2 ДС (К) - 217 66,3±3,9 17,5±2,6 27,1±4,1 56,2±5,8b 2,3±0,8 ДС (ЛГ) - 220 66,1±4,0 16,8±2,6 25,6±3,7 41,3±3,9 5,1±0,8 В присутствии КГ ОС - 196 67,1±3,9 20,7±2,2 30,6±1,7 42,0±4,0c 6,4±1,3 ДС (К) + 189 57,6±5,6 16,7±2,3 28,6±1,7 54,9±4,0d 5,1±1,1 ДС (ЛГ) + 195 58,2±3,1 13,9±2,6 23,8±4,0 42,4±6,9 6,9±2,7 |
|||||
П р и м еч а ни е. ОС — однофазная система (группа сравнения), ДС (К) — двухфазная система, без лютеинизирующего гормона (контроль), ДС (ЛГ) — двухфазная система с добавлением лютеинизирующего гормона (5 мкг/мл); КГ — клетки гранулезы.
a, b p < 0,05, c, d p < 0,05 — достоверность различий между сравниваемыми группами.
А Б В
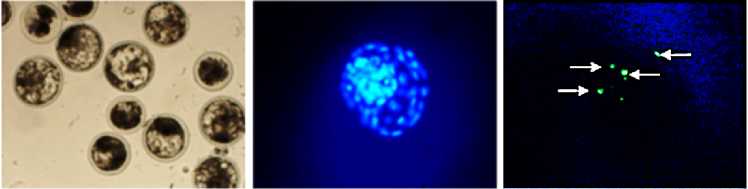
Рис. 1. Репрезентативные микрофотографии эмбрионов коров ( Bos taurus taurus ) на 7-е сут культивирования in vitro и выявление апоптоза: А — морфология морул и бластоцист (увеличение ½100), Б — окраска ядер в бластоцисте с помощью DAPI (синий цвет), цитологический препарат (увеличение ½200), В — окраска апоптотических ядер в бластоцисте методом TUNEL (зеленый цвет), цитологический препарат (TUNEL-позитивные ядра отмечены белыми стрелками, увеличение ½200); микроскоп Axio Imager. M2, «Carl Zeiss», Германия.
Качество эмбрионов, которое оценивали по числу ядер, содержащихся в поздних морулах/бластоцистах на 7-е сут после оплодотворения (см. рис. 1, Б), было выше при двухфазном культивировании в контрольной группе. Перенос ооцитов через 12 ч созревания в среду, лишенную гонадотропных гормонов, приводил к увеличению числа ядер в 1,3-1,4 раза (p < 0,05) и в отсутствие, и в присутствии клеток гранулезы, тогда как при добавлении ЛГ это число снижалось до значений в однофазном контроле (группа сравнения). В то же время доля апоптотических ядер в поздних морулах/бластоцистах (см. рис. 1, В) не зависела от системы дозревания ооцитов или воздействия ЛГ.
Как известно, переход к двухфазной системе культивирования ооцитов свиней, предполагающей исключение гонадотропных гормонов во второй фазе дозревания, кардинальным образом изменил эффективность всей технологии получения эмбрионов in vitro у этого вида животных (24). Данные нашей работы в определенной степени сходны с результатами, наблюдаемыми при созревании ооцитов свиней. Отсутствие ФСГ и ЛГ в среде на втором этапе культивирования ооцитов коров оказывало положительное влияние на развитие поздних морул/бластоцист.
Учитывая важное значение стероидных гормонов для ядерного и цитоплазматического созревания ооцитов КРС (25), на следующем этапе работы мы определяли концентрации 17 β -эстрадиола и прогестерона в культуральных средах, кондиционированных созревающими ОКК, в зависимости от используемой системы культивирования. В конце культивирования содержание 17 β -эстрадиола в двухфазной системе без гормонов (448±25 пг/мл) было меньше, чем в однофазной системе (583±27 пг/мл), в 1,3 раза (p < 0,01) (рис. 2, А). Внесение ЛГ в двухфазную систему обусловило более значительное снижение этого показателя (до 418±16 пг/мл, p < 0,001). Напротив, совместное культивирование ОКК с клетками гранулезы приводило к повышению концентрации 17 β -эстрадиола в культуральной среде, особенно в присутствии ЛГ (до 496±26 пг/мл, p < 0,05). В то же время мы не обнаружили различий между всеми исследуемыми вариантами по содержанию прогестерона в среде культивирования ОКК (см. рис. 2, Б).
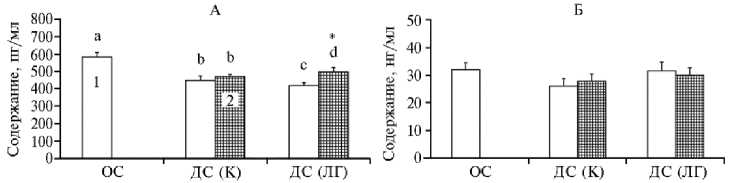
Рис. 2. Содержание 17 β -эстрадиола (А) и прогестерона (Б) в культуральной среде после дозревания ооцитов коров ( Bos taurus taurus ) in vitro в разных системах: ОС — однофазная система (группа сравнения), ДС (К) — двухфазная система, без лютеинизирующего гормона (контроль), ДС (ЛГ) — двухфазная система с добавлением лютеинизирующего гормона (5 мкг/мл); 1 — ооцит-кумулюсные комплексы (ОКК), 2 — ооцит-кумулюсные комплексы + клетки гранулезы (ОКК + КГ). Вертикальные отрезки — стандартные ошибки средних (SEM). Число независимых экспериментов — n = 6 (однофазная система), n = 5 (двухфазная система). a, b p < 0,01, a, c p < 0,001, a, d p < 0,05 — достоверность различий между сравниваемыми группами;
* p < 0,05 — достоверность различий между вариантами ОКК и ОКК + КГ.
Наблюдаемые вариации в содержании 17β-эстрадиола в среде при постоянстве продукции прогестерона фолликулярными клетками во вторую фазу созревания ооцитов не оказывали существенного влияния на способность последних к развитию до стадии поздней морулы/бластоцис-ты. При созревании ооцитов в контрольной двухфазной системе качество эмбрионов на предымплантационной стадии развития могло быть связано с уменьшением содержания 17β-эстрадиола в культуральной среде до определенного уровня, поскольку число ядер в них снижалось как при дальнейшем понижении, так и при повышении концентрации 17β-эстрадиола в присутствии лютеинизирующего гормона.
Таким образом, двухфазная система дозревания ооцитов коров может применяться как альтернатива общепринятому протоколу IVM (in vitro maturation). Перенос ооцитов через 12 ч культивирования в стандартной среде в свежую среду без гонадотропных гормонов не ухудшает их способность к дальнейшему эмбриональному развитию и повышает качество полученных поздних морул/бластоцист. Кроме того, концентрация 17 β -эстрадиола в культуральной среде на завершающем этапе дозревания ооцитов снижается, что также может оказывать некоторое положительное влияние на яйцеклетки. Отсутствие повышения содержания прогестерона в среде при изученных условиях указывает на необходимость поиска физиологически уместных факторов, стимулирующих продукцию прогестерона в ооцит-кумулюсных комплексах, с целью их дальнейшего применения во вторую фазу культивирования яйцеклеток.
Список литературы Способность ооцитов коров к эмбриональному развитию при созревании в разных системах двухфазного культивирования
- Mapletoft R.J, Hasler J.F. Assisted reproductive technologies in cattle: a review. Rev. Sci. Tech., 2005, 24(1): 393-403
- Lonergan P., Fair T. In vitro-produced bovine embryos: dealing with the warts. Theriogenology, 2008, 69: 17-22 ( ) DOI: 10.1016/j.theriogenology.2007.09.007
- Sanchez F., Smitz J. Molecular control of oogenesis. Biochim. Biophys. Acta, 2012, 1822: 1896-1912 ( ) DOI: 10.1016/j.bbadis.2012.05.013
- Blondin P., Coenen K., Guilbault L.A., Sirard M.A. In vitro production of bovine embryos: Developmental competence is acquired before maturation. Theriogenology, 1997, 47: 1061-1075 ( ) DOI: 10.1016/S0093-691X(97)00063-0
- Eppig J.J., Pendola F.L., Wigglesworth K., Pendola J.K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol. Reprod., 2005, 73: 351-357 (doi 10.1095/biolreprod.105.041798).
- Thompson J.G., Lane M., Gilchrist R.B. Metabolism of the bovine cumulus-oocyte complex and influence on subsequent developmental competence. Soc. Reprod. Fertil. Suppl., 2007, 64: 179-190.
- Gilchrist R.B., Thompson J.G. Oocyte maturation: emerging concepts and technologies to improve developmental potential in vitro. Theriogenology, 2007, 67: 6-15 ( ) DOI: 10.1016/j.theriogenology.2006.09.027
- Hussein T.S., Sutton-McDowall M.L., Gilchrist R.B., Thompson J.G. Temporal effects of exogenous oocyte-secreted factors on bovine oocyte developmental competence during IVM. Reprod. Fertil. Dev., 2011, 23: 576-584 ( ) DOI: 10.1071/RD10323
- Sirard M.A. Resumption of meiosis: mechanism involved in meiotic progression and its relation with developmental competence. Theriogenology, 2001, 55: 1241-1254 ( ) DOI: 10.1016/S0093-691X(01)00480-0
- Bilodeau-Goeseels S. Bovine oocyte meiotic inhibition before in vitro maturation and its value to in vitro embryo production: does it improve developmental competence? Reprod. Domest. Anim., 2011, 47: 687-693 ( ) DOI: 10.1111/j.1439-0531.2011.01924.x
- Zhang J., Wei Q., Cai J., Zhao X., Ma B. Effect of C-type natriuretic peptide on maturation and developmental competence of goat oocytes matured in vitro. PLoS ONE, 2015, 10(7): e0132318 ( ) DOI: 10.1371/journal.pone.0132318
- Franciosi F., Coticchio G., Lodde V., Tessaro I., Silvia C. Modina S.C., Fadini R., Dal Canto M., Renzini M.M., Albertini D.F., Luciano A.M. Natriuretic peptide precursor C delays meiotic resumption and sustains gap junction-mediated communication in bovine cumulus-enclosed oocytes. Biol. Reprod., 2014, 91(3): 61 ( ) DOI: 10.1095/biolreprod.114.118869
- Oliveira e Silva I., Vasconcelos R.B., Caetano J.V., Gulart L.V., Camargo L.S., Báo S.N., Rosa e Silva A.A. Induction of reversible meiosis arrest of bovine oocytes using a two-step procedure under defined and nondefined conditions. Theriogenology, 2011, 75(6): 1115-1124 ( ) DOI: 10.1016/j.theriogenology.2010.11.021
- Guemra S., da Silva Santo E., Zanin R., Monzani P.S., Sovernigo T.C., Ohashi O.M., Verde Leal C.L., Adona P.R. Effect of temporary meiosis block during prematuration of bovine cumulus-oocyte complexes on pregnancy rates in a commercial setting for in vitro embryo production. Theriogenology, 2014, 81(7): 982-987 ( ) DOI: 10.1016/j.theriogenology.2014.01.026
- Pavlok A., Lapathitis G., Cech S., Kubelka M., Lopatárová M., Holý L., Klíma J., Motlík J., Havlícek V. Simulation of intrafollicular conditions prevents GVBD in bovine oocytes: a better alternative to affect their developmental capacity after two-step culture. Mol. Reprod. Dev., 2005, 71(2): 197-208 ( ) DOI: 10.1002/mrd.20293
- Mingoti G.Z., Garcia J.M., Rosa-e-Silva A.A. Steroidogenesis in cumulus cells of bovine cumulus-oocyte-complexes matured in vitro with BSA and different concentrations of steroids. Anim. Reprod. Sci., 2002, 69: 175-186 ( ) DOI: 10.1016/S0378-4320(01)00187-7
- Schoenfelder M., Schams D., Einspanier R. Steroidogenesis during in vitro maturation of bovine cumulus oocyte complexes and possible effects of tri-butyltin on granulosa cells. J. Steroid. Biochem. Mol. Biol., 2003, 84: 291-300 ( ) DOI: 10.1016/S0960-0760(03)00042-6
- Tosca L., Uzbekova S., Chabrolle C., Dupont J. Possible role of 5´AMP-activated protein kinase in the metformin-mediated arrest of bovine oocytes at the germinal vesicle stage during in vitro maturation. Biol. Reprod., 2007, 77: 452-465 ( ) DOI: 10.1095/biolreprod.107.060848
- Blaschka C., Wrenzycki C. Temporal pattern of steroid hormone concentrations during in vitro maturation of bovine oocytes. Anim. Reprod., 2015, 12(3): 729.
- Gilchrist R.B., Ritter L.J., Armstrong D.T. Oocyte-somatic cell interactions during follicle development in mammals. Anim. Reprod. Sci., 2004, 82-83: 431-446 ( ) DOI: 10.1016/j.anireprosci.2004.05.017
- Сингина Г.Н., Багиров В.А., Данч С.С., Тарадайник Т.Е., Доцев А.В., Зиновьева Н.А. Получение эмбрионов in vitro методом межвидового оплодотворения яйцеклеток коров (Bos taurus) семенем зубра (Bison bonasus). Сельскохозяйственная биология, 2016, 51(6): 824-829 ( ) DOI: 10.15389/agrobiology.2016.6.824rus
- Parrish J.J., Susko-Parrish J.L., Leibfried-Rutledge M.L., Critser E.S., Eyestone W.H., First N.L. Bovine in vitro fertilization with frozen-thawed semen. Theriogenology, 1986, 25(4): 591-600 ( ) DOI: 10.1016/0093-691X(86)90143-3
- Rosenkrans C.F. Jr., First N.L. Effect of free amino acids and vitamins on cleavage and developmental rate of bovine zygotes in vitro. J. Anim. Sci., 1994, 72(2): 434-437 ( ) DOI: 10.2527/1994.722434x
- Funahashi H., Day B.N. Effects of the duration of exposure to hormone supplements on cytoplasmic maturation of pig oocytes in vitro. J. Reprod. Fertil., 1993, 98: 179-185 ( ) DOI: 10.1530/jrf.0.0980179
- Wang H.F., Isobe N., Kumamoto K., Yamashiro H., Yamashita Y., Terada T. Studies of the role of steroid hormone in the regulation of oocyte maturation in cattle. Reprod. Biol. Endocrinol., 2006, 4: 4 ( ) DOI: 10.1186/1477-7827-4-4


