Способы очистки газообразных отходов нефтехимических производств от углекислого газа для использования в твердооксидных топливных элементах
Автор: Филимонова А.А., Чичиров А.А., Власова А.Ю., Камалиева Р.Ф.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Рубрика: Исследования. Проектирование. Опыт эксплуатации
Статья в выпуске: 8 т.16, 2023 года.
Бесплатный доступ
В России разработка технологий по снижению вредных выбросов и парниковых газов в атмосферу соответствует направлению стратегии научно-технологического развития РФ до 2035 года. В рамках данной стратегии запланирован переход к экологически чистой и ресурсосберегающей энергетике. Переход на водородное топливо и водородсодержащие газы является огромным шагом на пути к декарбонизации. Наиболее доступным и экономически выгодным решением будет использование водородсодержащих газов нефтеперерабатывающих предприятий. Но перед использованием этих газов необходимо подвергнуть их предварительной очистке от неводородсодержащих ингредиентов и примесей. Анализ литературных источников позволил выделить основные способы очистки: абсорбция, хемосорбция, адсорбция, мембранные методы. Но наибольший интерес представляют адсорбционные методы, которые легче реализовать в промышленном масштабе и которые более экономически обоснованны. Поэтому в работе представлены результаты лабораторных исследований по определению улавливающей способности углекислого газа некоторых адсорбентов: активированный уголь, цеолит, бентонит, силикагель, извести гашеная и негашеная, высокоосновный анионит. Выбор сорбентов был обоснован их различной удельной поверхностью, различной природой происхождения, а также доступностью применения в промышленном масштабе.Эксперимент по улавливанию проводился на лабораторной установке, в адсорбер забивался сорбент и через него пропускался воздушный поток с углекислым газом. Непоглощенный сорбентом углекислый газ поступал в колбу с раствором гидроксида натрия концентрации 0,01 н. По завершении эксперимента у раствора гидроксида натрия определяли щелочность титриметрическим методом. По результатам эксперимента можно сделать вывод, что наибольшей улавливающей способностью по углекислому газу обладают следующие сорбенты: негашеная и гашеная известь, а также пропитанный в растворе гидроксида натрия цеолит. С точки зрения научного интереса можно выделить бентонит, который улавливает углекислый газ почти на 80 %. Остальные исследуемые сорбенты обладают средней улавливающей способностью.
Адсорбция, углекислый газ, тепловые электрические станции, твердооксидный топливный элемент
Короткий адрес: https://sciup.org/146282764
IDR: 146282764 | УДК: 621.352
Текст научной статьи Способы очистки газообразных отходов нефтехимических производств от углекислого газа для использования в твердооксидных топливных элементах
На сегодняшний день в России разработка технологий по снижению вредных выбросов и парниковых газов в атмосферу соответствует направлению стратегии научно-технологического развития Российской Федерации до 2035 года: «Переход к экологически чистой и ресурсосберегающей энергетике, повышение эффективности добычи и глубокой переработки углеводородного сырья, формирование новых источников, способов транспортировки и хранения энергии» [1]. В рамках данной политики необходимо пересматривать технологическое вооружение предприятий и разрабатывать национальные стратегии перехода на безуглеродную экономику. На сегодняшний день многие страны применяют различные подходы по сокращению выбросов углекислого газа в атмосферу, включающие в себя использование низкоуглеродистого топлива (ядерное топливо, водород и др.), использование возобновляемых видов энергии (энергия ветра, солнечная энергия, геотермальная энергия, низкопотенциальное тепло и др.), повышение энергоэффективности, внедрение геоинженерных подходов и подходов по энергосбережению, а также технологии по улавливанию и дальнейшей утилизации углекислого газа [2]. Существует три схемы улавливания углекислого газа: удаление СО 2 после сжигания органического топлива; удаление СО2 до сжигания органического топлива и кислородно-топливное сжигание.
Во всем мире шагом на пути к декарбонизации является переход на водородное топливо и водородсодержащие газы. Использование водородных топливных элементов приводит к повышению эффективности энергетического производства. Водородное топливо и водородсодержащие газы для топливных элементов должны соответствовать определенным требованиям, особенно по содержанию отравляющих веществ для катализаторов [3].
На нефтеперерабатывающих предприятиях после атмосферной и вакуумной переработки нефти, а также установки каталитических процессов вырабатываются углеводородные газы. Эти газы представляют собой три разновидности: сжиженные газы, используемые далее как сырье нефтехимических производств, и топливные газы двух видов: содержащие много этана и содержащие много водорода. Целесообразно выделять газовые потоки с однотипными характерными свойствами с последующей их переработкой, так как полезное использование этих газов является утилизацией отходов и дополнительно увеличивает глубину переработки нефти. Поэтому водородсодержащие газы после НПЗ могут быть сырьем для твердооксидных топливных элементов. Объем газов может составлять сотни тысяч тонн в час. Применение таких газов – экономически выгодное решение. Хотя еще совсем недавно данные газы отправлялись на факел, бесполезно сжигались и загрязняли окружающую среду [4].
Использование водородсодержащих газов НПЗ для твердооксидных топливных элементов предполагает наличие предварительной очистки газа перед сжиганием. Учитывая нестабильный состав водородсодержащих газов НПЗ, при очистке удаляются неводородсодержащие ин-– 946 – гредиенты и примеси, которые негативно сказываются на эффективности работы топливного элемента. Поэтому основная цель работы заключалась в определении улавливающей способности различных сорбирующих материалов на стадии очистки газа до сжигания.
Обзор литературы
Состав водородсодержащих газов НПЗ нестабилен и зависит от выработки готовых продуктов предприятия, усредненные значения за годовой период представлены в табл. 1.
Химические неводородсодержащие ингредиенты по-разному влияют на работоспособность топливных элементов. Для твердооксидных топливных элементов необходима очистка от серосодержащих соединений, которые относят к сильным загрязнителям. К основным соединениям, вызывающим необратимое ухудшение рабочих характеристик топливного элемента относятся: сероводород, дисульфид углерода, метил-/этилмеркаптаны, карбонилсульфид. Поэтому содержание сернистых соединений в водородсодержащем газе строго контролируется.
Особенное внимание уделяется и содержанию углекислого газа, который не только снижает концентрацию целевого компонента топлива (водорода), но и ухудшает поглощающую способность сорбентов по серосодержащим компонентам.
Ввиду требований к водородсодержащему топливу вводится входной количественный и качественный контроль, а также предусмотрены системы очистки от нежелательных неводородсодержащих ингредиентов. Для увеличения эффективности очистки от серосодержащих компонентов систему подготовки топлива необходимо дополнить блоком предварительной очистки от углекислого газа. Так как углекислый газ быстрее поглощается, насыщая сорбент, это приводит к «проскоку» серосодержащих компонентов. Поэтому необходима стадийная очистка с раздельным поглощением углекислого газа и серосодержащих соединений, именно таким способом будет достигнута максимальная степень извлечения сероводорода и меркаптанов.
В литературных источниках описаны различные способы улавливания углекислого газа. Например, А. Г. Окунев, С. Н. Трухан, А. И. Лысяков предлагают способ очистки водородсодержащего газа и способ регенерации поглотителя. Изобретение направлено на удаление оксида и диоксида углерода, которые значительно снижают работоспособность топливного элемента. В качестве адсорбента использовали раскаленный оксид кальция. Газовую смесь пропускали
Таблица 1. Состав водородсодержащего газа НПЗ
Table 1. Composition of hydrogen-containing gas of the refinery
Часто для удаления оксидов углерода и серы с дополнительной осушкой газа используют различные адсорбенты. Авторы В. В. Николаев, А. М. Трынов, С. А. Слющенко предложили способ последовательного контактирования с адсорбентом и синтетическим цеолитом с последующей регенерацией насыщенных цеолита и адсорбента противотоком при повышенной температуре. В качестве адсорбента был выбран силикагель и цеолит. Соотношение между силикагелем и цеолитом необходимо выдержать в соотношении частей 10:1 соответственно. Именно такое соотношение позволит выдержать эффективность метода на высоком уровне. Регенерацию адсорбента необходимо проводить в узких температурных рамках 180–220 ℃ [6].
Авторы В. Д. Беляев, В. В. Гальвита, П. В. Снытников предложили иной способ очистки водородсодержащего газа от оксидов углерода, который базировался на двухстадийном пропускании газа через катализатор (оксиды металлов (медь и марганец), нанесенные тонким слоем на поверхность носителя на первой стадии, и катализатор из благородных металлов на второй стадии) при температуре не ниже 20 0С и давлении не ниже 0,1 атм. На каждой стадии используются различные катализаторы [7].
Для очистки водородсодержащего газа авторы Б. В. Красий, Г. Л. Рабинович, И. И. Сорокин предложили адсорбент на основе оксидов марганца, включающий смешение оксидов марганца и гидроксида и/или оксида алюминия, пептизацию полученной смеси кислотой, формовку экс-трудированием и прокладку, отличающийся тем, что на смешение используют смесь оксидов марганца, содержащую 70–95 % диоксида в виде порошка с размером частиц менее 100 мкм. Отличительная особенность данного метода состоит в том, что содержание оксидов марганца составляет 70 %, что, в свою очередь, обуславливает повышенную сероемкость на 1–3 % при работе на реальном сырье, а также адсорбент обладает высокой механической прочностью. В качестве основного активного вещества могут использоваться различные формы оксидов марганца MnO, Mn2O3, Mn3O4 [8].
В качестве абсорбентов также можно использовать аминовые соединения. Аминовая хемосорбция распространена в основном в газовой промышленности и в нефтехимической. Особенностью применения аминов является высокая абсорбционная способность к поглощению как сероводорода, так и кислосернистых соединений, а также двуокиси углерода. Для осуществления аминовой очистки могут быть использованы различные амины: первичные, вторичные и третичные. Так, ученый Агаев Гасан Али Оглы предложил вариант аминовой очистки, которая заключалась в использовании водного раствора алканоламина (25–50 %) и полисульфида амина (0,1–10 %). При таком соотношении аминов достигается высокая степень абсорбции по меркаптанам и сохраняется высокая степень очистки по сероводороду [9].
Несмотря на эффективность аминовой очистки и разнотипность сорбирующих веществ, данный метод имеет недостатки. Большая часть аминов относится к ядовитым реагентам, установки представляют собой сложные многоступенчатые системы. Поэтому данный метод экономически не привлекателен для реализации в промышленном масштабе.
Департамент энергетики США на основании премии «Инновационные исследования, осуществляемые малым бизнесом» (Small Business Innovation Research, SBIR) No. DE-NT-000–5312 – 948 – опубликовал результаты изобретения мембранного разделения газа. Разделение происходит на поверхности мембран с целью удаления оксидов углерода в сочетании с абсорбцией для улавливания углекислого газа. Но данный способ экономически затратный и технологически сложный [10].
Таким образом, на основании проведенного анализа литературных данных можно заключить, что абсорбционные и мембранные методы имеют множество недостатков, которые существенно могут отразиться на возможности реализации очистки газа в промышленном масштабе. Поэтому наибольший интерес и актуальность представляют собой твердые адсорбционные материалы, которые способны улавливать углекислый газ. При выборе адсорбентов учитывались цена, экологические характеристики, возможность регенерации. Улавливающая способность адсорбентов оценивалась на лабораторной установке.
Материалы и методы
Для проведения лабораторного эксперимента была собрана лабораторная установка. При создании лабораторной установки основные требования опирались на доступность применяемых составляющих и легкость замены адсорбента. Установка представлена на рис. 1.
В качестве источника углекислого газа использовали баллон СО2 1 с редуктором. На редукторе установили расход газа 0,05 л/мин. Подачу углекислого газа осуществляли совместно с подачей воздуха в соотношении 1:5 соответственно, расход воздуха 0,25 л/мин. Воздух подавали с помощью воздушного компрессора 3.
Газовую смесь подавали в адсорбер 2. Адсорбер представляет собой стеклянную трубку диаметром 28 мм и длиной 450 мм, на конце адсорбера установлен перфорированный ограничитель, препятствующий выносу адсорбционного материала. Адсорбционный материал забивается не на всю длину трубки, а лишь на 70 %, то есть 330 мм. В адсорбер газовая смесь поступает через трубку, на конце которой установлен воздушный камень 5 для разбивания пузырьков газа на более мелкие. С помощью воздушного камня достигается максимальный контакт между газовой средой и твердым адсорбционным материалом. Время контакта сред составляло 4 мин. Газ после адсорбера поступал в коническую колбу 4 с щелочным раствором гидроксида натрия концентрации 0,01 н. Щелочной раствор был подкрашен до малиновой
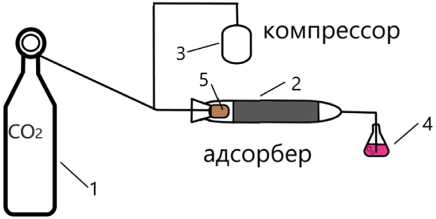
Рис. 1. Лабораторная адсорбционная установка по улавливанию углекислого газа: 1 – газовый баллон с СО2, 2 – адсорбер, 3 – компрессор; 4 – коническая колба; 5 – воздушный камень
Fig. 1. Laboratory adsorption plant for carbon dioxide capture: 1 – gas cylinder with CO2, 2 – adsorber, 3 – compressor; 4 – conical bulb; 5 – air stone

Рис. 2. Лабораторная адсорбционная установка улавливания углекислого газа
Fig. 2. Laboratory adsorption plant for carbon dioxide capture
окраски индикатором фенолфталеином. Такая индикация помогала визуально оценивать адсорбционные свойства сорбента. Исчезновение малиновой окраски свидетельствовало об отсутствии сорбционных свойств или их неэффективности улавливания углекислого газа проверяемым адсорбционным материалом. Реальное изображение установки приведено на рис. 2.
Точная оценка результата адсорбции углекислого газа осуществлялась с помощью титриметрического анализа, определения щелочности свободной и общей. Титрование проводили согласно ГОСТ 31957–2012 «Методы определения щелочности и массовой концентрации карбонатов и гидрокарбонатов» [11]. Данная методика позволяет определить массовые концентрации карбонатов и гидрокарбонатов. В качестве титранта используют раствор НСl 0,1 н. Титрование проводили с применением индикаторов фенолфталеина и метилового оранжевого.
Расчет количества поглощенного углекислого газа раствором гидроксида натрия определили по формуле 1.
—+ Щб/к хрпр /ммоль/.
Для расчета количества углекислого газа, поглощенного адсорбентом, необходимо учесть расход газа. Расход углекислого газа составил 0,005 л/мин, установка продувалась в течение 4 мин, соответственно, объем газа за 4 мин составил 0,02 л, или 0,89 ммоль (с учетом молярного объема газовой смеси 22,4 л/моль). Расчет количества углекислого газа, поглощенного адсорбентом, определили по формуле 2
0,89-
^-+ Щб/к х Гпр /ммоль; .
В качестве сорбентов были использованы вещества с различной удельной поверхностью, различной природы происхождения, доступные для применения в промышленном масштабе. В промышленности чаще всего применяют активные угли, минеральные материалы, а также синтетические ионообменные смолы. Были проверены следующие адсорбенты: активированный уголь, цеолит, бентонит, силикагель, извести гашеная и негашеная, высокоосновный анионит.
Для улучшения способности поглощения углекислого газа некоторые адсорбенты пропитывали в растворе гидроксида натрия. Активированный уголь помещали в 20 %-й раствор гидроксида натрия и выдерживали полчаса, после чего массу высушивали при температуре 90–100 0С, высушенный уголь использовали в качестве сорбента. Аналогичные мероприятия были произведены для бентонита и цеолита.
Высокоосновный анионит переводили в гидроксильную форму с применением 6 %-го раствора NaOH.
Результаты
В ходе лабораторного эксперимента проверялись различные сорбенты на способность поглощения углекислого газа. Выбор сорбентов основывался на данных литературного обзора, а также таких характеристиках, как экономическая обоснованность, доступность, нетоксич-ность выбранных материалов. Исследование каждого сорбента в отдельности проводилось согласно протоколу данного экспериментального исследования.
По завершении эксперимента у раствора гидроксида натрия определяли щелочность (гидратную, карбонатную, бикарбонатную) титриметрическим методом, результаты приведены в табл. 2.
По экспериментальным данным видно, что чем больше «проскочило» углекислого газа через адсорбент в раствор гидроксида натрия, тем сильнее растет карбонатная и бикарбонатная щелочность, гидратная щелочность показывает количество непрореагировавшего раствора гидроксида натрия с углекислым газом. Расчет проводился на основе расхода титранта раствора HCl концентрации 0,1 н. Общую щелочность определяли объемным методом, путем титрования пробы до значения рН=4,3 в присутствии индикатора метилового оранжевого. Свободную щелочность определяли по титрованию пробы до значения рН=8,3, в присутствии индикатора фенолфталеина. Свободная щелочность обусловлена содержанием в пробе воды гидроксидионов и половины содержания карбонат ионов.
По полученным данным следует отметить, что из всего перечня проверенных сорбентов наилучшие результаты показали: натронная известь, гашеная и негашеная известь.
В процессе сорбции огромное значение имеют физические характеристики адсорбционных материалов, а именно удельная поверхность. Данный показатель определяет количество сорбционных процессов, которые могут протекать одновременно. Удельная поверхность исследуемых адсорбентов рассчитана и приведена в табл. 3.
На основании расчетов можно сделать вывод, что наибольшей улавливающей способностью по углекислому газу обладают следующие сорбенты: негашеная и гашеная известь, а также пропитанный в растворе гидроксида натрия цеолит (рис. 3).
Таблица 2. Экспериментальные результаты поглощающей способности адсорбентов
Table 2. Experimental results of the absorption capacity of adsorbents
|
Адсорбент |
Присутствующие ионы |
Щелочность, мг-эвк/л |
Кол-во погл СО2, рас-ом NaOH, ммоль |
Кол-во СО2 погл.адс, ммоль |
Кол-во СО2 погл.адс, мл |
||
|
еч га Он S |
5 о to Он g 8 к |
ю к Он га с5 щ м н S га ю К |
|||||
|
Холостая проба |
СО 3 2- НСО 3 - |
0 |
0 |
8,7 |
0,87 |
0 |
0 |
|
Уголь активированный |
СО 3 2- НСО 3 - |
0 |
8 |
0,7 |
0,47 |
0,42 |
9,408 |
|
Уголь прокаленный |
ОН - СО 3 2- |
0,9 |
7,8 |
0 |
0,39 |
0,5 |
11,2 |
|
Уголь вымоченный |
ОН - СО 3 2- |
2,5 |
6,2 |
0 |
0,31 |
0,58 |
12,992 |
|
Цеолит природный |
СО 3 2- НСО 3 - |
0 |
8 |
0,7 |
0,47 |
0,42 |
9,408 |
|
Цеолит вымоченный |
ОН - СО 3 2- |
4,3 |
4,4 |
0 |
0,22 |
0,67 |
15,008 |
|
Бентонит |
СО 3 2- |
0 |
8,7 |
0 |
0,435 |
0,455 |
10,192 |
|
Бентонит вымоченный |
ОН - СО 3 2- |
5,1 |
3,6 |
0 |
0,18 |
0,71 |
15,904 |
|
Силикагель |
СО 3 2- НСО 3 - |
0 |
3,4 |
5,3 |
0,7 |
0,19 |
4,256 |
|
Известь СаО |
ОН - СО 3 2- |
6,1 |
2,6 |
0 |
0,13 |
0,76 |
17,024 |
|
Известь Са(ОН) 2 |
ОН - СО 3 2- |
6,1 |
2,6 |
0 |
0,13 |
0,76 |
17,024 |
|
Натронная известь |
ОН - СО 3 2- |
7,7 |
1 |
0 |
0,05 |
0,84 |
18,816 |
|
Высокоосновный анионит |
СО 3 2- НСО 3 - |
0 |
6,4 |
2,3 |
0,55 |
0,34 |
7,616 |
|
Высокоосновный анионит активированный |
ОН - СО 3 2- |
1,9 |
6,8 |
0 |
0,34 |
0,55 |
12,32 |
Остальные исследуемые сорбенты обладают средней улавливающей способностью:
-
– адсорбционные свойства активированного угля увеличиваются при его прокаливании при 300 0С, а также при пропитывании в растворе гидроксида натрия;
-
– среди природных материалов (бентонит и цеолит) наибольшей адсорбционной способностью обладает бентонит, но при обработке материалов раствором гидроксида натрия улавливающая способность цеолита увеличилась в два раза;
-
– силикагель не проявил эффективности в улавливании углекислого газа, так как данный адсорбент чаще применяется для осушки газов от паров воды;
-
– натронная известь чаще применяется в медицине для поглощения ингаляционных анестетиков и, судя по экспериментальным данным, задерживает углекислый газ на 95 %,
Таблица 3. Поглощающая способность адсорбентов с учетом удельной поверхности
Table 3. Absorption capacity of adsorbents taking into account specific surface area
|
Адсорбент |
Масса адсорбента, г |
Удельная поверхность, см 2 /г |
Поглощение мл СО 2 / 1 ед. уд. поверхности |
|
Уголь активированный |
35,6 |
2,5955 |
3,62 |
|
Уголь прокаленный |
35,6 |
2,5955 |
4,32 |
|
Уголь вымоченный |
120,6 |
0,7661 |
16,96 |
|
Цеолит природный |
140,9 |
0,6557 |
14,35 |
|
Цеолит вымоченный |
173 |
0,5341 |
28,10 |
|
Бентонит |
209,2 |
0,4417 |
23,07 |
|
Бентонит вымоченный |
134 |
0,6895 |
23,06 |
|
Силикагель |
89,1 |
1,0370 |
4,104 |
|
Известь СаО |
187,7 |
0,4923 |
34,58 |
|
Известь Са(ОН)2 |
147,3 |
0,6273 |
27,14 |
|
Натронная известь |
122,1 |
0,7568 |
24,86 |
|
Высокоосновный анионит |
103 |
0,8971 |
8,49 |
|
Высокоосновный анионит активированный |
123 |
0,7512 |
16,40 |
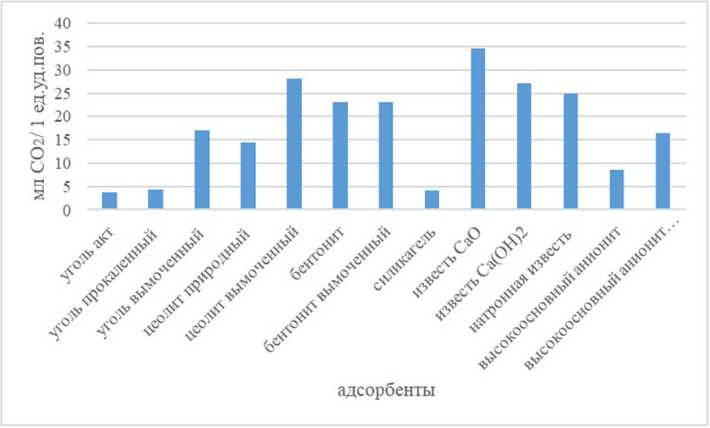
Рис. 3. Количество углекислого газа, поглощенного 1 единицей удельной поверхности адсорбента
Fig. 3. The amount of carbon dioxide absorbed by 1 unit of the specific surface of the adsorbent но с экономической точки зрения использование данного адсорбента в промышленном масштабе затруднительно;
-
– высокоосновный анионит в активированной форме улавливает углекислый газ из потока на 50 %.
В ходе исследования основной акцент был сделан на природный материал, а именно бентонит. В рассыпчатом порошкообразном виде в промышленном масштабе использовать бен-– 953 – тонит невозможно. Поэтому, перед тем как использовать глину в виде адсорбента, необходимо произвести следующие действия. Бентонит смешивается с водой и прокаливается при температуре 400 0С. В результате образуются пористые частицы сложной формы. Термическая обработка необходима для создания пористой структуры, где расстояние между слоями увеличено по сравнению с исходным материалом. Именно таким способом достигается наибольшая сорбционная способность. Улавливающая способность прокаленного бентонита аналогична улавливающей способности гашеной и негашеной извести. Также достоинством данного материала является простая регенерация паром.
Выводы
Развитие водородной энергетики играет важную роль в отказе от использования углеводородных видов топлива. Поэтому рациональное использование водородного топлива – масштабная задача для всего общества. Для твердооксидных топливных элементов можно использовать водородсодержащие газы, которые являются отходом нефтехимических производств. Особенностью этих газов является наличие неводородсодержащих ингредиентов, которые способны снижать работоспособность топливных элементов.
В ходе работы была собрана лабораторная адсорбционная установка для улавливания углекислого газа. Были апробированы различные сорбенты, которые доступны, безопасны и экономически рациональны для использования в промышленном масштабе.
По экспериментальным данным получилось, что наибольшей улавливающей способностью обладают сорбенты: гашеная и негашеная известь, пропитанный в щелочном растворе природный цеолит.
Наиболее доступный адсорбент – активированный уголь – был проверен в прокаленном виде и вымоченнном в растворе гидроксида натрия. Прокаливание и вымачивание увеличивают адсорбционные свойства на 4 и 67 % соответственно.
С точки зрения научного интереса можно выделить бентонит, который улавливает углекислый газ почти наравне с гашеной и негашеной известью. Для увеличения сорбционной способности порошкообразный бентонит был смешан с водой и прокален при температуре 400 0С, в результате достигнута развитая поверхность и пористая структура. На сегодняшний день существует большое многообразие бентонитовых глин, которые обладают различными характеристиками и свойствами, а значит, и отличными адсорбционными свойствами.
Список литературы Способы очистки газообразных отходов нефтехимических производств от углекислого газа для использования в твердооксидных топливных элементах
- Указ президента РФ от 01.12.2022 № 642 «О стратегии научно-технологического развития Российской Федерации» (с изменениями на 15 марта 2021 года).
- Gonzalez-Diaz A., Jiang L., Roskilly A. P., Smallbone A. J. The potential of decarbonising rice and wheat by incorporating carbon capture, utilisation and storage into fertiliser production, Green Chemistry. The Royal Society of Chemistry, 2020, 22(3), 882-894. http://dx.doi. org/10.1039/C 9GC 03746B
- ГОСТ Р 55466-2013/IS0/TS 14687-2:2008. Топливо водородное. Технические условия на продукт. Часть 2. Применение водорода для топливных элементов с протонообменной мембраной дорожных транспортных средств. Дата введения 2014-01-01.
- Мнушкин И. А. Способ глубокой переработки нефтезаводского углеводородного газа. Патент России № 2502717. 2013. [Mnushkin I. A. Method of deep processing of Petrozavodsk hydrocarbon gas. Russian Patent No. 2502717. 2013 (in Rus.)]
- Окунев А. Г., Трухан С.Н, Лысиков А. И. Способ получения водородсодержащего газа и способ регенерации поглотителя, применяемого в этом способе. Патент России № 2301722. 2007. [Okunev A. G., Trukhan S. N., Lysikov A. I. Method of obtaining hydrogen-containing gas and method of regeneration of the absorber used in this method. Patent of Russia No. 2301722. 2007 (in Rus.)]
- Николаев В. В., Трынов А. М., Слющенко С. А. Способ осушки и очистки углеводородных газов от меркаптанов и сероводорода. Патент России № 2213085. 2003. [Nikolaev V. V., Trynov A. M., Slushenko S. A. Method of drying and purification of hydrocarbon gases from mercaptans and hydrogen sulfide. Russian Patent No. 2213085. 2003 (in Rus.)]
- Беляев В. Д., Гальвита В. В., Снытников П. В., Семин Г. Л., Собянин В. А. Способ очистки водородсодержащей газовой смеси от оксида углерода (варианты). Патент России № 2359741. 2009. [Belyaev V. D., Galvita V. V., Snytnikov P. V., Semin G. L., Sobyanin V. A. Method of purification of hydrogen-containing gas mixture from carbon monoxide (variants). Russian Patent No. 2359741. 2009 (in Rus.)]
- Красий Б. В., Рабинович Г. Л., Сорокин И. И. Способ приготовления адсорбента серы. Патент России № 94037574. 1996. [Krasiy B. V., Rabinovich G. L., Sorokin I. I. Method of preparation of sulfur adsorbent. Russian Patent No. 94037574. 1996 (in Rus.)]
- Агаев, Вакулин, Кочетков, Мухтаров. Абсорбент для очистки газа от сероводорода и меркаптанов. Патент № 1583152. 1990. [Agaev, Vakulin, Kochetkov, Mukhtarov. Absorbent for gas purification from hydrogen sulfide and mercaptans. Patent No. 1583152. 1990 (in Rus.)]
- Виджманс Й. Д., Бейкер Р. В., Меркел Т. С. Способ отделения диоксида углерода из отработанного газа с использованием стадий мембранного разделения на основе продувки и абсорбции. Патент России № 2534075. 2014. [Widjmans J. D., Baker R. V., Merkel T. S. A method for separating carbon dioxide from exhaust gas using a membrane separation stage based on purging and absorption. Russian Patent No. 2534075. 2014 (in Rus.)]
- ГОСТ 31957-2012. Вода. Методы определения щелочности и массовой концентрации карбонатов и гидрокарбонатов. Дата введения 2014-01-01.


