Сравнение двух альтернативных методов хроматографической очистки при получении препарата VIII фактора свертывания плазмы крови человека в дозировке 500 единиц / флакон
Автор: Ямкин А.В., Стронин О.В., Никитина Л.Н., Семенова Н.А., Епанчинцев А.А., Шквыря Н.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2-2 т.26, 2011 года.
Бесплатный доступ
Сравнивались два метода хроматографической очистки при получении фактора VIII с дозировкой 500 ЕД/фл. Метод 1 - с использованием эксклюзионной и ионообменной хроматографий, метод 2 - с использованием од- ной ионообменной хроматографии. Установлено, что метод 1, несмотря на более низкий выход фактора VIII, обеспечивал более высокую степень очистки целевого белка по сравнению с методом 2. Таким образом, метод 1 является предпочтительным методом очистки при получении препарата VIII фактора свертывания плазмы крови человека.
Фактор свертывания viii, эксклюзионная хроматография, ионообменная хроматография
Короткий адрес: https://sciup.org/14919482
IDR: 14919482 | УДК: 612.115.4:615.012.8
Текст научной статьи Сравнение двух альтернативных методов хроматографической очистки при получении препарата VIII фактора свертывания плазмы крови человека в дозировке 500 единиц / флакон
Гемофилия А является врожденным заболеванием, при котором нарушается свертывание крови. Лечение больных гемофилией А основано на регулярных инъекциях препарата фактора свертывания крови VIII. Препараты фактора VIII ежегодно входят в программу государственных гарантий оказания гражданам РФ бесплатной медицинской помощи, разрабатываемой Минздравсоцразвития РФ и утверждаемой Правительством РФ. В России такие препараты не производятся, поэтому сейчас 100% применяемых очищенных препаратов фактора свертывания VIII являются импортными [1, 3]. Это обуславливает актуальность разработки технологии для получения отечественного препарата фактора свертывания крови VIII.
В предыдущей публикации [4] нами представлен оригинальный способ (патент №2324495) получения препарата VIII фактора свертывания крови человека. Цель работы: сравнение эффективности очистки с использованием эксклюзионной (SЕC) и ионообменной хроматографий (IEC) и одной ионообменной хроматографии при получении препарата VIII фактора свертывания плазмы крови человека в дозировке 500 ЕД/фл.
Материал и методы
Препарат VIII фактора получали из свежезамороженной плазмы крови (СЗП) по технологической схеме, фактически состоящей из следующих этапов:
Таблица 1
Характеристика раствора криопреципитата и элюата, полученных при очистке методом 1 (SEC+IEC) и методом 2 (IEC) (M±m)
|
Наименование объекта исследования |
Концентрация VIII фактора свертывания [ЕД/мл] |
Содержание общего белка [мг/мл] |
Удельная активность VIII фактора свертывания [ЕД/мг] |
Три-н-бутил-фосфат, [мкг/мл] |
Тритон Х100 [мкг/мл] |
Выход фактора VIII [%] |
Коэффициент вариации показателя “Выход фактора VIII” [%] |
|
Вирусинактивиро-ванный криопре- |
11±3 |
50±12 |
0,19±0,05 |
3000 |
10000 |
35±7* |
20 |
|
ципитат n=13 SEC+IEC n=6 |
60±8 |
2,2±0,5 |
28±8 |
0,2±0,1 |
0,3±0,1 |
57±5** |
8,8 |
|
IEC n=7 |
50±9 |
3,6±0,3 |
12±3 |
0,8±0,2 |
0,6±0,2 |
70±10** |
14,3 |
Примечание: M – среднее арифметическое значение по выборке; m – стандартное отклонение по выборке; n – объем выборки; * – по отношению к свежезамороженной плазме; * – по отношению к содержанию фактора VIII в растворе криопреципитата.
– разморозка СЗП при температуре 3–4 °С до полного исчезновения льда и формирования отчетливо видимого осадка [5, 15];
– отделение осадка (криопреципитата) центрифугированием на проточной центрифуге ОТР101-К1 (Россия) при 15000 об/мин в течение (40±10) мин;
– растворение криопреципитата в цитратном буфере в соотношении 1:4 при температуре (25±2) °С в течение 30 мин. Соотношение “буфер : криопреципитат” было 4 л : 1 кг соответственно;
– удаление нерастворимого осадка из раствора криопреципитата центрифугированием при 2500 g в течение 10 мин;
– вирусинактивирующая обработка раствора криопреципитата сольвент-детергентным методом в течение 6 часов при температуре (27±2) °С с использо-
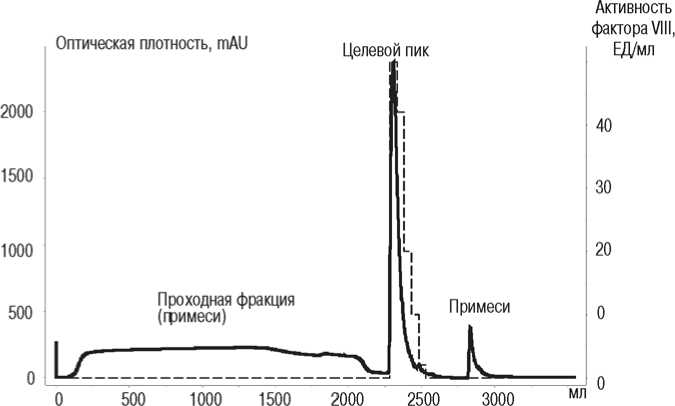
Рис. 1. Профиль элюции раствора криопреципитата при ионообменной хроматографии SEC-элюата (метод 1) и активность фактора VIII в разных хроматографических пиках:
- - активность фактора VIII, ЕД/мл;
– оптическая плотность при длине волны 280 нм, mAU
ванием в качестве вирусинактивирующих агентов три-н-бутилфосфата и Тритона Х-100 (Sigma-Aldrich Chemie GmbH, Германия) в конечных концентрациях 0,3 и 1% соответственно [6, 7, 9];
– осветляющая фильтрация вирусинактивированного раствора с использованием префильтров с диаметром пор 5 мкм (ООО “Палл Евразия”, Москва).
Далее фильтрат подвергался хроматографической очистке двумя альтернативными методами.
Метод 1 с использованием SEC и IEC:
– очистка фильтрата с помощью SEC, для чего вируси-нактивированый раствор криопреципитата наносили на хроматографическую колонну PI200/750 (YMC Europe, Германия) с сорбентом Sepharose 4FF (GE Healhcare Bio-Sciences AB, Швеция) на скорости 60±20 см/ч при давлении в хроматографической системе (2,5±0,5) бара, при комнатной температуре;
– сбор элюата, содержащего фактор VIII, добавление стабилизаторов;
– доочистка и концентрирование полученного хроматографического элюата с помощью IEC, для чего элюат наносили на хроматографическую колонну XK50/30 (GE Healhcare Bio-Sciences AB, Швеция) c сорбентом DEAE-Toyopearl 650M (Tosoh corporation, Япония) на скорости 70±20 см/ч при давлении в хроматографической системе (2,5±0,5) бара;
Метод 2 с использованием одной IEC:
– очистка и концентрирование фильтрата с помощью IEC, для чего вирусинактивированный раствор криопреципитата наносили на хроматографическую колонну XK50/30 c сорбентом DEAE-Toyopearl 650M на скорости 50±20 см/ч при давлении в хроматографической системе (2,5±0,5) бара;
После хроматографической очистки методами 1 и 2 следовали следующие этапы:
Таблица 2
Аналитические данные показателей качества препарата с дозировкой 500 ЕД/фл, произведенного с использованием очистки эксклюзионной и ионообменной хроматографий
|
Наименование показателя качества |
№600410 |
№610610 |
№620710 |
|
1 |
2 |
3 |
4 |
|
Описание. Аморфный порошок или пористая масса от белого до светло-желтого цвета |
Пористая масса белого цвета |
Пористая масса белого цвета |
Пористая масса белого цвета |
|
Подлинность. Препарат должен содержать: фактор VIII, натрий-ион, хлор-ион, сахарозу |
Обнаруживается активность фактора VIII. Качественные реакции на натрий-ион, хлор-ионы и сахарозу положительные |
Обнаруживается активность фактора VIII. Качественные реакции на натрий-ион, хлор-ионы и сахарозу положительные |
Обнаруживается активность фактора VIII. Качественные реакции на натрий-ион, хлор-ионы и сахарозу положительные |
|
Растворимость. Содержимое бутылки (флакона) с препаратом должно растворяться в 20 мл воды для инъекций в течение 20 мин при легком покачивании при комнатной температуре |
Содержимое флакона с препаратом растворяется в 20 мл воды для инъекций в течение 20 мин при легком покачивании при комнатной температуре |
Содержимое флакона с препаратом растворяется в 20 мл воды для инъекций в течение 20 мин при легком покачивании при комнатной температуре |
Содержимое флакона с препаратом растворяется в 20 мл воды для инъекций в течение 20 мин при легком покачивании при комнатной температуре |
|
Прозрачность. Должен выдерживать сравнение с эталоном IV |
Выдерживает сравнение с эталоном IV |
Выдерживает сравнение с эталоном IV |
Выдерживает сравнение с эталоном IV |
|
Цветность. Должен выдерживать сравнение с эталоном Y6 |
Выдерживает сравнение с эталоном Y6 |
Выдерживает сравнение с эталоном Y6 |
Выдерживает сравнение с эталоном Y6 |
|
Механические включения. Должен выдерживать требования РД 42-501-98 |
Выдерживает требования РД 42-501-98 |
Выдерживает требования РД 42-501-98 |
Выдерживает требования РД 42-501-98 |
|
рН. От 6,6 до 7,4 |
7,1 |
6,9 |
7,0 |
|
Белок. Не более 1,0% |
0,3% |
0,5% |
0,6% |
|
Потеря в массе при высушивании. Не более 5% |
2,6% |
2,8% |
3,0% |
|
Активность фактора VIII. От 400 до 600 ЕД/ фл |
480 ЕД/фл |
450 ЕД/фл |
480 ЕД/фл |
|
Удельная активность. Не менее 1 ЕД/мг белка |
7 ЕД/мг белка |
5 ЕД/мг белка |
4 ЕД/мг белка |
|
Калий-ион. Не более 4 мг/л |
1 мг/мл |
3 мг/мл |
3 мг/мл |
|
Пирогенность. Должен быть апирогенным |
Апирогенный |
Апирогенный |
Апирогенный |
|
Аномальная токсичность. Должен быть нетоксичным |
Нетоксичный |
Нетоксичный |
Нетоксичный |
|
Стерильность. Должен быть стерильным |
Стерильный |
Стерильный |
Стерильный |
– сбор элюата, содержащего фактор VIII, добавление стабилизаторов, заморозка при температуре минус (50±5) °С;
– контроль качества размороженного элюата;
– объединение партий размороженного элюата в лабораторно-промышленную серию, осветляющая и стерилизующая фильтрация промежуточного продукта;
– сублимационная сушка и контроль лиофилизированного препарата с дозировкой 500 ЕД/фл.
Контроль качества размороженного элюата проводили по следующим показателям:
– концентрация (активность) VIII фактора свертывания. Определяли методом измерения активированного частичного тромбопластинового времени с использованием коммерческих наборов (“НПО Ренам”, Мос- ква), в качестве стандарта использовали плазму с аттестованной активностью фактора VIII (“НПО Ренам”, Москва);
выход фактора VIII. Определяли как отношение общего количества фактора VIII в элюате после хроматографической очистки к общему количеству до хроматографической очистки;
содержание общего белка. Определяли биуретовым методом и методом Лоури [2];
удельная активность фактора VIII. Оценивали как отношение активности фактора VIII к количеству общего белка;
количество три-н-бутилфосфата. Определяли методом газовой хроматографии [10];
количество Тритона Х-100. Определяли методом об- ращенно-фазовой хроматографии [12].
Контроль качества лиофилизированного препарата с дозировкой 500 ЕД/фл проводили стандартными методами по показателям качества проекта ФСП на АнтигемоВир, лиофилизат для приготовления раствора для инфузий 500 ЕД. Дополнительное исследование молекулярномассового состава белков в исследуемом препарате в сравнении с препаратом Октанат проводили методом электрофореза в полиакриламидном геле в присутствии додецил-сульфата натрия [14]. Пробы не были нормированы по содержанию белка. Денситометрию геля проводили с помощью программы Phoretix.1.0.
Результаты представлены в виде среднеарифметического значения с указанием среднеквадратичного отклонения. Коэффициент вариации рассчитывали в процентах как отношение среднеквадратичного отклонения к среднеарифметическому значению.
Результаты и обсуждение
Обобщенные данные, полученные при производстве 13 экспериментальных серий, представлены в таблице 1. Установлено что, 65% фактора VIII терялось на стадии криофракционирования СЗП. Следует отметить, что без стадии криофракционирования при производстве препаратов иммуноглобулина и альбумина белки, образующие криопреципитат, входят в состав осадка А8, который является отходом производства [8, 15], поэтому даже с потерями криофракционирование увеличивает рентабельность производства препаратов крови [5]. Несмотря на высокое содержание белка в криопреципитате, удельная активность фактора VIII в нем была низкая, так как основную массу криопреципитата составляют примесные белки (табл. 1). На стадии SEC при использовании метода 1 удалялось значительное
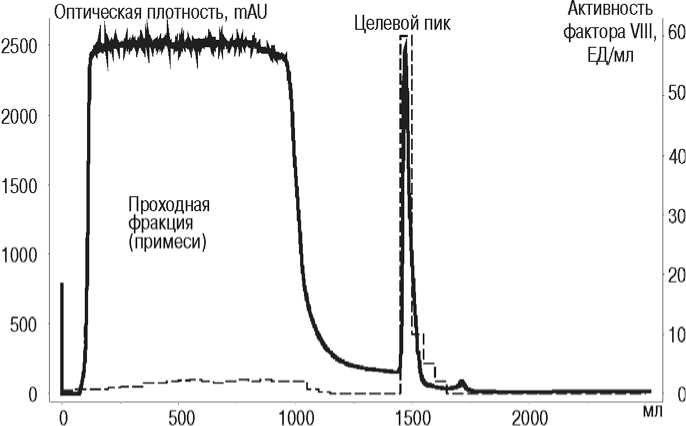
Рис. 2. Профиль элюции раствора криопреципитата при ионообменной хроматографии раствора криопреципитата (метод 2) и активность фактора VIII в разных хроматографических пиках:
- - активность фактора VIII, [ЕД/мл];
– оптическая плотность при длине волны 280 нм, [mAU]
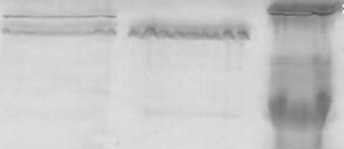
Альблтшш, альфа, бета и гамма-цепи фибриногена

Mr[KDa]
Субъединицы комплекса фактор__
МП - фактор фон
Виллебранда
^—04
^—67
----60
----18.5
^—14.5
Рис. 3. Молекулярно-массовый состав исследуемого препарата и препарата Октанат с дозировкой 500 ЕД/фл: 1 – препарат “Октанат” (ОКТАФАРМА Фармацевтика, Австрия); 2 – исследуемый препарат (“НПО Вирион”); 3 – маркеры молекулярных весов, кДа
количество примесных белков, что повышало в 68 раз удельную активность фактора VIII по сравнению с раствором криопреципитата. Однако концентрация фактора VIII в SEC-элюате составляла 4,5±05 ЕД/мл, что было недостаточно для дальнейшего производства препарата [8]. Это обусловило необходимость введения стадии концентрирования. При производстве препаратов крови методами выбора для концентрирования являются ультрафильтрация и IEC [5, 11, 13]. Предпочтение было отдано методу IEC, так как он позволяет не только концентрировать, но и дополнительно очищать полупродукт [5, 8, 13]. Это подтверждает типичный профиль элюции, получаемый при нанесении SEC – элюата на ионообменную колонну (рис. 1).
Судя по этому профилю, в “проходной фракции” элюировались примесные белки, оставшиеся после SEC, с неопределяемой активностью фактора VIII. После очистки методом 1 удельная активность фактора VIII была в 147 раз выше по сравнению с раствором криопреципитата. Выход фактора VIII относительно раствора криопреципитата при очистке методом 1 был 1,2 раза ниже по сравнению с методом 2 (табл. 1). При этом коэффициент вариации значений выхода был в 1,6 раза ниже по сравнению с методом 2, что указывает на менее стабильный выход при использовании метода 2 (табл. 1). Возможно, это было связано с разной концентрацией общего белка в растворе криопреципитата, наносимого на ионообменную колонну. Так, концентрация общего белка в растворе криопреципитата варьировала от 32 до 65 мг/мл. Несмотря на то, что условия IEC при методе 2 были подобраны таким образом, чтобы с ионообменными группами сорбента связывались только молекулы фактора VIII, возможно, происходило и неспецифическое связывание примесных белков раствора криопреципитата, что снижало емкость сорбента для целевого белка. В результате этого часть целевого белка не связывалась с сорбентом, а элюировалась вместе с примесями, что подтверждалось выявлением активности фактора VIII в “проходной фракции” IEC (рис. 2). Недостатком метода 2, кроме менее стабильного выхода, было то, что количество общего белка при его использовании было в 1,6 раз выше по сравнению с методом 1. Это обуславливало снижение удельной активности фактора VIII – интегрального показателя, характеризующего эффективность метода очистки. Так, при использовании метода 1 данный показатель был в 2,3 раза выше по сравнению с методом 2 (табл. 1). Это связано с тем, что метод 1 включает две стадии очистки: SEC и IEC. На стадии SEC удалялось основное количество белковых примесей, за счет чего снижались общее количество белка и вязкость раствора. В результате целевой белок более эффективно связывался с ионообменными группами сорбента. Следовательно, проведение SEC перед IEC обеспечивало более эффективное удаление примесей по сравнению с методом 2.
Следует отметить, что как после очистки методом 1, так и методом 2 удалялась основная часть вирусинакти-вирующих агентов, и их количество находилось в пределах допустимой нормы для препаратов фактора VIII (табл. 1) [7, 9].
Более низкий выход при использовании метода 1 в конечном итоге может обуславливать более высокую цену препарата, полученного с использованием этого метода. Однако в настоящее время основное внимание во всем мире уделяется именно степени очистки белков с направленным терапевтическим действием, полученных из плазмы крови, поэтому при получении препарата фактора VIII с дозировкой 500 ЕД/мл технологическая схема, включающая метод 1, представлялась более перспективной. В таблице 2 представлены основные показатели качества 3 серий препарата с дозировкой 500 ЕД/фл, произведенного в 2010 г. с использованием метода 1. Исследование молекулярно-массового состава образцов произведенного препарата в сравнении с зарегистрированным и широко применяемым в настоящее время в России препаратом “Октанат” (500 ЕД/фл, производитель ОКТАФАРМА Фармацевтика, Австрия), показало, что по молекулярно-массовому составу вышеуказанные препараты сопоставимы (рис. 3), что указывает на возможность замещения дорогостоящих импортных аналогов высококачественным отечественным препаратом VIII фактора свертывания.
Заключение
Комбинирование эксклюзионной и ионообменной хроматографий является предпочтительным методом очистки при получении препарата VIII фактора свертывания плазмы крови человека с дозировкой 500 ЕД/фл по сравнению с очисткой одной ионообменной хроматографией.
Список литературы Сравнение двух альтернативных методов хроматографической очистки при получении препарата VIII фактора свертывания плазмы крови человека в дозировке 500 единиц / флакон
- Государственный реестр лекарственных средств: официальное издание (по состоянию на 2011 г.) [Электронный ресурс]. -URL: http://grls.rosminzdrav.ru.
- Досон Р., Эллиот Д., Эллиот У. и др. Справочник биохимика. -М.: Мир, 1991. -С. 466-467.
- Ямкин А.В., Стронин О.В., Никитина Л.Н. и др. Способ получения и свойства препарата VIII фактора свертывания плазмы крови человека//Сибирский медицинский журнал (Томск). -2009. -№ 2, Вып. 2. -С. 17-20.
- апреля -Международный день гемофилии: электронный журнал "Медицинские Ведомости" 2002. -Т. 47, Вып. 4 [Электронный ресурс]. -URL: http://www.medcom.spb.ru.
- Burnouf T. Modern plasma fractionation//Transfus. Med. Rev. -2007. -Vol. 21(2). -P. 101-117.
- Burnouf T. еt al. A minipool process for solvent-detergent treatment of cryoprecipitate at blood centres using a disposable bag system//Vox Sang. -2006. -Vol. 91(1). -P. 56-62.4.
- Dichtelmuller H.O. et al. Robustness of solvent/detergent treatment of plasma derivatives: a data collection from Plasma Protein Therapeutics Association member companies//Transfusion. -2009. -Vol. 49(9). -P. 1931-1943.
- Dmoszynska A. et al. Pharmacokinetics of Optivate(®), a high-purity concentrate of factor VIII with von Willebrand factor in patients with severe haemophilia A//Haemophilia. -2011. -Vol. 17(2). -P. 185-90.
- Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products: Annex 4. -WHO Technical Report, Series, 2004. -No. 24. -P. 177.
- Nellaiappan K. et al. Validation of simple and sensitive gas chromatographic method for the analysis of tri-n-bytyl phosphate from virally inactivated human immunoglobulin//J. Chromatography B. -2001. -Vol. 757. -P. 181-189.
- Roberts P.L., Lloyd D., Marshall P.J. Virus inactivation in a factor VIII/VWF concentrate treated using a solvent/detergent procedure based on polysorbate 20//Biologicals. -2009. -Vol. 37(1). -P. 26-31.
- Strancar А. et al. Extraction of Triton X-100 and its determination virus-inactivated human plasma by the solvent-detergent method//J. of Chromatography A. -1994. -Vol. 658. -P. 475-481.
- Strategies for protein purification handbook from GE healthcare [Электронный ресурс]. -URL: www.geliefesciences.com/protein-purification.
- Weber K., Osborn M. The reliability of molecular weight determinations by dodecylsulfate-polyacrylamide gel electrophoresis//J. Biol. Chem. -1969. -Vol. 244. -P. 4406-16.
- Yazer M.H. et al. Cryoprecipitate prepared from plasma frozen within 24 hours after phlebotomy contains acceptable levels of fibrinogen and VIIIC//Transfusion. -2010. -Vol. 50(5). -P. 1014-18.


