Сравнение двух методов искусственного заражения растений подсолнечника возбудителем фомоза Phoma macdonaldii Boer. в условиях теплицы
Автор: Саукова С.Л., Антонова Т.С., Арасланова Н.М., Ивебор М.В.
Рубрика: Защита растений и иммунология
Статья в выпуске: 1 (177), 2019 года.
Бесплатный доступ
В течение 2017 г. были собраны пораженные фомозом стебли подсолнечника в селекционном питомнике ВНИИМК, на поле Армавирской опытной станции ВНИИМК, в Красногвардейском районе Ставропольского края и семена подсолнечника в Волгоградской области. Выделены моноспоровые культуры возбудителя болезни Phoma macdonaldii Boerema на среду овсяный агар (ОА). Определена агрессивность выделенных изолятов по семядольным листьям и фрагментам гипокотиля подсолнечника гибрида Альтаир. Наиболее агрессивными были изоляты № 19, собранный на селекционном поле ВНИИМК, и № 20 - из Красногвардейского района Ставропольского края. Испытаны два метода искусственного заражения растений подсолнечника в фазе первой пары настоящих листьев в основание листового черешка изолятами Phoma macdonaldii в условиях теплицы: первый - введением 0,2 мл суспензии спор гриба уколом шприца; второй - прикладыванием кусочков агара с мицелием, пикнидами и пикноспорами. Представлены иллюстрации внешних симптомов поражения возбудителем фомоза растений подсолнечника по каждому методу заражения. Полученные результаты показали, что необходимо использовать оба способа заражения и путём сопоставления результатов по баллам поражения отбирать генотипы, проявляющие сопротивление как внешних, так и внутренних тканей.
Подсолнечник, фомоз, мицелий, пикнида, пикноспоры, агрессивность, искусственная инокуляция, суспензия
Короткий адрес: https://sciup.org/142220369
IDR: 142220369 | УДК: 633.854.78:632.4:631.522 | DOI: 10.25230/2412-608X-2019-1-177-92-98
Текст научной статьи Сравнение двух методов искусственного заражения растений подсолнечника возбудителем фомоза Phoma macdonaldii Boer. в условиях теплицы
Введение. Фомоз, или черная стеблевая пятнистость (возбудитель Phoma macdonaldii Boerema), входит в число наиболее распространенных болезней подсолнечника во всем мире [1; 2]. Инфицированию подвержены все органы растения подсолнечника всех фенологических стадий [3]. При поражении фомозом на стебле и корне появляются пятна черного цвета, четко ограниченные от живых тканей [4]. На стебле пятна имеют округлую или овальную форму и обычно достигают 5 ̶ 15 см в длину, со временем пятно опоясывает стебель [5]. Гриб обычно развивается в тканях коры стебля. Однако в более поздний период вегетации подсолнечника наблюдаются симптомы болезни и в сердцевине, которые могут привести к задержке роста, уменьшению диаметра стебля, в результате чего растения имеют более короткий период вегетации [6]. Инфекция корневой шейки и корневой системы может приводить к симптомам, часто называемым преждевременным созреванием, и потери урожая могут достигать 0,7 и 1,3 т/га [7 ̶ 11]. Кроме того, гриб можно найти в семенах подсолнечника [12; 13].
В России в 1976 г. исследователями ВНИИМК были разработаны и усовершенствованы методы искусственного заражения растений подсолнечника при селекции на иммунитет к фомозу для полевых и тепличных условий. В условиях теплицы способ искусственного заражения состоял в том, что растения в фазе первой пары настоящих листьев опрыскивались суспензией спор гриба [14]. В лаборатории иммунитета и электрофореза (2002 г.) разработана методика заражения фомопсисом растений подсолнечника в фазе бутонизации путем внесения в разрез основания листового черешка искусственно инфицированных стерильных фрагментов стеблей подсолнечника с последующим дождеванием в утренние и вечерние часы на протяжении фаз цветения и созревания в открытом грунте. Эта методика показала свою эффективность для селекции устойчивых к фомопсису форм подсолнечника [15].
Во Франции в 2000 г. Roustaee с соавторами [16 ̶ 18] была описана методика внесения стерильной иглой инфекционного начала возбудителя фомоза в основание прикрепления листового черешка к стеблю растений подсолнечника в фазе первой пары настоящих листьев в условиях теплицы, благодаря которой идентифицированы толерантные генотипы, хотя полная устойчивость не была обнаружена. Различные уровни сопротивления были обнаружены среди культурных и диких форм подсолнечника [19; 20]. В Аргентине указанная выше методика применялась для изучения патогенной вариабельности между изолятами Phoma macdonaldii из разных агроклиматических зон возделывания подсолнечника [21]. В 2010 г. Seassau с соавторами [22] проводили ряд опытов по иноку-лированию стебля растений подсолнечника суспензией мицелия и пикноспор гриба P. macdonaldii разной концентрации (1 × 103 ̶ 1 × 106 спор/мл) и сделали вывод, что наиболее высокий уровень концентрации может быть применен для скрининга генотипов на устойчивость к фомозу.
Целью нашей работы являлось сравнение известных методов заражения растений подсолнечника, для выбора наиболее подходящего при инокуляции возбудителем фомоза в условиях теплицы.
Материалы и методы. В качестве инфекционного начала использовали пораженные фомозом фрагменты стеблей подсолнечника, которые были собраны в селекционном питомнике ВНИИМК, на полях Армавирской опытной станции ВНИИМК, в Красногвардейском районе Ставропольского края, а также семена из Волгоградской области. Выделение возбудителя болезни Phoma mac-donaldii осуществляли в соответствии с общепринятыми методиками [23]. Идентификацию видовой принадлежности проводили по систематике Boerema et al., 2004 [24].
Агрессивность изолятов определяли следующим образом: в чашки Петри (диаметр 90 мм) на питательную среду – овсяный агар (ОА) – высевали моноспоровые культуры P. macdonaldii, которые выращивали в термостате при температуре 25 оС. На 14-дневные колонии моноспоровых культур каждого изо-лята раскладывали семядольные листья и фрагменты гипокотиля 10-дневных растений подсолнечника гибрида Альтаир. Опыт закладывали в двух повторностях по 10 штук семядольных листьев и фрагментов гипокотиля одинакового размера (1 см) в каждой чашке
Петри. Контроль – семядольные листья и фрагменты гипокотиля раскладывали на стерильную питательную среду. Степень поражения (процент поражённой поверхности) учитывали на третьи сутки культивирования.
Опыты по искусственному заражению растений подсолнечника закладывались в зимний период в условиях теплицы, где контролировались условия выращивания и заражения растений. Посев семян подсолнечника осуществляли в металлические короба размером 2,5 × 0,7 м, наполненные песком и просеянным черноземом в соотношении 1 : 2. Схема опыта включала сорт ВНИИМК 8883, линию ВК-653 и гибрид Альтаир, повторность 3-кратная, в одной повторности 40 растений. Растения подсолнечника выращивали при переменной температуре 25–30 оС днем и 25 оС ночью (16-часовой фотопериод) при освещении лампами 20 тыс. люкс. Полив проводили ежедневно проточной водой из шланга по мере высыхания почвы. Мицелий гриба P. macdonaldii выращивали в чашках Петри в течение двух недель на среде ОА. Для заражения были взяты два наиболее агрессивных изолята (№ 19 и № 20) возбудителя фомоза. Заражение растений подсолнечника проводили в фазе второй пары настоящих листьев.
Растения подсолнечника инокулировали двумя методами. Первый ̶ в основание листового черешка первой пары настоящих листьев вводили уколом шприца по 0,2 мл суспензию гриба P. macdonaldii , которую получали путем смыва кисточкой в стерильную воду мицелия и пикнид с пикноспорами, выращенных на ОА в чашках Петри. Суспензию настаивали в течение часа, чтобы произошел выход пикноспор из пикнид. Концентрация суспензии составила 1 × 106 спор/мл, её определяли с помощью камеры Горяева. Контроль ̶ растения, зараженные стерильной водой.
Второй метод состоял в прикладывании в основание листовых черешков первой пары настоящих листьев (без их травмирования) одинаковых по размеру агаровых высечек колоний гриба с мицелием, пикнидами и вышедшими пикноспорами (1 × 1 см), что приближало процесс заражения к естественному протеканию его в природе. В контрольном варианте прикладывали высечки стерильной среды ОА.
В обоих вариантах участок инокуляции покрывали влажной ватой, а сверху ̶ фоль-94
гой, для меньшего испарения влаги. Вату смачивали ежедневно в течение одной недели. После снятия ваты и фольги, растения подсолнечника увлажняли путем опрыскивания стерильной водой один раз в день. Вода какой-то период времени сохранялась в бороздках черешка и могла способствовать успешному заражению фомозом. Растения подсолнечника выращивали до фазы бутонизации, учет проводили на 30-й день после заражения.
Процент пораженных стеблей и степень их поражения учитывали по разработанной нами 5-балльной шкале:
0 балл – нет некроза на стебле, зеленый лист;
-
1 балл – некроз на стебле до 0,3 см, лист засох, но оставался на стебле;
-
2 балл – некроз на стебле (длина до 1 см);
-
3 балл – некроз на стебле до 2 см и появление кольцевого некроза;
-
4 балл – некроз на стебле более 2 см и перелом его.
Результаты и обсуждение: В течение 2017 г. были собраны пораженные фомозом семена и фрагменты стеблей подсолнечника (20 изолятов) (табл. 1) и выделены моноспо-ровые культуры возбудителя болезни Phoma macdonaldii Boerema на среду овсяный агар.
Таблица 1
Происхождение изолятов возбудителя фомоза подсолнечника
|
№ изолята |
Место сбора изолятов, область край, город |
Пораженный орган растения, из которого выделен изолят |
|
1 ̶ 3 |
Волгоградская |
семена |
|
4 ̶ 7 |
Краснодарский (г. Краснодар) – физиологическая площадка ВНИИМК |
Стебель |
|
8 |
Краснодарский (АОС ВНИИМК) |
-//- |
|
9 ̶ 19 |
Краснодарский (г. Краснодар) – селекционное поле ВНИИМК |
-//- |
|
20 |
Ставропольский |
-//- |
При определении агрессивности выделенных изолятов в чашках Петри на среде ОА первые признаки поражения фомозом семядольных листьев и фрагментов гипокотилей 10-дневных растений гибрида Альтаир появлялись через сутки в виде некрозов. Позже (7-е сутки) на некрозах образовывались пик- ниды, которые располагались четкими концентрическими кругами, из их вместилищ массово выходили пикноспоры. Такое явление мы наблюдали и раннее при определении патогенных свойств изолятов [25].
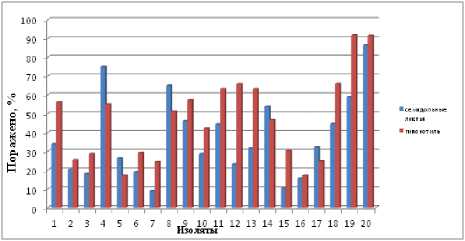
Рисунок 1 – Агрессивность изолятов Phoma macdonaldii Boerema при инокуляции семядольных листьев и фрагментов гипокотиля гибрида подсолнечника Альтаир
Процент пораженной поверхности семядольных листьев и фрагментов гипокотиля учитывали на третий день от момента раскладки на колонию патогена (рис. 1). Размер некроза варьировал в зависимости от изолята. Наиболее агрессивными были изоляты № 20 (Красногвардейский район Ставропольского края) и № 19 (селекционное поле ВНИИМК). Наименьшую агрессивность показал изолят № 7 (физиологическая площадка ВНИИМК), где процент пораженной поверхности семядольных листьев и фрагментов гипокотиля гибрида Альтаир на 3-й день учета составил 8,9 и 24,4 % соответственно.
Для искусственного заражения растений подсолнечника в условиях теплицы были отобраны два наиболее агрессивных изолята Phoma macdonaldii №№ 19 и 20.
При первом методе заражения в основание листового черешка первой пары настоящих листьев растений подсолнечника суспензию гриба Phoma macdonaldii вносили уколом шприца (травмируя растения). Первые симптомы болезни появились на 4-й день от момента внесения инфекции. Патоген, проникая в ткани подсолнечника, вызывал некроз вокруг поранения, т.е. некротроф, прежде чем оккупировать какой-либо участок растения, выделял в ткань хозяина токсические продукты (фитотоксины), которые убивали клетки, расширяя некроз – плацдарм существования паразита, таким образом, он питался содержимым мертвых клеток (рис. 2 а). Появившееся некротическое пятно распространялось на черешок и лист, который со временем засы- хал, но оставался висеть на стебле. В дальнейшем на отдельных растениях пятна неправильной формы черного цвета распространялись вдоль стебля, достигали 4,0 см и иногда окольцовывали (опоясывали) его. При сильном поражении растений подсолнечника фомозом, стебель переламывался и растение погибало, но патоген продолжал развиваться сапрофитно, это подтверждалось тем, что при закладывании пораженных стеблей подсолнечника во влажную камеру через пять дней образовывались пикниды и пикноспоры возбудителя фомоза.
Во втором методе при прикладывании высечек питательной среды ОА с мицелием гриба, пикнидами и пикноспорами (без травмирования), первые симптомы болезни появились позже ̶ на 5-й день, и не на всех растениях разных генотипов. Более длительное проникновение факультативного сапрофита через кутикулу растения требует затраты большой энергии патогена (рис. 2 б). По литературным данным известно, что фи-топатогенные грибы обладают большим набором ферментов, разрушающих углеводные полимеры, из которых построены клеточные стенки растений. Гриб, проникая в клетку, колонизует ткань, что приводит к появлению внешних симптомов болезни [26]. Признаки поражения растений подсолнечника разными изолятами P. macdonaldii были сходны при обоих методах заражения.

б
а
Рисунок 2 – Симптомы поражения растений подсолнечника гибрида Альтаир (указано стрелкой) на 20-й день после искусственного заражения грибом Phoma macdonaldii Boer. в пазуху черешка первой пары настоящих листьев в условиях теплицы (ориг.): а – введение суспензии мицелия, пикнид и пикноспор уколом шприца;
б – прикладывание высечек колоний гриба с мицелием, пикнидами и пикноспорами При сравнении двух методов заражения учитывали процент растений подсолнечника со степенью поражения 2–4 балла. Выявлялись различия между генотипами, что связано с разной силой роста и выносливостью к патогену (табл. 2, 3). На сорте ВНИИМК 8883 процент пораженных растений при инокули-ровании двумя изолятами № 20 и № 19 при первом методе составил 48 и 60 %, а при втором – 7 и 10 % соответственно.
Таблица 2
Поражение растений подсолнечника (%) на 30-й день после заражения инфекционным началом Phoma macdonaldii уколом в основание черешка первого настоящего листа г. Краснодар, ВНИИМК, 2017 г.
|
Изолят вобудите-ля фомоза, № |
Инокулированный генотип |
Балл поражения |
||||
|
0 |
1 |
2 |
3 |
4 |
||
|
20 |
ВНИИМК 8883 |
0 |
52 |
44 |
4 |
0 |
|
Альтаир |
0 |
37 |
56 |
3* |
4 |
|
|
ВК-653 |
0 |
66 |
21 |
7(3*) |
6(3*) |
|
|
19 |
ВНИИМК 8883 |
0 |
40 |
42 |
11 |
7* |
|
Альтаир |
0 |
20 |
60 |
14(7*) |
6(3*) |
|
|
ВК-653 |
0 |
44 |
33 |
13(3*) |
10(3**) |
|
|
Контроль (стерильная вода) |
ВНИИМК 8883 |
100 |
0 |
0 |
0 |
0 |
|
Альтаир |
100 |
0 |
0 |
0 |
0 |
|
|
ВК-653 |
100 |
0 |
0 |
0 |
0 |
|
Примечание: в скобках: * – кольцевой некроз на стебле; ** – перелом стебля
Таблица 3
Поражение растений подсолнечника (%) на 30-й день после заражения без травмирования, прикладыванием инфекционного начала изолятов Phoma macdonaldii в основание черешка первого настоящего листа г. Краснодар, ВНИИМК, 2017 г.
|
Изолят вобудите-ля фомоза, № |
Инокулированный генотип |
Балл поражения |
||||
|
0 |
1 |
2 |
3 |
4 |
||
|
20 |
ВНИИМК 8883 |
40 |
53 |
7 |
0 |
0 |
|
Альтаир |
40 |
40 |
0 |
17 |
3* |
|
|
ВК-653 |
29 |
42 |
12 |
13(8*) |
4* |
|
|
19 |
ВНИИМК 8883 |
50 |
40 |
3 |
7* |
0 |
|
Альтаир |
37 |
57 |
0 |
3 |
3** |
|
|
ВК-653 |
0 |
50 |
17 |
12* |
21(19* +2**) |
|
|
Контроль (овсяный агар) |
ВНИИМК 8883 |
100 |
0 |
0 |
0 |
0 |
|
Альтаир |
100 |
0 |
0 |
0 |
0 |
|
|
ВК-653 |
100 |
0 |
0 |
0 |
0 |
|
Примечание : в скобках: * – кольцевой некроз на стебле; ** – перелом стебля
Стебли подсолнечника гибрида Альтаир при заражении двумя изолятами поразились на 63 и 80 % при использовании первого метода, а при втором – на 20 и 6 % соответ-96
ственно. Следует отметить, что линия ВК-653 поразилась сильнее, чем сорт и гибрид. Об этом можно судить по наибольшему количеству пораженных растений по каждому изо-ляту при обоих методах заражения. Так, в первом варианте при заражении изолятом № 20 количество пораженных растений составило 34, и 56 % – изолятом № 19, а во втором варианте – 29 и 50 % соответственно, причем при заражении изолятом № 19 в обоих случаях происходил перелом стебля.
Сравнение двух методов искусственного заражения растений подсолнечника возбудителем фомоза показало, что при заражении прикладыванием кусочка агара с мицелием, пикнидами и пикноспорами по каждому изученному генотипу значительный процент растений имеет нулевую и первую степень поражения. Это свидетельствует о том, что в этом случае выявляются толерантные растения, покровные ткани которых сопротивляются проникновению возбудителя болезни, то есть этот метод может использоваться для дифференцирования селекционного материала. Инъекция инфекционного начала гриба уколом травмирует покровные ткани черешка, тем самым способствует быстрому развитию болезни, то есть игнорирует важную ступень защиты и при селекции на устойчивость такие растения не обязательно попадут в отбор. Такой метод, как единственный, не желательно использовать для селекции, его необходимо дополнить другим способом заражения.
Выводы: 1. Установлено варьирование по агрессивности 20 изолятов гриба Phoma mac-donaldii, выделенных из пораженных растений подсолнечника на среду ОА. Наибольшую агрессивность проявили изоля-ты из Красногвардейского района Ставропольского края (№ 20) и селекционного поля ВНИИМК (№ 19), процент пораженной поверхности семядольных листьев и фрагментов гипокотиля восприимчивого гибрида Альтаир на 3-й день после заражения составил 86 и 91 % и 59 и 92 % соответственно по вариантам.
-
2. Образование репродуктивных органов возбудителя фомоза во влажной камере на погибших пораженных стеблях подтверждает, что гриб сохраняется на растительных остатках в поле после уборки подсолнечника.
-
3. По двум методам искусственного заражения растений трех генотипов подсолнеч-
ника: сорта ВНИИМК 8883, гибрида Альтаир, и линии ВК-653, наибольший процент пораженных растений наблюдался на линии.
-
4. Сравнение двух методов искусственной инокуляции двумя наиболее агрессивными изолятами гриба Phoma macdonaldii растений подсолнечника в тепличных условиях показало, что при испытании устойчивости к фо-мозу разных генотипов подсолнечника необходимо использовать оба метода заражения и путем сопоставления результатов по баллам поражения отбирать те, которые проявляют сопротивление как внешних, так и внутренних тканей.
Список литературы Сравнение двух методов искусственного заражения растений подсолнечника возбудителем фомоза Phoma macdonaldii Boer. в условиях теплицы
- Hua Z., Ma G. A review of sunflower disease research in China//Proceedings of the 14th International Sunflower Conference. ̶ Beijing Shenyang, China, 10-12 June, 1996. ̶ Vol. 2. -P. 754-759.
- McDonald W.C. Phoma black stem of sunflower//Phytopathology. ̶ 1964. ̶ 54. ̶ Р. 492 ̶ 493.
- Алексеева С.П. Изучение видового состава и биологических особенностей возбудителей болезней подсолнечника в условиях Краснодарского края: автореф. дис. … канд. биол. наук. -Краснодар, 1969. -24 с.
- Abou Al Fadil, Alain Jauneau, Yves Martinez, Martina Rickauer, Grégory Dechamp-Guillaume. Characterisation of sunflower root colonisation by Phoma macdonaldii//Plant Pathology. ̶ 2009. -Vol. 124. ̶ P. 93 ̶ 103.
- Саукова С.Л., Ивебор М.В., Антонова Т.С., Арасланова Н.М. Возбудитель фомоза на вегетирующих растениях подсолнечника в Краснодарском крае//Масличные культуры. Науч.-тех. бюл. ВНИИМК. ̶̶ 2014. ̶̶ Вып. 2 (159-160). ̶ С. 167 ̶ 172.
- Maric A., Camprag D., Masirević S. Sunflower black stem (In Serbo-Croatian). -Nolit, Beograd, Yugoslavia, 1988. ̶ P. 37 ̶ 45.
- Acimović M. Sunflower diseases in Europe, the United States and Australia//Helia. ̶ 1984. -7. -Р. 45-54.
- Gulya T.J., Woods D.M., Bell R., Mau Cly. Diseases of sunflower in California//Plant Disease. ̶ 1991. ̶ 75. ̶ Р. 572 ̶ 574.
- Donald P., C. Hartman, J. Venette, G. Secor. Response of sunflowers to culture filtrates from Phoma macdonaldii//Phytopathology. -1987. ̶ 75. ̶ Р. 466 ̶ 468.
- Peres A., Lefol C. Phoma macdonaldii Boerema: e´le´ments de biologie et mise au point d'une me´thode de contamination artificielle en conditions controle´es//Proceedings of the 14th Intern. Sunfl. Conf. -Beijing Shenyang, China, 10-12 June, 1996. ̶ Vol. 2. -Р. 687 ̶ 693.
- Peres A., B. Poisson & G. Drolon. Le syndrome «pieds secs» du tournesol: étude des causes et approche de la nuisibilité//AFPP -sixième conférence internationale sur les maladies des plantes. France, 6 ̶ 8 December, 2000. ̶ Р. 489 ̶ 495.
- Stevan N., Maširević S., Terzić N., Dedić B. and I. Balalić. Phoma macdonaldii on seed and its importance in etiology of phoma black stem in sunflower//Зборник Матице српске за природне. ̶ № 126. ̶ 2014. ̶ P. 57 ̶ 65.
- Саукова С.Л., Арасланова Н.М., Антонова Т.С., Ивебор М.В. Фомоз (Phoma macdonaldii Boerema) в семенах подсолнечника//Масличные культуры. Науч.-тех. бюл. ВНИИМК. Вып. 2 (174). ̶ 2018. ̶ С. 107 ̶ 111.
- Пустовойт Г.В., Краснокутская О.Н., Илатовский В.П., Слюсарь Э.Л. Фитопатологические методы оценки подсолнечника при селекции на иммунитет к основным заболеваниям//Бюл. науч.-тех. информации по масличным культурам ВНИИМК. ̶ 1976. ̶ 1. -С. 3 ̶ 8.
- Антонова Т.С., Арасланова Н.М., Орлова С.Н., Бочкарев Н.И. Методика оценки устойчивости подсолнечника к фомопсису//Ι съезд микологов России. Тезисы докладов. Москва 11 ̶ 12 апреля, 2002. ̶ С. 172.
- Roustaee A., Barrault G., Dechamp-Guillaume G., Lesigne P., Sarrafi A. Inherence of partial resistance to black stem (Phoma macdonaldii) in sunflower//Plant Pathology. ̶ 2000b. ̶ 49. ̶ Р. 396 ̶ 401.
- Dedić B., Maširević S., Miladinović D., Jocić S., Terzić S., Tančić S., Mrđa J. Screening of sunflower inbred lines tolerance to Phoma black stem//Rastenievdni Nauki. ̶ 2012. ̶ 6. ̶ Р. 41 ̶ 44.
- Bert P.F., Deschamp-Guillaume G., Serre F., Jouan I., Tourvieille de Labrouche D., Nicolas P., F. Vear. Comparative genetic analysis of quantitative traits in sunflower (Helianthus annuus L.). Characterisation of QTL involved in resistance to Sclerotinia sclerotiorum and Phoma macdonaldii. Theoretical and Applied Genetics. ̶ ̶ 2004. -109. ̶ Р. 865 ̶ 874.
- Darvishzadeh R., Sarrafi A. Genetic analysis of partial resistance to black stem (Phoma macdonaldii) in sunflower as measured by a seedling test//Plant Breeding. ̶ 2007. ̶ 126. ̶ Р. 334 ̶ 336.
- Darvishzadeh R., Pirzad A., Danesh Y., A. Saraffi. The resistance response of sunflower genotypes to black stem disease under controlled conditions//Phytopathologia Mediterranea. ̶ 2010. ̶ 49. ̶ Р. 187 ̶ 193.
- Lazzaro N, Quiroz F., Eacande A. First report of virulence variability of Phoma macdonaldii in Argentina//18th International Sunflower Conference, Mar del Plata, Argentina, February 27. ̶ 2012. ̶ Vol. 1. -P. 258 ̶ 261.
- Seassau C., P. Debaeke, E. Mestries and G. Dechamp-Guillaume. Evaluation of inoculation methods to reproduce sunflower premature ripening caused by Phoma macdonaldii//Plant Dis. ̶ 2010b. ̶ 94. ̶ Р. 1398 ̶ 1404.
- Наумова Н.А. Методы микологических и фитопатологических исследований. -Л.: Сельхозиздат, 1937. -272 с.
- Boerema G.H., De Gruyter J., Noordeloos M.E. and Hamers M.E.C. Phoma identification manual//In: G Phoma sect. Plenodomus, CABI Publishing, UK. -P. 364 ̶ 366.
- Арасланова Н.М., Саукова С.Л., Антонова Т.С. Патогенность изолятов возбудителя фомоза для растений подсолнечника//В сб.: Инновационные исследования и разработки для научного обеспечения производства и хранения экологически безопасной сельскохозяйственной и пищевой продукции. Мат-лы Междунар. науч.-практ. конф., 6-26 апреля 2016 г., ФГБНУ ВНИИТТИ. -Краснодар, 2015. ̶ С.71 ̶ 74.
- Дьяков Ю.Т., Озерецковская О.А., Джавахия В.Т. . Общая и молекулярная фитопатология. -М.: Общество фитопатологов, 2001. ̶ 302 с.


