Сравнение эффективности и безопасности длительной и сокращенной двойной антиагрегантной терапии после эндоваскулярного закрытия открытого овального окна: клиническое исследование
Автор: Терещенко А.С., Меркулов Е.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.39, 2024 года.
Бесплатный доступ
Введение. С целью профилактики тромботических осложнений после эндоваскулярного закрытия открытого овального окна (ООО) назначается двойная антиагрегантная терапия (ДААТ) с переходом на монотерапию ацетилсалициловой кислотой (АСК). Данные препараты повышают риск кровотечений, в то время как ранняя отмена терапии способна привести к повторным ишемическим инсультам (ИИ) и транзиторным ишемическим атакам (ТИА). Эффективная и безопасная длительность ДААТ точно не установлена из-за малой доказательной базы.Цель исследования: сравнить эффективность и безопасность длительной и сокращенной по времени антиагрегантной терапии (ААТ) у пациентов, прошедших эндоваскулярное закрытие ООО.Материал и методы. В исследование включены 239 пациентов, прошедших эндоваскулярное закрытие ООО. Клинико-анамнестическая характеристика выборки: 140 (58,58%) женщин, медиана возраста - 43,00 [35,00; 52,00] года, 173 (72,38%) пациента перенесли ИИ, 66 (27,62%) - ТИА. Пациенты принимали ААТ по двум схемам: длительная ДААТ (клопидогрел + АСК) в течение 6 мес. с переходом на монотерапию АСК до 5 лет; сокращенная по длительности схема (ДААТ и монотерапия АСК до 6 мес.) Пациенты находились под наблюдением 38,23 [22,20; 48,67] мес. и были разделены на 2 группы. В первую группу вошли 145 (60,70%) пациентов с длительной ДААТ, во вторую - 94 (39,30%) пациента, которые принимали ДААТ по сокращенной схеме.Результаты. Различия между группами пациентов с длительной и сокращенной ДААТ по клинико-анамнестическим и интраоперационным характеристикам, частоте развития осложнений, состоянию в раннем послеоперационном периоде и отдаленной перспективе отсутствуют. Для всех параметров сравнения значение p ˃ 0,05. Продолжительность наблюдения для группы с длительной ДААТ составила 38,65 [23,14; 48,43] мес., 110 (75,86%) пациентов принимали клопидогрел в течение 6 мес., АСК - до 60 мес. За время наблюдения зафиксировано 6 (4,35%) случаев кровотечений, в том числе 1 (0,72%) крупное, 1 (0,72%) случай ИИ и 1 (0,72%) ТИА. Продолжительность наблюдения для группы с сокращенной длительностью ДААТ составила 35,70 [21,43; 51,67] мес. (р = 0,4088). Всего 74 (78,72%) пациента принимали клопидогрел в течение 6 мес. (р = 0,8970), а 68 (72,34%) прекратили терапию АСК через 6 мес. после эндоваскулярного закрытия ООО. За время наблюдения зафиксировано 1 (1,18%) малое кровотечение и 1 (1,18%) ИИ (р ˃ 0,05).Выводы. Длительная и сокращенная до 6 мес. ААТ имеет сравнимую эффективность в профилактике тромботических осложнений после эндоваскулярного закрытия ООО. При приеме ААТ наблюдается тенденция к увеличению риска развития кровотечений, вероятность которых повышается с длительностью лечения. Решение о продолжительности ААТ должно приниматься индивидуально на основании риска тромбообразования и кровотечений.
Двойная антиагрегантная терапия, эндоваскулярное закрытие открытого овального окна, открытое овальное окно, клопидогрел, ацетилсалициловая кислота, профилактика тромбообразования, криптогенный инсульт, транзиторная ишемическая атака
Короткий адрес: https://sciup.org/149147172
IDR: 149147172 | УДК: 616.12-089.844-085 | DOI: 10.29001/2073-8552-2024-39-4-47-55
Текст научной статьи Сравнение эффективности и безопасности длительной и сокращенной двойной антиагрегантной терапии после эндоваскулярного закрытия открытого овального окна: клиническое исследование
Эндоваскулярное закрытие открытого овального окна (ООО) является малотравматичной операцией, при которой местом доступа служит бедренная вена. Окклюдер устанавливается в тоннель овального окна в межпредсердной перегородке (МПП), в редких случаях требуется ее пункция. Возникновение микротравм и асептического воспаления происходит в результате механического воздействия устройства на эндотелий. Кроме того, поверхность окклюдера в силу биофизических свойств вызывает активацию системы свертывания крови с вовлечением клеточного и гуморального звена. С целью снижения вероятности образования микротромбов на устройстве его диски покрывают инертными материалами, такими как оксид титана [1].
Частота возникновения тромбоза окклюдера на текущий момент точно не установлена. Результаты клинических исследований показывают распространенность данного осложнения после эндоваскулярного закрытия ООО в диапазоне от 0,4 до 3%. Предполагается, что такая вариативность зависит от времени наблюдения за состоянием пациентов после манипуляции, типа установленного окклюдера, методов диагностики и возможного отсутствия симптомов тромбоэмболии [2–5].
Вероятность образования тромбов на устройстве считается максимальной в 1-й мес. после установки окклю-дера и минимальной после 1 года. Это связано с процессами эндокардиализации, которая в среднем занимает от 5–6 мес. до 1 года, а окончательное прорастание дисков устройства эндокардом может продолжаться до 5 лет. При этом важную роль играют свертывающая и противосвертывающая системы крови. Чрезмерная активность первой системы способна привести к образованию тромбов с их последующим отрывом и окклюзией просвета артерий головного мозга, а второй – к развитию кровотечений [2–4, 6].
Профилактика тромбозов после эндоваскулярного закрытия ООО заключается в назначении двойной антиагрегантной терапии (ДААТ) с дальнейшим переходом на монотерапию. В настоящее время среди экспертов-кардиологов отсутствует единое мнение по эффективной и безопасной продолжительности профилактики, что вызвано малой доказательной базой1 [1, 7].
Одной из наиболее распространенных схем является длительная – она предполагает ежедневный прием ацетилсалициловой кислоты (АСК) и клопидогрела в течение 6 мес., с переходом на монотерапию АСК до 5 лет. Данные рекомендации были сформулированы в Европейском консенсусном документе по ведению пациентов с ООО от 2018 г.2 [2]. В некоторых случаях назначается пожизненная антиагрегантная терапия (ААТ), что должно быть обосновано высоким риском тромбоза, возможной связью повторного ишемического инсульта (ИИ) с сопутствующими заболеваниями и низким риском кровотечений [3]. В 2020 г. было опубликовано мнение экспертов в области эндоваскулярного закрытия ООО J. Tobis, A. Krishnaswamy и D. Thaler, которые обсуждали состояние проблемы малой доказательной базы по достаточной и безопасной длительности ДААТ [8]. Они указывали, что такое состояние проблемы приводит к необходимости для врачей ориентироваться на собственный клинический опыт.
В 2022 г. Американским обществом по кардиоваскулярной ангиографии и вмешательствам (SCAI) были сформулированы новые рекомендации по лечению ООО, где длительность ДААТ составляла 5 мес. Также в данном документе указывается на недостаточное количество клинических исследований, что делает уровень убедительности рекомендаций низким. В результате в ведении пациентов, прошедших эндоваскулярное закрытие ООО, часть специалистов придерживались рекомендаций от 2018 г. с назначением длительной ДААТ. Другие специалисты в своей работе применяли рекомендации от 2022 г. и назначали сокращенную терапию.3
Ранняя отмена ДААТ и монотерапии АСК потенциально способна привести к тромбообразованию на устройстве. Вследствие этого возможно развитие повторных ИИ и транзиторных ишемических атак (ТИА) после эндоваскулярного закрытия ООО [9]. Однако последние исследования показывают, что частота АСК-ассоциированных кровотечений может превышать частоту ишемических событий [2, 10]. Авторы высказывают мнение относительно безопасности и эффективности сокращенной схемы ААТ. Так, предлагаются различные варианты длительности приема ДААТ от 1 до 12 мес. без дальнейшей монотерапии АСК или с ее продолжительностью до 8 мес. 1 [4, 11–14]. Таким образом, отсутствие доказательной базы относительно длительности профилактики тромбозов после эндоваскулярного закрытия ООО обусловливает проведение дальнейших клинических исследований на данную тему.
Цель исследования: сравнение эффективности и безопасности сокращенной и длительной ААТ у пациентов, прошедших эндоваскулярное закрытие ООО.
Материал и методы
Представленные данные являются фрагментом клинического исследования, проведенного на базе ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России в период с 2019 по 2023 гг. Критерии включения: возраст от 18 до 70 лет, подписанное добровольное информированное согласие на участие в исследовании, наличие показаний для эндоваскулярного закрытия ООО и успешное его проведение. Всего в исследование были включены 276 пациентов. Критерии исключения: возраст менее 18 и более 70 лет, отказ от участия в исследовании и/или проведения эндоваскулярного закрытия ООО, аллергическая реакция и/или непереносимость одного из компонентов ДААТ – АСК или клопидогрела. В общей выборке тромбофилия была выявлена у 30 и противопоказания для приема ДААТ – у 7 пациентов. С учетом этого в приведенной части исследования были обработаны данные 239 пациентов.
Выборка включала 140 (58,58%) женщин и 99 (41,42%) мужчин. Средний возраст пациентов составил 43,00 [35,00; 52,00] года. Индекс массы тела определялся на уровне 24,91 [22,10; 29,24] кг/м2. Дислипидемия была выявлена у 54 (22,59%) пациентов, артериальная гипертония – у 25 (10,46%), атеросклероз сонных артерий – у 16 (6,69%) и сахарный диабет 2-го типа – у 8 (3,35%) пациентов.
Все пациенты прошли стандартное предоперационное обследование, включавшее в том числе клинический анализ крови, трансторакальную эхокардиографию и чреспищеводную эхокардиографию (ЧПЭхоКГ). Также был выполнен расчет баллов по шкалам RoPE и AF-RoPE, позволяющим установить взаимосвязь участия ООО в развитии ишемических событий. По шкале RoPE медиана составила 7,00 [6,00; 8,00] баллов по выборке, а по шкале AF RoPE 11,00 [9,00; 13,00] баллов, что соответствует высокому риску ООО.
Эндоваскулярное закрытие ООО выполнялось в качестве вторичной профилактики ИИ и ТИА, которые были диагностированы у 173 (72,38%) и 66 (27,62%) пациентов соответственно. Для закрытия ООО были использованы три типа устройств: Figulla Flex II PFO (Occlutech Holding AG, Швейцария), Figulla Flex II UNI (Occlutech Holding AG, Швейцария) и Amplatzer Talisman PFO Occluder (Abbott Medical, США).
После проведения эндоваскулярного закрытия ООО пациентам была назначена ДААТ по двум схемам. Первая, длительная ДААТ, включала прием клопидогрела и АСК в течение 6 мес. с дальнейшим переходом на монотерапию АСК до 5 лет. В данном случае при назначении терапии специалисты руководствовались рекомендациями Европейского общества кардиологов от 2018 г. После выхода обновленных рекомендаций лечащие врачи кроме указанной выше схемы применяли также сокращенную по длительности ДААТ. Она включала ДААТ (клопидогрел + АСК) с последующим переходом на монотерапию АСК до 6 мес.
Контрольные обследования пациентов после эндоваскулярного закрытия ООО выполнялись через 1, 6 и 12 мес. после оперативного вмешательства. В дальнейшем осуществлялся телефонный контакт с целью выявить вероятные осложнения, наличие кровотечений, тромбозов, развитие повторных ИИ и ТИА, а также установить длительность приема ДААТ.
За период наблюдения часть пациентов самостоятельно прекратили прием лекарственных препаратов. Причины заключались в некомплаентности больных и не были связаны с аллергической реакцией или непереносимостью АСК и клопидогрела. Общая длительность наблюдения за состоянием пациентов составила 38,23 [22,20; 48,67] мес. – минимально 5 и максимально 70 мес. После прекращения приема АСК исследуемые оставались под наблюдением специалиста до 29,72 [15,46; 40,68] мес.
На момент окончания исследования все включенные пациенты были разделены на 2 группы. В первую группу включены данные 145 (60,70%) пациентов с длительной ДААТ, которые, согласно назначенной схеме, принимали клопидогрел и АСК в течение 6 мес. и АСК до 5 лет. Во второй группе представлены данные 94 (39,30%) пациентов, которым была назначена ДААТ с сокращенной длительностью, а также тех, которые самостоятельно прекратили прием препаратов, не придерживаясь сроков ДААТ в соответствии с первой схемой.
Статистический анализ данных проводили с помощью пакетов программ SPSS STATISTICA v.26 (IBM, США) и JMP Pro 17 (SAS, США). Проверку распределения количественных показателей на нормальность выполняли по критерию Колмогорова – Смирнова с коррекцией Лилье-форса. Показатели, имеющие распределение, отличное от нормального, представлены медианой ( Me ) и межквартильным промежутком [ Q 1; Q 3], Me [ Q 1; Q 3]. Категориальные показатели описаны абсолютными ( n ) и относительными (в %) частотами встречаемости. Сравнение количественных показателей в двух независимых группах пациентов производили с помощью непараметрического критерия Манна – Уитни. Статистическую значимость межгрупповых различий категориальных показателей оценивали с использованием χ 2 -критерия Пирсона. Для анализа риска развития кровотечения в течение периода наблюдения и оценки среднего времени до наступления кровотечения использовали кривые Каплана – Мейера. Сравнение кривых в группах осуществляли с помощью лог-рангового критерия Мантеля – Кокса. Критический уровень значимости при проверке статистических гипотез составлял p = 0,05.
Результаты
Сравнение групп пациентов по исходным клиникоанамнестическим характеристикам показало их сопоставимость. Статистически значимые различия по исследуемым признакам выявлены не были, значение p ˃ 0,05 регистрировалось для всех показателей (табл. 1).
Таблица 1. Исходная клинико-анамнестическая характеристика пациентов
Table 1. The baseline clinical and anamnestic characteristics of patients
|
Показатели |
Длительная ДААТ, n = 145 |
Сокращенная ДААТ, n = 94 |
р |
|
Возраст, лет, Me [ Q 1; Q 3] |
43,00 [35,00; 50,00] |
44,50 [35,00; 57,00] |
0,1820 |
|
Женщины, n (%) |
85 (58,62) |
55 (58,51) |
0,9865 |
|
ИМТ, кг/м2, Me [ Q 1; Q 3] |
24,80 [22,10; 29,24] |
25,75 [22,16; 29,62] |
0,7585 |
|
Артериальная гипертония, n (%) |
18 (12,41) |
7 (7,45) |
0,2203 |
|
Дислипидемия, n (%) |
34 (23,45) |
20 (21,28) |
0,6949 |
|
Атеросклероз сонных артерий, n (%) |
11 (7,59) |
5 (5,32) |
0,4933 |
|
Сахарный диабет, n (%) |
4 (2,76) |
4 (4,26) |
0,5297 |
|
Шкала RoPE, баллы, Me [ Q25%; Q75%] |
7,00 [6,00; 8,00] |
7,00 [5,00; 8,00] |
0,1421 |
|
Шкала AF RoPE, баллы, Me [ Q25%; Q75%] |
11,00 [9,00; 13,00] |
11,00 [9,00; 13,00] |
0,6086 |
Всем пациентам перед эндоваскулярным закрытием ООО была выполнена ЧПЭхоКГ с целью выявления индивидуальных анатомических особенностей сердца. Потенциально на вероятность формирования тромба на устройстве могли повлиять постоянный сброс крови через ООО справа налево, большой размер шунта, аневризма МПП и наличие дополнительных внутрисердечных структур. В данном случае механизм тромбообразования заключался в создании турбулентного тока крови, воздействующего на окклюдер и поврежденный эндокард в области овального окна. По результатам исследования статистически значимых различий между группами не выявлено, при сравнении показателей во всех случаях p ˃ 0,05 (табл. 2).
Таблица 2. Морфофункциональные характеристики структур межпредсердной перегородки
Table 2. Morphofunctional characteristics of the structures of the interatrial septum
|
Показатели |
Длительная ДААТ, n = 145 |
Сокращенная ДААТ, n = 94 |
р |
|
Периодическое шунтирование, n (%) |
55 (37,93) |
32 (34,04) |
0,5417 |
|
Постоянное шунтирование, n (%) |
90 (62,07) |
62 (65,96) |
0,5417 |
|
Аневризма МПП, n (%) |
98 (67,59) |
64 (68,09) |
0,9357 |
|
Длина тоннеля более 12 мм, n (%) |
84 (57,93) |
61 (64,89) |
0,2818 |
|
Большой размер шунта по данным пузырьковой пробы (более 20 сигналов), n (%) |
103 (71,03) |
71 (75,53) |
0,4453 |
|
Дополнительные структуры не выявлены, n (%) |
136 (93,79) |
88 (93,62) |
0,6972 |
|
Сеть Хиари, n (%) |
4 (2,76) |
4 (4,26) |
|
|
Евстахиев клапан, n (%) |
5 (3,45) |
2 (2,13) |
На основании полученных данных для каждого пациента был определен необходимый размер окклюдера. Были использованы такие устройства как Figulla Flex II PFO, Figulla Flex II UNI и Amplatzer Talisman PFO Occluder. Так как по всем изучаемым параметрам группы оказались сопоставимы, то и частота выбора каждого типа окклю-дера также не имела статистически значимых различий, р = 0,06 (рис. 1).
По длительности операции, времени воздействия ионизирующего облучения группы были сопоставимы ( p ˃ 0,05 для всех параметров), таблица 3.
Таблица 3. Интраоперационные характеристики пациентов
Table 3. Intraoperative characteristics of patients
|
Параметры |
Длительная ДААТ, n = 145 |
Сокращенная ДААТ, n = 94 |
р |
|
Длительность операции, мин ( Me [ Q25%; Q75%]) |
60,00 [45,00; 75,00] |
60,00 [40,00; 70,00] |
0,8275 |
|
Доза облучения, мЗВ ( Me [ Q25%; Q75% ]) |
9,40 [6,00; 15,12] |
8,41 [4,30; 13,30] |
0,0561 |
Эндоваскулярное закрытие ООО было успешно выполнено у всех пациентов в обеих группах. В группе с длительной ДААТ отмечались следующие интраоперационные осложнения: контакт с митральным клапаном, гемоперикард и дискомфорт за грудиной – каждое у 1 (0,69%) пациента. Также наблюдались наджелудочковая тахикардия в 7 (4,83%) случаях, пристеночный тромбоз вены и пульсирующая гематома – каждое в 2 (1,38%) случаях. В группе с сокращенной длительностью ДААТ были выявлены фибрилляция предсердий во время установки окклюдера, гемоперикард, эпизод неврологической симптоматики в виде выпадения полей зрения, дискомфорт за грудиной, психоэмоциональное возбуждение и артериовенозное соустье – каждое в 1 (1,06%) случае.
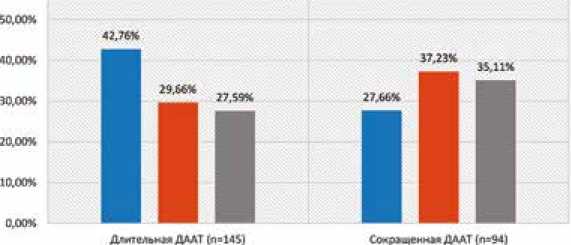
Рис. 1. Распределение установленных окклюдеров
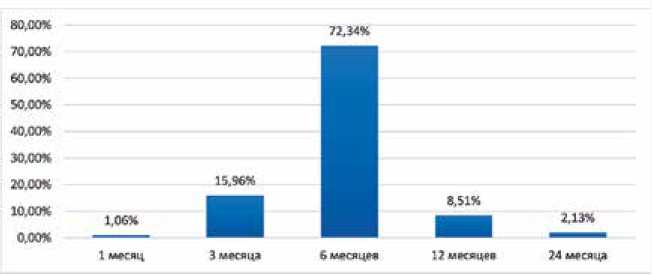
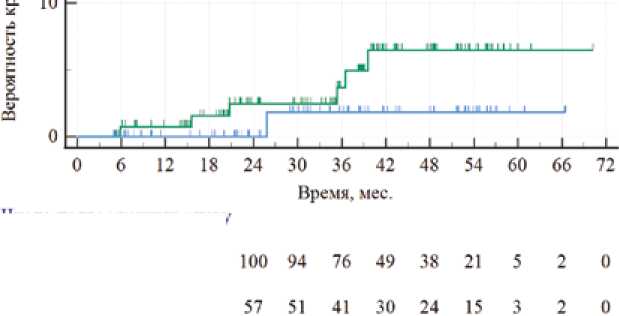
■ F Кроме того, у 5 (5,32%) пациентов была зафиксирована наджелудочковая тахикардия. В послеоперационном периоде в группе с длительной ДААТ у 10 (6,90%) пациентов была установлена имбибиция мягких тканей в месте доступа, у 2 (1,38%) развилось нарушение сердечного ритма по типу наджелудочковых аритмий, у 14 (9,66%) повышение температуры тела выше 37,1 °С, у 5 (3,45%) пациентов присутствовал сброс крови справа налево через овальное окно по данным контрольного ультразвукового исследования с пузырьковой пробой. За госпитальный период у пациентов из группы с сокращенной ДААТ наблюдались имбибиция мягких тканей в 3 (3,19%) случаях, нарушение сердечного ритма – в 4 (4,26%), повышение температуры тела выше 37,1 °С – в 6 (6,38%), значимый сброс через шунт по результатам пузырьковой пробы – в 3 (3,19%) случаях. При сравнении всех типов осложнений между группами статистически значимых различий выявлено не было (p ˃ 0,05 во всех случаях). Медиана количества койко-дней в группе с длительной ДААТ составила 6,00 [5,00; 7,00] дней, а в группе с сокращенной длительностью ДААТ – 7,00 [4,00; 8,00] дней, р = 0,36. Таким образом, группы пациентов были сопоставимы по всем характеристикам. После выписки контрольные визиты были установлены через 1, 6 и 12 мес. В некоторых случаях пациенты могли пропустить очередной осмотр, тогда их состояние фиксировалось в ходе телефонного разговора. Также по прошествии 12 мес. с момента выписки с ними поддерживался телефонный контакт с целью выявить возможные осложнения в отдаленном периоде и установить длительность приема ДААТ. Медиана периода наблюдения для группы с длительной ДААТ составила 38,65 [23,14; 48,43] мес., а для группы с сокращенной длительностью ДААТ – 35,70 [21,43; 51,67] мес., р = 0,4088. Большинство пациентов принимали клопидогрел в течение 6 мес. (рис. 2): 110 (75,86%) – в группе с длительной ДААТ и 74 (78,72%) – в группе с сокращенной длительностью ДААТ. Статистически значимые различия не выявлены, р = 0,9. Пациенты из группы с длительной ДААТ принимали АСК до 60 мес., медиана – 38,65 [23,14; 48,43] мес. В группе с сокращенной длительностью терапии большинство исследуемых прекратили прием препарата в течение 6 мес. после эндоваскулярного закрытия ООО (рис. 3) – в 68 (72,34%) случаях. Таким образом, большая часть пациентов из данной группы завершили ДААТ в течение полугода. Рис. 2. Длительность приема клопидогрела Fig. 2. Duration of clopidogrel administration Рис. 3. Длительность приема ацетилсалициловой кислоты в группе сокращенной двойной антиагрегантной терапии Fig. 3. Duration of acetylsalicylic acid administration in the shortened DAPT group После прекращения приема АСК и клопидогрела пациенты оставались под наблюдением специалиста на протяжении 1,77 [0,07; 10,23] и 30,23 [16,33; 42,00] мес. по группам соответственно, р = 0,001. Большая продолжительность контроля состояния исследуемых после завершения ДААТ из группы с сокращенной длительностью терапии обусловлена необходимостью дальнейшей оценки отдаленных результатов эндоваскулярного закрытия ООО. За время наблюдения в группе с длительной ДААТ всего зафиксировано 8 (5,80%) случаев кровотечения и церебральных сосудистых катастроф. Так, были диагностированы любые по величине кровотечения у 6 (4,35%) пациентов, в том числе крупные кровотечения – у 1 (0,72%). Эпизоды ишемии головного мозга наблюдались у 2 (1,45%) пациентов (ИИ – у 1 (0,72%) и ТИА – у 1 (0,72%) пациента). В группе сокращенной ДААТ у 1 (1,18%) пациента развилось малое кровотечение, у 1 (1,18%) – ИИ. Стати- стически значимые различия отсутствуют по всем парам признаков (р ˃ 0,05 во всех случаях). На основании полученных данных были построены кривые Каплана – Мейера для оценки вероятности кровотечений в группах с разной продолжительностью ДААТ (рис. 4). При сопоставлении кривых обращает на себя внимание их расхождение, начиная с 6-го мес., постепенное схождение в период с 27-го по 36-й мес. и последующее расхождение. На основании наблюдения можно сделать вывод о непропорциональности риска развития кровотечения у пациентов двух групп в течение всего периода наблюдения. При данных условиях наблюдения среднее время до наступления кровотечения для пациентов из группы длительной ДААТ составило 67,5 мес., а для сокращенной – 65,8 мес. Медианные значения достигнуты не были, что является следствием низкой частоты событий в обеих группах. ДАПТ(р 0.2.M') --- стандартная — сокращенная Рис. 4. Кривые Каплана – Мейера для оценки вероятности кровотечений при разной продолжительности двойной антиагрегантной терапии (Log-rank test: p = 0,2317) Fig. 4. Kaplan – Meier curves of bleed probability at different durations of DAPT (Log-rank test: p = 0.2317) Число подверженных риску Группа:стандартная 138 134 127 118 Группа: сокращенная 85 82 71 68 Совокупность полученных в ходе анализа данных позволяет прийти к заключению о наличии некоторой тенденции к более высоким рискам кровотечения в группе длительной ДААТ. Однако отсутствие статистической значимости различий (Log-rank test: p = 0,2317), малое количество неблагоприятных событий в обеих группах, а также высокая частота цензурирования наблюдений после 12 мес. не позволяют сделать однозначных выводов об оценке риска кровотечения. Обсуждение Данные приведенного клинического исследования демонстрируют отсутствие различий между группами с длительной и сокращенной ДААТ по исходным клинико-анамнестическим характеристикам, ходу эндоваскулярного закрытия ООО и состоянию пациентов в послеоперационном периоде. Это свидетельствует о минимальном воздействии указанных факторов на полученные результаты. Статистически значимые различия между группами пациентов по частоте тромботических осложнений, клинически проявляющихся в виде ИИ, ТИА и тромбообразо-вания на имплантированном окклюдере, установлены не были. Кроме отсутствия преимущества длительной ДААТ по сравнению с сокращенной схемой выявлена тенденция к некоторому увеличению риска кровотечений, что должно учитываться при планировании профилактических мероприятий после операции. Аналогичные данные были показаны в нескольких зарубежных работах. В исследовании длительности ДААТ с включением 259 пациентов, перенесших ИИ и прошедших эндоваскулярное закрытие ООО, установлено, что частота повторных эпизодов ишемии составила 0,2% пациента-год и не зависела от длительности ДААТ. В первую группу вошли 88 пациентов, которые принимали антиагрегантные препараты в течение 6 мес., в среднем 184 ± 27 дней. Вторая группа включала 171 пациента, длительность терапии которых в среднем составила 2 628 ± 1 993 дня. За десятилетний период наблюдения было зафиксировано 6 повторных ИИ. Статистически значимых различий между группами не зафиксировано, на основании чего авторы сделали вывод о достаточном сроке антиагрегантной терапии в течение 6 мес. В то же время указывается, что пациенты из первой группы были моложе, имели меньше сопутствующих заболеваний и повторных инсультов перед операцией [12]. В другом исследовании с участием 201 пациента после эндоваскулярного закрытия ООО назначался прием клопидогрела до полугода и АСК пожизненно. Длительность наблюдения составил в среднем 12 лет. За этот период у 6 (3,0%) пациентов зарегистрирована ТИА, у 2 (1,0%) – ИИ. Кроме того, у 13 (6,5%) пациентов наблюдалось кровотечение – 4 больших кровоизлияния, одно из которых с летальным исходом. Все пациенты, перенесшие тромботические осложнения и кровотечение, на момент их возникновения принимали ДААТ или монотерапию АСК. От антиагрегантной терапии через 6 [6; 14] мес. по разным причинам отказались 42 (20,9%) человека. Ни у одного из них в среднем за 10 лет наблюдения не выявлено повторной ишемии [11]. Наблюдение 453 пациентов в течение 8 лет показало развитие у них 27 (6,0%) случаев кровотечения, в том числе 6 крупных. При этом нежелательные события наблюдались только у 12 (2,6%), все эпизоды произошли на фоне приема АСК. По различным причинам 82 (18,0%) пациента прекратили прием терапии через 5–34 мес. после эндоваскулярного закрытия ООО, что в среднем составило 7 мес. профилактики. После отмены АСК ни у одного из них не было зафиксировано ИИ или ТИА [10]. Эффективность ДААТ на протяжении 6 мес. после эндоваскулярного закрытия ООО изучалась при участии 217 пациентов. За 580 [170,3; 420] дней наблюдения повторная ишемия головного мозга зарегистрирована у 9 (4,1%) обследованных, из которых 6 эпизодов произошли в течение первого года. При этом в 4 случаях причины не были связаны с тромбозом окклюдера. Кровотечение зафиксировано у 1 пациента, который на момент его развития принимал ДААТ [5]. Отсутствие разницы между ДААТ и монотерапией АСК в эффективности профилактики тромботических осложнений после эндоваскулярного закрытия ООО продемонстрировано в исследовании с участием 1532 пациентов. На протяжении 3 мес. 599 (39,1%) человек принимали только АСК, 933 (60,9%) – ДААТ. За 5 лет было зарегистрировано 58 нежелательных событий: при распределении по группам – 7,8 и 7,3% соответственно [15]. Аналогичные результаты по частоте развития ИИ и кровотечений получены с включением 157 и 734 пациентов, прошедших эндоваскулярное закрытие ООО и дефекта МПП. Авторы сделали вывод, что длительность ААТ более 6 мес. не оказывает существенного влияния на снижение частоты ишемических событий, но при этом увеличивает риск развития кровотечений [13, 14]. Крупные клинические исследования, представленные в зарубежной литературе, на тему достаточной и эффективной длительности ДААТ, а также ее превосходства над монотерапией АСК малочисленны. Все это приводит к отсутствию в клинических рекомендациях четких указаний на срок проведения профилактики после эндоваскулярного закрытия ООО. Следовательно, представляется оптимальным определять продолжительность приема антиагрегантных препаратов индивидуально в каждом случае с учетом рассчитанных рисков тромбообразова-ния и кровотечений. Представленное клиническое исследование имеет ограничение по объему выборки, поэтому актуально дальнейшее изучение вопроса длительности ДААТ после эндоваскулярного закрытия ООО с включением большего количества пациентов. Выводы Назначение ААТ по длительной схеме (клопидогрел и АСК в течение 6 мес. и монотерапия АСК до 5 лет) после эндоваскулярного закрытия ООО сопоставимо по клинической эффективности стратегии сокращенной ДААТ. Вместе с тем наблюдалась некоторая тенденция к повышению риска кровотечений в отдаленном периоде в группе длительной ДААТ (p > 0,05).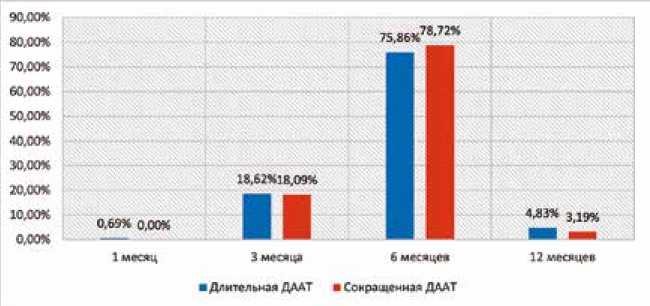
Список литературы Сравнение эффективности и безопасности длительной и сокращенной двойной антиагрегантной терапии после эндоваскулярного закрытия открытого овального окна: клиническое исследование
- Geisler T., Jorbenadze R., Popov A.F., Mueller K.L., Rath D., Droppa M. et al. Thrombogenicity and antithrombotic strategies in structural heart interventions and nonaortic cardiac device therapy-current evidence and practice. Thromb. Haemost. 2019;119(10):1590-1605. https://doi.org/10.1055/s0039-1694751.
- Luca F., Pino P.G., Parrini I., Di Fusco S.A., Ceravolo R., Madeo A. et al. Patent foramen ovale and cryptogenic stroke: Integrated management. J. Clin. Med. 2023;12(5):1952. https://doi.org/10.3390/jcm12051952.
- Olasinska-Wisniewska A., Grygier M. Antithrombotic/Antiplatelet treatment in transcatheter structural cardiac interventions-PFO/ASD/LAA occluder and interatrial shunt devices. Front. Cardiovasc. Med. 2019;6:75. https://doi.org/10.3389/fcvm.2019.00075.
- Mitsis A., Kyriakou M., Christodoulou E., Sakellaropoulos S., Avraamides P. Antithrombotic therapy following structural heart disease interventions: current status and future directions. Rev. Cardiovasc. Med. 2024;25(2):60 https://doi.org/10.31083/j.rcm2502060.
- Noble S., Bonvini R.F., Rigamonti F., Sztajzel R., Perren F., Meyer P. et al. Percutaneous PFO closure for cryptogenic stroke in the setting of a systematic cardiac and neurological screening and a standardised follow-up protocol. Open Heart. 2017;4(1):e000475. https://doi.org/10.1136/openhrt-2016-000475.
- Drakopoulou M., Soulaidopoulos S., Stathogiannis K., Oikonomou G., Papanikolaou A., Toutouzas K. et al. Antiplatelet and antithrombotic therapy after patent foramen oval and atrial septal defect closure. Curr. Pharm. Des. 2020;26(23):2769-2779. https://doi.org/10.2174/138527282499920 0427083838.
- Turc G., Calvet D., Guerin P., Sroussi M., Chatellier G., Mas J.L. CLOSE Investigators. Closure, anticoagulation, or antiplatelet therapy for cryptogenic stroke with patent foramen ovale: Systematic review of randomized trials, sequential meta-analysis, and new insights from the CLOSE study. J. Am. Heart Assoc. 2018;7(12):e008356. https://doi.org/10.1161/JAHA.117.008356.
- Krishnaswamy A. Post-closure antithrombotic therapy - does it matter? Presented on: June 24, 2020. TVT Connect 2020. URL: https://www.tctmd.com/news/antithrombotics-after-pfo-closure-much-discuss-little-data-inform (01.07.2024).
- Pristipino C., Filice F.B. Long-term benefits and risks in patients after persistent foramen ovale closure: a contemporary approach to guide clinical decision making. Kardiol. Pol. 2021;79(3):248-254. https://doi.org/10.33963/KP.15817.
- Wintzer-Wehekind J., Alperi A., Houde C., Cote J.M., Guimaraes L.F.C., Cote M. et al. Impact of discontinuation of antithrombotic therapy following closure of patent foramen ovale in patients with cryptogenic embolism. Am. J. Cardiol. 2019;123(9):1538-1545. https://doi.org/10.1016/j.amjcard.2019.01.043.
- Wintzer-Wehekind J., Alperi A., Houde C., Cote J.M., Asmarats L., Côté M. et al. Long-term follow-up after closure of patent foramen ovale in patients with cryptogenic embolism. J. Am. Coll. Cardiol. 2019;73(3):278- 287. https://doi.org/10.1016/j.jacc.2018.10.061.
- Kefer J., Carbonez K., Pierard S., Mouthuy F.P., Peeters A., Hermans C. et al. Antithrombotic therapy duration after patent foramen ovale closure for stroke prevention: Impact on long-term outcome. J. Interv. Cardiol. 2022;2022:6559447. https://doi.org/10.1155/2022/6559447.
- Rigatelli G., Zuin M., Dell’Avvocata F., Roncon L., Vassilev D., Nghia N. Light anti-thrombotic regimen for prevention of device thrombosis and/ or thrombotic complications after interatrial shunts device-based closure. Eur. J. Intern. Med. 2020;74:42-48. https://doi.org/10.1016/j.ejim.2019.12.010.
- Srivastava A., Dia A., Mishra S., Blair J.E., Paul J., Smazil J. et al. D-48 optimal duration of dual anti-platelet therapy after percutaneous patent foramen ovale and atrial septal defect closure. Journal of the Society for Cardiovascular Angiography and Interventions. 2022;1(3):100253. https://doi.org/10.1016/j.jscai.2022.100253.
- Guedeney P., Farjat-Pasos J.I., Asslo G., Roule V., Beygui F., Hermida A. et al Impact of the antiplatelet strategy following patent foramen ovale percutaneous closure. Eur. Heart. J. Cardiovasc. Pharmacother. 2023;9(7):601-607. https://doi.org/10.1093/ehjcvp/pvad023.


