Сравнение эффективности различных методик монополярной радиочастотной аблации миокарда для лечения длительно персистирующей фибрилляции предсердий : propensity score matching анализ
Автор: Евтушенко А.В., Евтушенко В.В., Павлюкова Е.Н., Курлов И.О., Ваизов В.Х., Катков В.А., Кириакиди Е.Н., Попов С.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.33, 2018 года.
Бесплатный доступ
Статья посвящена оценке результатов клинического применения различных методов монополярной радиочастотной аблации миокарда предсердий.Материал и методы. Всего в исследование включены 298 пациентов с приобретенной патологией сердца, осложненной фибрилляцией предсердий. Все операции выполнялись в условиях искусственного кровообращения и кардиоплегии. В основную анализируемую группу вошли 198 пациентов, которым аблация была выполнена с использованием пенетрирующей радиочастотной техники. Контрольная группа состояла из 100 пациентов, которым была выполнена операция с использованием «классического» монополярного метода радиочастотного воздействия. Обе группы существенно не различались по всем показателям до операции, тем не менее для повышения доверия к результатам была проведена псевдорандомизация с использованием методики Propensity score matching.Результаты. Анализ результатов показал, что пенетрирующая методика воздействия имеет значительно более высокую эффективность по сравнению с «классической» методикой в раннем и отдаленном послеоперационном периодах. В раннем послеоперационном периоде ее эффективность составляет 93%, а в долгосрочной перспективе — 88%. Эффективность «классической» монополярной процедуры ниже: 86 и 68% соответственно.
Фибрилляция предсердий, пенетрирующая радиочастотная аблация
Короткий адрес: https://sciup.org/149125234
IDR: 149125234 | DOI: 10.29001/2073-8552-2018-33-3-46-56
Текст научной статьи Сравнение эффективности различных методик монополярной радиочастотной аблации миокарда для лечения длительно персистирующей фибрилляции предсердий : propensity score matching анализ
Фибрилляция предсердий (ФП) относится к одним из наиболее распространенных и социально значимых расстройств сердечного ритма. Так, в популяции семидесятилетних ее встречаемость достигает 10%. По данным Фре-мингемского исследования, ФП увеличивает риск развития сердечной недостаточности (СН) с 3,2 до 20,6% у мужчин и с 2,9 до 26,0% у женщин, а также повышает общую летальность в 2 раза, а летальность при сердечно-сосудистых заболеваниях — почти в 3 раза. Расходы на лечение пациентов с ФП только в США могут достигать 8–16 млрд долларов в год. При этом в кардиохирургической практике она осложняет течение от 10 до 65% всех случаев.
Общеизвестным является факт, что персистенция ФП даже после успешного хирургического лечения заболеваний сердца ухудшает состояние прооперированных как минимум на 1 ФК NYHA, повышает риск инфарктов паренхиматозных органов и инсультов примерно в 7 раз, а также снижает качество их жизни и психологического комфорта. Известно также, что сохраняющаяся после операции ФП снижает производительность сердца и снижает эффективность самой операции, в частности тем, что ухудшает расход крови по аортокоронарным шунтам.
ФП — это огромная нагрузка на общественное здравоохранение, связанная со значительной заболеваемостью и смертностью. Хирургическое лечение ФП в настоящее время рекомендуется при пароксизмальной, персистирующей или длительно персистирующей ФП во время сопутствующей операции на сердце. Хирургическое лечение ФП как самостоятельная операция может рассматриваться с осторожностью у пациентов с непереносимостью или резистентностью к антиаритмическим препаратам. Несколько исследований дали многообещающие результаты, используя новые аблационные методы, разработанные за последние несколько лет. Тем не менее по-прежнему существует потребность в дополнительных высококачественных рандомизированных исследованиях, чтобы иметь возможность делать надежные клинические рекомендации относительно хирургического лечения ФП [1].
Основными проблемами хирургических подходов к лечению ФП на открытом сердце являются трудности достижения трансмурального повреждения стенки предсердия.
Помимо использования различных устройств для аблации ФП существует несколько способов выполнения самой процедуры аблации. Традиционно двумя вариантами были катетерная технология и хирургическая аблация.
Хирургическое лечение ФП является быстро развивающейся областью сердечно-сосудистой хирургии. В пользу этого говорит множество исследований, охватывающих различные доступные варианты аблационных техник [1].
Однако при оценке результатов эффективности различных методик хирургического лечения ФП есть некоторые нюансы. Во-первых, при представлении результатов есть переменное определение «успех». Это часто описывается как «свобода от ФП» хотя и не определяется далее более конкретно [1]. И, наоборот, в нескольких исследованиях сообщается об «успехе», когда пациенты находятся в синусовом ритме (СР) при наблюдении [1].
Во-вторых, существует огромная гетерогенность в отношении периодов наблюдения, используемых в каждом исследовании. В различных исследованиях периоды наблюдения варьируются от 1 до 5 лет, при этом отсутствие стандартизованного интервала очень затрудняет надежное сравнение результатов [2].
При обзоре современной литературы очевидно, что при хирургическом лечении ФП используется множество наборов линий повреждения. Объяснением этому может быть переход к минимально инвазивной хирургии, целью которого является достижение хороших результатов при использовании менее инвазивных методов. Кроме того, широко признано, что процедура «Лабиринт III» имеет ограниченное применение из-за ее технической сложности. Это привело к разработке других методов воздействия, которые менее инвазивны и легче выполнимы. Было бы целесообразно установить некоторую общую совокупность линий повреждения миокарда предсердий, которую можно было бы использовать в исследованиях.
В настоящее время EACTS рекомендуют использовать терминологию «Лабиринт» («MAZE»), «изоляция легочных вен» (PVI) и «ушко левого предсердия» (LAA) при описании различных модификаций процедур [3]. Это устранило бы разночтения в многообразии схем воздействия на миокард в каждом исследовании и позволяло бы точно сравнивать результаты исследований [1].
Исследования последних лет показали, что выполнение полного набора линий схемы «Лабиринт» в левом предсердии имеет преимущество перед одной только изоляцией легочных вен у пациентов, оперированных одномоментно по поводу пороков митрального клапана и пароксизмальной ФП [4]. Но в то же время в некоторых работах отмечается, что выполнение набора линий для аблации может сильно варьироваться и влиять на результат [5].
Кроме того, имеются ограниченные данные по сравнению различных источников энергии при аблации ФП. В нескольких исследованиях изучалось использование индивидуальных методов аблации для лечения ФП в сочетании с кардиохирургическими вмешательствами [1]. Однако очень немногие исследования сравнивали возможности различных источников энергии друг с другом [1]. Будущие исследования, выполняющие это сравнение, были бы жизненно важны, поскольку необходимы доказательства для определения способов аблации с самыми высокими показателями успеха и наименьшими осложнениями [1].
Основным ограничением в оценке эффективности того или иного метода хирургического лечения ФП является большой пробел в литературных данных при попытках найти рандомизированные исследования, необходимые для получения достоверных результатов и позволяющие создать правильные клинические рекомендации. Существует определенная необходимость в более хорошо проработанных проспективных рандомизированных исследованиях, рассматривающих различные методы аблации [1].
Кроме того, выраженная разнородность исследуемых больных ставит под сомнение тот факт, что именно какой-то один источник энергии для выполнения аблации ФП имеет преимущество перед остальными. Необходимо более глубокое изучение механизмов запуска и поддержания ФП для того, чтобы одномоментно воздействовать на несколько звеньев патогенеза. С учетом описанного выше гибридного лечения ФП необходимо предложить концепцию комплексного подхода, способного воздействовать с разных сторон на ФП. Все вышеописанные исследования практически не включали в себя пациентов с ревматической болезнью сердца, что также ставит под сомнение проекцию их результатов на общую популяцию.
Цель исследования: сравнение ближайших и отдаленных результатов (до 120 мес.) двух разновидностей («классической» и модифицированной пенетрирующей) моно-полярной методики радиочастотного (РЧ) воздействия на миокард при лечении длительно персистирующей ФП.
Материал и методы
В период с 1998 по 2018 г. по поводу длительно персистирующей ФП было прооперировано 298 пациентов (n=298), таблица 1. Всем пациентам хирургическое лечение ФП проводилось как сопутствующая процедура при лечении пороков сердца. В качестве источника энергии использовался РЧ-генератор, имеющий мощность на выходе до 100 Вт. При этом основным рабочим диапазоном была энергия 30–40 Вт. Данный диапазон был подобран экспериментальным путем на этапе разработки и клинических испытаний прибора. Именно данная мощность энергии позволяла добиться трансмурального повреждения миокарда предсердий при использовании электродов рабочим диаметром от 6 до 10 мм без обугливания и структурного повреждения стенки предсердий. По мере совершенствования подходов к РЧ-аблации миокарда были сформированы 2 группы пациентов. В качестве основной анализируемой группы были выделены пациенты с принципиально новым подходом к деструкции миокарда предсердий, так называемой пенетрирующей монополярной методикой воздействия (n =198). Основным отличием данной методики является модифицированный монополярный электрод с игольчатым наконечником, который позволяет проводить РЧ-воздействие на всю толщину стенки предсердия, вызывая трансмуральное повреждение.
Вторую (контрольную) группу составили пациенты, которым РЧ-воздействие проводилось по «классической» монополярной методике с использованием шаровидного электрода рабочим диаметром 8 мм ( n =100).
Как в основной, так и в контрольной группах пассивный электрод деструктора располагался под лопатками пациента. Контроль трансмуральности повреждения осуществлялся автоматически методом импедансометрии с индикацией на панели прибора.
В обеих группах воздействие на миокард предсердий проводилось по схеме «Лабиринт IV», при этом воздействие проводилось как эпи-, так и эндокардиально с тем учетом, чтобы линии РЧ-повреждения, нанесенные на эпикард, дублировались на эндокарде. Данный прием позволил повысить вероятность достижения трансмураль-ности повреждения.
Контроль эффективности процедуры осуществлялся стимуляцией площадки легочных вен после восстановления сердечной деятельности. При отсутствии проведения стимулов на предсердия процедура считалась выполненной эффективно.
Обе группы не имели статистически значимых различий по дооперационным показателям, таким как возраст, размеры полостей сердца по данным эхокардиографии (ЭхоКГ), продолжительность персистенции ФП.
В раннем послеоперационном периоде пациентам проводилась учащающая электрокардиостимуляция (ЭКС) в режиме AAI для подавления эктопической активности предсердий. Назначение антиаритмических препаратов (амиодарон) проводилось по необходимости, в случае развития пароксизмов наджелудочковых тахикардий либо частой предсердной экстрасистолии при отсутствии противопоказаний к назначению препарата.
Оценка эффективности процедуры в раннем и отдаленном послеоперационном периодах проводилась с использованием ЭКГ в 12 отведениях, суточного мониторирования ЭКГ (преимущественно системы фирм «Schiller» и «Инкарт»), опроса пациентов путем телефонной беседы или электронной почты. Функциональный класс СН оценивался с помощью теста с 6-минутной ходьбой.
Статистическую обработку полученных данных проводили с применением пакета программ STATISTICA 10
Таблица 1
Характеристика пациентов обеих групп ( n =298)
|
Параметры |
Пенетрирующая монополярная методика |
«Классический» монополярный «Лабиринт» |
p-value |
|
Общее количество пациентов, n |
198 |
100 |
- |
|
Соотношение мужчины/женщины |
0,64 |
0,61 |
0,3 |
|
Средний возраст, лет |
51,1±7,6 |
50,8±9,8 |
0,4 |
|
Средний класс СН (NYHA) |
2,5±0,3 |
2,4±0,9 |
0,1 |
|
Диаметр ПП, мм |
63,4±5,1 |
63,2±7,9 |
0,2 |
|
Диаметр ЛП, мм |
51,6±6,4 |
52,2±7,1 |
0,4 |
|
Объем ЛП, мл |
220,1±7,3 |
223,4±4,8 |
0,7 |
|
СДЛА, мм рт. ст. |
43,5±10,2 |
44,5±9,6 |
0,4 |
|
ПЖ, мм |
25,4±5,63 |
24,9±6,05 |
0,3 |
|
Толщина МЖП, мм |
10,2±1,74 |
10,4±1,58 |
0,1 |
|
КДР, мм |
53,3±9,2 |
52,9±12,9 |
0,6 |
|
КСР, мм |
36,01±8,2 |
34,2±8,03 |
0,2 |
|
КДО, мл |
125,9±45,5 |
121,4±49,2 |
0,08 |
|
КСО, мл |
51,9±30,4 |
47,6±28,6 |
0,3 |
|
ФВ (М), % |
59,9±11,5 |
62,9±11,8 |
0,02 |
|
ФВ (В), % |
60,01±10,3 |
62,3±9,6 |
0,4 |
|
КДИ |
67,5±22,04 |
64,02±23,7 |
0,1 |
|
КСИ |
27,9±14,9 |
24,9±13,7 |
0,07 |
|
Средний градиент на МК (у больных с митральным стенозом), мм рт. ст. |
11,1±1,5 |
10,7±2,3 |
0,08 |
|
Степень регургитации МК, ERO, мм2 |
22,0±1,2 |
23,1±1,6 |
0,4 |
|
Средняя доказанная давность ФП, лет |
4,5±1,2 |
4,6±1,1 |
0,1 |
|
Заболевания, осложнившиеся ФП |
|||
|
Врожденные пороки сердца |
10 |
14 |
0,02 |
|
Приобретенные пороки сердца |
187 |
83 |
0,4 |
|
ИБС |
1 |
3 |
0.03 |
|
Этиология пороков сердца |
|||
|
Ревматизм |
153 |
71 |
0,06 |
|
Дегенеративный кальциноз аортального клапана |
5 |
1 |
0,002 |
|
Дисплазия соединительной ткани |
25 |
7 |
0,01 |
|
Врожденные септальные дефекты |
10 |
16 |
0,04 |
|
Инфекционный эндокардит |
4 |
2 |
0,2 |
|
Выполненные вмешательства |
|||
|
Протезирование МК |
74 |
35 |
0,3 |
|
Протезирование МК и пластика ТК |
64 |
34 |
0,1 |
|
Протезирование МК и АоК |
5 |
3 |
0,4 |
|
Протезирование МК, АоК, пластика ТК |
4 |
3 |
0,02 |
|
Реконструкция МК |
31 |
4 |
0,003 |
|
Протезирование АоК |
5 |
1 |
0,02 |
|
Пластика ДМПП |
10 |
16 |
0,01 |
|
Пластика ДМПП и коронарное шунтирование - 1 - |
|||
|
Коронарное шунтирование |
1 |
3 |
0,03 |
|
Протезирование МК и коронарное шунтирование |
2 |
- |
- |
|
Пластика ЛП |
31 |
11 |
0,01 |
Примечание: СН — сердечная недостаточность, ПП — правое предсердие, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, КДР — конечный диастолический размер, КСР — конечный систолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объем, ФВ (М) — фракция выброса, М-режим, ФВ (В) — фракция выброса, В-режим, КДИ — конечный диастолический индекс объема ЛЖ, КСИ — конечный систолический индекс объема ЛЖ, МК — митральный клапан, ТК-трикуспидальный клапан, АоК — аортальный клапан, ДМПП — дефект межпредсердной перегородки.
for Windows (StatSoft). Проверку на соответствие выборок нормальному закону распределения проводили критерием Шапиро — Уилка (Shapiro — Wilk). Равенство дисперсий проверялось с использованием критерия Левена. Описание данных осуществлялось с помощью среднего и стандартного отклонения — M ±StD (в случае нормальности распределения данных), медианы, верхнего и нижнего квартилей, межквартильного размаха (при распределении, отличающемся от нормального). Для оценки степени значимости межгрупповых различий использовали t -критерий Стьюдента и U -критерий Манна — Уитни. Для оценки степени значимости внутригрупповых различий (динамика показателей до и после воздействия внутри одной группы) использовали тест Вилкоксона. При сравнении в динамике 3 и более показателей пользовались методом попарных сравнений с поправкой Бонферрони. Для оценки качественных показателей использовали критерий χ 2 (при ожидаемом количестве событий более 5) либо точный критерий Фишера в случае меньшего количества событий. Уровень значимости « р » принимали равным 0,05 , соответственно, доверительная вероятность ( Р дов.)=0,95.
Оценка отдаленных результатов хирургического лечения ФП проводилась с использованием кривых Каплана — Мейера. При сравнении межгрупповой эффективности применялся log-rank тест. Псевдорандомизация проведена методом propensity score matching с использованием способов Kernel и поиска ближайшего соседа.
Результаты
Эффективность процедуры у тех пациентов, которым РЧ-процедура «Лабиринт» выполнена по классической методике воздействия с использованием шаровидного монополярного электрода, при выписке из стационара составила 78%. При этом назначение антиаритмических препаратов (преимущественно амиодарона) позволяет поддерживать эффект операции в сроки наблюдения до 12 мес. Дисфункция синусового узла, потребовавшая проведения временной ЭКС, зарегистрирована у 80% пациентов. 10 пациентам потребовалась в дальнейшем имплантация постоянного искусственного водителя ритма. Ранняя послеоперационная летальность в данной группе пациентов составила 5 человек (5%). Все случаи послеоперационной летальности не связаны с кардиальными причинами.
При изучении ранних и отдаленных результатов применения пенетрирующей методики РЧ-воздействия (табл. 2) выявлено, что эффективность методики при выписке пациентов из стационара составила 92% и при применении антиаритмической терапии (ААТ) остается на этом уровне в сроки наблюдения 6–12 мес. При этом ранняя дисфункция синусового узла (ДСУ), потребовавшая проведения временной ЭКС, наблюдалась у 40% больных. Имплантация постоянного водителя ритма потребовалась 7 пациентам (3,5%). 3 пациента в раннем послеоперационном периоде находились на экстракорпоральной мембранной оксигенации (ЭКМО) в связи с пневмонией, 2 из них скончались.
Несмотря на полученную однородность дисперсии, исходно были выявлены статистически значимые различия по ряду показателей между анализируемыми группами. В связи с этим для повышения доверия к анализируемым данным было решено использовать метод псевдорандомизации propensity score matching [6–8]. Пары были сформированы на основании ключевых показателей, таких как основная этиология поражения сердца, преобладающий тип порока, сопутствующие вмешательства на сердце, длительность персистенции ФП, основные ЭхоКГ показатели до и после вмешательства, продолжительность искусственного кровообращения (ИК) и пережатия аорты. Для формирования пар использовался метод подбора с помощью поиска «ближайшего соседа», соответствующего заданному отрезку PS.
Таблица 2
Ранние и среднесрочные результаты применения различных методик РЧ-воздействия на предсердия ( n =298)
|
Показатели |
Пенетрирующая методика (n=198) |
«Классическая» методика (n=100) |
|
Ранняя ДСУ |
81 (41%) |
86 (86%) |
|
СР при выписке |
184 (93%) |
78 (78%) |
|
ЭКМО |
3 (1,5%) |
- |
|
Летальность |
3 (1,5%) |
2 (2%) |
|
В сроки до 12 мес. |
||
|
А) СР без ААТ |
174 (88%) |
51 (51%) |
|
Б) СР с ААТ |
184 (93%) |
68 (68%) |
|
Потребность в ЭКС |
7 (3,5%) |
10 (10%) |
|
Летальность |
4 (2 %) — от некардиальных причин |
5 (5%) — 1 пациент скончался от геморрагического инсульта |
|
Тромбоэмболии |
0 |
0 |
|
Без эффекта |
10 (5%) |
19 (19%) |
|
Примечание: СР — синусовый ритм, ААТ — |
антиаритмическая терапия. |
|
Заданный отрезок был рассчитан на основании стандартного отклонения, после чего выполнен подбор пар. Данный способ позволил сформировать 81 пару наблюдений, что явилось достаточным для статистической об- работки полученного материала и позволило оценить результаты хирургического лечения длительно персистирующей ФП в обеих группах на однородном материале (табл. 3).
Таблица 3
Формирование пар сравнения на основе метода PSM
|
Параметры |
Группа c пенетрирующей методикой (n=81) |
Группа с «классической» монополярной методикой (n=81) |
р |
Difference |
|
Возраст, лет |
50,8±8,5 |
51,6±10,2 |
0,57 |
0,571 |
|
Женщин, n |
53 (65,4%) |
49 (60,5%) |
0,52 |
–0,075 |
|
ЛП до вмешательства, мм |
51,9±6,0 |
51,7±7,3 |
0,9 |
1,041 |
|
ЛП после вмешательства, мм |
46,1±5,4 |
46,4±5,4 |
0,76 |
1,041 |
|
ПЖ до вмешательства, мм |
24,9±5,9 |
25,2±6,3 |
0,7 |
1,041 |
|
ПЖ после вмешательства, мм |
21,9±4,0 |
22,4±4,5 |
0,45 |
1,041 |
|
МЖП до вмешательства, мм |
10,4±2,1 |
10,5±1,4 |
0,8 |
1,041 |
|
МЖП после вмешательства, мм |
10,5±2,0 |
10,5±1,7 |
0,90 |
1,041 |
|
КДР до вмешательства, мм |
52,0±10,9 |
52,0±11,2 |
0,99 |
1,041 |
|
КДР после вмешательства, мм |
49,9±6,0 |
49,5±7,3 |
0,75 |
1,041 |
|
КСР до вмешательства, мм |
33,4±8,0 |
34,2±8,2 |
0,71 |
1,041 |
|
КСР после вмешательства, мм |
32,6±6,4 |
32,6±7,0 |
1,0 |
1,041 |
|
ФВ (М) вмешательства, % |
63,3±10,7 |
62,3±11,6 |
0,60 |
1,041 |
|
ФВ (М) после вмешательства, % |
63,3±9,7 |
63,4±10,1 |
0,95 |
1,041 |
|
КДО до вмешательства, мл |
118,1±43,1 |
120,1±48,7 |
0,79 |
1,041 |
|
КДО после вмешательства, мл |
104,3±32,3 |
105,9±34,0 |
0,76 |
1,041 |
|
КСО до вмешательства, мл |
46,3±28,3 |
47,5±27,8 |
0,79 |
1,041 |
|
КСО после вмешательства, мл |
40,3±19,9 |
41,5±22,7 |
0,71 |
1,041 |
|
ФВ(В) до вмешательства, % |
62,2±9,1 |
62,0±9,4 |
0,91 |
1,041 |
|
ФВ(В) после вмешательства, % |
62,2±7,5 |
62,0±8,9 |
0,89 |
1,041 |
|
КДИ до вмешательства, мл/м2 |
63,1±20,0 |
63,7±23,1 |
0,87 |
1,041 |
|
КДИ после вмешательства, мл/м2 |
55,8±14,5 |
56,1±15,7 |
0,87 |
1,041 |
|
КСИ до вмешательства, мл/м2 |
24,5±13,1 |
25,1±13,2 |
0,75 |
1,041 |
|
КСИ после вмешательства, мл/м2 |
21,6±9,3 |
22,2±11,0 |
0,69 |
1,041 |
|
СДПЖ до операции, мм рт. ст. |
43,9±8,5 |
43,9±9,4 |
0,99 |
1,041 |
|
СДПЖ после операции, мм рт. ст. |
34,3±8,1 |
34,3±7,3 |
1,0 |
1,041 |
|
Время ИК, мин |
121,1±25,6 |
125,6±28,3 |
0,28 |
1,041 |
|
Пережатие аорты, мин |
77,0±20,3 |
79,5±23,1 |
0,45 |
1,041 |
|
Протезирование МК, n |
58 (72%) |
60 (74%) |
0,337 |
–0,052 |
|
Пластика МК, n |
23 (28%) |
21 (26%) |
0,337 |
0,052 |
|
Пластика ЛП, n |
15 (19%) |
14 (17%) |
0,45 |
0,054 |
|
Сопутствующее вмешательство на ТК |
15 (19%) |
14 (17%) |
0,1 |
1,045 |
|
Сопутствующее вмешательство на АоК |
3 (3,7%) |
4 (4,6%) |
0,08 |
1,045 |
|
Продолжительность ФП, мес. |
26,7±11,3 |
24,5±12,1 |
0,09 |
1,05 |
|
ФВ ЛЖ, % |
55,7±4,2 |
54,9±3,3 |
0,122 |
0,751 |
|
Средний класс СН по NYHA |
2,5±0,5 |
2,7±0,3 |
0,688 |
–0,051 |
|
Этиология |
||||
|
Ревматический порок, n |
60 (74%) |
60 (74%) |
0,99 |
0,042 |
|
Дегенеративный порок, n |
20 (24,8%) |
20 (24,8 %) |
1,0 |
0,150 |
|
ИЭ, n |
1 (1,2%) |
1 (1,2%) |
1,0 |
0,041 |
|
Характер поражения митрального клапана |
||||
|
Стеноз, n |
57 (70%) |
58 (72%) |
0,382 |
–0,052 |
|
Недостаточность, n |
21 (26%) |
21(26%) |
1,0 |
0,036 |
|
Сочетанное поражение, n |
3 (4%) |
2 (3%) |
0,646 |
0,215 |
Примечание: СДПЖ — систолическое давление в правом желудочке, ИЭ — инфекционный эндокардит.
После формирования пар сравнения проводился попарный анализ показателей, оценивались отдаленные результаты на основе использования метода Каплана — Мейера.
По данным сравнения на основании составленных пар подтверждено преимущество пенетрирующей методики над обычной монополярной с использованием классического шаровидного электрода (табл. 4, рис. 1).
После распределения пациентов на пары сравнения по методу PSM мы получили возможность оценить непосредственно влияние самого метода пенетрирующей РЧ-аблации на исход лечения длительно персистирующей ФП.
Так как метод PSM позволяет исключить возможное влияние сторонних факторов на анализ эффективности непосредственно самой методики, то это позволило создать математическую модель на основании использова-
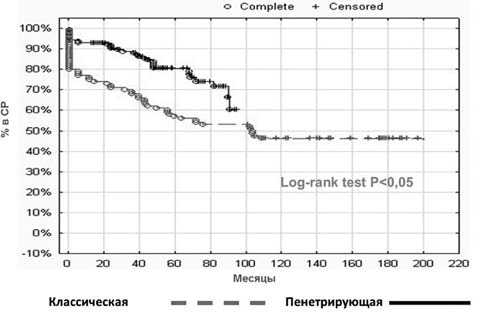
Рис. 1. Сравнение эффективности «классической» монополярной и пенетрирующей методик воздействия в отдаленном периоде ния логистической регрессии, где анализируемым фактором оказался сам метод пенетрирующей РЧ-аблации, таблица 5.
Как видно из приведенной таблицы, отношение шансов составляет 2,66, а в ДИ не входит 1, что говорит о статистической значимости результата, а также о том, что использование пенетрирующей методики выступает протективным фактором, позволяя увеличить шансы на успех хирургического лечения в 2,66 раза.
Обсуждение
ФП после хирургического лечения патологии сердца является распространенным, дорогостоящим и ухудшающим течение послеоперационного периода осложнением в кардиохирургии [9]. Мало того что она ухудшает течение послеоперационного периода у пациентов, но и, усугубляя явления сердечной недостаточности, фактически сводит на нет все результаты труда кардиохирургов [10]. После операций на сердце ФП встречается в среднем в 35% случаев у пациентов, не имеющих в анамнезе данного вида аритмии. При наличии данных за ФП в анамнезе риск возникновения ее приближается к 100% в послеоперационном периоде [11]. Пик возникновения ФП приходится на 2-й послеоперационный день, что приводит к пролонгированию в среднем на 12–24 ч времени нахождения в палате отделения реанимации и интенсивной терапии. Стоимость лечения таких пациентов крайне высока, а эффективность существующих методов профилактики является достаточно низкой [9]. Послеоперационная ФП была идентифицирована как независимый предиктор многих неблагоприятных исходов, в том числе от 2- до 4-кратного повышенного риска
Таблица 4
Сравнение ранних и среднесрочных результатов пенетрирующей и «классической» монополярной методик РЧА (попарный анализ на основании метода PSM)
|
Параметры |
Пенетрирующая методика ( n = 81) |
«Классическая» методика (n=81) |
p -value |
|
Ранняя ДСУ, n (%) |
34 (42) |
69 (86) |
<0,001 |
|
СР при выписке, n (%) |
77 (95) |
63(78) |
0,03 |
|
В сроки 12 мес. |
|||
|
А) СР без ААТ, n (%) |
73 (90) |
41 (51) |
<0,001 |
|
Б) СР с ААТ, n (%) |
77 (95) |
55 (68) |
<0,001 |
|
ЭИТ, n (%) |
4 (5) |
9 (11) |
0,002 |
|
ЭКС, n (%) |
3 (3,7) |
10 (12) |
<0,001 |
|
Летальность, n (%) |
2 (2,5) |
3 (3,7) |
0,09 |
|
Тромбоэмболии, n (%) |
0 |
0 |
ns |
Примечание ЭИТ — электроимпульсная терапия.
Таблица 5
Математическая модель эффективности использования пенетрирующей методики РЧ-аблации миокарда предсердий
Медикаментозная терапия ФП даже в последнее время отличается крайне низкой эффективностью: более чем в 50% ФП рецидивирует по прошествии одного года лечения, и в 84% случаев рецидив наблюдается к концу второго года лечения, а кроме того, лечение пациентов с ФП связано с высокими экономическими затратами [9, 20], поэтому наиболее эффективным считается хирургическое лечение ФП.
Наличие у пациента структурной патологии сердца (пороки, ишемическая болезнь сердца), осложнением которых является ФП, делает медикаментозное лечение аритмии нецелесообразным. Основным методом лечения в такой ситуации является хирургический, заключающийся в коррекции структурной патологии сердца и сочетанном хирургическом лечении ФП.
В соответствии с Рекомендациями по лечению ФП, выпущенными Европейской ассоциацией кардиологов в содружестве с Европейской ассоциацией кардиотора-кальных хирургов (EACTS), наличие у пациента бессимптомного порока сердца при сопутствующей ФП требует хирургической коррекции. Так, ранняя хирургия патологии митрального клапана показана при выраженной регургитации, сохранной фракции выброса и впервые возникшей ФП даже при отсутствии симптомов. Вальву-лотомия должна быть рассмотрена у асимптомных пациентов с выраженным митральным стенозом и впервые возникшей ФП [14].
Выполнение процедуры «Лабиринт» существенно повышает шансы на сохранение СР в послеоперационном периоде у кардиохирургических больных. Анализ анатомических данных аутопсийного материала позволяет говорить о том, что жировая ткань, покрывающая структуры левого и правого предсердий (в частности, легочных вен), не позволяет выполнить адекватную РЧ-деструкцию эпикардиально [19]. Очевидно, что альтернативой «классическому» РЧ-воздействию в условиях глубокой гипотермии должны стать новые принципы проведения РЧ-энергии вглубь миокарда. Эти методы, в идеале, должны обеспечивать нагрев всех слоев миокарда с одинаковой температурой в диапазоне 50–70 °С при минимализации времени и площади воздействия. Решить эту проблему помогает использование пенетрирующей методики РЧ-воздействия. Она позволяет сразу проводить деструкцию на всю глубину миокарда, а особая конструкция устройства делает возможным воздействие практически на любую глубину. Жировая ткань также не является препятствием для воздействия, так как электрод проходит через нее и достигает непосредственно миокарда. Благодаря этому возможно обеспечивать нагрев всех слоев миокарда с одинаковой температурой в диапазоне 50–70 °С при минимализации времени и площади воздействия [15, 16].
Анализ клинических данных показал, что применение пенетрирующей методики воздействия является более эффективным, чем использование обычной («классической») монополярной методики воздействия. Статистически значимая разница (по данным log-rank теста) между сплошной выборкой пациентов и при сравнении подгрупп пациентов с атриомегалией показывает преимущество пенетрирующей методики перед обычной монополярной. Очевидно, что это преимущество обусловлено рядом факторов. Первым и наиболее важным фактором является сам принцип методики, позволяющий воздействовать непосредственно на всю толщину миокарда в единый момент времени, что сокращает площадь и время воздействия, а также позволяет провести РЧ-воздействие в тех участках миокарда, которые покрыты жировой тканью. Вторым положительным эффектом применения данной методики является то, что при нанесении эпикардиального повреждения пенетрирующим электродом следы его воздействия отчетливо видны на эндокарде, что позволяет продублировать эпикардиальные линии повреждения эндокардиальными, которые четко совпадут. Результатом данного технического решения является гарантированная трансмуральность повреждения миокарда предсердий, что подтверждено и биопсийным материалом, и стимуляцией изолированных зон предсердий с отсутствием проведения стимула на соседние участки миокарда.
В настоящее время развитие пенетрирующих систем получает распространение, в частности, для лечения желудочковых нарушений ритма сердца. Так, группа исследователей опубликовала экспериментальную работу, в которой показала, что использование игольчатого электрода с орошением приводит к более глубокому повреждению миокарда левого желудочка при потенциальной аблации эктопических очагов, чем применение стандартного монополярного электрода [17]. При этом in vivo не было зафиксировано каких-либо серьезных осложнений, связанных с применением данной техники.
В нашем исследовании на основании большого клинического материала (198 пациентов) сделано заключение об эффективности применения данной методики. При этом у всех пациентов, вошедших в исследование, не зарегистрировано ни одного случая осложнений, связанных непосредственно с процедурой. Это говорит о том, что предлагаемая нами техника легко применима в клинике и безопасна в использовании. Анализ литературных дан- ных показывает, что она не уступает в эффективности биполярной методике воздействия, особенно в раннем и среднесрочном периодах наблюдения [18]. К преимуществам пенетрирующей методики РЧ-аблации можно также отнести и ее универсальность, позволяющую использовать один и тот же электрод для лечения как наджелудочковых, так и желудочковых нарушений ритма сердца в условиях стернотомии. Также к преимуществам относится и возможность применения пенетрирующего электрода в зонах фиброзных колец митрального и трикуспидального клапанов, которые являются проблемными участками из-за большой разницы в толщине миокарда.
Заключение
Таким образом, использование пенетрирующей технологии РЧ-аблации для лечения длительно персистирующей ФП является эффективным и безопасным. Обязательное дублирование эпикардиальных линий эндокардиальными позволяет добиться гарантированной трансмуральности повреждения миокарда предсердий и обеспечивает стабильные результаты процедуры в среднесрочном и отдаленном периодах. Кроме того, использование данной методики в условиях гипотермии миокарда дает возможность сократить время воздействия, необходимое для необратимой деструкции кардиомиоцитов, что позволяет добиться еще нескольких положительных эффектов.
Список литературы Сравнение эффективности различных методик монополярной радиочастотной аблации миокарда для лечения длительно персистирующей фибрилляции предсердий : propensity score matching анализ
- Kyprianou K., Pericleous A., Stavrou A., Dimitrakaki I. A., Challoumas D., Dimitrakakis G. Surgical management of atrial fibrillation. World J. Cardiol. 2016 January 26; 8(1): 41-56. DOI: 10.4330/wjc.v8.i1.41
- Shemin R. J., Cox J. L., Gillinov A. M., Blackstone E. H., Bridges C. R. Guidelines for reporting data and outcomes for the surgical treatment of atrial fibrillation. Ann. Thorac. Surg. 2007; 83: 1225-1230. PMID: 17307507. DOI: 10.1016/j.athoracsur.2006.11.094
- Dunning J., Nagendran M., Alfieri O. R., Elia S., Kappetein A. P., Lockowandt U., Sarris G. E., Kolh P. H. Guideline for the surgical treatment of atrial fibrillation. Eur. J. Cardiothorac. Surg. 2013; 44: 777-791. PMID: 23956274. DOI: 10.1093/ejcts/ezt413
- Богачев-Прокофьев А. В., Пивкин А. Н., Железнев С. И., Афанасьев А. В., Шарифулин Р. М., Караськов А. М. Результаты различных схем аблации предсердий при коррекции пороков митрального клапана и пароксизмальной фибрилляции предсердий: рандомизированное иследование. Анналы аритмологии. 2016; 13(3): 128-137.
- Пиданов О. Ю., Богачев-Прокофьев А. В., Елесин Д. А., Иваницкий Э. А., Бобровский O. A., Шиленко П. А., Дурыгин П. А., Зотов A. C., Вачев C. A., Вайкин В. Е., Мамчур С. Е., Сапельников О. В., Быстров Д. О. Торакоскопическая аблация для лечения пациентов с изолированной формой фибрилляции предсердий в России. Патология кровообращения и кардиохирургия. 2018; 22(2): 14-21. DOI: 10.21688-1681-3472-2018-2-14-21.
- Rosenbaum P. R., Rubin D. B. The central role of the propensity score in observational studies for causal effects. Biometrika. 1983; 70(1): 41-55.
- D’Agostino R. B. Propensity score methods for bias reduction in the comparison of a treatment to a nonrandomized control group. Statistics in Medicine. 1998; 17(19): 2265-2281.
- Гржибовский А. М., Иванов С. В., Горбатова М. А., Дюсупов А. А. Использование псевдорандомизации (propensity score matching) для устранения систематических различий между сравниваемыми группами в обсервационных исследованиях с дихотомическим исходом. Экология человека. 2016; 05: 50-64.
- Greenberg J. W., Lancaster T. S., Schuessler R. B., Melby S. J. Postoperative atrial fibrillation following cardiac surgery: a persistent complication. Eur. J. Cardiothorac. Surg. 2017; 52(4): 665-672.
- DOI: 10.1093/ejcts/ezx039
- Евтушенко А. В. Постоянная электрокардиостимуляция у больных с мерцательной аритмией и протезом митрального клапана. Дис. … канд. мед. наук. Новосибирск; 1996: 180.
- Богачев-Прокофьев А. В., Сапегин А. В., Пивкин А. Н., Шарифулин Р. М., Афанасьев А. В., Овчаров М. А., Караськов А. М. Среднеотдаленные результаты профилактической аблации предсердий у пациентов с пороками митрального клапана и атриомегалией: пилотное рандомизированное исследование. Патология кровообращения и кардиохирургия. 2017; 21(2): 98-107. DOI: 10.21688-1681-3472-2017-2-98-107.
- Евтушенко А. В., Евтушенко В. В., Саушкина Ю. В., Минин С. М., Петлин К. А., Смышляев К. А., Ваизов В. Х., Гусакова А. М., Суслова Т. Е., Лишманов Ю. Б., Попов С. В. Клиническая оценка радиочастотной денервации сердца. Вестник аритмологии. 2014; 76: 5-10.
- Евтушенко В. В., Макогончук И. С., Евтушенко А. В. Правила и принципы отбора пациентов на хирургическое лечение приобретенных пороков сердца, осложненных фибрилляцией предсердий. Сибирский медицинский журнал. 2017; 32(3): 29-34.
- 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J. 2016; 37: 2893-2962.
- DOI: 10.1093/eurheartj/ehw210
- Евтушенко А. В., Евтушенко В. В., Смышляев К. А., Быков А. Н., Кистенев Ю. В., Анфиногенова Я. Д., Павлюкова Е. Н., Курлов И. О., Попов С. В. Зависимость глубины радиочастотного повреждения миокарда от исходного сопротивления тканей в различных температурных условиях. Патология кровообращения и кардиохирургия. 2016; 20(1): 35-39.
- Евтушенко А. В., Евтушенко В. В., Быков А. Н., Сырямкин В. И., Кистенев Ю. В., Анфиногенова Я. Д., Смышляев К. А., Курлов И. О. Экспериментальное исследование эффективности радиочастотной деструкции миокарда с применением орошаемого и сухого пенетрирующего активных электродов.
- Медицинская техника. 2016; 4(298): 22-25.
- Berte B., Cochet H., Magat J., Naulin J., Ghidoli D., Pillois X., Casassus F., Yamashita S., Mahida S., Derval N., Hocini M., Quesson B., Bernus O., Weerasooriya R., Haïssaguerre M., Sacher F., Jaïs P. Irrigated Needle Ablation Creates Larger and More Transmural Ventricular Lesions Compared With Standard Unipolar Ablation in
- an Ovine Model. Circulation: Arrhythmia and Electrophysiology. 2015; 8: 1498-1506.
- DOI: 10.1161/CIRCEP.115.002963
- Phan K., Xie A., Tian D. H., Shaikhrezai K., Yan T. D. Systematic review and meta-analysis of surgical ablation for atrial fibrillation during mitral valve surgery. Ann. Cardiothorac. Surg. 2014; 3: 3-14. PMID: 24516793.
- DOI: 10.3978/j.issn.2225-319X.2014.01.04
- Евтушенко А. В., Евтушенко В. В., Петлин К. А., Беленкова Е. М., Князева Е. К., Антонченко И. В., Ваизов В. Х., Попов С. В., Шипулин В. М. Пути оптимизации достижения трансмуральности повреждения миокарда предсердий при радиочастотном воздействии. Вестник аритмологии. 2007; 48: 15-21.
- Тепляков А. Т., Гарганеева А. А., Аптекарь В. Д., Рыбальченко Е. В., Степачева Т. А. Оценка антиишемической эффективности баллонной ангиопластики, коронарного шунтирования и консервативной терапии у постинфарктных больных с однососудистым стенозированием коронарного русла при 3-летнем проспективном наблюдении. Кардиология. 2003; 43(7): 16.


