Сравнение метаболических процессов в тканях тонкой и толстой кишок в остром периоде спинальной травмы по данным флуоресцентного время-разрешенного имиджинга FLIM
Автор: Балеев М.С.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
Особое место в развитии ряда ранних и поздних осложнений у пациентов со спинальной травмой отводится кишечной дисфункции, которая определяет дисбаланс обменных процессов в виде мальдигестии, мальабсорбции, кишечной дискинезии. Изучение метаболических процессов в тканях кишечной трубки на фоне травматической болезни спинного мозга позволит открыть новые возможности для коррекции энтеральной и толстокишечной недостаточности и снизить количество хирургических осложнений. Цель. Изучить особенности динамики метаболических процессов в тканях тонкой и толстой кишок при остром повреждении спинного мозга. Материалы и методы. Эксперимент выполнен на лабораторных животных – крысах линии Wistar (n=22). Травма спинного мозга воспроизводилась посредством полного пересечения спинного мозга на уровне позвонков Th5-Th6. Оценку динамики клеточного метаболизма осуществляли в разные временные промежутки развития посттравматической болезни in vivo с помощью технологии флуоресцентного время-разрешенного макроимиджинга FLIM по автофлуоресценции в спектральном канале метаболического кофактора НАД(Ф)Н. Результаты. Острый период травмы спинного мозга сопровождается изменением эндогенной автофлуоресценции тканей серозной оболочки тонкой и толстой кишок. В тонкой кишке отмечается снижение активности обменных процессов и их катаболическая направленность. В стенке толстой кишки, напротив, метаболические процессы с течением времени усиливаются. Выводы. Впервые в эксперименте in vivo показано, что острый период спинальной травмы сопровождается нарушением метаболических процессов в тканях кишечной трубки, при этом имеет место принципиальная разнонаправленность. Данный факт требует более взвешенного подхода в борьбе с кишечной недостаточностью у пациентов в остром периоде травматической болезни спинного мозга.
Травма позвоночника, спинной мозг, тонкая кишка, толстая кишка, автофлуоресценция, FLIM, метаболизм, катаболизм, саркопения, энергетический обмен
Короткий адрес: https://sciup.org/14133869
IDR: 14133869 | УДК: 612.338 | DOI: 10.34014/2227-1848-2025-3-108-117
Текст научной статьи Сравнение метаболических процессов в тканях тонкой и толстой кишок в остром периоде спинальной травмы по данным флуоресцентного время-разрешенного имиджинга FLIM
Введение. Кишечная дисфункция является одним из самых важных и малоизученных аспектов травматической болезни спинного мозга (ТБСМ). Особое внимание обращают на себя метаболические процессы в просвете и стенке кишечной трубки при ее острой деиннервации [1, 2]. Последняя определяет такие патологические состояния, как энтеральная и толстокишечная недостаточность. Они характеризуются нарушениями всасывательной, секреторной, моторной, эвакуаторной, иммунной, барьерной функций пищевари- тельного тракта и их прогрессия является причиной диспротеинемии, дисбаланса минеральных веществ, электролитов, аминокислот, микробиома кишки и, как результат, развития мышечной кахексии, хронической эндотокси-немии с распространением воспалительных процессов на другие органы и системы [3]. Борьба с подобными дефицитными состояниями во многом определяется ранним энтеральным питанием с высоким содержанием белковых продуктов, с одной стороны, и применением медикаментозной терапии – с другой [4–
6]. Вместе с тем недостаточность энергетического обмена из-за пищевого термогенеза, достигающего 30 %, снижает скорость переваривания, всасывания и усвоения белковых продуктов, что в конечном счете определяет высокий уровень метаболического дисбаланса у пациентов с ТБСМ [7–10]. Применение фармакологических препаратов может нивелировать данную проблему, однако их биодоступность ставится под сомнение ввиду тех же самых причин [11, 12].
Отсутствие объективных знаний о процессах метаболизма в стенках тонкой и толстой кишок после травмы спинного мозга обусловлено недостатком соответствующего оборудования, необходимого для подобного рода исследований.
Сегодня благодаря внедрению в исследовательскую практику технологий время-разрешенного флуоресцентного имиджинга (fluorescence lifetime imaging, FLIM) такая возможность появилась [13–16].
Цель исследования. Изучить особенности динамики метаболических процессов в тканях тонкой и толстой кишок при остром повреждении спинного мозга.
Материалы и методы. В качестве экспериментальных животных были использованы самцы крыс линии Wistar массой от 230 до 285 г
(n=22). Условия содержания животных в сертифицированном виварии ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России и порядок проведения исследования соответствовали международным правилам Guide for the Care and Use of Laboratory Animals и отвечали требованиям Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (18.03.1986). Работа одобрена комитетом по этике ФГБОУ ВО «ПИМУ» Минздрава России (протокол № 17 от 11.10.2019).
Оперативные вмешательства проводились под общим обезболиванием смесью пропорциональных массе тела растворов: 3,5 % тилетамина гидрохлорида, золазепама и 2 % ксилазина гидрохлорида внутрибрюшинно. В основную группу вошли 20 лабораторных животных, которым воспроизводили травму спинного мозга с последующей регистрацией процессов метаболизма в стенках тонкой и толстой кишок и забором материала для гистологического исследования. У 2 животных участки тонкой и толстой кишок забирали на патоморфологическое исследования без моделирования травмы (рис. 1).

Рис. 1. Схема эксперимента. Забор образцов тонкой и толстой кишки на патоморфологическое исследование у животных без травмы, через 3 и 24 ч после нее
Fig. 1. Experimental scheme. Collection of small and large intestine samples for pathomorphological examination in animals without injury; 3 and 24 hours after injury
Эксперимент проведен в два этапа. Первым этапом стало выполнение 20 животным под общим обезболиванием срединной лапаротомии (разрез до 4 см) с последующим переменным выведением в лапаротомную рану участков тонкой и толстой кишок и динамической автофлуоресценцией их тканей со стороны серозной оболочки. Метаболические процессы регистрировали до нанесения спинальной травмы, через 3 и 24 ч после нее.
В эксперименте лабораторные животные основной группы были разделены на
2 подгруппы: 1) крысы (n=10), исследование у которых проводили до травмы и через 3 ч после нее с дальнейшим забором гистологического материала; 2) крысы (n=10), исследование у которых проводили через 24 ч с последующим забором патоморфологиче-ского материала.
Модель спинальной травмы воспроизводилась посредством полного пересечения спинного мозга на уровне позвонков Th5-Th6 после микрохирургической ламинэктомии (рис. 2 а) [17, 18].
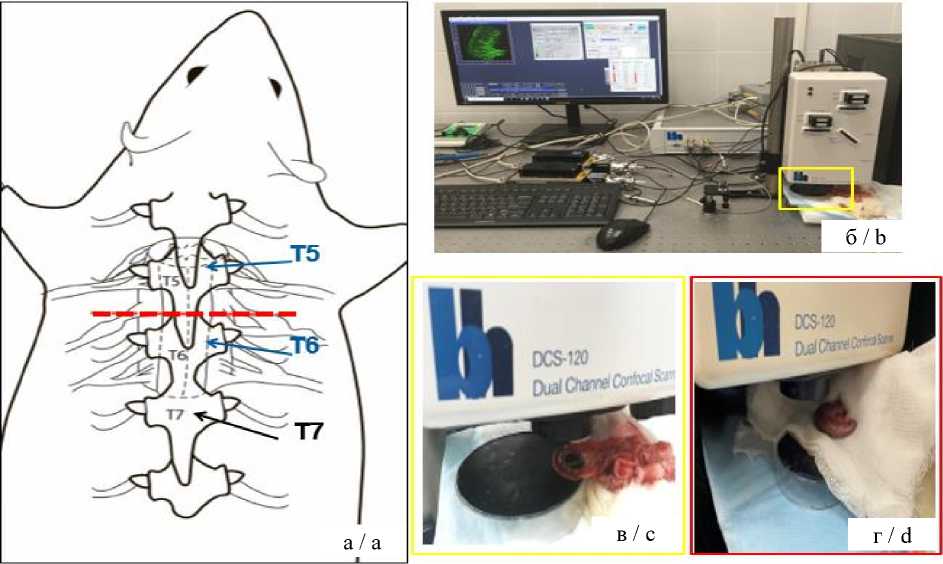
Рис. 2. Схема нанесения спинальной травмы (а), FLIM-макросканер и проведение регистрации эндогенной флуоресценции (б) с поверхности тонкой (в) и толстой (г) кишок крысы in vivo
Fig. 2. Scheme of spinal injury (a), FLIM macroscanner and registration of endogenous fluorescence (b), from the surface of the small (c) and large (d) intestines of rats in vivo
их относительные вклады (а 1 и а 2 , а 1 +а 2 =100 %), а также средневзвешенное время жизни (τm) [14, 19].
Способность FLIM оценивать баланс гликолитического и окислительного метаболизма клеток обусловлена возможностью регистрации автофлуоресценции кофакторов дегидрогеназ – восстановленного никотинамидаденин-динуклеотидфосфата и окисленного флавина-лениндинуклеотида. При этом гликолиз характеризуется коротким временем жизни флуоресценции свободной формы НАД(Ф)Н (~0,45 нс), тогда как связанная форма ассоциирована с митохондриальным дыханием и определяется более длинным временем жизни (~2–3 нс).
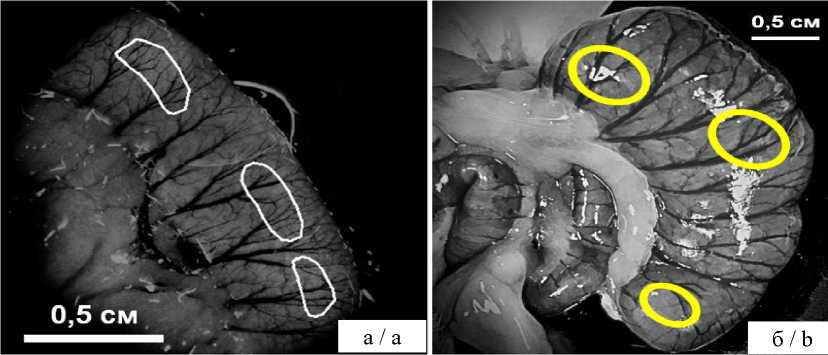
В анализ были включены 50 зон тонкой и 50 зон толстой кишок, в которых оценены параметры затухания эндогенной флуоресценции со стороны серозной оболочки (рис. 3). Сканирование проводили до нанесения спинальной травмы, через 3 ч (n=10) и 24 ч (n=10) после нее, затем выполняли забор гистологического материала на патоморфологическое исследование.
б / b а / a
Рис. 3. Пример выделения областей интереса на FLIM-изображениях тонкой (а) и толстой (б) кишок крысы со стороны серозной оболочки для расчета параметров затухания эндогенной флуоресценции
Fig. 3. An example of selecting areas of interest in FLIM images of the small (a) and large (b) intestines of rats from the serous membrane side to calculate the parameters for endogenous fluorescence attenuation
Для статистической обработки данных использовали программу IBM SPSS Statistics 20. Оценку статистической значимости различий при сравнении групп по количественному признаку проводили по критерию Вилкоксона для непараметрических выборок. Данные представлены в виде Me [Q1; Q2], где Ме – медиана, Q1 – нижний квартиль, Q2 – верхний квартиль. Критическое значение уровня значимости принимали равным 5 % (р≤0,05).
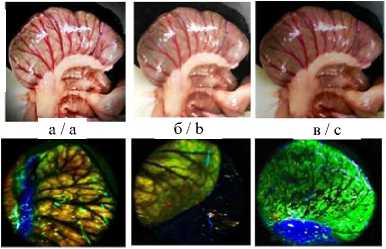
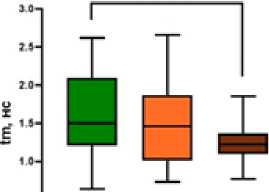
Результаты и обсуждение. В ходе экспериментального исследования макроскопически произведена визуальная оценка состояния кишечной трубки, методом FLIM были установлены различия в динамике метаболических процессов в тканях тонкой и толстой ки- шок после спинальной травмы. Микроскопически оценены гистологические изменения в кишечной трубке. До нанесения травмы визуально нормальные тонкая и толстая кишки имели розовый цвет, активно перистальтиро-вали (рис. 4 а). При этом исходное средневзвешенное время жизни флуоресценции в серозной оболочке тонкой кишки составило 1,49 [1,20; 2,09] нс, в тканях толстой кишки – 1,25 [0,98; 1,51] нс. Время жизни флуоресценции короткой и длинной компонент до травмы в тонкой кишке составляло соответственно 0,52 [0,46; 0,58] нс и 5,8 [4,0; 6,3] нс, в толстой кишке – 0,48 [0,40; 0,54] нс и 4,0 [2,79; 5,26] нс (табл. 1). Сразу после спинальной травмы явных патологических процессов не наблюдалось, однако к исходу 3 ч перистальтика тон- кой кишки визуально снизилась, серозная оболочка стала несколько тусклее по сравнению с нормой, тогда как в толстой кишке визуально нарушений не фиксировалось (рис. 4 б). Значения τm статистически значимо не изменились, однако имели тенденцию к снижению для тонкой кишки (1,45 [1,01; 1,86] нс, р=0,461) и тенденцию к росту для толстой (1,34 [1,16; 1,48] нс, р=0, 561) (табл. 1). Через
24 ч после спинальной травмы в макроскопической картине тонкой кишки фиксировались признаки динамической кишечной непроходимости: раздутость кишечных петель, отсутствие перистальтических движений, некоторая отечность кишечной стенки, тусклая серозная оболочка с участками выраженной гиперемии (рис. 4 в). Толстая кишка была менее паретич-ной с несколько тусклой серозной оболочкой.
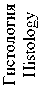
Норма (до травмы) Norm (before trauma)
Через 3 ч после травмы 3 hours after injury
Через 24 ч после травмы 24 hours after injury)
Фото Photo
FLIM. Li
Норма (до травмы) Norm (before trauma)
Через 3 ч после травмы 3 hours after injury
Через 24 ч после травмы 24 hours after injury)
Фото Photo
FLIM, Tm

Тонкая кишка Small intestine
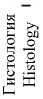
Толстая кишка Large intestine p=0,0001
p=0.0001
IS'
0 ° 1 i i i
Норма 3 ч / 3 hours 24 ч / 24 hours (до травмы)
Norm после травмы /
(before trauma) after injury ж / g
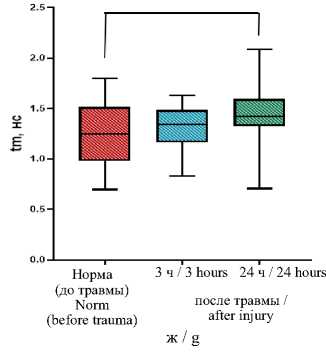
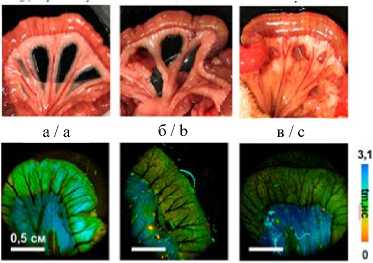
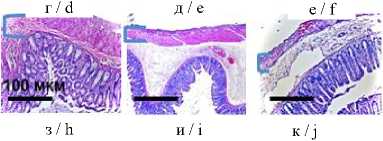
Рис. 4. Макрофото, макро-FLIM и гистология тонкой и толстой кишок крыс со стороны серозной оболочки в разный период после нанесения спинальной травмы (а-в); FLIM-изображения, параметр τm (г-е); диаграмма сравнения τm в исследуемых группах (ж); гистологические изображения, окраска гематоксилином и эозином (з-к)
Fig. 2. Macro-photo, macro-FLIM and histology of the small and large intestines of rats from the serous membrane side at different periods after spinal injury (a-c); FLIM-images, τm parameter (d-f); diagram comparing the τm parameter in the study groups (g); histological images, hematoxylin and eosin staining (h-j)
Таблица 1
Table 1
Параметры времени жизни автофлуоресценции, рассчитанные для серозной оболочки тонкой (А) и толстой (B) кишок
Autofluorescence lifetime parameters calculated for the serous membrane of the small (A) and large (B) intestines
|
Параметр Parameter |
Норма (до травмы) Norm (before injury) |
Через 3 ч после травмы 3 hours after injury |
Через 24 ч после травмы 24 hours after injury |
||
|
Me [Q1; Q2] |
Me [Q1; Q2] |
р* |
Me [Q1; Q2 |
р* |
|
|
τ m (нс) А |
1,49 [1,20; 2,09] |
1,45 [1,01; 1,86] |
0,461 |
1,19 [0,98; 1,32] |
0,0001 |
|
τ m (нс) B |
1,25 [0,98; 1,51] |
1,34 [1,16; 1,48] |
0,561 |
1,42 [1,32; 1,59] |
0,041 |
|
τ 1 (нс) А |
0,52 [0,46; 0,58] |
0,54 [0,40; 0,62] |
0,959 |
0,53 [0,48; 0,60] |
0,441 |
|
τ 1 (нс) B |
0,48 [0,40; 0,54] |
0,49 [0,46; 0,51] |
0,876 |
0,56 [0,51; 0,62] |
0,078 |
|
τ 2 (нс) А |
5,8 [4,0; 6,3] |
5,7 [3,2; 6,6] |
0,573 |
3,8 [3,0; 4,5] |
0,0001 |
|
τ 2 (нс) B |
4,0 [2,79; 5,26] |
4,52 [3,85; 5,0] |
0,673 |
4,59 [4,1; 6,11] |
0,008 |
|
a 1 (% ) А |
76,7 [72,3; 81,3] |
78,2 [74,6; 81,3] |
0,272 |
78,9 [75,3; 79,7] |
0,019 |
|
a 1 (% ) B |
77,3 [74,5; 79,1] |
77,5 [75,9; 79,8] |
0,263 |
77,9 [76,6; 80,5] |
0,018 |
|
a 2 (%) А |
23,1 [18,6; 27,6] |
21,9 [18,6; 25,3] |
0,268 |
21,3 [20,0; 22,2] |
0,0001 |
|
a 2 (%) B |
22,7 [20,9;25,4] |
22,4 [20,9; 24,1] |
0,275 |
21,2 [19,4; 23,3] |
0,0001 |
Примечание. * – критерий Вилкоксона, сравнение данной группы с нормой.
Note. * – Wilcoxon test, comparison with the norm; τ 1 , τ 2 – fluorescence lifetime of short and long components, respectively; a 1 , a 2 – relative contributions of short and long components, respectively.
Анализ данных FLIM свидетельствует о том, что значения τm статистически значимо (р=0,0001) снизились до 1,19 [0,98; 1,32] нс в тканях тонкой кишки и статистически значимо (р=0,041) выросли до 1,42 [1,32; 1,59] нс в тканях толстой кишки. Время жизни флуоресценции длинной компоненты через 24 ч после травмы значимо (р=0,0001) снизилось до 3,8 [3,0; 4,5] нс в тканях тонкой кишки и увеличилось (р=0,008) до 4,59 [4,1; 6,11] нс в тканях толстой кишки (табл. 1). Значения процентного вклада короткой (а 1 ) и длинной компонент (а 2 ) для стенок тонкой и толстой кишки также приведены в табл. 1.
Морфологическое исследование тканей 2 контрольных крыс показало, что патологических изменений на уровне всех слоев кишечной трубки как со стороны тонкой, так и со стороны толстой кишки не наблюдалось. Через 3 ч после травмы гистологические изменения также не зафиксированы (рис. 4 з-и). По истечении 24 ч в серозной оболочке и подслизистой основе толстой кишки наблюдалось умеренное воспаление и истончение слизистой, тогда как в тонкой кишке слабо выраженное воспаление наблюдалось лишь в 25 % случаев, а выраженное диффузное вплоть до формирования мелких очаговых некрозов – в 42 % случаев, в остальных 33 % случаев зафиксированы острые дисциркуляторные расстройства микроциркуляции (рис. 4 к).
Полученные данные свидетельствуют о том, что острый период травмы спинного мозга в различные временные промежутки сопровождается разнонаправленными метаболическими процессами в тканях тонкой и толстой кишок. Так, в тонкой кишке вклад короткой компоненты растет относительно нормы, говоря о катаболической направленности обмена веществ со сдвигом метаболизма в сторону гликолиза, что, вероятнее всего, связано с нарушением перфузии стенки тонкой кишки, с одной стороны, и нарушением ее симпатической иннервации – с другой. Кроме того, значительное снижение τ 2 через 24 ч после нарушения спинномозговых структур указывает на изменения флуорофорного состава ткани за счет нарушения структуры коллагена и пониженного всасывания липидов.
В тканях толстой кишки интенсивность и эффективность метаболических процессов, напротив, повышается. Работы A.R. White указывают на тот факт, что после травмы спинного мозга АТФ-опосредованные тормозные нейросинаптические связи в толстой кишке (IJPs) могут оставаться функционально активными на протяжении нескольких недель. Данное явление объясняется компенсатор- ными реакциями, реализуемыми через механизмы нейрогуморальной регуляции, изменения в которой непосредственно связаны с энергетическим обменом в тканях толстой кишки [20].
Заключение. Острый период травмы спинного мозга сопровождается разнонаправленными нарушениями метаболических процессов в серозной оболочке тонкой и толстой кишок, которые прогрессируют с течением времени. Так, в тканях тонкой кишки обменные процессы имеют катаболическую направленность с усилением процессов анаэробного гликолиза, что требует активной энтеральной терапии с учетом энергетических затрат на пищеварение. В серозной оболочке стенки толстой кишки, напротив, наблюдается усиление метаболических процессов, что дает право на применение препаратов, активно всасывающихся в просвете толстой кишки, и при этом иметь возможность снизить потерю воды, электролитов, минералов, витаминов, сохранить ферментацию короткоцепочечных жирных кислот.
Таким образом, установленные закономерности могут стать ключом к решению проблемы кишечной недостаточности как предиктора ряда общехирургических осложнений у пациентов с последствиями спинальной травмы.
Работа выполнена при поддержке сотрудников ФГБОУ ВО «Приволжский исследовательский медицинский университет» Министерства здравоохранения Российской Федерации (г. Нижний Новгород): Е.Б. Киселевой, М.В. Ширмановой, В.И. Щеславского, Н.Д. Гладковой, М.А. Сироткиной, М.Г. Рябкова – и РНФ (проект № 19-75-10096).


