Сравнение методов изотермической петлевой амплификации в режиме реального времени (LAMP) и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ПЦР) для диагностика Streptococcus pneumoniae у свиней
Автор: Толстова Е.А., Агольцов В.А., Черных О.Ю., Падило Л.П., Попова О.М.
Статья в выпуске: 3 т.255, 2023 года.
Бесплатный доступ
Цель исследования являлось сравнение методов изотермической петлевой амплификации в режиме реального времени (LAMP) и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ПЦР) для диагностика Streptococcus pneumoniae у свиней. Результаты, полученные при проведении лабораторных диагностических исследований биоматериала от свиней, поступившего в Кропоткинскую краевую лабораторию за последние 4 года (с 2019 по 2022 гг.), свидетельствуют о высокой частоте обнаружения S. pneumoniae (от 33 до 65%). Сравнив методики ПЦР и LAMP можно отметить, что у изотермической петлевой амплификации время реакции занимает от 5 до 45 минут, что позволяет провести то же исследование, что и ПЦР, но значительно быстрее, а также LAMP имеет высокую специфичность от 4-6 праймеров, а ПЦР только 2.
Диагностика, пцр с флуоресцентной детекцией в режиме реального времени, изотермическая петлевая амплификация lamp, свиньи
Короткий адрес: https://sciup.org/142238924
IDR: 142238924 | УДК: 619.615.33.616.24-002.636.4 | DOI: 10.31588/2413_4201_1883_2_255_336
Текст научной статьи Сравнение методов изотермической петлевой амплификации в режиме реального времени (LAMP) и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ПЦР) для диагностика Streptococcus pneumoniae у свиней
Streptococcus pneumoniae является основной причиной пневмонии, менингита и других инвазивных заболеваний, приводящих к заболеваемости и смертности среди поросят от 1 до 4 месяцев, а также свиноматок. Неточная идентификация S. pneumoniae скрывает точную оценку тяжести заболевания и может отсрочить выбор лечения. Это общая проблема, с которой чаще всего сталкиваются крупные свиноводческие комплексы. Противоречивые методы выявления часто задерживают раннюю идентификацию и подтверждение S. pneumoniae .
Имеющиеся данные о тяжести болезни и распространенности S. pneumoniae достоверно не оценены, также, как и факторы риска, с которыми сталкивается свиноводство в настоящее время, что, в свою очередь, ограничивает использование доступных пневмококковых вакцин. В данной статье мы рассматриваем и сравниваем методы: ПЦР и LAMP в режиме реального времени [9, 14, 15].
Такие методы как посев или обнаружение антигена, традиционно использовались для микробиологической диагностики, но они требуют много времени и недостаточно чувствительны. Метод ПЦР позволил сократить время диагностики, но требует дорогостоящего оборудования. Таким образом, появляются новые изотермические методы, одним из которых является петлевая изотермическая амплификация (LAMP) [1, 3, 6].
Метод изотермической петлевой амплификации в режиме реального времени LAMP – это метод амплификации ДНК при постоянной температуре 65°C с использованием ДНК-полимеразы, способной вытеснять вторую цепь ДНК, и праймеров, при достройке которых формируются ампликоны [8, 9, 10].
Выявления ДНК Streptococcus p n e u moniae основан на экстракции ДНК из биологического материала совместно с ДНК экзогенного контрольного образца (ВКО L ) и проведения изотермической петлевой амплификации, полученной ДНК в режиме «реального времени» [1, 2, 3].
Полимеразная цепная реакция (ПЦР) – циклический процесс, принцип которого сводится к следующему: молекулу ДНК подвергают температуре 95 °C (денатурации) для расплетения двойной цепи ДНК, далее при охлаждении до 55-65 °C праймеры комплементарно присоединяются к специфическому фрагменту одноцепочной ДНК (отжиг праймеров), и при последующем повышении температуры до 72 °C начинается ферментативный процесс достройки (синтез) молекулы ДНК при участии фермента Taq-полимеразы. Эти операции составляют один цикл ПЦР и приводят к удвоению количества ДНК в исследуемом образце [4, 5, 6].
Преимущество ПЦР заключается в том, что она позволяет проводить генетические исследования даже с небольшими количествами целевого биологического материала. Этот метод позволяет размножить любой фрагмент ДНК в течение двух или даже трех часов [7, 8, 11].
LAMP же в свою очередь, высокоспецифичен и увеличивает количество амплифицированной ДНК даже до миллиарда копий менее чем за час, по сравнению с миллионом копий, получаемых с помощью ПЦР на данной промежутке времени. Изотермическое усиление может быть выполнено без предварительного лабораторного оборудования, например, в сухом блочном нагревателе или водяной бане.
Другим инновационным аспектом LAMP является его высокая специфичность благодаря использованию нескольких праймеров (от четырех до шести), которые могут различать до восьми специфических местоположений на матрице ДНК, по сравнению только с двумя при обычной ПЦР [12, 13, 14].
Цель исследования – сравнение методов изотермической петлевой амплификации в режиме реального времени (LAMP) и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ПЦР) для диагностика Streptococcus pneumoniae у свиней.
Материал и методы исследований. Исследования проводились на базе Кропоткинской краевой ветеринарной лаборатории. Были применены методики: изотермическая петлевая амплификация в режиме реального времени (LAMP) и полимеразная цепная реакция с флуоресцентной детекцией в режиме реального времени (ПЦР). Использованы ПЦР-набор «Вет-фактор» (Россия) и WarmStart LAMP (New England Biolabs).
Материалом для лабораторных исследований служили: смывы из носовых ходов и ротовой полости свиноматок, а также патологический материал от трупов поросят.
Для постановки реакций было задействовано следующее оборудование: Амплификаторы («Rotor-Gene 6000» Corbett Research, Австралия) и «Real-time CFX Connect» (Bio-Rad Laboratories, США) с принадлежностями, твердотельный термостат для пробирок типа «Эппендорф» на 1,5мл с диапазоном температур от 25 до 99°C (ТТ-2-«Термит», Россия), микроцентрифуга для пробирок типа «Эппендорф» до 12 тыс. об/мин («MiniSpin», Германия), вортекс («ТЭТА-2», Россия) вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости («ОМ-1», Россия), настольный бокс с бактерицидной лампой («БАВп-«Ламинар-С» - 1,2», Россия).
Результат исследований.
Streptococcus pneumoniae является повсеместным условно-патогенным микроорганизмом и выступает в качестве этиологического фактора многих патологий свиней. Результаты, полученные при проведении лабораторных диагностических исследований биоматериала, поступившего в Кропоткинскую краевую лабораторию за последние 4 года (с 2019 по 2022 гг.), свидетельствуют о высокой частоте обнаружения S. pneumoniae (Таблица 2).
При проведении исследований ПЦР с флуоресцентной детекцией в режиме реального времени (ПЦР) и изотермической петлевой амплификации в режиме реального времени (LAMP) были отмечены следующие отличительные черты (Таблица 2). LAMP протекает непрерывно при поддержании температуры 65°C, что оптимально для Bst-полимеразы, так в реакционной смеси остаются свободные дНТФ и праймеры. При анализе кривых флуоресценции проводят определение порогового цикла реакций Ct, который не эквивалентен Ct ПЦР. Из-за лавинообразного накопления продуктов амплификации, трудно провести количественную оценку анализируемой мишени в образце.
Таблица 1 – Статистические данные по S. pneumoniae в Краснодарском крае за 2019-2022 гг.
|
Год |
Количество проб патматериала |
Проведено ПЦР/LAMP исследований |
Получено положительных результатов |
% положительных результатов |
|
2019 |
15 |
15 |
5 |
33,33 |
|
2020 |
12 |
12 |
6 |
50,0 |
|
2021 |
20 |
20 |
13 |
65,0 |
|
2022 |
10 |
10 |
2 |
20,0 |
Таблица 2 – Отличительные черты ПЦР и LAMP
|
Характеристика |
ПЦР |
LAMP |
|
Предварительный этап денатурации ДНК |
нужен |
не нужен |
|
Температурный режим |
Термоциклирование |
Изотермический (65°C) |
|
Специфичность |
Высокая (2 праймера) |
Очень высокая (4-6 праймеров) |
|
Время реакции |
от 45 мин – 1,5 ч |
от 5 мин – 45 мин |
|
Идентификация нескольких мишеней в одной пробирке |
да |
нет |
|
Количественный анализ |
да |
нет |
|
Контаминационная опасность |
высокая |
очень высокая |
Биологический материал отбирали следующим образом: мазки (со слизистой носоглотки, ротоглотки) снимали с помощью стерильного зонда, зонд помещали в пластиковую микропробирку объемом 1,5 мл с 0,5 мл стерильного физиологического раствора. Фрагменты тканей и органов - кусочки паренхиматозных органов размером 1х1х1 см (печень, легкие, селезенка), лимфатические узлы, фрагменты пораженных кожных покровов, мозг – отбирали в стерильные контейнеры.
Далее готовили исследуемые пробы для выделения ДНК. Пробы тканей и органов гомогенизировали с использованием стерильных фарфоровых ступок и пестиков, затем готовили 10% суспензию на стерильном фосфатном буфере. Суспензию переносили в пробирку объемом 1,5 мл и центрифугировали при 2 тыс. об/мин («MiniSpin», Eppendorf) в течение 5 минут. Супернатант использовали для экстракции НК.
Исследование состояло из следующих этапов:
-
1. Экстракция ДНК из исследуемых образцов;
-
2. Полимеразная цепная реакция (ПЦР) и изотермическая амплификация ДНК с флуоресцентной детекцией в режиме
-
3. Анализ и интерпретация результатов.
«реального времени»;
Следующим этапом была экстракция ДНК из исследуемых образцов. Объем исследуемого материала для экстракции ДНК – 50-100 мкл для жидких проб, 20-40 мг для твердых гомогенизированных проб.
Отбирали и необходимое количество одноразовых пробирок для проб, включая пробирку для отрицательного контроля экстракции. Маркировали пробирки, пробирку для отрицательного контроля экстракции промаркировали как ВК-. Внесли в каждую пробирку по 10 мкл реагента ВКО из конкретного набора реагентов для амплификации ДНК, затем по 500 мкл лизирующего раствора. В пробирку ВК-вносили 100 мкл ОКО. В остальные пробирки с лизирующим раствором и ВКО вносили по 100 мкл проб, используя наконечники с фильтром.
Образцы осторожно перемешивали на вортексе и прогревали до 60°C в течение 5 минут. Затем образцы центрифугировали в течение одной минуты при 12000 об/мин (MiniSpin, Eppendorf). К прогретым образцам добавляли по 100 мкл преципитирующего раствора, перемешивали на вортексе, в дальнейшем сбрасывали капли. Аккуратно ресуспендировали сорбент на вортексе. В каждый образец добавляли по 50 мкл ресуспендированного сорбента. Перемешивали на вортексе, выдерживали на столе 5 минут. Для лучшего результата сорбции пробирки с сорбентом время от времени колыхали. Затем сорбент осаждали в пробирках центрифугированием при 12000 об/мин. («MiniSpin», «Eppendorf») на одну минуту. Супернатант удаляли вакуумным отсасывателем. К осадку добавляли 300 мкл раствора Отмывки-1 и встряхивали до полного ресуспендирования сорбента. К осадку добавляли 500 мкл раствора для Отмывки-2, перемешивали на вортексе до получения равномерной суспензии. Сорбент осаждали центрифугированием в течение 1 минуты. Супернатант убирали при помощи вакуумного отсасывателя, далее повторяли этот этап еще раз.
Затем аккуратно убирали жидкость полностью, не захватывая сорбент. Образцы в пробирках помещали в термостат при температуре 60°С на 15 минут для просушки. Крышки пробирок были открыты.
Следующим шагом было добавление в пробирки 100 мкл буфера для элюирования ДНК, TEбуффера. Встряхивали на вортексе до получения равномерной суспензии. При закрытых крышках образцы нагревали до 60°С в течение 5 минут, встряхивая каждые 2 минуты. Последним этапом экстракции было одноминутное центрифугирование пробирок при 12 000 об/мин (MiniSpin, Eppendorf). Супернатант содержал очищенный НК. Далее образцы готовили для ПЦР и LAMP в режиме «реального времени». Общий объем реакционной смеси 25 мкл, объем ДНК-образца 10 мкл. Успешное протекание реакции контролируют с помощью ПKO, ВKO T2 и ДНК-буфера/LAMP-буфера. Смесь встряхивали и капли отбрасывали мгновенным центрифугированием. Подобрали необходимое количество пробирок для амплификации ДНК исследуемых и контрольных образцов.
Добавляли 15 мкл приготовленной реакционной смеси. В подготовленные пробирки добавляли: 10 мкл буфера ДНК/LAMP в отрицательный контроль (К-) ПЦР/LAMP пробирку и в пробирку с положительным ПЦР/LAMP контролем (К+) - 10 мкл ПКО.
Подготовленные для ПЦР/LAMP пробирки помещали в ячейки реакционного модуля приборов (Rotor-Gene 6000, Corbett Research, Австралия) и Real-time CFX Connect (Bio-Rad Laboratories, США). Устройство было запрограммировано в соответствии с инструкциями производителя. По окончании программы мы приступили к анализу и интерпретации результатов.
Учет результатов ПЦР и LAMP. Анализ проводился по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца). Результат считался достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК Для ПЦР в режиме «реального времени» в соответствии с таблицей 3, а для LAMP в соответствии с таблицей 4.
В случае, если в ВК- значение Ct для ВКО отсутствует или превышает граничное, а в К+ значение Ct для ВКО менее граничного (и в образцах Ct для ВКО менее граничного) – результаты можно считать достоверными. Также, в случае если значение Ct для ВКО в К+ отсутствует или превышает граничное, а в ВК- и образцах менее граничного – результаты можно считать достоверными. Если для исследуемого образца по каналу JOE(HEX)/Yellow значение Сt определяется позднее 30 цикла при корректном прохождении положительных и отрицательных контролей – он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (Ct на канале JOE (HEX)/Yellow более 30), требуется повторное взятие материала от того же животного для проведения ПЦР-исследования и (или) использование альтернативных методов диагностики.
В случае, если Ct на канале HEX определено Ct ⩽ 50, а на канале FAM отсутствует или определено, а также когда Ct на канале HEX определено меньше граничного, Ct ⩽ 55, а на канале HEX отсутствует – результаты можно считать достоверными. Если (Ct на канале HEX отсутствует или определено Ct>50), необходимо провести повторное исследование соответствующего образца, начиная с этапа экстракции. В случае повторения аналогичного результата, повторяем с этапа отбора материала.
Кинетические кривые положительных результатов ПЦР и LAMP -исследований с флуоресцентной детекцией в режиме «реального времени» M. S. pneumoniae представлены на рисунке 1 и 2.
Данные расчета результатов ПЦР и LAMP исследований S. pneumoniae представлены в таблице 5.
Таблица 3 – Оценка результатов анализа ПЦР с флуоресцентной детекцией
|
Проба |
Канал детекции |
Результат |
|
|
JOE(HEX)/ Yellow |
FAM/Green |
||
|
S. pneumoniae |
ВКО |
||
|
ПКО К+ |
До 31 |
до 31 |
Реакции положительного и внутреннего контролей прошли успешно |
|
ДНК буфер К |
Сигнал отсутствует |
Сигнал отсутствует |
Реакция прошла успешно |
|
Любое значение |
Сигнал отсутствует |
Специфическая контаминация! Требуется повторная постановка! Рекомендуется поставить смывы |
|
|
Сигнал отсутствует |
Любое значение |
Контаминация ВКО! Требуется повторная постановка! Рекомендуется поставить смывы |
|
|
ОКО ВК |
Сигнал отсутствует |
Любое значение от 1 до 32 |
Экстракция прошла успешно |
|
Любое значение |
Сигнал отсутствует или любое значение |
Специфическая контаминация! Требуется повторная постановка! Рекомендуется поставить смывы |
|
|
Сигнал отсутствует |
Сигнал отсутствует или значение Ct >32 |
Результат недостоверный, возможно из-за ингибиторов. Требуется повторная экстракция! |
|
|
Образцы |
Любое значение от 1 до 30 |
Сигнал отсутствует или любое значение |
Результат анализа положительный. ДНК. S. pneumoniae присутствует |
|
Сигнал отсутствует |
Любое значение от 1 до 32 |
Результат анализа отрицательный |
|
|
Сигнал отсутствует |
Сигнал отсутствует или значение Ct >32 |
Результат не достоверный. Требуется повторная экстракция |
|
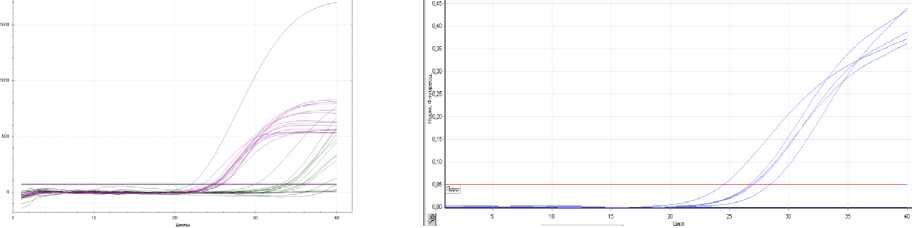
Рисунок 1 – Кинетическая кривая положительного результата анализа S. pneumoniae методом ПЦР
Рисунок 2 – Кинетическая кривая положительного результата анализа на S. pneumoniae методом LAMP
Таблица 4 – Анализ LAMP с флуоресцентной детекцией в режиме «реального времени»
|
Значение порогового цикла (Ct) по каналу для флуорофора |
Результат |
||
|
FAM |
HEX |
||
|
Отсутствует или определено |
определено Ct ⩽ 50 |
Обнаружена ДНК S. pneumoniae |
|
|
Определено меньше граничного, Ct ⩽ 55 |
отсутствует |
Не обнаружена S. pneumoniae |
|
|
Отсутствует или определено больше граничного Ct>55 |
Отсутствует или определено Ct>50 |
Невалидный/Сомнительный Требуется повторное исследование |
|
|
Результаты для контролей различных этапов исследований |
|||
|
Контроль |
Контролируемый Этап LAMP-исследования |
Значение порогового цикла (Ct) по каналу для флуорофора |
|
|
FAM |
HEX |
||
|
ПК |
LAMP |
не учитывается |
определено Ct ⩽ 35 |
|
ОК |
Экстракция ДНК, LAMP |
определено Ct ⩽ 50 |
отсутствует |
|
К- |
LAMP |
отсутствует |
отсутствует |
Таблица 5 – Данные расчета ПЦР и LAMP исследований с флуоресцентной детекцией в режиме «реального времени» S. pneumoniae
|
Лунка |
Флуор. |
Мишень |
Содерж. |
Проба |
Cq |
Среднее Cq |
Ст. отклонение Cq |
|
C02 |
FAM |
Неизвестно |
3 |
25,14 |
25,14 |
0,000 |
|
|
C11 |
FAM |
Неизвестно |
11 |
24,91 |
24,91 |
0,000 |
|
|
D02 |
FAM |
Неизвестно |
4 |
25,87 |
25,87 |
0,000 |
|
|
D11 |
FAM |
Неизвестно |
око |
23,36 |
23,36 |
0,000 |
|
|
E02 |
FAM |
Неизвестно |
5 |
25,70 |
25,70 |
0,000 |
|
|
E11 |
FAM |
Неизвестно |
К- |
H/О |
0,00 |
0,000 |
|
|
F02 |
FAM |
Неизвестно |
6 |
24,79 |
24,79 |
0,000 |
|
|
F11 |
FAM |
Неизвестно |
ПК |
24,54 |
24,54 |
0,000 |
|
|
G02 |
FAM |
Неизвестно |
7 |
25,71 |
25,71 |
0,000 |
|
|
G11 |
FAM |
Неизвестно |
ПК |
H/О |
0,00 |
0,000 |
|
|
H02 |
FAM |
Неизвестно |
8 |
24,30 |
24,30 |
0,000 |
|
|
A02 |
HEX |
Неизвестно |
1 |
38,07 |
38,07 |
0,000 |
|
|
A11 |
HEX |
Неизвестно |
9 |
39,96 |
39,96 |
0,000 |
|
|
B02 |
HEX |
Неизвестно |
2 |
35,30 |
35,30 |
0,000 |
|
|
B11 |
HEX |
Неизвестно |
10 |
35,54 |
35,54 |
0,000 |
|
|
C02 |
HEX |
Неизвестно |
3 |
32,80 |
32,80 |
0,000 |
|
|
C11 |
HEX |
Неизвестно |
11 |
34,51 |
34,51 |
0,000 |
|
|
D02 |
HEX |
Неизвестно |
4 |
29,78 |
29,78 |
0,000 |
|
|
D11 |
HEX |
Неизвестно |
око |
38,22 |
38,22 |
0,000 |
|
|
A11 |
HEX |
Неизвестно |
5 |
33,30 |
33,30 |
0,000 |
|
|
B02 |
HEX |
Неизвестно |
К- |
H/О |
0,00 |
0,000 |
|
|
B11 |
HEX |
Неизвестно |
6 |
33,44 |
33,44 |
0,000 |
|
|
C02 |
HEX |
Неизвестно |
ПК |
H/О |
0,00 |
0,000 |
|
|
LAMP S. pneumoniae |
|||||||
|
Лунка |
Флуор. |
Мишень |
Содерж. |
Проба |
Cq |
Среднее Cq |
Ст. отклонение Cq |
|
A02 |
HEX |
Неизвестно |
1 |
27,11 |
27,11 |
0,000 |
|
|
B02 |
HEX |
Неизвестно |
2 |
26,72 |
26,72 |
0,000 |
|
|
C02 |
HEX |
Неизвестно |
3 |
26,94 |
26,94 |
0,000 |
|
|
D02 |
HEX |
Неизвестно |
4 |
28,48 |
28,48 |
0,000 |
|
|
E02 |
HEX |
Неизвестно |
око |
Н/О |
0,00 |
0,000 |
|
|
F02 |
HEX |
Неизвестно |
К- |
Н/О |
0,00 |
0,000 |
|
|
A02 |
FAM |
Неизвестно |
ПК |
16,75 |
16,75 |
0,000 |
|
Заключение . Результаты, полученные при проведении лабораторных диагностических исследований биологического материала от свиней, поступившего в Кропоткинскую краевую лабораторию за последние 4 года (с 2019 по 2022 гг.), свидетельствуют о высокой частоте обнаружения S. pneumoniae (от 33 до 65%). Сравнив методики ПЦР и LAMP можно отметить, что у изотермической петлевой амплификации время реакции занимает от 5 до 45 минут, что позволяет провести то же исследование, что и ПЦР, но значительно быстрее, а также LAMP имеет высокую специфичность от 4-6 праймеров, а ПЦР только 2. Однако, рекомендации относительно оптимизации изотермических реакций амплификации подробно не разработаны, в отличие от ПЦР. Также большое число праймеров на мишень увеличивает вероятность взаимодействия праймеров для мультиплексированных наборов мишений. Немаловажный фактор, это ограниченность предложений на российском рынке реагентов отечественного производства для реакции петлевой изотермической амплификации.
Резюме
Цель исследования являлось сравнение методов изотермической петлевой амплификации в режиме реального времени (LAMP) и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ПЦР) для диагностика Streptococcus pneumoniae у свиней. Результаты, полученные при проведении лабораторных диагностических исследований биоматериала от свиней, поступившего в Кропоткинскую краевую лабораторию за последние 4 года (с 2019 по 2022 гг.), свидетельствуют о высокой частоте обнаружения S. pneumoniae (от 33 до 65%). Сравнив методики ПЦР и LAMP можно отметить, что у изотермической петлевой амплификации время реакции занимает от 5 до 45 минут, что позволяет провести то же исследование, что и ПЦР, но значительно быстрее, а также LAMP имеет высокую специфичность от 4-6 праймеров, а ПЦР только 2.
Список литературы Сравнение методов изотермической петлевой амплификации в режиме реального времени (LAMP) и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ПЦР) для диагностика Streptococcus pneumoniae у свиней
- Агольцов, В. А. Эффективность и безопасность лекарственных препаратов при лечении экспериментальных и спонтанных микоплазменных инфекций / В. А. Агольцов, Л. П. Падило, О. П. Бирюкова, М. М. Лигидова // Ветеринария сегодня. – 2022. – № 11. – С. 169-175.
- Бирюченкова, М. В. Разработка методов обнаружения генома Streptococcus suis на основе полимеразной цепной реакции / М. В. Бирюченкова, // Труды Федерального центра охраны здоровья животных. – Владимир. – 2017. – Т. 15 – С. 70-81.
- Лигидова, М. М. Терапевтическая эффективность энтрикима при энзоотической пневмонии свиней / М. М. Лигидова, В. А. Агольцов, Л. П. Падило, А. А. Гусев // Научная жизнь – 2020. – Выпуск 9 – С. 1260-1269.
- Лигидова, М. М. Изучение фармакокинетики действующих веществ препарата «Энтриким» при применении его животным / М. М. Лигидова, Е. А. Толстова, А. М. Семиволос, В. А. Агольцов, М. П. Мариничева // Аграрный научный журнал– 2022. – № 8 – С.47-49.
- Сухинин, А. А. Использование ПЦР для идентификации патогенных стрептококков / А. А. Сухинин // Вопросы нормативно-правового регулирования в ветеринарии. – 2010. – № 2 – С. 13-15.
- Толстова, Е. А. Особенности диагностики и терапии стрептококкоза свиней, осложненного РРСС на племенной ферме / Е. А. Толстова, В. А. Агольцов, Л. П. Падило // Научная жизнь – 2022. – Т. 17. – Выпуск 1 – С. 157-166.
- Толстова, Е. А. Диагностика, терапия и специфическая профилактика стрептококкоза свиней, осложненного пастереллезом и микоплазмом / Е. А. Толстова, М. М. Лигидова, Л. П. Падило, А. М. Семиволос, В. А. Агольцов // Аграрный научный журнал – 2022. – № 1 – С.71-75.
- Clark, L. K. Evaluation of the effectiveness of a macrolide antibiotic on reduction of respiratory pathogens in 12-day and 21-day weaned pigs / L. K. Clark, C. C Wu., W. G. Alstine., K. E. Knox // J. Swine Health Prod. – 1998. V. 6 (6). – P. 257-262.
- Dacak, D. Primer reporte de micoplasmosis en Procyon cancrivorus en cautiverio en Asunción, Paraguay / D. Dacak, J. Petters., L. Batista-Cirne, M. Lucero, R. Aliendre, J. Guzmán, R. Ordoñez // Rev. Inv. Vet. – Perú. – 2021. – P. 32 (1): e19494. DOI: 10.15381/RIVEP.V32I1.19494.
- De Almeida, J. F. Polimerase chain reaction (PCR) in the diagnosis of goat mycoplasmosis proceeding from cultures stored in glycerol / J. F. De Almeida, E. R. do Nascimento, V. L. De Almeida Pereira [et al.] // Rev. Bras. Med. Vet. – 2007. – V. 29 (2). – P. 54-57.
- Mc Kelvie, J. Evaluation of tulathromycin for the treatment of pneumonia following experimental infection of swine with Mycoplasma hyopneumoniae / J. Mc Kelvie, J. H. Morgan., I. A. Nanjiani, J. Sherington, T. G. Rowan, S. J. Sunderland // Veterinary Therapeutics. – 2005. V. 6 (2). – P. 197-202. PMID: 16094566.
- Morrow, C. J. M. Antimicrobial susceptibility of pathogenic mycoplasmas in chickens in Asia. / C. J. M. Morrow, M. Z. Kreizinger, R. R. Achari, K. Bekő, C. Yvon Gyuranecz //Vet. Microbiol. – 2020. – V. 250. – P. 108840. – DOI: 10.1016/j.vetmic.2020.108840.
- Olson, L. B. The effect of tilmicosin in minimizing atrophic rhinitis, pneumonia, and pleuritis in swine / L. B. Olson, L. R. J. Bäckström // Swine Health Prod. – 2000. – V. 8 (6). P. 263–268.
- Suresh, V. Novel Real-Time PCR Assay for Rapid Detection of Virulent Streptococcus equi Subspecies zooepidemicus / V. Suresh, V. Kuchipudi, Meera Nair, A. Michele Yon // An Emerging Pathogen of Swine Front Vet Sci.2021.DOI:10.3389/fvets.2021.604675
- Zhang, X. H. Investigation of the efficiency and safety of tilmicosin phosphate in treating experimental mycoplasmal infections in pigs. / X. H. Zhang, J. Z. Pan, N. Wu, S. Tang, X. D. Lei, Y. Y. Sun [et al.] // Turk. J. Vet. Anim. Sci. – 2018. – V. 42(6). – P. 571–580. DOI: 10.3906/vet-1804-76.


