Сравнительная характеристика и адаптивные механизмы солеустойчивости у разных генотипов твердой и мягкой пшеницы
Автор: Федореева Л.И., Бесалиев И.Н., Шелепова О.В., Кононенко Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Зерновые культуры устойчивость и адаптация
Статья в выпуске: 3 т.58, 2023 года.
Бесплатный доступ
Изучение адаптивных механизмов солеустойчивости для выявления и отбора устойчивых генотипов пшеницы остается актуальной задачей в связи с тем, что площади земельных угодий с повышенной засоленностью во всем мире постоянно увеличиваются. В настоящей работе основное внимание было уделено процессам накопления и выведения токсичных ионов из корней и листьев у разных генотипов пшеницы и влиянию этих ионов на состояние растительных тканей. Показано, что у изученных сортов твердой пшеницы при повышении засоленности уменьшались размеры корневой системы и, как следствие, снижалось поглощение токсичных ионов Na+. У мягкой пшеницы повысилась ионная проводимость и усилилось выведение ионов Na+. Мы сравнили проявления солевого стресса, вызванного высокими концентрациями NaCl, и механизмы солеустойчивости и адаптации к его токсическому действию у сортов разных видов пшеницы в полевых условиях в Оренбургской области. Первичную оценку солеустойчивости сортов пшеницы проводили по степени ингибирования роста хлористым натрием. На основании первичной оценки были отобраны четыре различающихся по солеустойчивости генотипа - два сорта твердой пшеницы ( Triticum durum Desf.) Золотая и Оренбургская 10 и два сорта мягкой пшеницы ( Triticumaestivum L.) Ульяновская 105 и Оренбургская 22. Окончательную оценку на солеустойчивость отобранных сортов проводили в течение вегетационного сезона 2022 года, выращивая растения в полевых условиях на мелких делянках (площадью 1,8 м2 каждая) в 3-кратной повторности каждого варианта. Для создания солевого стресса хлорид натрия вносили на делянки после появления всходов и до фазы кущения в виде раствора (200 мМ NaCl). Контролем служили растения, выращенные в отсутствие солевого стресса. Адаптивные механизмы проявления устойчивости к хлориду натрия у генотипов пшеницы исследовали с использованием биохимических, молекулярно-генетических и светооптических методов анализа. Защитные механизмы растений при действии солевого стресса включают блокировку и выведение Na+ и Cl- из клеточной цитоплазмы, активацию системы антиоксидантной защиты и увеличение толерантности растений за счет различных механизмов регуляции активности генов. Наши результаты показывают, что сорта пшеницы Ульяновская 105 и Оренбургская 22 сохраняют селективность ионов K+ по отношению к ионам Na+ и при стрессе поддерживают более высокое соотношение K+/Na+ (соответственно 4,12 и 4,18) по сравнению с сортами Золотая и Оренбургская 10 (соответственно 1,26 и 3,75). Регуляция ионных потоков обеспечивается ионными транспортерами. Повышенная активность генов двух классов транспортеров НКТ у сорта Оренбургская 22 способствует большему выведению Cl- и Na+ и, наоборот, у сорта Золотая наблюдается накапливание токсичных ионов, которые приводят к снижению содержания хлорофиллов a и b (Chl a и Chl b). Более низкое отношение Chl a/Chl b у сорта Оренбургская 22, чем у сорта Золотая (соответственно 2,03 против 2,43), указывает на высокое содержание Chl b, который расширяет спектр поглощение света, что способствует усилению фотосинтеза. Различие в накоплении активных форм кислорода (АФК) свидетельствует об инициации разных механизмов антиоксидантной защиты у разных генотипов пшеницы. Накопление продуктов АФК в корнях сортов Ульяновская 105 и Оренбургская 22 при засолении интенсивнее происходит в зонах чехлика и меристемы, что в 1,3 раза ниже по сравнению с сортами Золотая и Оренбургская 10. В этих сортах пшеницы продукты АФК накапливаются во всех исследуемых зонах, однако в зоне чехлика меньше, чем в остальных зонах. У чувствительных к NaCl генотипов пшеницы наблюдали повреждения в клетках корня, тогда как у устойчивых генотипов пшеницы повреждения были минимальны. Солевой стресс у чувствительных сортов пшеницы может приводить к программируемой клеточной гибели. Деградация нуклеиновых кислот является одним из маркеров процесса отмирания растения. По степени деградации ДНК наиболее неустойчивым оказался сорт Золотая. Комплексный подход позволил выявить различные механизмы устойчивости к солевому стрессу у генотипов пшеницы.
Мягкая пшеница, твердая пшеница, солевой стресс, ионные транспортеры, хлорофилл, активные формы кислорода, нуклеаза активность, деградация днк, программируемая клеточная гибель
Короткий адрес: https://sciup.org/142238893
IDR: 142238893 | УДК: 633.11:631.523:577.21 | DOI: 10.15389/agrobiology.2023.3.510rus
Текст научной статьи Сравнительная характеристика и адаптивные механизмы солеустойчивости у разных генотипов твердой и мягкой пшеницы
Растения очень пластичны и быстро приспосабливаются к изменя-
∗ Исследование выполнено в соответствии с государственными заданиями FGUM -0431 2022-0003, FNFZ-2022-0014 и ГБС РАН 122042700002-6.
ющимся неблагоприятным условиям внешней среды. В зависимости от механизмов и скорости адаптации растения можно разделить на толерантные и чувствительные к абиотическим стрессам. Хлоридно-натриевая засоленность относится к наиболее распространенным и изученным абиотическим факторам (1, 2). Засоление почв в значительной степени связано с хозяйственной деятельностью человека и используемыми агротехническими приемами (полив почвы, применение удобрений). Это становится одной из основных угроз устойчивому сельскому хозяйству, вызывая снижение продуктивности растений вследствие нарушений на физиологическом, биохимическом и молекулярном уровнях. Площади засоленных сельскохозяйственных угодий имеют тенденцию к постоянному увеличению в результате вторичного засоления. Общая площадь засоленных почв в России составляет 66,4 млн га, или 3,9 % от всего земельного фонда (3). Оренбургская область относится к району с высоким процентом засоленных почв (5,3 % от площади сельскохозяйственных земельных угодий). В настоящее время засоление почвы относят к основным лимитирующим факторам, негативно влияющим на рост и развитие пшеницы — наиболее важной сельскохозяйственной культуры (4). Высокие концентрации ионов Na+ токсичны для клеточного метаболизма и могут подавлять активность многих важных ферментов, деление и размножение клеток, вызывать дезорганизацию мембран и осмотический дисбаланс, что в конечном итоге способно привести к торможению роста и даже к гибели растения (1, 2, 5).
Понимание механизмов реакций на абиотический стресс важно для обеспечения стабильного урожая. Растения выработали способность противостоять воздействию стрессоров на клеточном и тканевом уровнях. Устойчивость растений к засолению обусловлена действием специфических и (или) неспецифических механизмов, поддерживающих стабильный метаболизм, рост и развитие в онтогенезе и связанных с чувствительностью к одному или нескольким видам стрессовых факторов, в том числе к осмотическому и окислительному стрессовому воздействию хлорида натрия (6). Эти механизмы включают изменения в устьичной проводимости, в гормональном балансе, системе антиоксидантной защиты, осмотической регуляции и выведении токсинов, Na+ и Cl - из вакуолей, блокировку транспорта Na+ в клетку, исключение Na+ из потока транспирации (7, 8).
Сложный контроль и реакция на абиотические и биотические стрессы достигается благодаря скоординированному действию множества генов, которые прямо или косвенно участвуют в защитных реакциях у растений (9). Увеличение активности некоторых генов, кодирующих осмолиты, компоненты ионных каналов, рецепторы и некоторые другие регуляторные сигнальные факторы или ферменты, способны увеличить толерантность растений к действию солей (10, 11). В норме в почве водный потенциал в клетках корня ниже, чем во внешней среде, и приток воды происходит с участием белков водного канала — так называемых аквапоринов (12). В солевой среде разница в водном потенциале между почвой и клетками корня значительно меньше, чем в нормальных условиях, или даже выше, что приводит к снижению поглощения или потере воды (13). Как результат, происходит ингибирование роста, что в конечном итоге приводит к серьезным повреждениям растительных тканей.
На клеточном уровне механизмы солеустойчивости направлены на уменьшение накопления Na+ в цитоплазме посредством ограничения проникновения Na+ в клетки, обеспечения активного транспорта Na+ из клеток и перемещения в клеточные компартменты — вакуоли (14). Ионы K+ предпочтительны для поглощения корнями из почвы, и большинство рас- тений проявляют высокую степень дискриминации K+ и Na+. Сообщалось, что высокоаффинные ионные транспортеры (high-affinity K+ transporters, HKTs) активны на уровне плазматической мембраны и функционируют в качестве симпортеров Na+/K+, а также селективных унипортеров Na+ (15). HKTs могут иметь две основные функции: извлекать Na+ из почвенного раствора, чтобы снизить потребность в K+, и уменьшать накопление Na+ в листе, удаляя Na+ из ксилемы и перемещая Na+ во флоэму.
Для клетки токсичность, вызванная высоким содержанием ионов Na+, является преобладающей ионной токсичностью, она приводит к торможению различных процессов, таких как поглощение K+ (9, 10), инактивация жизненно важных ферментов (15), торможение фотосинтеза (16). В клетке фотосинтетические процессы наиболее чувствительны к токсичному воздействию Na+, а их нарушение напрямую связано с сокращением фиксации углерода и продукции растительной биомассы (16).
В результате влияния различных неблагоприятных биотических и абиотических факторов (гипоксия, засуха, засоление, физические повреждения в месте ранения и заражение патогенами) в растительных тканях повышается содержание активных форм кислорода (АФК), однако их избыток также может приводить к повреждениям — окислительному стрессу АФК (17, 18). Образование и накопления AФК происходит в растении в процессе окислительно-восстановительного метаболизма (19, 20). Защиту растительной клетки от токсического воздействия АФК обеспечивает антиоксидантная система, которая контролирует концентрацию АФК (21). АФК могут также действовать как важные сигнальные молекулы, которые регулируют защитные механизмы растения, его рост, развитие и ответ на внешние воздействия (22).
Изучению хлорофиллов, в частности определению их количества и соотношения, посвящено множество исследований, что обусловлено важной ролью этого пигмента в физиологии растения. Хлорофиллы участвуют в поглощении и передаче световой энергии и переносе электронов в процессе фотосинтеза. Содержание хлорофилла может изменяться в ответ на биотические и абиотические стрессы, например при заражении патогенами (23) или световом стрессе (24, 25). Таким образом, количественная оценка хлорофилла дает важную информацию о влиянии окружающей среды на рост растений (26).
Оренбургская область расположена в основном в двух почвенных зонах (чернозем и каштановые почвы), серые лесные почвы составляют 0,4 %. Площади, подверженные засолению, в области составляют по разным оценкам от 13,9 от 15,0 % почвенного фонда. Всего солонцовые почвы здесь занимают 1971,8 тыс. га, в том числе 541,5 тыс. га пашни (27,5 %) (27). В этих условиях основой обеспечения стабильных урожаев пшеницы остается оценка способности сортов адаптироваться к условиям солевого стресса, изучение его проявлений у растений и выявление механизмов, позволяющих эффективно ему противостоять.
В настоящей работе основное внимание было уделено процессам накопления и выведения токсичных ионов из корней и листьев у разных генотипов пшеницы и влиянию этих ионов на состояние растительных тканей. Мы показали, что у изученных сортов твердой пшеницы при повышении засоленности уменьшались размеры корневой системы, как следствие, снижалось поглощение токсичных ионов Na+. У мягкой пшеницы повысилась ионная проводимость и усилилось выведение ионов Na+. Также отмечено, что у сортов твердой пшеницы надземная часть растений более адаптирована к засолению, чем подземная.
Цель работы — сравнение проявлений солевого стресса, вызванного высокими концентрациями NaCl, и механизмов солеустойчивости и адаптации к его токсическому действию у разных сортов пшеницы в условиях Оренбургской области.
Методика. Сорта мягкой пшеницы ( Triticum aestivum L.) Ульяновская 105 и Оренбургская 22 и твердой пшеницы ( Triticum durum Desf.) Золотая и Оренбургская 10 были получены из коллекции ФГБНУ ФНЦ биологических систем и агротехнологий РАН (г. Оренбург, Россия).
Полевые опыты проводили в центральной зоне Оренбургской области (экспериментальные участки ФГБНУ Федеральный научный центр РАН, делянки площадью 1,8 м2, по 3 делянки на вариант). Почва участков — чернозем южный суглинистый, солонцеватый, карбонатный. Мощность гумусового горизонта 45-55 см, pH почвенного раствора близка к нейтральной (6,8-7,0). Содержание гумуса в пахотном слое — З,5-4,2 %, общего азота — от 0,2 до 0,6 %, доступного фосфора — 1,5-2,5 мг/100 г почвы, обменного калия — 30-40 мг/100 г почвы. Опыт заложен по черному пару. Посев сортов провели 3 мая 2022 года сеялкой СН-16 (Россия) при норме высева всхожих семян 4,5 млн/га. Эффект солевого воздействия на пшеницу изучали при корневом поливе проростков раствором хлористого натрия (200 мМ, 100 мл раствора на проросток) от фазы полных всходов до фазы кущения (3 раза в течение 14 сут). Контрольные образцы пшеницы поливали водой. В этот период имело место превышение среднесуточной температуры воздуха при недостаточном количестве осадков (33 % от нормы). Содержание продуктивной влаги на опытном участке к началу вегетации было достаточным и сохранилось без существенных изменений до фазы кущения. Растения (по 30 шт. в 3 повторностях) собирали на стадии кущения для морфометрического, биохимического, цитологического анализов.
Долю мертвых клеток у побегов определяли в фазу кущения при прижизненном окрашивании 0,5 % водным раствором трипанового синего в течение 5 мин. Образцы 3-кратно промывали проточной водой, окрашивание визуализировали с помощью световой микроскопии (микроскоп Olympus BX51, «Olympus Corporation», Япония; объектив ½10; изображения получали с помощью цифровой камеры Color View II, Германия).
Для прижизненной визуализации АФК в клетках корня на стадии кущения использовали водный раствор Carboxy-H2DFFDA («Thermo Fisher Scientific», США) согласно протоколу (28). Препараты анализировали с использованием флуоресцентного микроскопа Olympus BX51 (объектив ½10, X = 490 нм). Интенсивность флуоресценции измеряли с помощью цифровой камеры Color View II (программа Cell, «Soft Imaging System», Германия). Изображения анализировали и обрабатывали в программе ImageJ .
Хлорофилл экстрагировали из измельченной надземной биомассы (навески побегов, по 500 мг) 80 % ацетоном в течение 30 мин. Оптическую плотность раствора измеряли на спектрофотометре SmartSpec™ Plus («Bio-Rad», США). Количественное содержание хлорофиллов определяли по формулам (29):
Chl a, мг/мл = 11,63 x А 665 - 2,39 x А 649 ;
Chl b, мг/мл = 20,61 x А 649 - 5,18 x А 665 .
Суммарный белок из побегов и корней (по 1 г исследуемого материала) экстрагировали 50 мМ Трис-HCl буфером (pH 7,5), содержащим 0,8 М сахарозу и 0,35 М NaCl (в течение 1 ч при 25 °С). Количество белка определяли по методу Брэдфорд. Измеряли OD595 экстракта и рассчитывали концентрацию по калибровочной кривой, построенной с бычьим сыворо- точным альбумином («Serva», США).
Нуклеазную активность определяли спектрофотометрически (спектрофотометр SmartSpec™ Plus, «Bio-Rad», США) при X = 260 нм, используя в качестве субстрата раствор тимусной ДНК («Реахим», Россия) (А 260 = 1,0 в 0,5 М ацетатном буфере, рН 5,0). Реакцию проводили при 37 °С в течение 2 ч. За единицу активности принимали такое количество фермента, которое вызывало увеличение оптической плотности раствора на 0,01 ед. (30).
ДНК выделяли из корней растений в стадии кущения (по 2 г) согласно протоколу ООО «Синтол» (Россия) и визуализировали, используя электрофорез в 1,2 % агарозном геле.
РНК выделяли по отдельности из побегов и корней проростков пшеницы в стадии кущения (по 100 мг) с помощью набора реагентов РНК-Экстран по протоколу производителя (ООО «Синтол», Россия). Концентрацию РНК в полученных препаратах определяли на нанофотометре IMPLEN («IMPLEN», США).
кДНК получали по стандартной методике, используя набор реагентов для проведения обратной транскрипции согласно протоколу (ООО «Синтол», Россия). Сведения о первичной структуре генов HKT взяты из базы данных NCBI . Праймеры к транскриптам этих генов были подобраны с помощью online сервиса NCBI PrimerBLAST и синтезированы в ООО «Синтол» (Россия). (TaHKT1;4 — 5´-ATT CAG GCA ACA CCT AAT CAT GC-3´ и 5´-GCA TCA CAA GAA TGA GGA TGA GC-3´; TaHKT2;1 — 5´-TAT GTG ATG AGT CGC AGC TTG AA-3´ и 5´-GCA ACA AGA GGC CTG AAT TCT TT-3´).
ПЦР в реальном времени (ПЦР-РВ) проводили в термоциклере CFX 96 Real-Time System («Bio-Rad», США). Режим ПЦР-РВ был одинаковым для всех образцов: 95 °С, 5 мин — активация полимеразы, далее 45 циклов — 94 °С, 30 с, 58 °С, 30 с, 72 °С, 30 с. ПЦР-РВ выполняли в 3 повторностях для каждого образца и в 3 аналитических повторностях. Относительный уровень экспрессии генов рассчитывали по калибровочной кривой, построенной с ПЦР-продуктами, которые были получены с праймерами к гену GaPDh , кодирующему белок глицерид-3-фосфатдегидрогеназу (glyceraldehyde-3-phosphate dehydrogenase), взятому в качестве референсного: 5´-GCC CCA GAG GAG TGT TCA AA-3´ и 5´-AAA ATG TGA GCC GCT AAG CC-3´).
Эффективность ПЦР в реальном времени (ПЦР-РВ) рассчитывали по формуле: E, % = (10 - 1/ 5 - 1) - 100, где s — угол наклона зависимости десятичного логарифма значений С t от концентрации кДНК. Эффективность ПЦР-РВ с праймерами к исследованным генам составила 95-96 %.
Для анализа содержания ионов в листьях и корнях пшеницы в стадии кущения разрушали клеточные стенки (100-300 мг в 25 мл деионизированной воды) (ультразвуковой дезинтегратор, НПП «Сапфир», Россия); частота 35 кГц в течение 30 мин при 40 °С). Полученную суспензию фильтровали через мембрану Millipore 0,45 мкм («Millipore», США). Пробы анализировали на ионометре ИТАН (НПП «Томьаналит», Россия). Содержания ионов (мг/л) в пробах определяли по градуировочному графику. Содержание электролитов в образцах определяли по электропроводности раствора с помощью кондуктометра Эксперт-002 (ООО «Эконикс», Россия) (31).
Рассчитывали средние значения полученных показателей ( М ) и их стандартные отклонения (±SD). Статистическую обработку проводили с использованием программ Statistica 6.0 («StatSoft, Inc.», США) и STATAN («Statanly Technologies», Россия). Достоверность различий определяли по t -критерию Стьюдента при p < 0,05.
Результаты. Увеличение содержания NaCl в почве сопровождалось уменьшением общей биомассы 14-сут растений у сортов Оренбургская 22 и Ульяновская 105 (оно достигало 20 %), тогда как у сорта Золотая она увеличивалась (до 30 % прироста) (табл. 1; приведены данные по 30 растениям в 3 повторностях в каждом варианте на стадии кущения).
1. Морфометрические показатели растений в фазу кущения (14 сут) у изученных сортов пшеницы при хлоридном засолении (200 мМ NaCl) ( N = 3, n = 30, М ±SD; экспериментальные участки ФГБНУ Федеральный научный центр РАН, Оренбургская обл., 2022 год)
Сорт I Вариант I Общая сырая биомасса, г ] Высота побега, см ] Длина корня, см
Хлорид натрия неодинаково воздействовал на длину корня и высоту побега у разных генотипов пшеницы. Сорта мягкой пшеницы по высоте побега проявляли большую толерантность к засолению, тогда как сорта твердой пшеницы оказались более чувствительны к хлориду натрия, особенно сорт Золотая (уменьшение высоты побега на 25 % по сравнению с сортами мягкой пшеницы, для которых эта величина составила 15 %). Корневая система у сорта Золотая оказалась также самой чувствительной (уменьшение длины корней на 30 %) по сравнению с другими исследованными сортами как твердой, так и мягкой пшеницы, у которых отмечали уменьшение длины корней на 15-20 % (см. табл. 1).
Ионы К+ необходимы для регуляции водно-солевого баланса в растениях (32). Во всех представленных в таблице 2 сортах пшеницы содержание К+ в тканях листа более чем в 2 раза превышало этот показатель в корне. У изученных сортов при солевом стрессе увеличивалось содержание ионов K+ в листе. Исключение составил сорт Ульяновская 105, у которого мы отмечали уменьшение количества K+ в листе. В корне при солевом стрессе наблюдали увеличение содержание ионов K+ только у сортов Оренбургская 22 и Оренбургская 10.
Наши данные демонстрируют ограниченное поступление Na+ в корни пшеницы с последующим переносом иона к побегам и его удаление через листья для поддержания приемлемого уровня Na+. Эти результаты согласуются с данными, полученными ранее другими исследователями (33). Поскольку корни находятся в непосредственном контакте с почвой и поглощают питательные вещества, в корнях наблюдалось более высокое накопление Na+ по сравнению с контролем.
Сравнение распределения Na+ между тканями листа и корня в условиях солевого стресса выявило накопление Na+ в более высокой концентрации в листе (кроме сорта Золотая) (см. табл. 2), что указывает на то, что лист служит основным аккумулятором Na+. При солевом стрессе значительное количество Na+ транспортировалось от листа к корню. У чувствительного к засолению сорта Золотая, вероятно, не произошел отток избыточного количества Na+ из листьев и не было ограничения для поступления Na+ в корень.
-
2. Концентрация ионов и электропроводность в листьях и корнях у изученных сортов пшеницы в фазу кущения (14 сут) при хлоридном засолении (200 мM NaCl) ( N = 3, n = 5, М ±SD; экспериментальные участки ФГБНУ Федеральный научный центр РАН, Оренбургская обл., 2022 год)
Сорт и объект
Содержание ионов K+, мг/г навески
Содержание ионов Na+, мг/г навески
Соотношение K+/Na+
Содержание ионов Cl-, мг/г навески
Электропроводность, мкSm
Ульяновская 105:
лист
Мягкая
пшеница ( Triticum aestivum L.)
контроль
15,37±0,77a
1,65±0,08e
9,31b
8,38±0,42f
813,38±40,67b
NaCl корень
11,85±0,59d
2,03±0,10c
5,84f
11,96±0,60c
660,50±33,02d
контроль
6,17±0,31f
0,93±0,05i
6,63d
5,08±0,25j
398,73±19,94h
NaCl
Оренбургская 22: лист
5,36±0,27g
1,30±0,06f
4,12k
9,24±0,46e
384,75±19,20h
контроль
12,03±0,60c
1,26±0,06g
9,55a
9,11±0,45e
802,80±40,14b
NaCl корень
14,30±0,71b
1,98±0,10c
7,22c
13,35±0,67b
797,44±39,87c
контроль
5,38±0,27g
1,03±0,05h
5,22h
5,57±0.28i
316,56±15,83i
NaCl
Золотая: лист
6,64±0,33e
1.59±0,08e
Твердая
4,18l 7,92±0.40g
пшеница ( Triticum durum Desf.)
300.35±15,02i
контроль
9,86±0,49e
1,36±0,07f
7,25c
9,18±0,46e
562,34±28,12e
NaCl корень
12,08±0,60c
1,91±0,09c
6,32e
19,63±0,98a
949,33±47,47a
контроль
4,82±0,24h
1,20±0,06g
4,02m
5,06±0.25j
386,05±19,30h
NaCl
Оренбургская 10: лист
4,64±0,23i
3,67±0,18a
1,26o
10,28±0,51d
468,56±23,43f
контроль
11,37±0,57d
2,27±0,11b
5,01i
8,50±0,42f
765,93±38,30c
NaCl корень
12,48±0,62c
2,22±0,11b
5,62g
13,92±0,70b
825,31±41,26b
контроль
4,81±0,24h
1,01±0,05h
4,76j
3,71±0,18k
308,55±15,43i
NaCl
6,53±0,33e
1,74±0,09d
3,75n
7,44±0,37h
420,20±21,01g
a-o Разные буквы означают, что средние величины показателя для вариантов в столбце статистически значимо различаются по t -критерию Стьюдента при p < 0,05 (буквенные обозначения присвоены в порядке убывания величины M ).
Наши результаты показывают, что генотипы мягкой пшеницы сохраняли селективность по K+ по сравнению с Na+ и поддерживали более высокое соотношение K+/Na+ при солевом стрессе, в то время как генотипы твердой пшеницы такой способности не проявили, особенно чувствительный к засолению сорт Золотая. При увеличении концентрации Cl - в почвенном растворе у сортов твердой пшеницы накопление Cl - в корнях происходило в 2 раза интенсивнее, меньшие количества отмечали у мягкой пшеницы, особенно у сорта Оренбургская 22. В листьях сильнее всего накапливал ионы Cl - сорт Золотая. По нашим данным, сорт Золотая следует считать чувствительным к действию ионов Cl - . Мы полагаем, что у этого сорта нарушены механизмы выведения ионов из ксилемы в вакуоли корня (33), а также оттока избытка ионов Na+ и Cl- из листьев (33).
Величина электропроводности пропорциональна концентрации электролитов и характеризует накопление суммы ионов (K+/Na+/Cl-) в тканях растений. При высокой электропроводности в тканях накапливается в целом большее количество ионов. Например, у сорта Ульяновская 105 электропроводность тканей листа была самой высокой и обусловленной наибольшей концентрацией ионов К+. То же отмечали в корнях. У сорта Золотая при солевом стрессе электропроводность в листьях и корнях увеличивалась, но это было обусловлено накоплением ионов Cl- в этих органах.
Как правило, K+ предпочтителен для поглощения корнями из почвы, и большинство растений демонстрируют высокую степень дискриминации K+/Na+ в отношении их поглощения. Гены семейства HKT (транспортеры ионов K+ и Na+ в растениях) разделяются на два подсемейства. Подсемейство HKT1 найдено у всех высших растений. Гены этого подсемейства кодируют селективные ионные транспортеры, гены подсемейства HKT2 — транспортеры обоих ионов (К+ и Na+) (11, 14).
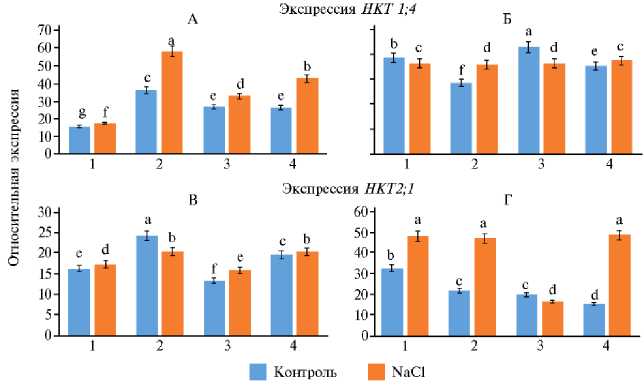
Рис. 1 . Экспрессия генов транспортеров ионов K+ и Na+ HKT 1;4 и HKT2;1 в листьях (А и В) и корнях (Б и Г) у изученных сортов мягкой пшеницы Triticum aestivum L. (1 — Ульяновская 105, 2 — Оренбургская 22) и твердой пшеницы Triticum durum Desf. (3 — Золотая, 4 — Оренбургская 10) в фазу кущения (14 сут) при хлоридном засолении (200 мМ NaCl) ( N = 3, n = 5, М ±SD; экспериментальные участки ФГБНУ Федеральный научный центр РАН, Оренбургская обл., 2022 год).
a-g Разные буквы означают, что средние величины показателя для вариантов в столбце статистически значимо различаются по t -критерию Стьюдента при p < 0,05 (буквенные обозначения присвоены в порядке убывания величины M ).
Увеличение экспрессии гена селективного транспортера ионов K+ HKT1;4 должно сопровождаться уменьшением накопления K+. Самый низ- кий уровень экспрессии HKT1;4 отмечали у сорта Ульяновская 105 как в листьях, так и в корнях (рис. 1). Как видно из данных, представленных в таблице 2, у сорта Ульяновская 105 содержание K+ действительно самое высокое в обоих органах. У сорта Оренбургская 22 концентрация K+ не самая низкая, но уровень экспрессии HKT1;4 был самым высоким (см. рис. 1, табл. 2). Вероятно, этот факт обусловлен тем, что ионный обмен во всех органах (не только в листьях и корнях) у сорта Оренбургская 22 более интенсивный, чем у других сортов пшеницы. Транспортеры II класса, как мы уже отмечали, не обладают селективностью и способны переносить как K+, так и Na+. Наибольшую активность экспрессии HKT2;1 отмечали у сорта Оренбургская 22 в листе, наименьшую — у сорта Оренбургская 10. Эти данные по экспрессии генов HKT2;1 согласуются с наблюдаемом нами накоплением ионов Na+ в листе.
Вероятно, наблюдаемый уровень экспрессии HKT1;4 обусловлен необходимостью интенсивного транспорта ионов К+ (например, в другие органы растения). Высокая активность экспрессии HKT1;4 у сорта Ульяновская 105 приводит к выведению ионов К+ из корней. Уровень экспрессии HKT1;4 у сорта Золотая также один из самых высоких, что согласуется со снижением содержания ионов К+ в корнях у этого сорта по сравнению с таковым у сортов Оренбургская 10 и Оренбургская 22. У сорта Оренбургская 22 солевой стресс приводит к значительному повышению экспрессии HKT1;4 в листьях, но при этом также возрастает концентрация ионов К+. Возможно, транспортеры I класса проявляют селективность по отношению к ионам К+ только в нормальных условиях. При солевом стрессе и избытке ионов Na+ транспортеры этого класса также начинают активно перемещать токсичные ионы Na+. Интересно отметить, что при солевом стрессе у всех изученных сортов пшеницы уровень экспрессии HKT2;3 в корнях практически одинаков. Так, у сорта Оренбургская 22 ионные транспортеры II класса наиболее активны, и этот сорт пшеницы подвержен наименьшей ток-сикации ионами Na+, они активнее выводятся из ксилемы. Наоборот, у сорта Оренбургская 10 отмечали наибольшее накопление ионов Na+ в листе.
Зеленые растения содержат два основных вида хлорофиллов — Chl a и Chl b, которые нековалентно ассоциированы с мембранными белками (34). Chl a входит в состав реакционного центра антенной решетки, в которой присутствуют основные белки, связывающие Chl a с каротиноидами (34). Солевой стресс, возникающий в результате избытка ионов Na+ и Cl-, приводит к уменьшению содержания хлорофиллов и каротиноидов, к некрозу листьев и снижению метаболических функций в клетке, включая фотосинтез (26, 35). Анализ содержания Chl а и Chl b позволяет количественно оценить повреждения фотосинтетического аппарата, вызванные абиотическим стрессом (35).
Уменьшение содержание Chl а при солевом стресса мы наблюдали у всех изученных генотипов пшеницы (табл. 3). При этом самые выраженные изменения происходили у сортов Оренбургская 22 и Золотая. Для сорта Оренбургская 22 было характерно наибольшее количество Chl а, для сорта Золотая — наименьшее. При солевом стрессе содержание Chl а у сорта Оренбургская 22 уменьшалось в 1,1 раза, у сорта Золотая — в 2,1 раза. Надо отметить, что соотношение Chl a/Chl b у сорта Золотая было выше, чем у сорта Оренбургская 22, хотя содержание Chl a и Chl b у сорта Оренбургская 22 оказалось выше, чем у сорта Золотая. При солевом стрессе у сорта Оренбургская 22 соотношение Chl a/Chl b увеличилось по сравнению с контролем, у сорта Золотая — практически не изменилось. Тот факт, что величина Chl a/Chl b у сорта Оренбургской 22 ниже, чем у сорта Золотая, указывает на высокое содержание Chl b, который расширяет спектр поглощение света, что способствует усилению фотосинтеза (35).
-
3. Содержание хлорофиллов a и b в листьях у изученных сортов пшеницы в фазу кущения (14 сут) при хлоридном засолении (200 мМ NaCl) ( N = 3, n = 5, М ±SD; экспериментальные участки ФГБНУ Федеральный научный центр РАН, Оренбургская обл., 2022 год)
Ограничение процесса фотосинтеза тормозит рост растений. Это приводит к повышению содержания активных форм кислорода (АФК) за счет их избыточной продукции и функционального дисбаланса защитных механизмов (19). Увеличение накопления АФК приводит к снижению чистого притока Na+ в корни, снижению нагрузки Na+ на ксилему и удержанию K+ в корнях с последующим повышением устойчивости к засолению (36). АФК — это неизбежные побочные продукты аэробного метаболизма и важные сигнальные молекулы, участвующие в регуляции многих физиологических процессов, связанных с ростом и развитием растений, однако избыток АФК вызывает окисление липидов, приводящее к повреждению мембран, деградации белков, инактивации ферментов, модификации оснований и разрывов ДНК, что приводит к мутации и, в конечном итоге, к программируемой гибели клеток (37).
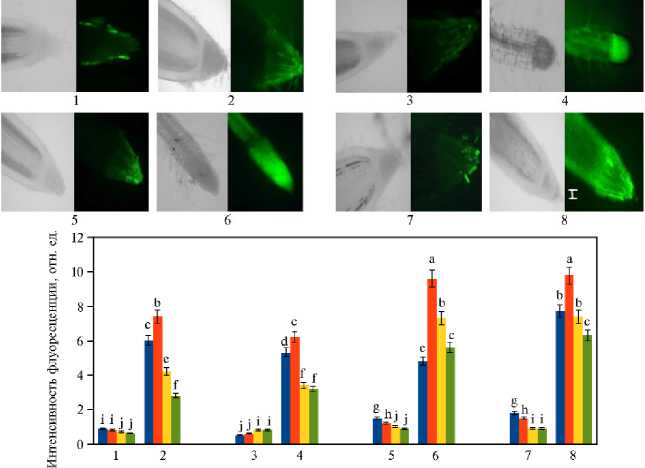
■ Чехлик ■ Меристема ■ Зона растяжения ■ Зона деления
Рис. 2 . Распределение клеток, содержащих и не содержащих активные формы кислорода (соответственно АФК+ и АФК - ), в зонах корней у изученных сортов мягкой пшеницы Triticum aestivum L. (1, 2 — Ульяновская 105, 3, 4 — Оренбургская 22) и твердой пшеницы Triticum durum Desf. (5,
6 — Золотая, 7, 8 — Оренбургская 10) в фазу кущения (14 сут) при хлоридном засолении (200 мМ NaCl) (2, 4, 6, 8) по сравнению с контролем (1, 3, 5, 7) ( N = 3, n = 5, М ±SD; экспериментальные участки ФГБНУ Федеральный научный центр РАН, Оренбургская обл., 2022 год). Масштабный отрезок 400 мкм; флуоресцентный микроскоп Olympus BX51 («Olympus Cor-poration», Япония; для прижизненной визуализации АФК использовали водный раствор Car-boxy-H2DFFDA, «Thermo Fisher Scientific», США).
a-j Разные буквы означают, что средние величины показателя для вариантов в столбце статистически значимо различаются по t -критерию Стьюдента при p < 0,05 (буквенные обозначения присвоены в порядке убывания величины M ).
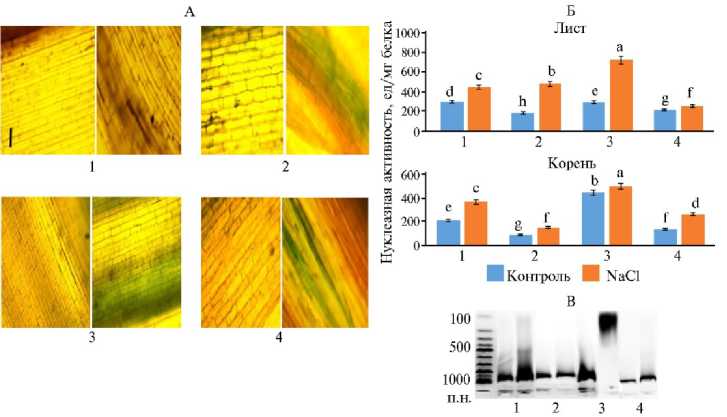
Рис. 3. Ж изнеспособность клеток колеоптиля (А, окрашивание трипановым синим) , нуклеазная активность в листьях и корнях (Б, слева — контроль, справа — солевой стресс) и электрофоретическое разделение ДНК из клеток корней в 1,2 % агарозном геле (В) у изученных сортов мягкой пшеницы Triticum aestivum L. (1 — Ульяновская 105, 2 — Оренбургская 22) и твердой пшеницы Triticum durum Desf. (3 — Золотая, 4 — Оренбургская 10) в фазу кущения (14 сут) при хлоридном засолении (200 мМ NaCl) ( N = 3, n = 5, М ±SD; экспериментальные участки ФГБНУ Федеральный научный центр РАН, Оренбургская обл., 2022 год). Масштабный отрезок 400 мкм (флуоресцентный микроскоп Olympus BX51, «Olympus Corporation», Япония; окрашивание трипановым синим). Маркер молекулярных масс ДНК (100-1000 п.н.) (ООО «Синтол», Россия). a-j Разные буквы означают, что средние величины показателя для вариантов в столбце статистически значимо различаются по t -критерию Стьюдента при p < 0,05 (буквенные обозначения присвоены в порядке убывания величины M ).
Окрашивание корней флуоресцентным красителем для выявления АФК показало, что при солевом стрессе АФК обнаруживались в тканях многих зон корней, однако интенсивность окрашивания в клетках разных зон варьировалась. Мы изучили распределение клеток с повышенным уровнем АФК в разных корневых зонах (рис. 2). У изученных сортов мягкой пшеницы накопление продуктов АФК при засолении происходило интенсивнее в зонах чехлика и меристемы, но было в 1,3 раза ниже, чем у сортов твердой пшеницы. У твердой пшеницы продукты АФК накапливались во всех изученных зонах, однако в чехлике их содержание оказалось меньше, чем в остальных зонах. При этом у твердой пшеницы повышение содержания АФК по сравнению с контролем в наибольшей степени происходило в клетках эпидермиса и коры и в меньшей — в зоне центрального цилиндра (см. рис. 2). О том, что клетки эпидермиса и коры корней наиболее тран-скрипционно активны при засолении, сообщалось и в других исследованиях (38). По мнению их авторов, индукция транскрипционной активности в тканях внутренних слоев корня под воздействием солевого стресса указывает на пространственную регуляцию этого сигнального пути (38, 39).
Самое интенсивное флуоресцентное окрашивание мы наблюдали в корнях растений сорта Золотая. Такое накопление АФК в клетках корней под действием засоления свидетельствует о нарушении гомеостаза АФК в этих клетках и тканях, которое может спровоцировать программируемую клеточную гибель (ПКГ). При этом сорта мягкой пшеницы оказались устойчивее к засолению, чем сорта твердой пшеницы (см. рис. 2).
Для оценки жизнеспособности клеток при солевом стрессе мы провели окрашивание колеоптилей проростков трипановым синим (рис. 3). В контроле видимые изменения в окрашивании практически отсутствовали, но при солевом стрессе повреждение клеток оказалось довольно сильным (более темное окрашивание) и различалось в зависимости от сорта пшеницы. Так, у сорта Золотая на более чем 50 % площади клетки были повреждены при засолении, тогда как у сортов Оренбургская 10 этот показатель составил не более 40 %, Оренбургская 22 — 20 %, Ульяновская 105 — 25 %. Таким образом, под действием высоких концентраций NaCl жизнеспособность клеток колеоптиля у сортов Оренбургской 22 и Ульяновской 105 выше, чем у сортов Золотая и Оренбургская 10, более чувствительных к засолению (см. рис. 3).
Деградация нуклеиновых кислот на завершающих стадиях онтогенеза растения (при гибели) имеет массированный характер (40, 41). На рисунке 3, В представлены данные электрофореза ДНК из корней четырех сортов пшеницы, выращенных в разных условиях. Для контрольных образцов всех сортов характерно присутствие высокомолекулярной ДНК, тогда как при солевом стрессе наблюдается ее деградация. Наибольшую степень деградации показал сорт Золотая, что согласуется с результатами определения суммарной нуклеазой активности (см. рис. 3, Б), которая у сорта Золотая оказалась самой высокой как в листьях, так и в корнях.
Таким образом, по биометрическим показателям наиболее устойчивыми к действию высоких концентраций NaCl в почве оказались сорта мягкой пшеницы. Сорт твердой пшеницы Золотая проявил наибольшую чувствительность к солевому стрессу. Одним из механизмов увеличения толерантности растения является вывод токсичных ионов из цитоплазмы клеток растений. Повышенная активность генов ионных транспортеров двух классов НКТ у сорта Оренбургская 22 способствует большему выведению ионов Cl- и Na+ и, наоборот, у сорта Золотая наблюдается накопление токсичных ионов (42). Оно сопровождается уменьшением содержания хлорофиллов a и b и увеличением содержания АФК, как следствие, усиливается повреждения тканей корней, особенно у сортов Золотая и Оренбургская 10. Различие в накоплении продуктов АФК свидетельствует об активации разных механизмов антиоксидантной защиты у разных генотипов пшеницы. Наибольшая аккумуляция в корнях продуктов АФК под действием NaCl наблюдается у сортов твердой пшеницы, особенно у сорта Золотая, что инициирует программируемую клеточную гибель.
Итак, полученные нами результаты показали, что разные генотипы пшеницы развили неодинаковые механизмы адаптации к солевому стрессу. Увеличение засоленности почвы привело к уменьшению размеров корневой системы у сортов твердой пшеницы, что сопровождалось уменьшением поглощения токсичных ионов Na+. Сорта мягкой пшеницы усилили ионную проводимость и выведение ионов Na+, особенно сорт Оренбургская 22. У сорта Ульяновская 105 отмечено самое высокое содержание ионов К+, которые создают барьер для проникновения ионов Na+. Наземная часть растений у сортов твердой пшеницы более адаптирована к засолению, чем подземная. В пользу этого свидетельствуют полученные нами данные о содержании хлорофиллов, в частности о соотношении Chl a/Chl b, указывающем на усиление фотосинтеза. Для углубления представлений о механизмах адаптации к засолению у разных генотипов мы планируем продолжить исследования, используя дополнительные методы анализа процессов, формирующих ответ на солевой стресс в зависимости от стадии развития растений, и расширив разнообразие изучаемых сортов пшеницы.
Список литературы Сравнительная характеристика и адаптивные механизмы солеустойчивости у разных генотипов твердой и мягкой пшеницы
- Munns R., Tester M. Mechanisms of salinity tolerance. Annu. Rev. Plant Biol., 2008, 59: 651-681 (doi: 10.1146/annurev.arplant.59.032607.092911).
- Tuteja N. Mechanisms of the high salinity tolerance in plants. Methods in Enzymology, 2007, 428: 419-438 (doi: 10.1016/S0076-6879(07)28024-3).
- Панкова Е.И., Горохова И.Н. Анализ сведений о площади засоленных почв России на конец XX и начало XXI веков. Бюллетень Почвенного института им. В.В. Докучаева, 2020, 103: 5-33 (doi: 10.19047/0136-1694-2020-103-5-33).
- Balandrán-Quintana R.R., Mercado-Ruiz J.N., Mendoza-Wilson A.M. Wheat bran proteins: a review of their uses and potential. Food Reviews International, 2015, 31: 279-293 (doi: 10.1080/87559129.2015.1015137).
- Munns R., James R.A., Gilliham M., Flowers T.J., Colmer T.D. Tissue tolerance: an essential but elusive trait for salt-tolerant crops. Functional Plant Biology, 2016, 43: 1103-1113 (doi: 10.1071/FP16187).
- Parihar P., Singh S., Singh, R., Singh V.P., Prasad S.M. Effect of salinity stress on plants and its tolerance strategies: a review. Environ. Sci. Pollut. Res., 2015, 22: 4056-4075 (doi: 10.1007/s11356-014-3739-1).
- DeRose-Wilson L., Gaut B.S. Mapping salinity tolerance during Arabidopsis thaliana germination and seedling growth. PLoS ONE, 2011, 6(8): e22832 (doi: 10.1371/journal.pone.0022832).
- Munns R., James R.A., Xu B., Athman A., Conn S.J., Jordans C., Byrt C.S., Hare R.A., Tyer-man S.D., Tester M., Plett D., Gilliham M. Wheat grain yield on saline soils is improved by an ancestral Na+ transporter gene. Nat. Biotechnol., 2012, 11: 360-364 (doi: 10.1038/nbt.2120).
- Apse M.P., Aharon G.S., Snedden W.A., Blumwald E. Salt tolerance conferred by overex-pression of a vacuolar Na+/H+ antiport in Arabidopsis. Science, 1999, 20: 1256-1258 (doi: 10.1126/science.285.5431.1256).
- Apse M.P., Blumwald E. Na+ transport in plants. FEBS Lett., 2007, 581: 2247-2254 (doi: 10.1016/j.febslet.2007.04.014).
- Jabnoune M., Espeout S., Mieulet D., Fizames C., Verdeil J.L., Conéjéro G., Rodríguez-Na-varro A., Sentenac H., Guiderdoni E., Abdelly C., Véry A.A. Diversity in expression patterns and functional properties in the rice HKT transporter family. Plant Physiol., 2009, 150: 1955-1971 (doi: 10.1104/pp.109.138008).
- Tournaire-Roux C., Sutka M., Javot H., Gout E., Gerbeau H., Luu D.-T., Bligny R., Maurel C. Cytosolic pH regulates root water transport during anoxic stress through gating of aquaporins. Nature, 2003, 425: 393-397 (doi: 10.1038/nature01853).
- Boursiac Y., Chen S., Luu D.-T., Sorieul M., van den Dries N., Maurel C. Early effects of salinity on water transport in Arabidopsis roots. Molecular and cellular features of aquaporin ex-pression. Plant Physiol., 2005, 139: 790-805 (doi: 10.1104/pp.105.065029).
- Horie T., Hauser F., Schroeder J.I. HKT transporter-mediated salinity resistance mechanisms in Arabidopsis and monocot crop plants. Trends Plant Sci., 2009, 14: 660-668 (doi: 10.1016/j.tplants.2009.08.009).
- Murguía J.R., Bellés J.M., Serrano R. A salt-sensitive 3´(2´),5´-bisphosphate nucleotidase in-volved in sulfate activation. Science, 1995, 267: 232-234 (doi: 10.1126/science.7809627).
- Tsugane K., Kobayashi K., Niwa Y., Ohba Y., Wada K., Kobayashi H. A recessive Arabidopsis mutant that grows photoautotrophically under salt stress shows enhanced active oxygen detoxifi-cation. Plant Cell, 1999, 11: 1195-1206 (doi: 10.1105/tpc.11.7.1195).
- Choudhury F.K., Rivero R.M., Blumwald, E., Mittler R. Reactive oxygen species, abiotic stress and stress combination. Plant J., 2017, 90: 856-867 (doi: 10.1111/tpj.13299).
- Fichman Y., Mittler R. Rapid systemic signaling during abiotic and biotic stresses: is the ROS wave master of all trades? Plant J., 2020, 102: 887-896 (doi: 10.1111/tpj.14685).
- Del Rio L.A. ROS and RNS in plant physiology: an overview. Journal of Experimental Botany, 2015, 66: 2827-2837 (doi: 10.1093/jxb/erv099).
- Caverzan A., Casassola A., Brammer S.P. Antioxidant responses of wheat plants under stress. Genet Mol. Biol., 2016, 39(1): 1-6 (doi: 10.1590/1678-4685-GMB-2015-0109).
- You J., Chan Z. ROS regulation during abiotic stress responses in crop plants. Frontiers in Plant Science, 2015, 6: 1092 (doi: 10.3389/fpls.2015.01092).
- Foyer C.H., Noctor G. Redox regulation in photosynthetic organisms: signaling, acclimation, and practical implications. Antioxid. Redox Signal., 2009, 11(4): 861-906 (doi: 10.1089/ars.2008.2177).
- Mur L.A.J., Aubry S., Mondhe M., Kingston-Smith A., Gallagher J., Timms-Taravella E., James C., Papp I., Hörtensteiner S., Thomas H., Ougham H. Accumulation of chlorophyll ca-tabolites photosensitizes the hypersensitive response elicited by Pseudomonas syringae in Arabidop-sis. New Phytol., 2010, 188: 161-174 (doi: 10.1111/j.1469-8137.2010.03377.x).
- Brouwer B., Ziolkowska A., Bagard M., Keech O., Gardeström P. The impact of light intensity on shade-induced leaf senescence. Plant Cell Environ., 2012, 35: 1084-1098 (doi: 10.1111/j.1365-3040.2011.02474.x).
- Kitajima K., Hogan K.P. Increases of chlorophyll a/b ratios during acclimation of tropical woody seedlings to nitrogen limitation and high light. Plant Cell Environ., 2003, 26: 857-865 (doi: 10.1046/j.1365-3040.2003.01017.x).
- Kalaji H.M., Jajoo A., Oukarroum A., Brestic M., Zivcak M., Samborska I.A., Cetner M.D., Łukasik I., Goltsev V., Ladle R.J. Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress conditions. Acta Physiol. Plant., 2016, 38: 102 (doi: 10.1007/s11738-016-2113-y).
- Климентьев А.И. Почвы. Почвенный покров. Географический атлас Оренбургской области. М., 1999: 40-41.
- Kononenko N.V., Baranova E.N., Dilovarova T.A., Akanov E.N., Fedoreyeva L.I. Oxidative damage to various root tissues and aerial parts of durum and soft wheat seedlings during chloride salinity. Agriculture, 2020, 10: 55-71 (doi: 10.3390/agriculture10030055).
- Hu X., Tanaka A., Tanaka R. Simple extraction methods that prevent the artifactual conversion of chlorophyll to chlorophyllide during pigment isolation from leaf samples. Plant Methods, 2013, 9: 19 (doi: 10.3390/agriculture10030055).
- Fedoreyeva L.I., Sobolev D.E., Vanyushin B.F. Wheat endonuclease WEN1 dependent on S-adenosyl-L-methionine and sensitive to DNA methylation status. Epigenetics, 2007, 2: 50-53 (doi: 10.4161/epi.2.1.3933).
- Fedoreyeva L.I., Lazareva E.M., Shelepova O.V., Baranova E.N., Kononenko N.V. Salt induced autotophagy and programmed cell death in wheat. Agronomy, 2022, 12: 2161-2181 (doi: 10.3390/agronomy12081909).
- Зялалов А.А., Газизов И.С., Ионенко И.Ф. Экспериментальное доказательство сопряжения водного тока с циркуляцией калия в растении. Доклады академии наук, 1994, 336: 712-713.
- Deinlein U., Stephan A.B., Horie T., Luo W., Xu G., Schroeder J.I. Plant salt-tolerance mech-anisms. Trends Plant Sci., 2014, 19: 371-379 (doi: 10.1016/j.tplants.2014.02.001).
- Gree B.R., Hichersky E., Kloppstech К. Chlorophyll a/b-binding proteins: an extended family. Trends in Biochemical Sciences, 1991, 16: 181-186 (doi: 10.1016/0968-0004(91)90072-4).
- Mehta P., Jajoo A., Mathur S., Bharti S. Chlorophyll a fluorescence study revealing effects of high salt stress on Photosystem II in wheat leaves. Plant Physiol. Biochem., 2010, 48: 16-20 (doi: 10.1016/j.plaphy.2009.10.006).
- Jiang C., Belfield E., Cao Y., Smith J., Harberd N. An Arabidopsis soil salinity tolerance mutation confers ethylene mediated enhancement of sodium/potassium homeostasis. Plant С el l , 2013, 3535 3352 doi: 10.1105/tpc.113.115659).
- Mancini A., Buschini A., Maria Restivo F.M., Rossi C., Poli P. Oxidative stress as DNA damage in different transgenic tobacco plants. Plant Sci., 2006, 170: 845-852 (doi: 10.1016/j.plantsci.2005.12.002).
- Geng Y., Rui Wu R., Wee Ch., Xie F., Wei X., Chan P., Tham C., Duan L., Dinnenya J. A spatio-temporal understanding of growth regulation during the salt stress response in Arabidopsis. The Plant Cell, 2013, 25: 2132-2154 (doi: 10.1105/tpc.113.112896).
- Deinlein U., Stephan A., Horie T., Luo W., Xu G., Schroeder J. Plant salt tolerance mechanisms. Trends Plant Sci ., 2014, 19: 371 379 (doi: 10.1016/j.tplants.2014.02.001).
- Papini A. Investigation of morphological features of autophagy during plant programmed cell death. Methods Mol. Biol., 2018, 1743: 9-19 (doi: 10.1007/978-1-4939-7668-3_2).
- Fuchs Y., Steller H. Live to die another way: modes of programmed cell death and the signals emanating from dying cells. Nat. Rev. Mol. Cell Biol., 2015, 16: 329-344 (doi: 10.1038/nrm3999).
- Shi H., Lee B.H., Wu S.J., Zhu J.K. Overexpression of a plasma membrane Na+/H+ antiporter gene improves salt tolerance in Arabidopsis thaliana. Nat. Biotechnol., 2003, 21: 81-85 (doi: 10.1038/nbt766).


