Сравнительная характеристика тестикулярной и уретральной микробиоты у пациентов с различными видами азооспермии и сопутствующим варикоцеле
Автор: Фаниев М.В., Кадыров З.А., Дружинина Н.К., Степанов В.С., Прокопьев Я.В., Федоренко Т.В., Маркелова М.И., Хуснутдинова Д.Р., Григорьева Т.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 4 т.16, 2023 года.
Бесплатный доступ
Введение. Повсеместно с проблемой бесплодия сталкивается около 15% пар репродуктивного возраста, при этом мужской фактор, выступает основной причиной в 50% случаев. Отсутствие эффективного лечения мужского бесплодия во многом обусловлено многофакторной этиологией данного заболевания. Одним из таких факторов выступают инфекции урогенитального тракта, диагностический поиск которых требует разработки новых методов. На сегодняшний день, секвенирование следующего поколения (NGS), использующие последовательность нуклеотидов в 16S рРНК-область бактериального генома является самым современным и высокочувствительным методом определения микробиома.
Азооспермия, микробиота яичка, микробиота уретры, варикоцеле, мужское бесплодие
Короткий адрес: https://sciup.org/142240797
IDR: 142240797 | DOI: 10.29188/2222-8543-2023-16-4-80-91
Текст научной статьи Сравнительная характеристика тестикулярной и уретральной микробиоты у пациентов с различными видами азооспермии и сопутствующим варикоцеле
андрология экспериментальная и клиническая урология № 4 2023
Во всем мире с проблемой бесплодия сталкивается около 15% пар репродуктивного возраста [1], при этом мужской фактор,выступает основной причиной в 50% случаев [1–3]. Исследование глобальных показателей бесплодия, проведенное с 1990 по 2010 год в 190 странах, показало, что 48,5 миллионов пар были бесплодными, 19,2 миллиона из них страдали от первичного бесплодия, в то время как у 29,3 миллионов было диагностировано вторичное бесплодие [4]. В 10-15% случаев этиология бесплодия остается идиопатической [5, 6].
Отсутствие эффекта от лечения мужского бесплодия во многом связано с многофакторной этиологией данного заболевания. Одним из таких факторов могут являться инфекции урогенитального тракта,не всегда подвергшиеся адекватному диагностическому поиску Исследования in vitro выявили механизмы, с помощью которых бактерии влияют на функцию семенной жид-кости,включая агглютинацию подвижных сперматозоидов, индукцию апоптоза, выработку факторов иммобилизации и нарушение акросомальной реакции [7–11]. Микроорганизмы, населяющие определенный локус человеческого тела,способны формировать со-общества.Данные сообщества носят название микробиом. Анализ последовательности гена 16S рРНК может привести к открытию новых патогенов и позволяет идентифицировать некультивируемые бактерии, обеспечивая независимость от условий роста [12]. Тра- диционно считалось, что мужская уретра стерильна или лишь временно колонизирована микроорганизмами, однако, сегодня Van Der Pol. и соавт. отмечают, что микробиота уретры формируется еще до начала половой жизни, расширяя свой видовой состав при получении индивидом сексуального опыта и дополняясь транзиторной микрофлорой. Однако существует и резидентная микробиота уретры, к ней относят: Lactobacilli, Diphteroides, Streptococcus, Peptostreptococcus [13].
Особое место в исследовании структуры микробиоты урогенитального тракта занимает тестикулярная ткань,что связано с инвазией при заборе материала и техническими трудностями диагностики. В связи с чем многие клинические исследования основывались на диагностике показателей эякулята. Долгое время внутренняя среда яичка считалась абсолютно стерильной, и первым, кто опроверг данную догму, стал M. Alfano и соавт., доказавшие присутствие микроорганизмов в структуре микробиоты яичка [14]. При исследовании микробиологического состава семенной жидкости чаще всего выделяют такие виды, как Enterobacteriaceae (включая Escherichia coli, Enterococcus faecalis, Klebsiella spp., Salmonella spp., Proteus spp. и Pseudomonas spp. ), Streptococcus spp. ( S. agalactiae, S. anginosus, S. faecalis и S. virid-ians ), Staphylococcus spp. (S aureus, S. haemolyticus Sepidermidis ), также встречаются возбудители инфекций, передающихся половым путем (ИППП) ( Ure-aplasma urealyticum, Mycoplasma spp. и Chlamydia trachomatis), Gardnerellavaginalis, Bacteroides spp., Mor-ganella morganii и др. [15].
Следует отметить, что эякулят представляет собой совокупность секретов желез, входящих в урогенитальный тракт мужчины и, следовательно, микробиологические сообщества, населяющие последний, способны оказывать влияние на качество семенной жидкости. Методы исследования микробиологических сообществ всегда вызывали огромный интерес среди врачебного сообщества. К основным методам, позволяющим установить микробиологический состав исследуемой области,на сегодняшний день в рутинной практике относят культуральные методы исследования [16]. Однако, по мнению Г.А. Осипова и соавт., существующая методология микробиологического обследования пациента в клинических лабораториях по разным причинам не позволяет выявлять большинство клинически значимых микробов из числа аэробных актинобактерий, всех анаэробов и других трудно культивируемых микроорганизмов [17]. Альтернативным методом,позволяющим определить состав микробиологического сообщества,является метод полимеразной цепной реакции (ПЦР) [18]. Однако данный метод позволяет выявить строго определенный спектр микроорганизмов, что толкает исследователей к поиску новых методов верификации состава микробиологических сообществ.
К самым современным и высокочувствительным методам определения микробиома относят секвенирование следующего поколения (NGS), которое использует последовательность нуклеотидов в 16S рРНК-область бактериального генома для идентификации бактерий [19, 20]. Это позволило более точно охарактеризовать микробиологический спектр бактериальных таксонов,которые не могли быть выделены стандартными методами исследования и проанализировать крупномасштабные последовательности микробного генома.
Целью данной работы является изучение, а также сравнение структуры тестикулярной и уретральной микробиоты у пациентов с различными видами азооспермии и сопутствующим варикоцеле.
МАТЕРИАЛЫ И МЕТОДЫ
В основу данной работы легли результаты анализа 107 инфертильных пациентов с различными видами азооспермии и, в отдельных случаях, с сопутствующим варикоцеле,обратившихся в Центр репродуктивной и клеточной медицины ГБУЗ ДГКБ г. Краснодар Министерства здравоохранения Краснодарского края.
В результате подготовки проб 31 образец не соответствовал критериям качества и был исключен из исследования. Таким образом, в исследовании вошли 76 мужчин с подтвержденной азооспермией и сопутствующим варикоцеле в возрасте 23-49 (в среднем 28±5,1). В зависимости от вида азооспермии и сопут- ствующего варикоцеле пациенты были разделены на три группы, где 1 группу (n=34), составили пациенты с необструктивной азооспермией (NОА), 2 группу (n=21) пациенты с обструктивной азооспермией (ОА) и 3 группу (n=21) с необструктивной азооспермией и сопутствующем варикоцеле (Var).
Критериями включения служили: добровольное информированное согласие пациента на участие в исследовании, возраст старше 18 лет, бесплодие в браке более 1 года при регулярной половой жизни без использования средств контрацепции, азооспермия, отсутствие антибактериальной терапии в течение последних 3 месяцев, наличие варикоцеле, подтвержденного ультразвуковым исследованием органов мошонки с допплерографией.
Критериями исключения были: наличие онкологической патологии, инфекции, передаваемые половым путем (ИППП), генетические и эндокринные факторы бесплодия, тяжелая соматическая патология на момент обследования,регулярный прием лекарственных средств,приводящих к развитию бесплодия и гипогонадизма, повышение концентрации простатспе-цифического антигена в сыворотке крови более 4 нг/мл, психические заболевания, хронический алкоголизм и наркомания, наличие ВИЧ-инфекции.
Для исследования бактериального спектра урогенитального тракта и контроля чистоты метода,был произведен забор биологического материала из уретры у каждого пациента, которому проводилась micro-TESE (мультифокальная биопсия яичек) в протоколе вспомогательных репродуктивных технологий (ВРТ). Методика проведения, micro-TESE была первоначально описана P.N. Schlegel в 1999 году, в качестве более эффективной альтернативы по сравнению с TESE, для извлечения сперматозоидов у мужчин с НOA [21].
Для исследования структуры микробиома тестикулярной ткани был проведен анализ ампликонов бактериального гена 16S pРНК с использованием высокопроизводительного секвенирования нового поколения (NGS) [22].
Данные обрабатывали с помощью программы QIIME (версия 1.9.1). При определении микробиологического состава образцов были использованы новые версии программы обработки данных секвенирования ампликонов 16SрРНК и таксономическая база данных (QIIME2+GreenGenes2), позволяющая повысить точность определения таксонов.
РЕЗУЛЬТАТЫ
Сравнительная характеристика структуры микробиоты уретры и тестикул пациентов была проанализирована по средним значениям в группах, на уровне фил и семейств. При анализе полученных дан- ных таксоны, доля которых была ниже 0,5% хотя бы в двух образцах, были исключены.
Таксономический состав микробиоты уретры
При оценке полученных данных таксономический состав микробиоты уретры можно представить следующим образом. (рис. 1).
Достоверных отличий микробиологического состава при исследовании микробиоты уретры у пациентов с группой 1 (NОА) и группой 2 (ОА) обнаружено не было. Однако, выявлены отличия таксономического состава микробиоты уретры у пациентов 3 группы (Var) с варикозным расширением вен лозовидного сплетения и азооспермией (рис. 2А).
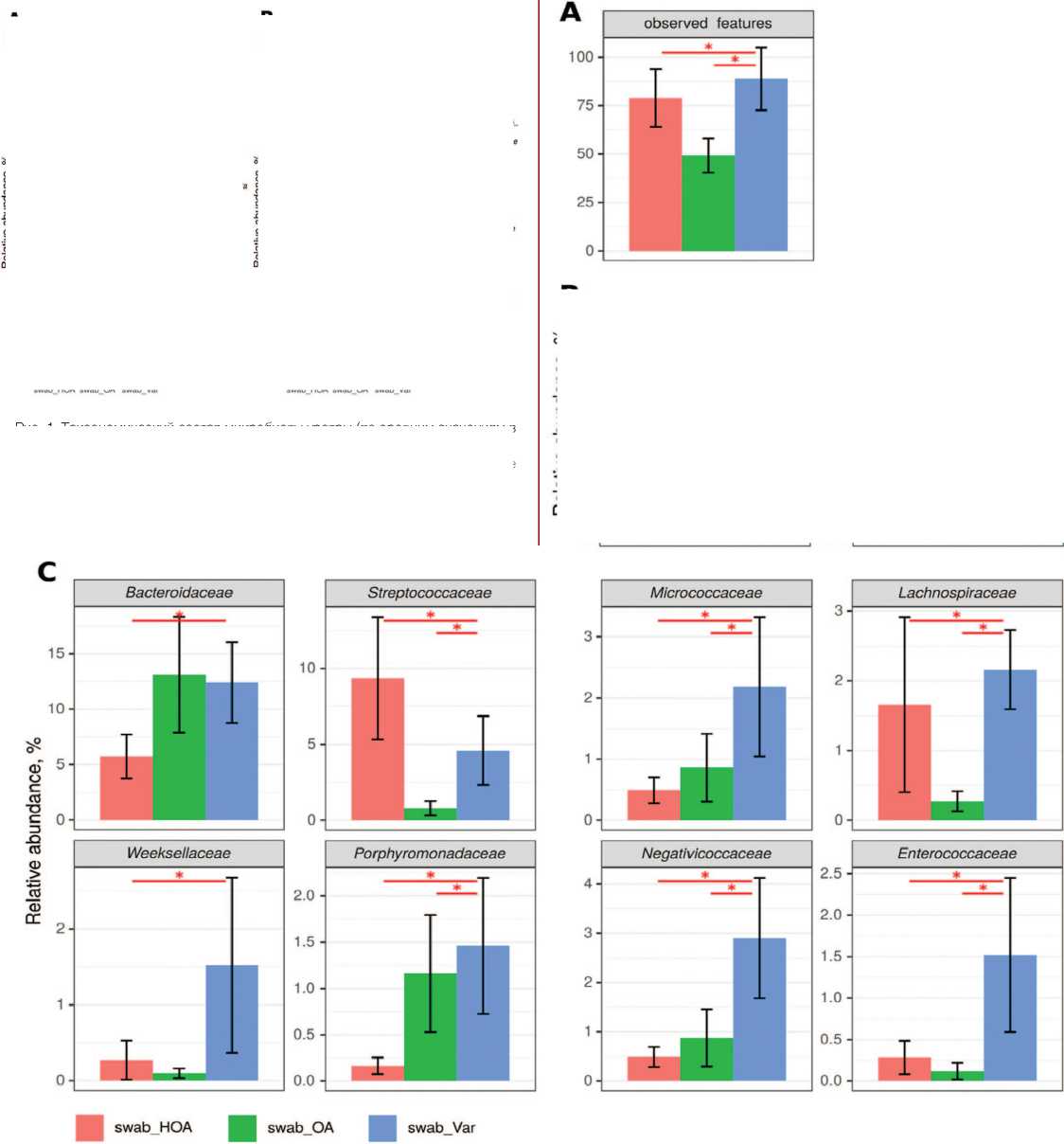
Рис. 2. Достоверные отличия таксономического состава микробиоты уретры.
Примечания: А – разнообразие сообщества, В – филы, С – семейства. * - достоверность различий между группами p<0,05 (тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини Хохберга).
Fig. 2. Significant differences in the taxonomic composition of the urethral microbiota. Notes: A – community diversity, B – phyla, C – families. * - significance of differences between groups p<0.05 (Kruskal-Wallis test adjusted for multiple comparisons using the Benjamini-Hochberg method
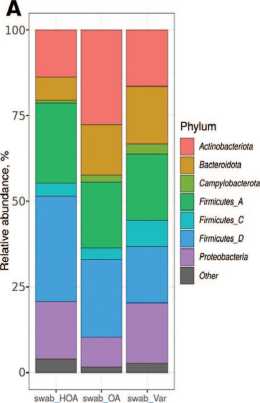
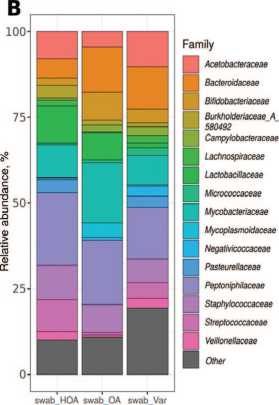
Рис. 1. Таксономический состав микробиоты уретры (по средним значениям в группе). А – на уровне фил, В – на уровне семейств
Fig. 1. Taxonomic composition of the urethral microbiota (based on average values in the group). A – at the phylum level, B – at the family level
Достоверно снижено количество обнаруженных таксонов, а также фил и семейств, которые представлены на рисунке 2 ( p <0,05) и таблице 1, характеризующие различия относительной представленности таксонов в образцах микробиоты уретры.
Если сравнивать качественные данные,наличие или отсутствие таксона в образце,то NОА и ОА различаются частотой встречаемости только филы Bacteroidota. При сравнении видового состава микроорганизмов у пациентов с варикоцеле и группами па-
Таблица 1. Представленность таксонов в образцах микробиоты уретры
Table 1. Representation of taxa in urethral microbiota samples
|
Таксоны Taxa |
Относительная представленность таксонов микробиоты уретры, (М±SD) Relative representation of urethral microbiota taxa, (M±SD) |
Достоверность различий между группами, (р) Significance of differences between groups, (p) |
||||
|
Группа 1/ Group 1 (NОА) |
Группа 2/Group 2 (ОА) |
Группа 3/Group 3 (Var) |
NOA vs OA |
NOA vsVar |
OA vsVar |
|
|
Альфа-разнообразие |
||||||
|
Observed_features |
79,00±87,16 |
49,29±40,62 |
88,86±73,96 |
0,72 |
0,01 |
0,02 |
|
Филы |
||||||
|
Bacteroidota |
6,78±11,82 |
14,75±24,17 |
16,81±17,91 |
0,10 |
<0,01 |
0,09 |
|
Firmicutes_C |
3,80±7,74 |
3,30±5,66 |
7,69±11,93 |
1,00 |
0,02 |
0,02 |
|
Patescibacteria |
0,31±1,65 |
0,01±0,03 |
0,15±0,33 |
0,48 |
0,02 |
0,02 |
|
Fusobacteriota |
1,00±3,83 |
0,04±0,13 |
0,46±0,84 |
0,51 |
0,02 |
0,02 |
|
Desulfobacterota_I |
0,00±0,00 |
0,01±0,06 |
0,12±0,24 |
0,56 |
<0,01 |
0,01 |
|
Семейства |
||||||
|
Bacteroidaceae |
5,74±11,51 |
13,12±23,97 |
12,42±16,71 |
0,20 |
0,01 |
0,19 |
|
Streptococcaceae |
9,35±23,52 |
0,80±2,18 |
4,59±10,41 |
0,27 |
0,03 |
0,01 |
|
Micrococcaceae |
0,49±1,23 |
0,86±2,53 |
2,18±5,22 |
0,99 |
0,04 |
0,04 |
|
Lachnospiraceae |
1,66±7,33 |
0,27±0,65 |
2,16±2,60 |
0,60 |
<0,01 |
<0,01 |
|
Weeksellaceae |
0,27±1,51 |
0,10±0,30 |
1,52±5,30 |
0,36 |
0,03 |
0,18 |
|
Porphyromonadaceae |
0,16±0,52 |
1,16±2,90 |
1,46±3,37 |
0,21 |
<0,01 |
0,03 |
|
Acutalibacteraceae |
0,03±0,17 |
0,10±0,24 |
0,78±1,16 |
0,15 |
<0,01 |
0,01 |
|
Ruminococcaceae |
0,14±0,67 |
0,07±0,20 |
0,30±0,56 |
0,77 |
0,04 |
0,08 |
|
Negativicoccaceae |
0,49±1,18 |
0,88±2,66 |
2,90±5,61 |
0.99 |
0,03 |
0,03 |
|
Enterococcaceae |
0,28±1,17 |
0,12±0,47 |
1,52±4,26 |
0,82 |
0,04 |
0,02 |
|
Fusobacteriaceae_993521 |
0,39±1,99 |
0,00±0,02 |
0,37±0,72 |
0,46 |
0,01 |
<0,01 |
|
Flavobacteriaceae |
0,05±0,27 |
0,00±0,00 |
0,06±0,13 |
0,31 |
0,12 |
0,04 |
|
Coprobacillaceae |
0,08±0,38 |
0,03±0,12 |
0,23±0,35 |
1,00 |
<0,01 |
0,01 |
|
Brevibacteriaceae |
0,12±0,54 |
0,00±0,00 |
0,26±0,97 |
0,29 |
0,14 |
0,04 |
|
Peptostreptococcaceae_256921 |
0,09±0,48 |
0,14±0,59 |
0,41±0,98 |
0,29 |
<0,01 |
0,06 |
|
Oscillospiraceae_88309 |
0,01±0,04 |
0,04±0,15 |
0,17±0,34 |
0,89 |
0,03 |
0,04 |
|
Microbacteriaceae |
0,22±1,16 |
0,03±0,11 |
0,29±0,68 |
1,00 |
0,05 |
0,047 |
|
Helicobacteraceae |
0,03±0,15 |
0,01±0,05 |
0,44±1,22 |
0,85 |
0,01 |
0,02 |
|
o__Bacteroidales,f_ |
0,00±0,00 |
0,11±0,38 |
0,15±0,35 |
0,22 |
0,01 |
0,21 |
|
Rikenellaceae |
0,01±0,03 |
0,00±0,00 |
0,30±0,63 |
0,87 |
<0,01 |
<0,01 |
|
Desulfovibrionaceae |
0,00±0,00 |
0,01±0,06 |
0,12±0,24 |
0,56 |
<0,01 |
0,01 |
|
o__Christensenellales,f__CAG-74 |
0,00±0,00 |
0,02±0,07 |
0,07±0,18 |
0,33 |
0,03 |
0,23 |
|
c__Clostridia_258483, o__UBA1381, f__UBA1381 |
0,00±0,00 |
0,00±0,01 |
0,07±0,19 |
0,52 |
0,02 |
0,08 |
|
Tannerellaceae |
0,01±0,04 |
0,00±0,00 |
0,15±0,40 |
0,72 |
<0,01 |
<0,01 |
Примечания: для оценки различий между группами применяли тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини-Хохберга Notes: To assess differences between groups, the Kruskal-Wallis test was used, corrected for multiple comparisons using the Benjamini-Hochberg method.
циентов с азооспермией невозможно выделить определенные филы, в силу широкого разнообразия последних (табл. 2).
Таксономический состав микробиоты ткани яичка
При исследовании микробиоты яичка обнаружены значительные отличия видового разнообразия у пациентов с NОА,пациентов с ОА и пациентов с варикоцеле.
При NОА отмечается снижение видового разнообразия микробиоты яичка,и достоверно отличается целый ряд таксонов. При сравнении микробиоты уретры было выявлено сходство видового состава микробиоты у пациентов с NОА и АО,тогда как видовой состав микробиоты яичка у пациентов с ОА имеет сходство с аналогичным у пациентов с варикоцеле (рис. 4 , табл. 3). Интересная ситуация с семейством Enterobacteriaceae_A , представленность которого в среднем больше 34% в биопсиях группы NОА (рис. 3В).
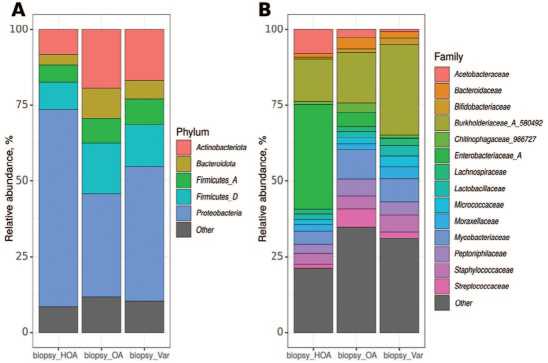
Рис. 3. Таксономический состав микробиоты ткани яичка (по средним значениям в группе). А – на уровне фил, В – на уровне семейств.
Fig. 3. Taxonomic composition of testicular tissue microbiota (based on average values in the group). A – at the phylum level, B – at the family level
Однако достоверных отличий дальше по этому семейству мы не обнаружили. На наш взгляд это связано с тем, что у 12 пациентов в группе NОА доля данного
Таблица 2. Частоты встречаемости бактериальных таксонов в уретре в группах сравнения Table 2. Frequencies of occurrence of bacterial taxa in the urethra in comparison groups
|
Таксоны Taxa |
Частота встречаемости таксона, (%) Frequency of taxon occurrence, (%) |
Достоверность различий между группами, (р) Significance of differences between groups, (p) |
||||
|
Группа 1/ Group 1 (NОА) |
Группа 2/Group 2 (ОА) |
Группа 3/Group 3 (Var) |
NOA vs OA |
NOA vsVar |
OA vsVar |
|
|
Филы |
||||||
|
Bacteroidota |
70,6 |
100,0 |
100,0 |
0,01 |
0,01 |
1,00 |
|
Firmicutes_C |
52,9 |
57,1 |
95,2 |
0,79 |
<0,01 |
0,01 |
|
Fusobacteriota |
20,6 |
14,3 |
52,4 |
0,72 |
0,03 |
0,03 |
|
Desulfobacterota_I |
0,0 |
4,8 |
28,6 |
0,38 |
0,01 |
0,04 |
|
Семейства |
||||||
|
Bacteroidaceae |
61,8 |
85,7 |
95,2 |
0,11 |
0,03 |
0,61 |
|
Burkholderiaceae_A_580492 |
38,2 |
42,9 |
76,2 |
0,78 |
0,03 |
0,09 |
|
Streptococcaceae |
44,1 |
33,3 |
81,0 |
0,57 |
0,02 |
0,01 |
|
Lachnospiraceae |
35,3 |
52,4 |
85,7 |
0,27 |
<0,01 |
0,06 |
|
Pseudomonadaceae |
17,6 |
28,6 |
52,4 |
0,50 |
0,04 |
0,31 |
|
Porphyromonadaceae |
17,6 |
33,3 |
71,4 |
0,21 |
<0,01 |
0,04 |
|
Acutalibacteraceae |
8,8 |
28,6 |
61,9 |
0,07 |
<0,01 |
0,07 |
|
Fusobacteriaceae_993521 |
11,8 |
4,8 |
42,9 |
0,64 |
0,03 |
0,03 |
|
Coprobacillaceae |
8,8 |
9,5 |
42,9 |
1,00 |
0,02 |
0,049 |
|
Peptostreptococcaceae_256921 |
5,9 |
19,0 |
42,9 |
0,19 |
<0,01 |
0,19 |
|
Helicobacteraceae |
2,9 |
4,8 |
28,6 |
1,00 |
0,03 |
0,14 |
|
o__Bacteroidales;__ |
0,0 |
9,5 |
23,8 |
0,21 |
0,02 |
0,41 |
|
Rikenellaceae |
2,9 |
4,8 |
38,1 |
1,00 |
<0,01 |
0,03 |
|
Desulfovibrionaceae |
0,0 |
4,8 |
28,6 |
0,38 |
0,01 |
0,14 |
|
Tannerellaceae |
2,9 |
0,0 |
28,6 |
1,00 |
0,03 |
0,03 |
Примечания: для оценки различий между группами применяли тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини-Хохберга Notes: To assess differences between groups, the Kruskal-Wallis test was used, corrected for multiple comparisons using the Benjamini-Hochberg method.
Таблица 3. Представленность таксонов в образцах микробиоты ткани яичка
Table 3. Representation of taxa in testicular tissue microbiota samples
|
Таксоны Taxa |
Относительная представленность таксонов микробиоты уретры, (М±SD) Relative representation of urethral microbiota taxa, (M±SD) |
Достоверность различий между группами, (р) Significance of differences between groups, (p) |
||||
|
Группа 1/ Group 1 (NОА) |
Группа 2/Group 2 (ОА) Группа 3/Group 3 (Var) NOA vs OA NOA vsVar |
OA vsVar |
||||
|
Альфа-разнообразие |
||||||
|
faith_pd |
31,59±51,66 |
46,32±45,78 |
88,82±81,82 |
0,046 |
<0,01 |
0,08 |
|
observed_features |
63,32±72,10 |
99,90±71,98 |
180,57±98,12 |
0,04 |
<0,01 |
0,02 |
|
shannon_entropy |
3,41±1,64 |
4,51±0,98 |
4,95±1,22 |
0,047 |
<0,01 |
0,21 |
|
simpson |
0,78±0,16 |
0,89±0,07 |
0,86±0,15 |
0,046 |
0,02 |
0,61 |
|
Филы |
||||||
|
Actinobacteriota |
8,30±10,94 |
19,46±17,71 |
16,81±13,98 |
0,01 |
0,01 |
0,84 |
|
Proteobacteria |
65,09±30,60 |
34,06±22,19 |
44,32±30,96 |
<0,01 |
0,01 |
0,45 |
|
Firmicutes_D |
8,99±12,31 |
16,57±13,85 |
13,93±11,34 |
0,03 |
0,047 |
0,74 |
|
Firmicutes_A |
5,63±9,32 |
8,15±6,97 |
8,58±6,82 |
0,049 |
0,04 |
0,77 |
|
Bacteroidota |
3,45±4,33 |
9,93±11,38 |
6,05±4,22 |
0,01 |
0,01 |
0,66 |
|
Firmicutes_C |
0,95±2,58 |
1,58±3,28 |
1,63±2,99 |
0,04 |
0,04 |
0,79 |
|
Deinococcota |
0,14±0,63 |
0,33±0,80 |
0,31±0,54 |
0,17 |
0,01 |
0,23 |
|
Семейства |
||||||
|
Mycobacteriaceae |
4,34±8,25 |
9,78±14,78 |
7,48±8,01 |
0,03 |
0,01 |
0,97 |
|
Peptoniphilaceae |
3,06±8,38 |
5,40±6,90 |
4,37±4,32 |
0,01 |
0,01 |
0,91 |
|
Bacteroidaceae |
1,18±2,56 |
3,81±9,70 |
2,20±2,66 |
0,08 |
0,03 |
0,57 |
|
Staphylococcaceae |
3,59±9,42 |
4,28±7,28 |
5,55±5,80 |
0,34 |
0,02 |
0,19 |
|
Streptococcaceae |
1,23±3,01 |
6,07±9,82 |
2,01±2,09 |
<0,01 |
0,01 |
0,58 |
|
Lactobacillaceae |
1,71±4,65 |
1,91±2,74 |
3,53±6,46 |
0,09 |
0,04 |
0,58 |
|
Micrococcaceae |
1,60±4,49 |
2,12±3,58 |
3,60±3,82 |
0,10 |
<0,01 |
0,15 |
|
Moraxellaceae |
2,32±5,99 |
1,89±4,12 |
3,94±6,83 |
0,64 |
0,02 |
0,07 |
|
Pseudomonadaceae |
0,94±1,96 |
1,55±2,62 |
1,64±1,57 |
0,35 |
<0,01 |
0,04 |
|
Weeksellaceae |
0,44±1,02 |
1,14±1,86 |
1,01±1,01 |
0,01 |
<0,01 |
0,37 |
|
Porphyromonadaceae |
0,33±1,36 |
0,34±0,67 |
0,48±0,86 |
0,26 |
0,02 |
0,25 |
|
Acutalibacteraceae |
0,14±0,38 |
0,58±1,66 |
0,63±1,07 |
0,45 |
0,01 |
0,07 |
|
Dermabacteraceae |
0,16±0,46 |
0,82±1,19 |
0,17±0,27 |
0,02 |
0,25 |
0,23 |
|
Pasteurellaceae |
0,14±0,69 |
1,20±3,29 |
0,41±1,30 |
0,12 |
<0,01 |
0,19 |
|
Sphingomonadaceae |
0,42±0,99 |
0,39±0,98 |
0,37±0,61 |
0,36 |
0,03 |
0,22 |
|
Enterococcaceae |
0,07±0,41 |
0,04±0,18 |
0,27±0,69 |
0,86 |
<0,01 |
0,01 |
|
Flavobacteriaceae |
0,11±0,29 |
0,46±0,69 |
0,45±0,67 |
0,07 |
0,02 |
0,54 |
|
Alcanivoracaceae |
0,07±0,40 |
0,12±0,32 |
0,49±0,68 |
0,33 |
<0,01 |
0,01 |
|
Sphingobacteriaceae |
0,04±0,24 |
0,56±1,94 |
0,40±0,64 |
0,24 |
<0,01 |
0,02 |
|
Beijerinckiaceae |
0,56±2,06 |
0,14±0,55 |
0,71±1,45 |
0,28 |
0,03 |
0,01 |
|
Bacillaceae_H_294103 |
0,10±0,37 |
0,01±0,05 |
0,18±0,24 |
0,61 |
<0,01 |
<0,01 |
|
c__Alphaproteobacteria |
0,11±0,33 |
0,21±0,48 |
0,27±0,41 |
0,37 |
0,02 |
0,14 |
|
Marinococcaceae |
0,04±0,18 |
0,14±0,44 |
1,16±2,58 |
0,41 |
0,03 |
0,18 |
|
Nitrococcaceae |
0,00±0,00 |
0,04±0,17 |
1,41±4,41 |
0,59 |
<0,01 |
<0,01 |
|
Nanopelagicaceae |
0,02±0,08 |
0,50±0,95 |
0,01±0,03 |
<0,01 |
0,52 |
0,03 |
|
Helicobacteraceae |
0,00±0,00 |
0,03±0,12 |
0,42±1,83 |
0,51 |
0,01 |
0,04 |
|
Deinococcaceae |
0,13±0,64 |
0,28±0,88 |
0,18±0,37 |
0,17 |
0,02 |
0,32 |
|
Legionellaceae_A |
0,06±0,31 |
0,27±0,70 |
0,03±0,13 |
0,047 |
0,74 |
0,09 |
|
Gemmatimonadaceae |
0,07±0,41 |
0,18±0,47 |
0,12±0,56 |
0,04 |
0,80 |
0,07 |
|
Propionibacteriaceae |
0,05±0,18 |
0,02±0,08 |
0,14±0,28 |
0,98 |
0,01 |
0,01 |
|
Rhizobiaceae_A_499470 |
0,02±0,09 |
0,07±0,32 |
0,28±0,70 |
0,76 |
<0,01 |
<0,01 |
|
Listeriaceae |
0,00±0,00 |
0,06±0,25 |
0,10±0,26 |
0,30 |
0,04 |
0,27 |
|
Vibrionaceae |
0,00±0,00 |
0,00±0,00 |
0,12±0,27 |
1,00 |
<0,01 |
<0,01 |
|
Gaiellaceae |
0,00±0,00 |
0,21±0,52 |
0,04±0,18 |
0,03 |
0,33 |
0,23 |
|
Blastocatellaceae_430966 |
0,00±0,00 |
0,15±0,37 |
0,01±0,03 |
0,02 |
0,52 |
0,08 |
Примечания: для оценки различий между группами применяли тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини-Хохберга Notes: To assess differences between groups, the Kruskal-Wallis test was used, corrected for multiple comparisons using the Benjamini-Hochberg method
Таблица 4. Частоты встречаемости бактериальных таксонов в ткани яичка в группах сравнения
Table 4. Frequencies of occurrence of bacterial taxa in testicular tissue in comparison groups
|
Таксоны Taxa |
Относительная представленность таксонов микробиоты уретры, (М±SD) Relative representation of urethral microbiota taxa, (M±SD) |
Достоверность различий между группами, (р) Significance of differences between groups, (p) |
||||
|
Группа 1/ Group 1 (NОА) |
Группа 2/Group 2 (ОА) |
Группа 3/Group 3 (Var) |
NOA vs OA |
NOA vsVar |
OA vsVar |
|
|
Филы |
||||||
|
Actinobacteriota |
73,5/26,5 |
95,2/4,8 |
100,0/0,0 |
0,11 |
0,03 |
1,00 |
|
Firmicutes_A |
35,3/64,7 |
66,7/33,3 |
76,2/23,8 |
0,04 |
0,02 |
0,73 |
|
Fusobacteriota |
20,6/79,4 |
33,3/66,7 |
57,1/42,9 |
0,35 |
0,03 |
0,32 |
|
Deinococcota |
8,8/91,2 |
28,6/71,4 |
47,6/52,4 |
0,11 |
0,01 |
0,34 |
|
Семейства |
||||||
|
Mycobacteriaceae |
50,0/50,0 |
85,7/14,3 |
100,0/0,0 |
0,01 |
<0,01 |
0,23 |
|
Peptoniphilaceae |
38,2/61,8 |
81,0/19,0 |
90,5/9,5 |
<0,01 |
<0,01 |
0,66 |
|
Bacteroidaceae |
55,9/44,1 |
81,0/19,0 |
90,5/9,5 |
0,12 |
0,02 |
0,66 |
|
Streptococcaceae |
44,1/55,9 |
76,2/23,8 |
85,7/14,3 |
0,04 |
0,01 |
0,70 |
|
Lactobacillaceae |
41,2/58,8 |
76,2/23,8 |
85,7/14,3 |
0,02 |
0,01 |
0,70 |
|
Micrococcaceae |
44,1/55,9 |
71,4/28,6 |
95,2/4,8 |
0,09 |
<0,01 |
0,09 |
|
Lachnospiraceae |
47,1/52,9 |
57,1/42,9 |
90,5/9,5 |
0,58 |
<0,01 |
0,049 |
|
Aerococcaceae |
26,5/73,5 |
42,9/57,1 |
66,7/33,3 |
0,25 |
0,01 |
0,25 |
|
Veillonellaceae |
23,5/76,5 |
52,4/47,6 |
61,9/38,1 |
0,06 |
0,03 |
0,76 |
|
Moraxellaceae |
38,2/61,8 |
52,4/47,6 |
85,7/14,3 |
0,40 |
<0,01 |
0,06 |
|
Pseudomonadaceae |
29,4/70,6 |
42,9/57,1 |
95,2/4,8 |
0,39 |
<0,01 |
<0,01 |
|
Weeksellaceae |
29,4/70,6 |
66,7/33,3 |
85,7/14,3 |
0,02 |
<0,01 |
0,28 |
|
Neisseriaceae_563222 |
32,4/67,6 |
52,4/47,6 |
76,2/23,8 |
0,20 |
0,01 |
0,20 |
|
Porphyromonadaceae |
14,7/85,3 |
28,6/71,4 |
52,4/47,6 |
0,30 |
0,02 |
0,30 |
|
Acutalibacteraceae |
23,5/76,5 |
28,6/71,4 |
61,9/38,1 |
0,75 |
0,03 |
0,09 |
|
Ruminococcaceae |
26,5/73,5 |
33,3/66,7 |
61,9/38,1 |
0,76 |
0,04 |
0,18 |
|
Xanthomonadaceae_616009 |
29,4/70,6 |
42,9/57,1 |
76,2/23,8 |
0,39 |
<0,01 |
0,09 |
|
Pasteurellaceae |
5,9/94,1 |
23,8/76,2 |
47,6/52,4 |
0,14 |
<0,01 |
0,20 |
|
Sphingomonadaceae |
20,6/79,4 |
38,1/61,9 |
66,7/33,3 |
0,22 |
<0,01 |
0,18 |
|
Enterococcaceae |
2,9/97,1 |
4,8/95,2 |
33,3/66,7 |
1,00 |
0,01 |
0,07 |
|
Flavobacteriaceae |
20,6/79,4 |
42,9/57,1 |
57,1/42,9 |
0,19 |
0,03 |
0,54 |
|
Alcanivoracaceae |
2,9/97,1 |
14,3/85,7 |
47,6/52,4 |
0,15 |
<0,01 |
0,06 |
|
Sphingobacteriaceae |
2,9/97,1 |
14,3/85,7 |
47,6/52,4 |
0,15 |
<0,01 |
0,06 |
|
Beijerinckiaceae |
23,5/76,5 |
9,5/90,5 |
57,1/42,9 |
0,29 |
0,03 |
0,01 |
|
Bacillaceae_H_294103 |
8,8/91,2 |
4,8/95,2 |
47,6/52,4 |
1,00 |
0,01 |
0,01 |
|
c__Alphaproteobacteria |
17,6/82,4 |
28,6/71,4 |
57,1/42,9 |
0,50 |
0,01 |
0,18 |
|
Nitrococcaceae |
0,0/100,0 |
4,8/95,2 |
38,1/61,9 |
0,38 |
<0,01 |
0,03 |
|
Nanopelagicaceae |
5,9/94,1 |
38,1/61,9 |
14,3/85,7 |
0,01 |
0,36 |
0,24 |
|
Helicobacteraceae |
0,0/100,0 |
4,8/95,2 |
23,8/76,2 |
0,38 |
0,02 |
0,28 |
|
Deinococcaceae |
5,9/94,1 |
23,8/76,2 |
38,1/61,9 |
0,14 |
0,01 |
0,51 |
|
Propionibacteriaceae |
8,8/91,2 |
9,5/90,5 |
42,9/57,1 |
1,00 |
0,02 |
0,049 |
|
Rhizobiaceae_A_499470 |
5,9/94,1 |
9,5/90,5 |
52,4/47,6 |
0,63 |
<0,01 |
0,01 |
|
Vibrionaceae |
0,0/100,0 |
0,0/100,0 |
23,8/76,2 |
1,00 |
0,02 |
0,07 |
Примечания: для оценки различий между группами применяли тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини-Хохберга Notes: To assess differences between groups, the Kruskal-Wallis test was used, corrected for multiple comparisons using the Benjamini-Hochberg method семейства составляет >87%, тогда как у остальных 22 пациентов в данной группе выявляемость этого семейства равна нулю. В группе пациентов с ОА данный микроорганизм был выявлен только в одном образце. У пациентов с варикоцеле данное семейство не обнаружено.
Оценка качественного состава микробиоты яичка у пациентов 1 и 2 группы показала, что видовой состав микробиоты значительно отличается от такового у пациентов 3 группы, а группа 2 занимает промежуточное положение по видовому составу (табл. 4).
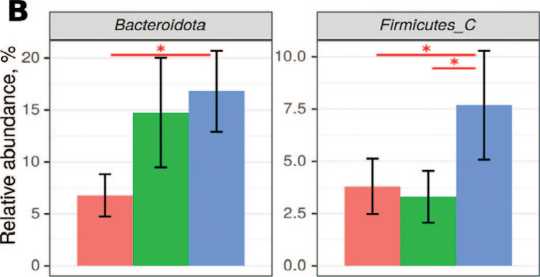
Бактериальные таксоны, которые обнаруживаются как в уретре, так и в ткани яичка
В результате анализа данных нами было выявлено 6 фил и 12 семейств бактерий общих для ткани яичка и для уретры. При сравнении частоты встречае- мости этих бактерий,были выявлены отличия в группах сравнения. В основном отличия характерны для группы NОА по сравнению с варикоцеле. ОА занимает промежуточное положение (рис. 5).
ОБСУЖДЕНИЕ
При сравнении микробиоты уретры в группах инфертильных пациентов с различными видами азооспермии с сопутствующим варикоцеле и без,можно отметить сходство 1 и 2 группы за счет обеднения микробного спектра, в отличие от пациентов 3 группы,где представлено более широкое разнообразие бактериальных таксонов. Следует отметить, что применение высокопроизводительных методов секвенирования ДНК следующего поколения позволило охарактеризовать микробиом мочевыводящих путей и привело к отказу от ранее установленной концепции
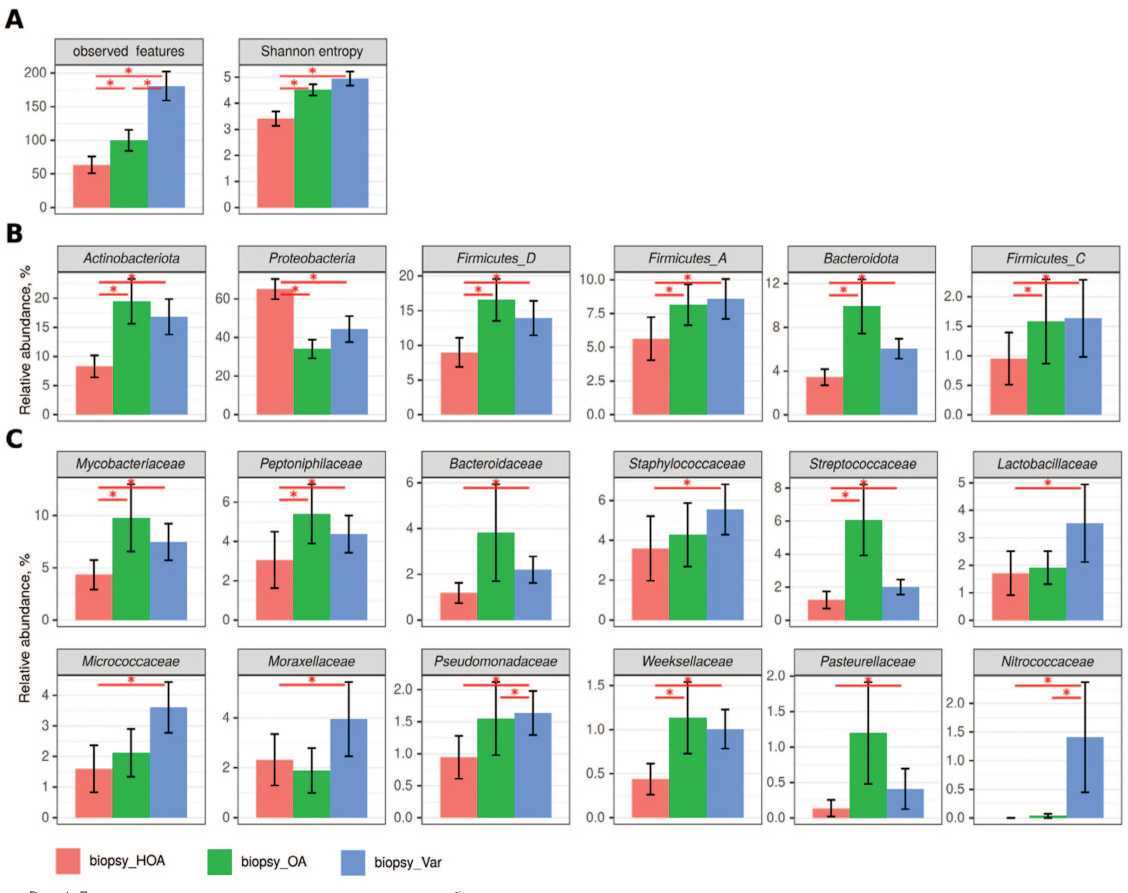
Рис. 4. Достоверные отличия таксономического состава микробиоты ткани яичка
Fig. 4. Significant differences in the taxonomic composition of testicular tissue microbiota
Примечания: А – разнообразие сообщества, В – филы, С – семейства. * - достоверность различий между группами p<0,05 (тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини Хохберга)
Notes: A – community diversity, B – phyla, C – families. * - significance of differences between groups p<0.05 (Kruskal-Wallis test adjusted for multiple comparisons by the Benjamini-Hochberg method)
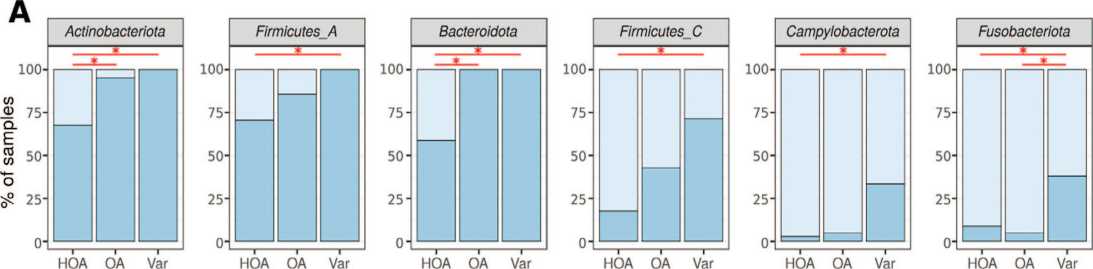
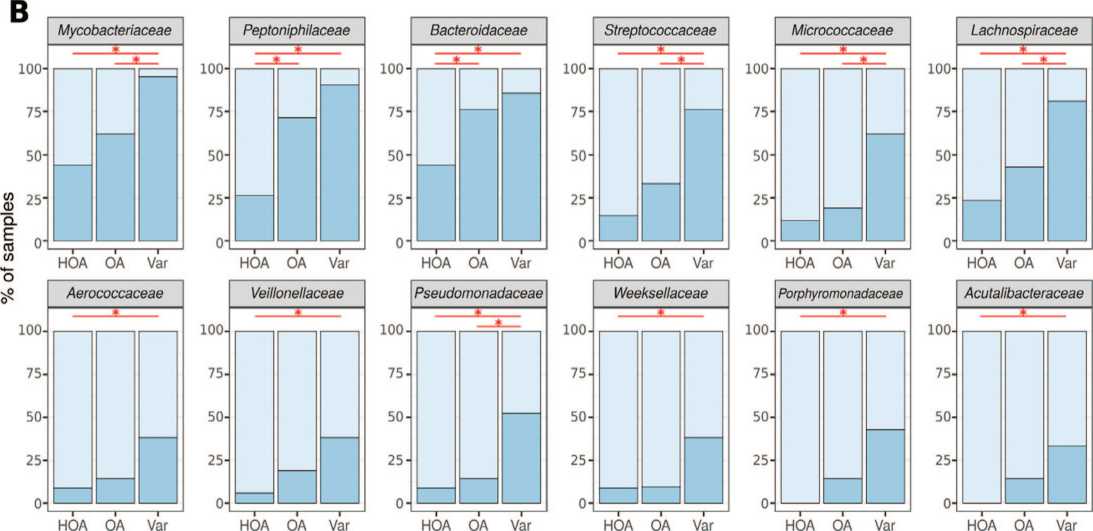
presence | absence
Рис. 5. Достоверно отличающиеся частоты встречаемости бактериальных таксонов, которые обнаруживаются и в уретре, и в яичке одновременно Fig. 5. Significantly different frequencies of occurrence of bacterial taxa, which are found in both the urethra and the testicle at the same time
Примечания: А – филы, В – семейства. *-p<0,05, точный критерий Фишера с поправкой на множественное сравнение методом Бенджамини-Хохберга Notes: A – phyla, B – families. *-p<0.05, Fisher's exact test adjusted for multiple comparisons by the Benjamini-Hochberg method стерильности,так же данный метод позволил идентифицировать состав комменсальных микробных сообществ в мочевыводящих путях и,непосредственно, в уретре.
Учитывая вариабельность микробиоты уретры мужчин, которая формируется на протяжении всей жизни под действием внешней среды,описывают широкий спектр уретральной микрофлоры,составляю-щий более 70 родов, среди которых могут быть выделены патогенные таксоны,способные снизить репродуктивный потенциал мужчины [13]. В свою очередь при сравнении частоты встречаемости микроорганизмов в 1и 2 группе обращает на себя внимание только фила Bacteroidota, которую трудно определить в 3 группе за счет широкого разнообразия видового спектра биотопов. Данная ситуация, на наш взгляд, объясняется нарушением целостностью гематотести-кулярного барьера (ГТБ) у пациентов 3 группы с нали- чием варикоцеле за счет таксономического разнообразия микробиоты полового партнера, которая способна вызвать дисбиоз. По данным R. Mändar и соавт., Streptococcus agalactiae и Gardnerella vaginalis, традиционно ассоциированные с бактериальным вагинозом у женщин, способны вызвать воспалительные реакции в ткани яичка [22]. Эта гипотеза не является патогномоничной в развитии инфертильности,так как микробиота уретры вариабельна и нестабильна за счет своих анатомических и физиологических особенностей,в отличие от микробиома яичка.
Следует отметить,что при сравнении в группах структуры микробиоты яичка наблюдается скудный микробный спектр по видовому разнообразию у пациентов с необструктивной азооспермией.Особое место занимает с семейство Enterobacteriaceae_A, так как данный биотоп не определен в нашем исследовании у пациентов в группе NОА и сопутствующим варикоцеле, и лишь в одном случае выявлен в группе обструктивной азооспермии.
Также следует учитывать, что впервые проведено исследование тестикулярного микробиома инфертиль-ных мужчин в Краснодарском крае. Опираясь на качественный состав микробиоты яичка у пациентов с NОА, пациентов с ОА и пациентов с варикоцеле можно с уверенностью заключить, что видовой состав микробиоты яичка значительно различается у пациентов с NОА и пациентов с варикоцеле, в то время как видовой состав микробиома тканей яичка у пациентов с ОА занимает промежуточную позицию имея общие микроорганизмы с каждой из приведенных выше групп.
ВЫВОДЫ
На основании проведенного исследования можно заключить,что микробиота уретры мужчин имеет широкий бактериальный спектр,который формируется на протяжении всей жизни,но имеет свои особенности у инфертильных мужчин за счет большего разнообразия бактериальных таксонов, фил и семейств, что, на наш взгляд, связано с нарушением работы ГТБ,в частности,у пациентов с варикоцеле,и требует дальнейших исследований. Структура микробиоты тестикулярной ткани имеет снижение видового разнообразия у пациентов с необструктивной азооспермией с доминирующим семейством Enterobacte-riaceae_A, в отличие от пациентов с обструктивной азооспермией и пациентов с NОА и сопутствующим варикоцеле. Сложившаяся ситуация и разночтения научных публикаций и экспертных мнений требует дальнейшего расширения спектра научных междисциплинарных поисков и исследований.
Список литературы Сравнительная характеристика тестикулярной и уретральной микробиоты у пациентов с различными видами азооспермии и сопутствующим варикоцеле
- Assidi M. Infertility in men: advances towards a comprehensive and integrative strategy for precision theranostics. Cells 2022;11(10):1711. https://doi.org/10.3390/cells11101711.
- World Health Organization. WHO Manual for the Standardised Investigation and Diagnosis of the Infertile Couple. 2000. URL: https://www.who.int/publications/i/item/9780521774741.
- Кульченко Н.Г., Мяндина Г.И., Альхеджой Х. Клинический опыт выявления полиморфизма гена SEPS1 при мужском бесплодии. Трудный пациент 2018;(6):65-6. [Kulchenko N.G., Myandina G.I., Alkhedjoy H. Clinical experience of detecting polymorphism in the seps1 gene in a male patient with infertility. Trudnyy patsiyent = Difficult Patient 2018;(6):65-6. (In Russian)]. URL: https://cyberleninka.ru/article/n/klinicheskiy-opyt-vyyavleniya-polimorfizmagena-seps1-pri-muzhskom-besplodii.
- Starc A, Trampuš M, Pavan Jukić D, Rotim C, Jukić T, Polona Mivšek A. Infertility and sexual dysfunctions: a systematic literature review. Acta Clin Croat 2019;58(3):508-15. https://doi.org/10.20471/acc.2019.58.03.15.
- Knez J, Vlaisavljević V. Ženska neplodnost. In: Takač I, Geršak K, eds. Ginekologija in perinatologija. 1st edn. Maribor: Medicinska fakulteta 2016;170-9. (In Slovene).
- Raheem A, Ralph D. Male infertility: causes and investigations. Trends Urol Men’s Health 2011;2(5):8-11. http://doi.org./10.1002/tre.216.
- Villegas J, Schulz M, Soto L, Sanchez R. Bacteria induce expression of apoptosis in human spermatozoa. Apoptosis 2005;10(1):105-10. https://doi.org/10.1007/s10495-005-6065-8.
- Kaur S, Prabha V. Receptor mediated amelioration of the detrimental effects of sperm agglutinating factor on sperm parameters. Andrology 2013;1(4):624-31. https://doi.org/10.1111/j.2047-2927.2013.00088.x.
- Núñez-Calonge R, Caballero P, Redondo C, Baquero F, Martínez-Ferrer M, Meseguer MA. Ureaplasma urealyticum reduces motility and induces membrane alterations in human spermatozoa. Hum Reprod 1998;13(10):2756-61. https://doi.org/10.1093/humrep/13.10.2756.
- Boguen R, Treulen F, Uribe P, Villegas JV. Ability of Escherichia coli to produce hemolysis leads to a greater pathogenic effect on human sperm. Fertil Steril 2015;103(5):1155-61. https://doi.org/10.1016/j.fertnstert.2015.01.044.
- Maps, Geo-Q. The effect of Ureaplasma urealyticum on the level of P34H expression, the activity of hyaluronidase, and DNA fragmentation in human spermatozoa. Am J Reprod Immunol 2017;77(1):e12600.
- Clarridge JE 3rd. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clin Microbiol Rev 2004;17(4):840-62. https://doi.org/10.1128/CMR.17.4.840-862.2004.
- Van Der Pol, Nelson DE. Microbial Communities of the Male in editors David H. Persing, Fred C. Tenover, Randall T. Hayden, Margareta Ieven, Melissa B. Miller, Frederick S. Nolte, Yi-Wei Tang, Alex van Belkum Molecular Microbiology: Diagnostic Principles and Practice, Third Edition. https://doi.org/10.1128/9781555819071.ch13.
- Alfano M, Ferrarese R, Locatelli I, Ventimiglia E, Ippolito S, Gallina P, et al. Testicular microbiome in azoospermic men-first evidence of the impact of an altered microenvironment. Hum Reprod 2018;33(7):1212-7. https://doi.org/10.1093/humrep/dey116.
- Farahani L, Tharakan T, Yap T, Ramsay JW, Jayasena CN, Minhas S. The semen microbiome and its impact on sperm function and male fertility: A systematic review and meta-analysis. Andrology 2021;9(1):115-44. https://doi.org/10.1111/andr.12886.
- Кадыров З.А., Степанов В.С., Алдыраков Э.М., Мошеинашвили Ш.Г. Микробиота органов урогенитальной системы. Урология 2021;6:136–40. [Kadyrov Z.A., Stepanov V.S., Aldyrakov E.M., Mosheinashvili Sh.G. Microbiota of the urogenital system. Urologiya = Urologiia 2021;6:136–40. (In Russian)]. https://dx.doi.org/10.18565/urology.2021.6.136-140
- Осипов Г.А., Родионов Г.Г. Микроэкология человека в норме и патологии по данным масс-спектрометрии микробных маркеров. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях 2013;(2):43–53. [Osipov G.A., Rodionov G.G. Microenvironment in human health and disease by mass spectrometry of microbial markers. Mediko-biologicheskie i sotsialnopsikhologicheskie problemy bezopasnosti v chrezvychainykh situatsiyakh = MedicоBiological and Socio-Psychological Problems of Safety in Emergency Situations 2013;(2):43–53. (In Russian)].
- Рахматулина М.Н., Болдырева М.Н., Липова Е.В., Чекмарев А.С., Галкина И.С. Оценка состава микробиоты мочеиспускательного канала у мужчин с инфекциями, передающимися половым путем. Урология 2019;(6):31–7. [Rakhmatulina M.R., Boldyreva M.N., Lipova E.V., Chekmarev A.S., Galkina I.S. Evaluation of the composition of the microbiota of the urethra in men with sexually transmitted infections. Urologiya = Urologiia 2019;(6):31–37. (In Russian)].
- Fraczek M, Hryhorowicz M, Gill K, Zarzycka M, Gaczarzewicz D, Jedrzejczak P, et al. The effect of bacteriospermia and leukocytospermia on conventional and nonconventional semen parameters in healthy young normozoospermic males. J Reprod Immunol 2016;118:18-27. https://doi.org/10.1016/j.jri.2016.08.006.
- Rybar R, Prinosilova P, Kopecka V, Hlavicova J, Veznik Z, Zajicova A, Rubes J. The effect of bacterial contamination of semen on sperm chromatin integrity and standard semen parameters in men from infertile couples. Andrologia 2012;44 Suppl 1:410-8. https://doi.org/10.1111/j.1439-0272.2011.01198.x.
- Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999;14(1):131–135. https://doi.org/10.1093/humrep/14.1.131.
- Фаниев М.В., Кадыров З.А., Гудков Г.В., Крутенко Д.В., Прокопьев Я.В., Водолажский Д.И. Способ малоинвазивного выделения бактериальной ДНК из биоптата тестикулярной ткани у инфертильных мужчин. Патент Российской Федерации 2 810 467. URL: https://www.fips.ru/iiss/document.xhtml?faces-redirect=true&id=7b8c6d8dcec562974c0a370b0eb52ac1.


