Сравнительная клинико-морфологическая оценка результатов хирургического лечения ИБС у больных сахарным диабетом типа 2 и у пациентов без нарушений углеводного обмена
Автор: Ахмедов Ш.Д., Мотрева А.П., Роговская Ю.В., Кошельская О.А., Шипулин В.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.22, 2007 года.
Бесплатный доступ
Проведено клинико-морфологическое сравнение результатов шунтирования коронарных артерий у 30 пациентов ишемической болезнью сердца в сочетании с сахарным диабетом типа 2 и 30 человек без нарушений углеводного обмена, подвергшихся операции АКШ. По данным морфологического исследования биопсийного материала миокарда левого желудочка, получено, что у пациентов СД более выражена и чаще встречается эндотелиальная дисфункция, гиперхромия ядер, уменьшение количества функционирующих капилляров и экспрессии рецепторов к инсулину через 6-12 месяцев после АКШ. Таким образом, получены морфофункциональные признаки изменений в миокарде, на основании которых возможно осуществлять прогноз течения атеросклероза и функционирования аортокоронарных кондуитов у больных с сахарным диабетом типа 2.
Сахарный диабет 2-го типа, аортокоронарное шунтирование, кондуиты, микроциркуляторное русло, инсулиновые рецепторы
Короткий адрес: https://sciup.org/14918748
IDR: 14918748 | УДК: 616.132.2-004.6-06:616.379-008.64]-089.86
Текст научной статьи Сравнительная клинико-морфологическая оценка результатов хирургического лечения ИБС у больных сахарным диабетом типа 2 и у пациентов без нарушений углеводного обмена
Сахарный диабет является независимым фактором риска сердечно-сосудистой заболеваемости и смертности [1]. В сравнении с общей популяцией, смертность от сердечно-сосудистых заболеваний среди диабетических пациентов возрастает в 2 раза у мужчин и в 4 раза – у женщин [1]. Известно, что диабет значительно ухудшает прогноз больных с инфарктом миокарда [2] и острым коронарным синдромом [3]. Во многих исследованиях показано, что сахарный диабет 34
представляет собой фактор риска неблагоприятных исходов эндоваскулярных вмешательств и коронарного шунтирования [4,5,6,7]. Несмотря на важность проблемы, многие аспекты хирургического лечения ИБС у больных сахарным диабетом остаются недостаточно изученными. В доступной литературе отсутствуют исследования, посвященные оценке функциональности коронарных шунтов и морфологии миокарда у больных сахарным диабетом 2-го типа.
Цель исследования – сравнительная клиникоморфологическая оценка результатов операции аортокоронарного шунтирования (через 6-12 месяцев) у больных ИБС, ассоциированной с сахарным диабетом, и у пациентов без нарушений углеводного обмена.
МАТЕРИАЛ И МЕТОДЫ
В проспективное исследование включены 60 больных с ИБС на фоне стенозирующего атеросклероза коронарных артерий (мужчин – 50 человек, женщин – 10 человек), которым выполнялась операция АКШ. Все пациенты были разделены на две группы: 30 пациентов с сахарным диабетом 2-го типа (группа I) и 30 пациентов без нарушений углеводного обмена (группа II). В табл. 1 представлена клиническая характеристика групп до операции коронарного шунтирования. Из нее видно, что исследуемые группы не отличались по возрасту, полу, продолжительности ИБС, доли больных, перенесших инфаркт миокарда, наличия гипертонической болезни. Липидснижающую терапию до оперативного лечения получали только 8 (26%) пациентов группы I и 10 (34%) больных группы II. В соответствии с современными рекомендациями ведения больных ИБС в сочетании с сахарным диабетом всем пациентам, подвергнутым хирургическому лечению, были назначены статины (вазилип, крестор). Индекс шунтируемых артерий составил 3,0 в группе I и 2,7 – в группе II (p=0,04).
По результатам первичной коронаровентрикулогра-фии (КВГ) поражение трех и более магистральных коронарных артерий имело место у всех 30 больных сахарным диабетом и у 24 (80%) больных контрольной группы (p=0,04). Стеноз ствола левой коронарной артерии (изолированный и в сочетании с трехсосудистым поражением) выявлен только в основной группе – у 3 (10%) пациентов. Операция коронарного шунтирования проводилась в условиях искусственного кровообращения и фармакохолодовой кардиоплегии. Во время операции коронарного шунтирования в исследуемых группах применялось сочетание венозных шунтов и кондуитов из левой внутренней грудной артерии (табл. 2).
Для изучения морфологических и иммуногистохимических особенностей миокарда левого желудочка
Таблица 2
Виды кондуитов, применяемых во время операции в основной и контрольной группах
|
Типы кондуитов |
Группа I (n=30) |
Группа II (n=30) |
|
Вена+ВГА |
23 (76%) |
21 (70%) |
|
Вена+ВГА+ЛА |
6 (21%) |
7 (24%) |
|
ВГА+ЛА |
0 |
1 |
|
ВГА+ВГА |
1 (3%) |
1 (3%) |
ВГА- внутренняя грудная артерия, ЛА- радиальная артерия.
(ЛЖ) у всех пациентов основной и контрольной групп во время основного этапа операции и во время контрольных шунтографий (через 6-12 месяцев) выполнялась биопсия миокарда ЛЖ. На унифицированном анализаторе изображения, состоящего из микроскопа Micros “MC 300” (Австрия), увеличением х 400 и персонального компьютера “Pentium-4” при оптическом увеличении оценивались следующие морфологические параметры: размеры ядер кардиомиоцитов, пролиферация и слущи-
Таблица 1
Клиническая характеристика больных основной и контрольной групп, включенных в исследование
|
Показатели |
Группа I (n=30) |
Группа II (n=30) |
|
|
Возраст, годы |
54±7,1 |
52±9,6 |
|
|
Пол (м /ж) |
23(76%) / 7 (24%) |
24 (80 %) / 6 (20%) |
|
|
Длительность СД 2-го типа, годы |
8,7±5,4 |
- |
|
|
Продолжительность ИБС, годы |
6,8± 4,3 |
5,9±3,8 |
|
|
Глюкоза крови ммоль/л |
8,3±2,6 |
4,6±1,04 |
|
|
Число больных, перенесших инфаркт миокарда |
22 (74%) |
25 (84%) |
|
|
Функциональный класс стенокардии (%), число больных |
II ФК |
8 (26%) |
9 (30%) |
|
III ФК |
18 (60%) |
17 (56 %) |
|
|
IV ФК |
4 (14%) |
4 (14 %) |
|
|
Гипертоническая болезнь |
28 (93,3 %) |
27 (90 %) |
|
|
ОХС, ммоль/л |
5,8±1,15 |
5,76±1,17 |
|
|
ТГ, ммоль/л |
2,56±0,09 |
2,3±0,86 |
|
|
ЛПНП, ммоль/л |
3,64±1,3 |
3,59±1,1 |
|
|
ЛПВП, ммоль/л |
0,98±1,78 |
1,11±1,1 |
|
|
Индекс атерогенности, ммоль/л |
3,86±1,43 |
3,23±0,89 |
|
|
Доля больных, получающих статины |
8 (26%) |
10 (34%) |
|
|
Сахароснижающая терапия:
сахароснижающие препараты |
9 (30%) 21 (70%) |
-- |
|
вание эндотелия сосудов, выраженность липофусциноза и вакуолизации цитоплазмы кардиомиоцитов.
При оптическом увеличении х 1000 проводился подсчет открытых и закрытых капилляров в миокарде ЛЖ и полуколичественные показатели экспрессии инсулиновых рецепторов. Для полуко-личественной оценки экспрессии рецепторов к инсулину применяли иммуногистохимическое исследование с использованием реактивов фирмы “Daco–cytomation”. Оценка экспрессии рецепторов к инсулину проводилась по 4-балльной системе: 1 балл – очень мало, 2 балла – мало, 3 балла – умеренное количество, 4 балла – много.
Статистическая обработка результатов проведена с использованием пакета STATISTICA 6.0 for Windows. Применены t-тест для зависимых и независимых величин, корреляционный анализ Спирмана. Статистически значимыми результаты считались при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Через 6-12 месяцев после проведения операции коронарного шунтирования рецидив стенокардии напряжения отмечался у 60% пациен-
тов с сахарным диабетом, в то время как в контрольной группе – у 25% больных (p=0,03). Инфаркт миокарда после операции АКШ в сроке до 1 года регистрировался у 10% больных сахарным диабетом, тогда как у больных без нарушений углеводного обмена – в 2% случаях (p=0,02). Это согласуется с данными других исследователей, свидетельствующих, что у больных с диабетом более часто отмечается возобновление стенокардии, возникновение инфаркта миокарда, проведение повторного коронарного шунтирования [11] .
При анализе данных контрольных коронарошун-тографий мы выяснили, что дополнительные стенозы ранее неизмененных коронарных артерий имели место у 25% больных диабетом и в 13% случаев у пациентов без нарушения углеводного обмена (p=0,04). Кроме того, в группе больных сахарным диабетом не функционировало 13% кондуитов, в то время как в
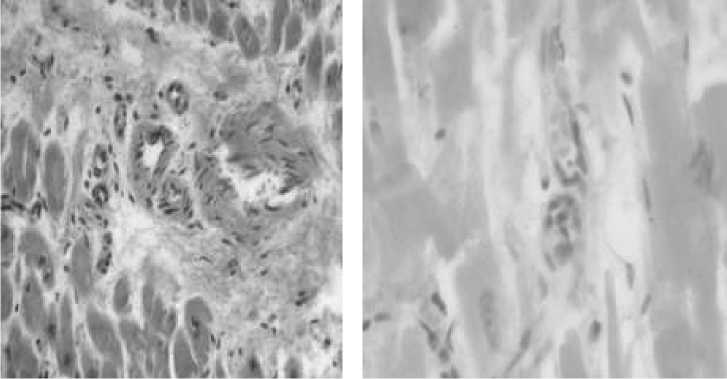
Рис. 1. Морфологическая картина миокарда ЛЖ у пациентов ИБС, ассоциированной с сахарным диабетом: а) слущивание эндотелия. б) пролиферация эндотелия (увеличение х 400, окраска гематоксилином и эозином)
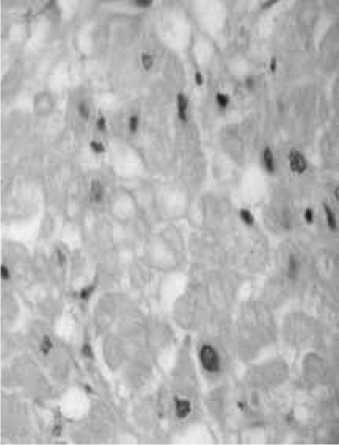
Рис. 2. Морфологическая картина миокарда ЛЖ у больных ИБС, ассоциированной с сахарным диабетом: а) Гиперхромия ядер б) Липофусциноз в) Вакуолизация ( увеличение х 400, окраска гематоксилином и эозином)
контрольной группе не функционировало менее 5% шунтов (p=0,03). Мнение о том, что сахарный диабет способствует ускоренному развитию атеросклероза, подтверждается большим количеством клинических и патологоанатомических исследований [19]. В частности, в исследовании V.H. Thorani et al (1999) показано , что количество рестенозов коронарных шунтов при сахарном диабете в среднем на 30% выше, чем у пациентов без диабета [12].
Неблагоприятный прогноз течения ИБС у больных с диабетом, обусловлен не только быстрым прогрессированием атеросклероза, но и повреждением сосудов микроциркуляторного русла. Известно, что даже при нестенозирующем атеросклерозе коронарных артерий у пациентов с сахарным диабетом имеют место выраженные изменения в системе микроциркуляции, приводящие к апоптозу кардиомиоцитов [16]. При изучении особенностей морфологии миокарда ЛЖ до операции коронарного шунтирования, мы получили, что более чем у 70% больных сахарным диабетом наблюдалась умеренная и выраженная пролиферация эндотелия, а у пациентов контрольной группы она отсутствовала (p=0,04). Слущивание эндотелия имело место у половины больных основной группы и у 35% пациентов контрольной группы (p=0,03), рис.1. Эти изменения эндотелия характеризуют наличие эндотелиальной дисфункции, однако ее биохимическая основа все еще окончательно не установлена. Как известно, развитие ЭД, в целом, может быть обусловлено снижением синтеза оксида азота, повреждением механизмов его освобождения, нарушением диффузии или повышенным разрушением оксида азота в сосудистой стенке, а также комбинацией этих факторов. Предполагается, что ЭД развивается под влиянием целого ряда факторов, среди которых выделяются метаболические, гуморальные и гемодинамические [13,14,15].
В биоптатах больных группы I статистически значимо чаще, чем у пациентов группы II в исходном состоянии встречалась гиперхромия ядер кардиомиоцитов (p=0,03), что, с одной стороны, свидетельствует о наличии компенсаторной гипертрофии одной части кардиомиоцитов в ответ на атрофию и апоптотическую гибель другой части [16], с другой стороны, отражает нарушения синтетических процессов в клетках [16] (рис 2). При изучении состояния цитоплазмы кардиомиоцитов на светооптическом уровне мы отметили более выраженную вакуолизацию цитоплазмы кардиомиоцитов у пациентов с диабетом до хирургического лечения (p=0,04), что с учетом литературных данных [16], было расценено нами как признак повреждения саркоплазматической сети (рис 2).
Известно, что саркоплазматическая сеть является структурным элементом сопряжения возбуждения-сокращения. Увеличение содержания вакуолей в цитоплазме кардиомиоцитов при сахарном диабете 2-го типа можно рассматривать как компенсаторно-приспособительную реакцию канальцев саркоплазматической сети на гипертрофию, поскольку при увеличении размеров клетки проведение по саркоплазматической сети и миофибриллам затруднено [16,17]. Через 1 год после операции АКШ у пациентов с диабетом также наблюдалась статистически значимо выраженная пролиферация (p=0,03), слущивание (p=0,04) эндотелия, вакуолизация цитоплазмы кардиомиоцитов и наличие большего количества гиперхромных ядер(p=0,04) в сравнении с пациентами без нарушений углеводного обмена, мы расценили это как дальнейшее влияние СД на изменения в морфологии миокарда.
Во многих литературных источниках показано, что атеросклероз у больных диабетом протекает тяжелее, чем у больных без нарушений углеводного обмена, сведения о наличии связи между клиническими особенностями диабета и выраженностью атеросклероза противоречивы [18]. Одни авторы находят зависимость выраженности поражения микроциркулятор-ного русла от особенностей клинического течения и длительности сахарного диабета [16], другие – нет [18]. Известно, что именно микроангиопатия играет ведущую роль в развитии миокардиальной дисфункции у пациентов с диабетом [16]. Учитывая эти данные, мы изучили динамику количества капилляров на единицу площади в основной и контрольной группах.
Как оказалось, после операции АКШ у больных СД количество нефункционирующих капилляров на единицу площади увеличилось с 46% до 66% (p=0,03), тогда как у пациентов без нарушений углеводного обмена статистически значимого увеличения количества нефункционирующих капилляров не наблюдалось (с 38 % до 40%). Интересно было выяснить, существует ли связь между изменениями микро- и макроциркуляции в группах. В ходе корреляционного анализа мы получили, что в основной группе количество нефункционирующих капилляров исходно имело прямую связь со степенью выраженности стенозов коронарных артерий (n=30, R=0,80; p=0,04) до АКШ и количеством дополнительных стенозов в коронарных артериях после операции (n=30, R=0,80, p=0,04). В контрольной группе таких связей не прослеживалось. Это свидетельствует о том, что у пациентов с нарушением углеводного обмена имеет место большее количество нефункционирующих капилляров, которое взаимосвязано со степенью выраженности стенозирующего атеросклероза коронарных артерий, все это говорит о том, что у этих больных скорость прогрессирования атеросклероза выше, чем у пациентов без нарушения углеводного обмена. Этот результат является закономерным, поскольку хорошо известно, что атеросклеротический процесс в сосудах при диабете 2-го типа затрагивает в большей степени микроциркуляторное русло и уменьшение количества функционирующих капилляров отражает характер гипоксических нарушений в кардиомиоцитах [16].
При полуколичественной оценке инсулиновых рецепторов в миокарде ЛЖ у больных сахарным диабетом в исходном состоянии определялось статистически значимо меньшее их содержание, в сравнении с контрольной группой . При индивидуальном анализе экспрессии инсулиновых рецепторов мы получили, что среди больных диабетом у 18 человек количество рецепторов к инсулину не изменилось, а у 9 пациентов наблюдалось дальнейшее уменьшение рецепторов, и только у трех диабетических пациентов наблюдалось увеличение количество рецепторов после операции. В то время как у пациентов без нарушения углеводного обмена у 22 пациентов не наблюдалось изменений в количестве рецепторов, у 6 человек происходило их увеличение по сравнению с исходными показателями, и только в 2 случаях происходило снижение количества рецепторов после коронарного шунтирования. Наши данные показали, что одной из причин более быстрого прогрессирования атеросклероза в коронарных артериях после аортокоронарного шунтирования у больных СД может быть усиление степени инсули-норезистентности за счет уменьшения экспрессии к инсулиновым рецепторам.
Учитывая, что у пациентов с СД наблюдаются более выраженные нарушения микроциркуляторного русла, липидного состава крови, им были рекомендованы статины после операции АКШ. При статистическом анализе исследуемых групп мы получили, что существует связь между количеством открытых капилляров и приемом статинов в группе с СД после операции.
Таким образом, после операции АКШ у пациентов с сахарным диабетом типа 2 в сравнении с больными без нарушения углеводного обмена наблюдается более частое возобновление стенокардии и развитие повторных инфарктов миокарда. Наибольшее количество нефункционирующих аортокоронарных кондуитов в проспективном наблюдении у больных с СД свидетельствует о быстром прогрессировании атеросклероза, который затрагивает и микроциркуляторное русло, и функционирование инсулиновых рецепторов.
Список литературы Сравнительная клинико-морфологическая оценка результатов хирургического лечения ИБС у больных сахарным диабетом типа 2 и у пациентов без нарушений углеводного обмена
- Kannel W.B., McGee D.L. Diabetes and cardiovascular disease: the Framingham Study. JAMA 1979; 241: 2035-2038.
- GISSI-2 Investigators, Zuanetti G., Latini R., Maggioni A.P. et al. Influence of diabetes on mortality in acute myocardial infarction: data from GISSI-2 study. J Am Coll Cardiol 1993; 22: 1788-1794.
- McGuire D.K., Emanuelsson H., Granger C.B. Influence of diabetes mellitus on clinical outcomes across the spectrum of acute coronary syndromes. Findings from the GUSTO-llb Study. Eur Heart J 2000; 21: 1750-1758).
- Morris J.J., Smith L.R., Jones R.H., et al. Influence of diabetes and mammary artery grafting on survival after coronary bypass. Circulation 1991; 84 Suppl 3: III: 275-284.
- BARI Investigators, Influence of diabetes on 5-year mortality and morbidity in a randomized trial comparing CABG and PTCA in patients with multivessel disease. The Bypass Angioplasty Revascularization Investigation (BARI) Circulation 1997, 96: 1761 -1769.
- Kuntz R.E. Importance of considering atherosclerosis progression when choosing a coronary revascularization strategy. The diabetes-percutaneous transluminal coronary angioplasty dilemma. Circulation 1999, 99: 847-851.
- Lau K.W., Ding I.P., Johan A. et al. Midterm angiographic outcome of single-vessel intracoronary stent placement in diabetic versus nondiabetic patients: a matched comparative study. Am Heart J 1998; 136: 150-155).
- Stein B., Weintraub W.S., Gebhart S.S.P. et al. Influence of diabetes mellitus on early and late outcome after percutaneous transluminal coronary angioplasty. Circulation 1995; 91: 979-989.
- Kornowski R., Mintz G.S., Kent K.M. et al. Increased restenosis in diabetes mellitus after coronary interventions is due to exaggerated intimal hyperplasia. A serial intravascular ultrasound study. Circulation 1997;95:1366-1369.
- Otsuka Y., Myazaki S., Okumura H. et al. Abnormal glucose tolerance, not small vessel diameter, is a determinant of longterm prognosis in patients treated with balloon coronary angioplasty. Eur Heart J 2000; 21: 1790-1796.
- Holmes D.R., Vlietstra R.E, Smith H.C. et.al Restenosis after percutaneous transluminal coronary angioplasty.Am.J.Cardiol.1984. -Vol. 53. -P. 77 C-81 C.
- Thourani V.H.Weintraub W.S. Stein B et.al. Influence of Diabetes Mellitus on Early and Late Outcome after Coronary Artery Bypass Graftimg. Ann. Thorac Surg 1999: 67: 1045-1052.
- Shiraishi A, Simpson D.G, Carver W.et.al. Vinculin is an essential component for nofmal myofibrillar arrangement in fetal mouse cardiac myocytes. J. Moll Cell Cardiol 1997; 29; 2041-2052.
- Cohen R.A. Endothelial dysfunchion in diabetic vascular disease. Medicographia 1997; 55: 131-153.
- Stehouwer C.B. Lambert J. Don Ker. A.J.M. et al. Endothelial dysfunction and pathogenesis of diabetic angiopathy. Cardiovase Rec 1997; 34; 55-68.
- Е.И.Соколов. Диабетическое сердце. Москва, "Медици-на" 2002.
- De Fronzo R.A., Ferranini E. Insulin resistance: A multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia and atherosclerotic cardiovascular disease. Diabetes Care 1991; 14; 173-194.
- Stolar M.W. Atherosclerosis in diabetes: the role of hyperinsulinemia. Metabolism 1988; 37(suppl): 1-9.
- Reiter S.J, Rumberger J.A et.al. Precision of measurements of right and left ventricular volum by cine computed tomography.Circulation 1986; 8: 361-74.
- Polonsky K.S., Stuns J., Bell G.I. Non-insulin-dependent diabetes mellitus -a genetically programmed failure of the beta cell to compensate for insulin resistance. N. Engl J Med 1996; 334: 777-83.


