Сравнительная макроскопическая характеристика почек крыс при различных способах фиксации
Автор: Смирнов А.В., Гуров Д.Ю., Гучигова Э.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Морфология
Статья в выпуске: 3 (51), 2016 года.
Бесплатный доступ
Представлены результаты качественного и количественного анализа данных, полученных при проведении макроскопического исследования почек крыс при различных способах фиксации. Проведена сравнительная характеристика ряда морфологических параметров почек крыс под воздействием различных сроков экспозиции в фиксирующих растворах, используемых при изготовлении макропрепаратов.
Макропрепарат, формалин, глиоксаль, бальзамирование органов
Короткий адрес: https://sciup.org/142149189
IDR: 142149189 | УДК: 616-091.7
Текст научной статьи Сравнительная макроскопическая характеристика почек крыс при различных способах фиксации
Изучение макропрепаратов является неотъемлемой частью обучения студентов и слушателей медицинских, фармацевтических, биологических и сельскохозяйственных вузов на морфологических дисциплинах согласно рабочим программам в соответствие с ФГОС 3. Фиксирующий раствор, применяемый при консервации макропрепаратов и бальзамировании, должен отвечать ряду условий [4].
Во-первых, это обеспечение безопасности обучающихся при осуществлении образовательной деятельности. Согласно федеральному закону РФ «Об образовании в Российской Федерации» (№ 273-ФЗ от 29.12.2012, ст. 41, п. 8), «охрана безопасности обучающихся включает в себя: … 8) обеспечение безопасности обучающихся во время пребывания в организации, осуществляющей образовательную деятельность» [11].
Во-вторых, это сохранение прижизненных визуальных характеристик тканей макропрепарата, поскольку вскоре после наступления биологической смерти или удаления органов из организма появляются посмертные изменения [8]. Фиксатор необходим для предотвращения аутолиза и сохранения материала в нативном виде с целью последующего изучения [5].
Кроме того, при выборе фиксатора или бальзамирующего раствора желательно учитывать экономический аспект, т. е. оптимальное соотношение цены раствора с его низкой токсичностью и способностью вызывать минимальные макроскопические изменения в тканях при длительном хранении объектов [7].
Наиболее часто для сохранения макропрепаратов используются растворы на основе формалина [7], который относится ко 2-му классу опасности по ГОСТ 12.1.1007 – высокоопасные вещества.
В продаже в Российской Федерации имеется фиксирующая смесь «Альдофикс» на основе глиоксаля, отечественного производства, не содержащая формальдегида и относящаяся к 4-му классу опасности (вещества малоопасные), т. е. более безвредная в применении [10].
Однако информации о результатах влияния глиоксаля на морфологические параметры органов и тканей в процессе изготовления макропрепаратов при различных сроках фиксации и сравнительной характеристики макропрепаратов, изготовленных с применением других фиксаторов на основе формалина, в доступной научной литературе нами не обнаружено.
ЦЕЛЬ РАБОТЫ
Сопоставление результатов качественного и количественного макроскопического исследования почек крыс при различных способах и длительности фиксации.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследования были проведены на 12 образцах почек белых крыс линии Wistar [2, 9]. В качестве фиксирующего раствора были использованы смеси на основе нейтрального за-буференного формалина (Ф) и глиоксаля (А) (коммерческое название «Альдофикс»).
Почки продольным разрезом разделяли на 2 половины и проводили измерения поперечного и продольного диаметров. 6 образцов (1-я группа) были помещены в раствор 10 % формалина; 6 образцов (2-я группа) были помещены в раствор «Альдофикса», представляющего собой раствор глиоксаля (альдегида муравьиной кислоты).
Через 1, 3 и 10 суток образцы извлекали, исследовали их качественные (форму, характер поверхности и разреза, определяли изменение цвета и консистенции), количественные (измеряли продольный и поперечный диаметры почек) характеристики, производили фотосъёмку исследуемого биоматериала с заранее определённой освещенностью рабочего места с использованием фотоаппарата Nikon D3000 kit.
Затем образец помещали в марлевый мешочек, который в дальнейшем маркировали цветной нитью и погружали в соответствующий фиксатор.
Через трое суток была произведена перезаливка растворов. Образцы 1-й группы помещали в раствор, состоящий из 50 мл 10 % формалина, 25 мл 96 ° этилового спирта и 25 мл проточной воды.
Образцы 2-й группы помещали в раствор, состоящий из 50 мл альдофикса, 25 мл 96 ° этилового спирта, 25 мл проточной воды.
Полученные в ходе фотосъёмок изображения макропрепаратов открывали в программе Adobe Photoshop CS5, содержащей таблицу цветовой гаммы HSL [1, 3].
На цифровых фотографиях почек, выполненных через 1, 3 и 10 суток фиксации, определяли цифровые значения насыщенности в 6 различных участках, заносили данные в таблицу, проводили статистическую обработку с построением графика.
Полученные количественные данные были подвергнуты статистической обработке с использованием U-критерий Манна–Уитни [6].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При качественном изучении макропрепаратов почек крыс отмечалось прогрессивное изменение цвета поверхности и среза органа с приобретением серого оттенка. При этом более выраженные изменения были выявлены при фиксации альдофиксом уже после первых суток (рис. 1).
Таблица HSL представлена показателями: H – оттенок, S – насыщенность и L – свет.
Значения оттенка «H» повышались тем больше, чем больше обесцвечивались (серели) почки после воздействия на них фиксирующей смеси.
Свет «L» имел фиксированный показатель (L = 14), что достигалось путём сохранения одинаковых условий освещённости рабочего места при каждой фотосъёмке.
В данной методике мы пренебрегли значением насыщенности (S).
При проведении анализа с использованием таблицы цветовой гаммы, выявили, что на 1-е сутки оттенок почки, не подвергшейся влиянию фиксаторов, имел H = 5 [ДИ 3,7; 6,3] усл. ед. На 3-и сутки органы, фиксированные в растворе на основе глиоксаля, имели H = 42 [ДИ 41,07; 42,93] усл. ед., в растворе на основе формалина H = 31 [ДИ 29,7; 32,3] усл. ед. На 10-е сутки у почек, находившихся в глиоксале H = 50 [ДИ 47,7; 52,3] усл. ед., в формалине H = 40 [ДИ 38,8; 41,2] усл. ед.
Следовательно, значение показателя оттенка (H) у почек из формалина на 10-е сутки ниже на 20 %, по сравнению с показателем H почек из смеси содержащей глиоксаль (p < 0,05), что говорит о лучшей сохранности цвета под действием фиксатора на основе формалина (рис. 2), так как насыщенность цвета пропорционально уменьшается с повышением значения H (значения оттенка) в цветовой гамме.
Левая почка

Рис. 1. Качественный анализ цвета органов после фиксации
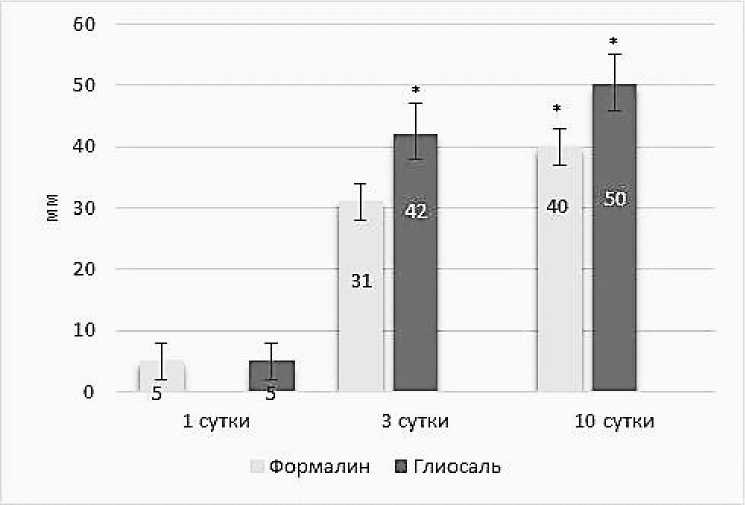
Рис. 2. Изменение H при различных методах фиксации
– различия достоверны относительно контрольной группы при p < 0,05 (использован непараметрический критерий Манна–Уитни;
тест Колмагорова–Смирнова с поправкой Лиллиефорса)
Изменение диаметра почек крыс при различных методах фиксации
|
Номер группы |
Время исследования, в сут. |
||
|
1-е |
3-и |
10-е |
|
|
Продольный диаметр, мм |
|||
|
1-я (Ф) |
13,0 ± 0,26 |
12,8 ± 0,31 |
11,7 ± 0,21 |
|
2-я (А) |
13,0 ± 0,26 |
11,2 ± 0,31* |
8,8 ± 0,31* |
|
Поперечный диаметр, мм |
|||
|
1-я (Ф) |
9,2 ± 0,31 |
9,3 ± 0,21 |
8,0 ± 0,26 |
|
2-я (А) |
9,2 ± 0,31 |
7,7 ± 0,21* |
5,7 ± 0,21* |
– p < 0,05 по сравнению с 1-й группой (двухфакторный дисперсионный анализ с постобработкой тестом Бонферрони).
Отмечено различие в значениях диаметров исследуемых органов различных групп. На 3-и сутки исследования продольный диаметр почек, фиксированных в растворе на основе глиоксаля, уменьшается на 12,5 % (p < 0,05) по сравнению с фиксацией в растворе на основе формалина. На 10-е сутки разница возросла до 24 % (p < 0,05).
Почки, находившиеся в альдофиксе, оказались более сморщенными и значительно меньше в сравнении с почками, фиксированными в растворе на основе формалина, что можно наблюдать на фотографии представляющей две изначально идентичные половины, различающиеся между собой после фиксации по форме и размеру (рис. 3).
Правая почка
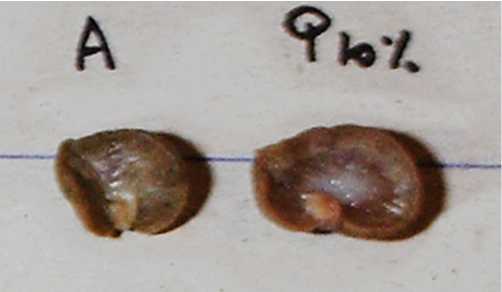
Рис. 3. Изменение формы почек под воздействием различных фиксаторов
ЗАКЛЮЧЕНИЕ
На основании проведенного количественного макроскопического исследования с последующим статистическим анализом, установлено, что поперечный диаметр почки крысы под действием фиксирующего раствора на основе глиоксаля (2-я группа), на 3-и сутки исследования уменьшилcя на 17 % (p < 0,05), на 10-е сутки – на 28 % (p < 0,05) по сравнению с почками, находившимися в фиксаторе на основе формалина (1-я группа).
Продольный диаметр почки крысы под действием фиксирующего раствора на основе глиоксаля (2-я группа) на 3-и сутки исследования уменьшился 12,5 % (p < 0,05) по сравнению с фиксацией в растворе на основе формалина (1-я группа). На 10-е сутки разница возросла до 24 % (p < 0,05).
Анализ изменения цвета, проведённый в таблице цветовой гаммы HSL, и последующая статистическая обработка показали, что более эффективную сохранность цветового оттенка органов обеспечивает фиксация в растворе на основе формалина, о чём свидетельствуют полученные в ходе исследований данные.
Почки, фиксированные в формалине, имели числовое значение оттенка (H) на 10-е сутки ниже на 20 % (p < 0,05) по сравнению с органами, фиксированными в глиоксале.
Проведённые исследования демонстрируют большую сохранность качественных и количественных макроскопических параметров почек крыс под воздействием различных сроков экспозиции в фиксирующем растворе на основе формалина по сравнению с использованием менее токсичного фиксатора на основе глиоксаля.
Является перспективным продолжение поиска новых фиксаторов, обладающих меньшей токсичностью, что соответствует закону РФ (Ф3 № 273) «Об образовании в Российской Федерации», но обеспечивающих лучшую сохранность органов и тканей при бальзамировании.
Список литературы Сравнительная макроскопическая характеристика почек крыс при различных способах фиксации
- Жулькова Е. С., Ильясова Н. Ю., Куприянов А. В. Технология выделения лейкоцитов на изображениях препаратов крови//Компьютерная оптика. -2007. -Т. 31, № 2. -С. 77-81.
- Количественная характеристика патоморфологических изменений в эндокринной части поджелудочной железы крыс при моделировании экспериментального стрептозотоцин-индуцированного сахарного диабета/А. В. Смирнов, Г. Л. Снигур, А. Т. Яковлев и др.//Волгоградский научно-медицинский журнал. -2015. -№ 4 (48). -С. 21-24.
- Кузнецов А. В., Куприянов А. В., Ильясова Н. Ю. Анализ изображения радужной оболочки глаза с использованием преобразования радона//Вестн. Самарского гос. Аэрокосмического ун-та -2008. -№ 2 (15). -С. 240-244.
- Меркулов Г. А. Курс патогистологической техники/Под ред. Д. Н. Чистовича. -Л.: МЕДГИЗ Ленинградское отделение. -1961. -323 с.
- Пикалюк В. С., Мороз Г. А., Кутя С. А. Методическое пособие по изготовлению анатомических препаратов. -Изд-во Крым. гос. мед. ун-та, 2004. -C. 76.
- Реброва О. Ю. Статистический анализ медицинских данных. -2006. -С. 104-108.
- Саркисов Д. С., Перов Ю. Л. Микроскопическая техника: Руководство/Под ред. Д. С. Саркисова и Ю. Л. Перова. -М.: Медицина, 1996. -535 с.
- Сафин Р. Я. Применение иммунологических методов исследования для определения давности наступления смерти//Сибирский мед. журн. -2007. -Т. 73, № 6. -С. 18-20.
- Экспериментальная модель диабетической нефропатии у крыс/А. А. Спасов и др.//Вестник Волгоградского государственного медицинского университета. -2015. -№ 3 (35). -С. 36-40.
- http://aldofix. ru/#application
- http://www.zakonrf.info/zakon-ob-obrazovanii-v-rf/41/


