Сравнительная оценка хирургической реваскуляризации миокарда с использованием аутоартериальных и аутовенозных кондуитов у пациентов с ишемической болезнью сердца: госпитальные результаты
Автор: Бояджян Г.А., Донаканян С.А., Шварц В.А., Петросян А.Д., Коасари А.К., Санакоев М.К., Испирян А.Ю., Айгумов Р.Н., Бокерия Л.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Хирургия
Статья в выпуске: 4 т.19, 2023 года.
Бесплатный доступ
Цель: оценить госпитальные результаты аортокоронарного шунтирования с использованием аутоартериальных и аутовенозных кондуитов. Материал и методы. Проведено рандомизированное клиническое исследование. Внутренняя грудная артерия слева использовалась в обеих группах (для шунтирования передней межжелудочковой ветви), остальными кондуитами, в зависимости от распределения в группы, были либо только лучевая артерия или лучевая артерия и большая подкожная вена (исследуемая группа) или только большая подкожная вена (контрольная группа). Изучаемые исходы: госпитальная летальность, инфаркт миокарда (5-й тип), цереброваскулярные события, дыхательная недостаточность, кровотечение, нарушения ритма сердца, острое повреждение почек.
Аортокоронарное шунтирование, артериальные кондуиты, венозные кондуиты, ишемическая болезнь сердца, кардиохирургия, осложнения
Короткий адрес: https://sciup.org/149144837
IDR: 149144837 | УДК: 616.379-008.64:616.12-005.4:616.132.2-089 | DOI: 10.15275/ssmj1904358
Текст научной статьи Сравнительная оценка хирургической реваскуляризации миокарда с использованием аутоартериальных и аутовенозных кондуитов у пациентов с ишемической болезнью сердца: госпитальные результаты
EDN: LWXPUH
-
1 Введение. В настоящее время ишемическая болезнь сердца (ИБС) занимает лидирующее место среди всех сердечно-сосудистых заболеваний [1]. Несмотря на развитие медикаментозной терапии и интервенционных методов лечения ИБС, в большинстве случаев хирургическая операция аортокоронарного шунтирования (АКШ) остается методом выбора у этих пациентов [2]. Последние годы как в мире, так и в России наблюдается увеличение проведения общего количества операций АКШ. Например, если в 1997 г. в нашей стране на 1 млн населения приходилось 20 операций АКШ, то в 2015 г. этот показатель вырос до 200 на 1 млн населения [3]. Сегодня в год выполняется примерно 33 тыс. операций АКШ. Современный уровень коронарной хирургии позволяет выполнять АКШ с низкой госпитальной летальностью. Среди ключевых факторов, влияющий на эффективность операции, является проходимость шунтов и долговечность их функционирования, что, в свою очередь, помимо качества наложения анастомоза, зависит от выбора шунтирующего материала и от метода его забора [4]. Наиболее часто используемыми кондуитами считаются левая внутренняя грудная артерия (ЛВГА), большая подкожная вена (БПВ и ПВ соответственно), правая внутренняя грудная артерия и лучевая артерия (ЛА).
Многочисленные благоприятные отдаленные результаты маммарно-коронарного шунтирования (МКШ) в дальнейшем предопределили интерес к исследованиям бимаммарно-коронарного шунтирования (биМКШ). БиМКШ показало более высокий показатель выживаемости и снижение частоты повторных вмешательств, но было ассоциировано высоким риском развития раневых осложнений, что вероятно было связано с редукцией кровоснабжения передней стенки грудной клетки [4]. Однако 2018 г. D. Р. Taggart и соавт. опубликовали результаты проспективного многоцентрового рандомизированного исследования Arterial Revascularization Trial (the ART), в котором сравнивались группы пациентов с биМКШ и МКШ. По результатам анализа не было статистически значимых различий в общей выживаемости, по частоте развития инфаркта миокарда (ИМ), по частоте инсульта и других церебральных событий, инфекционных осложнений ран, между группами биМКШ и МКШ с использованием ЛВГА [5].
БПВ чаще всего используется в качестве венозного кондуита из-за ее многочисленных преимуществ, включая техническую доступность для забора, достаточную длину для шунтирования в любой пораженной области и диаметр, который обычно соответствует диаметру коронарной артерии (КА). Тем не менее высокая травма, полученная во время забора БПВ, представляет собой фактор риска ранней дисфункции кондуита после операции. Проходимость венозных кондуитов, выделенных скелетированно,
Corresponding author — Gevorg A. Boyadzhyan
Тел.: +7 (968) 5587799
по разным данным составляет 70-85% через год после операции и снижается до менее 50% через 10 лет [6].
В 1973 г. известный французский кардиохирург A. Carpentier и соавт. впервые использовали ЛА в качестве артериального кондуита при АКШ [7]. ЛА служит предпочтительным артериальным графтом из-за того, что его диаметр аналогичен диаметру КА, а также из-за его способности адаптироваться к высокому кровяному давлению, что в конечном счете приводит к его хорошей проходимости как в ближайший, так и в отдаленный период [8]. Несколько исследований показали, что проходимость ЛА через год колеблется в пределах 89-92% [9]. Важно отметить, что важным фактором для долгосрочной функциональности ЛА является значительный стеноз КА (более 90% и выше) и отсутствие конкурентного кровотока [9].
Долгосрочное функционирование шунтов — решающий фактор, влияющий на качество и продолжительность жизни пациента, особенно с точки зрения облегчения стенокардии и предотвращения сердечных осложнений. Несмотря на результаты исследований в пользу использования аутоартериальных кондуитов, наиболее часто используемыми остаются венозные кондуиты: в России очень мало медицинских учреждений, активно применяющих аутоартериальную (кроме ЛВГА), тем более полную аутоартериальную, реваскуляризацию [10]. Поскольку важнейшим элементом операции АКШ является выбор подходящего кондуита, мы начали рандомизированное клиническое исследование для оценки результатов использования ЛА в качестве второго кондуита при проведении операции АКШ [11]. В данной статье приводится предварительный анализ собранных данных этого исследования.
Цель — оценить результаты АКШ с использованием аутоартериальных и аутовенозных шунтов.
Материал и методы. Дизайн исследования. Протокол исследования соответствовал этическим принципам Хельсинкской декларации и этическим принципам правительства Российской Федерации в отношении эпидемиологических исследований. Локальный этический комитет одобрил данный протокол исследования на соответствие международным стандартам надлежащей клинической практики. Перед рандомизацией каждый пациент давал письменное информированное согласие на участие в исследовании.
Критерии включения. В исследовании приняли участие пациенты, которым предстояла операция коронарного шунтирования и которые согласились принять участие в исследовании.
Критерии невключения: шунтирование одной КА; возраст до 18 и старше 74 лет; невозможность использования артериальных и венозных кондуитов. Использование ЛА возможно только при условии сохранности ладонных дуг по данным ультразвукового исследования. Кроме этого, для оценки разомкну-тости ладонных дуг использовалась проба Аллена;
снижение сократительной функции левого желудочка (ФВ ЛЖ <40%); сопутствующая онкологическая патология, а также онкологическое заболевание в анамнезе, потребовавшее лучевую терапию в области грудной клетки; предшествующие операции на открытом сердце; сопутствующая патология с плохим прогнозом на ближайшие два года.
Рандомизация. Пациенты, которые соответствовали критериям включения/невключения, были распределены на две группы в соотношении 1:1 путем блочной рандомизации методом конвертов, с размером блока 10. Исследуемая группа отнесена к артериальной реваскуляризации, контрольная группа — к венозной.
Конечные точки исследования. Первичной конечной точкой исследования являлась госпитальная летальность. Ко вторичным конечным точкам исследования относились: ИМ (5-й тип), мозговой инсульт (МИ) или нарушение мозгового кровообращения (ОНМК) или транзиторная ишемическая атака (ТИА), дыхательная недостаточность (ДН), кровотечение, нарушения ритма сердца, включая послеоперационную фибрилляцию предсердий (ПОФП), острое повреждение почек (ОПП), инфекционные осложнения общие, инфекционные осложнения раны, имплантацию электрокардиостимулятора (ЭКС), развитие гематомы в области забора кондуитов.
Определения исходов. Развитие ИМ 5-го типа, ассоциированного с АКШ, определялось согласно третьему универсальному определению ИМ [12]. Инсульт или ОНМК или ТИА был поставлен на основании клинических данных, результатов КТ головного мозга, заключения врача-невролога о состоявшемся осложнении. ДН была определена как длительность времени ИВЛ более 24 ч в послеоперационный период. Факт развития ПОФП был определен как эпизод с отсутствием видимых регулярных p -волн, появлением f -волн и нерегулярных R-R интервалов на электрокардиограмме в течение более 30 с или по данным суточного ЭКГ-мониторирования по Холтеру. Развитие ОПП идентифицировано в соответствии с критериями KDIGO (Kidney Disease Improving Global Outcomes): определялось либо при условии повышения уровня креатинина в сыворотке крови >0,3 мг/дл (>26,5 ммоль/л) в течение 48 ч, либо как увеличение в ≥1,5 раза от исходного значения в течение 7 дней. Кровотечение рассматривалось как острая кровопотеря в ранний послеоперационный период у пациента, которая потребовала инфузионного введения компонентов крови (плазмы или эритроцитарной массы).
Техника проведения хирургической операции. Операция АКШ выполнялась как на работающем сердце по методике off-pump, так и в условиях искусственного кровообращения (ИК) (на параллельной перфузии) доступом из срединной стернотомии. Внутренняя грудная артерия слева использовалась в обеих группах (для шунтирования ПМЖВ), остальными кондуитами в зависимости от распределения в группы были либо только ЛА или ЛА и БПВ (исследуемая группа) или только БПВ (контрольная группа). Возможность выделения ВГА определялась на основании данных ангиографии подключичной артерии. Выделение ВГА осуществлялось скелети-рованно. Выделение ЛА и БПВ выполнялось классическим способом (рис. 1, 2). ЛА в основном была выделена с левой верхней конечности, билатеральное выделение ЛА отсутствовало (большинству пациентов с правой стороны накануне выполнена
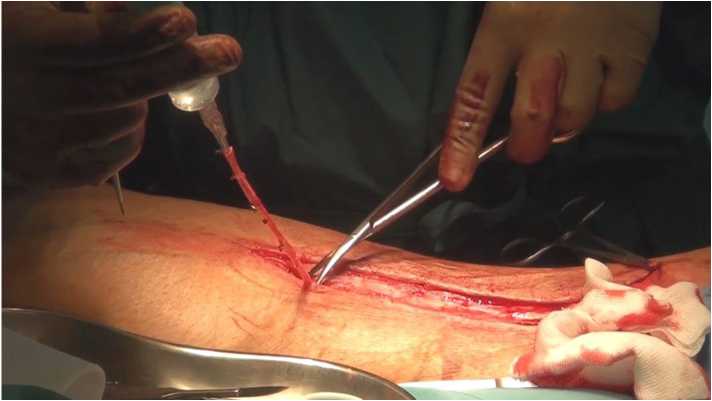
Рис. 1. Интраоперационное выделение большой подкожной вены
Рис. 2. Интраоперационный забор лучевой артерии коронароангиография, что стало причиной исключения данного кондуита в возможном использовании). Анастомоз с ЛА был только одиночным, секвенциальные дистальные анастомозы с ЛА отсутствовали. ИК осуществлялось путем канюляции аорты и правых отделов двуступенчатой канюлей через ушко правого предсердия. Оценка качества шунтов (тела кондуитов, анастомозов) осуществлялась выполнением интраоперационной шунтографии.
Статистический анализ. Анализ проводился с помощью программ Statistica® Statsoft, и SPSS® Statistics 25.0. Данные представлены в виде медианы и межквартильного диапазона — Me (Q1; Q3) и частот. Для сравнения двух независимых выборок использовали U-критерий Манна — Уитни для количественных переменных и критерий χ2 Пирсона для категориальных переменных. Для оценки исходов использовали расчет отношения шансов и 95% доверительный интервал. Статистически значимым считалось различие между группами при p<0,05.
Результаты. За год от начала исследования рассмотрены данные 112 пациентов с ИБС. Согласно критериям включения/невключения рандомизированы 27 пациентов, 13 из которых вошли в исследуемую группу («артерии»), а 14 — в контрольную группу («вены»). В одном случае наблюдалась конверсия: при проведении интраоперационной шунтографии была обнаружена дисфункция артериального шунта, в результате чего он был заменен на венозный шунт. Таким образом, в итоге из 27 пациентов количество пациентов в исследуемой группе составило 12 человек, в контрольной — 15.
При сравнении исходных клинических, лабораторных и инструментальных данных, а также исходной медикаментозной терапии группы были сопоставимы и однородны, за исключением ИМТ и частоты применения ингибиторов АПФ в предоперационный период (табл. 1). По операционным и ранним
Таблица 1
|
Параметр |
Артерии ( n =12) |
Вены ( n =15) |
p |
|
Клинические данные |
|||
|
Возраст, лет |
62,5 (56; 68) |
67 (58; 71) |
0,170 |
|
Мужской пол, % |
67 |
93 |
0,082 |
|
Площадь поверхности тела, м2 |
2,08 (1,9; 2,3) |
2,14 (2,1; 2,2) |
0,558 |
|
Вес, кг |
91 (84; 102) |
93 (85; 95) |
0,864 |
|
Индекс массы тела, Ед |
32,8 (30,6; 34,8) |
29,4 (27,1; 30,8) |
0,015* |
|
Стенокардия, % |
44 |
47 |
0,798 |
|
Syntax Score |
30 (25; 35) |
28 (27; 31) |
0,663 |
|
Диабет, % |
33 |
33 |
1,000 |
|
Хроническая обструктивная болезнь легких, % |
8,3 |
0 |
0,263 |
|
Артериальная гипертензия, % |
100 |
80 |
0,106 |
|
Перенесенный ИМ, % |
33 |
40 |
0,726 |
|
ОНМК/МИ, % |
8,3 |
6,7 |
0,872 |
|
Курение, % |
17 |
6,7 |
0,420 |
|
ЭхоКГ |
|||
|
ФВ ЛЖ, % |
56 (50; 62) |
59 (55; 61) |
0,261 |
|
Конечный систолический размер, мм |
3,7 (3,2; 4,4) |
3,4 (3,2; 3,6) |
0,305 |
|
Конечный диастолический размер, мм |
5,4 (4,7; 6,0) |
4,9 (4,6; 5,2) |
0,146 |
|
Конечный систолический объем, мл |
49 (38; 80) |
44 (35; 51) |
0,353 |
|
Конечный диастолический объем, мл |
119 (94; 159) |
108 (88; 121) |
0,251 |
|
Степень МН |
1,5 (1,25; 1,75) |
1,5 (1,0; 1,5) |
0,506 |
Лабораторные данные
|
Лейкоциты, тыс./мкл |
8,2 (7,7; 9,2) |
6,7 (6,0; 8,3) |
0,124 |
|
Гематокрит |
44 (42; 45) |
43 (39; 46) |
0,464 |
|
Тромбоциты, тыс./мкл |
233 (185; 264) |
236 (172; 270) |
0,807 |
|
Креатинин, мкмоль/л |
92 (75; 102) |
92 (77; 114) |
0,660 |
|
Глюкоза крови, ммоль/л |
6,4 (5,4; 7,0) |
5,7 (5; 7,5) |
0,836 |
|
Калий, ммоль/л |
4,3 (3,9; 4,5) |
4,4 (4,2; 4,8) |
0,183 |
|
Аспартатаминотрансфераза, ед/л |
21 (15; 28) |
19 (16; 26) |
0,883 |
|
Аланинаминотрансфераза, ед/л |
23 (17; 33) |
21 (16; 26) |
0,608 |
Медикаментозная терапия
|
β-адреноблокаторы, % |
92 |
87 |
0,687 |
|
Ингибиторы аденозинпревращающего фермента, % |
100 |
40 |
0,012* |
|
Блокаторы кальциевых каналов, % |
42 |
47 |
0,798 |
|
Диуретик тиазидный, % |
0 |
0 |
— |
|
Диуретик петлевой, % |
0 |
0 |
— |
|
Диуретик калийсберегающий, % |
8,3 |
13 |
0,687 |
Окончание табл. 1
|
Параметр |
Артерии ( n =12) |
Вены ( n =15) |
p |
|
Нестероидные противовоспалительные средства, % |
17 |
0 |
0,106 |
|
Ацетилсалициловая кислота, % |
17 |
20 |
0,823 |
|
Другие дезагреганты, % |
25 |
13 |
0,446 |
|
Нитраты, % |
42 |
40 |
0,931 |
|
Статины, % |
100 |
83 |
0,931 |
|
Низкомолекулярный гепарин/гепарин, % |
67 |
80 |
0,440 |
Примечание:Syntax Score — система балльной оценки поражения коронарных артерий; * — различия между контрольной и исследуемой группами статистически значимы.
Таблица 2
Операционные и послеоперационные данные
|
Параметр |
Артерии ( n =12) |
Вены ( n =15) |
p |
|
ИК, % |
92 |
87 |
0,187 |
|
Время ИК, мин |
95 (90; 110) |
110 (93; 127) |
0,309 |
|
ПМЖВ |
100 |
100 |
1,000 |
|
Диагональная ветвь |
42 |
27 |
0,420 |
|
Ветвь тупого края |
33 |
60 |
0,176 |
|
Огибающая ветвь |
17 |
47 |
0,107 |
|
Intermedia |
25 |
27 |
0,923 |
|
Правая коронарная артерия |
33 |
33 |
1,000 |
|
Задняя межжелудочковая ветвь правой коронарной артерии |
17 |
33 |
0,335 |
|
Общее количество кондуитов |
2,5 (2;3) |
3 (2;4) |
0,151 |
|
Кардиотоническая поддержка, % |
83 |
80 |
|
|
Адреналин |
8,3 |
13 |
|
|
Норадреналин |
58 |
73 |
0,827 |
|
Допамин |
8,3 |
0 |
|
|
Добутамин |
8,3 |
6,7 |
|
|
Время ИВЛ, ч |
14 (12; 18) |
9,3 (5,8; 13) |
0,034* |
|
Койко-день п/о |
7 (7; 8,5) |
7 (7; 7) |
0,410 |
П р и м еч а н и е : * — различия между контрольной и исследуемой группами статистически значимы.
Сравнительная характеристика пациентов по исходным данным
послеоперационным данным также не было статистически значимых отличий между группами, кроме длительности пребывания на искусственной вентиляции легких (ИВЛ) в отделениях реанимации и интенсивной терапии: в исследуемой группе продолжительность ИВЛ была более длительной, чем с контрольной: 14 (12; 18) ч против 9,3 (5,8; 13) ч, p =0,034 (табл. 2). Койко-день после операции также статистически значимо не отличался между группами.
В табл. 3 представлены изучаемые клинические исходы — первичная и вторичные конечные точки исследования. Частота первичной точки составила 0% в обеих группах. Кроме того, не было ни одного случая развития ИМ, МИ/ОНМК/ТИА, кровотечения, инфекционных осложнений и имплантаций электрокардиостимулятора. Наиболее частыми осложнениями были нарушения ритма сердца, включая ПОФП, а также ОПП. Не было статистически значимых отличий между группами ни по одному исходу (табл. 3).
Обсуждение. В данной работе проанализированы предварительные госпитальные результаты сравнительного хирургического лечения ИБС с использованием аутоартериальных и аутовенозных кондуитов. В дополнение к ЛВГА-ПМЖВ вторым кондуитом в зависимости от рандомизации была либо ЛА, либо БПВ. Таким образом, третьим и более кондуитом всегда выступала БПВ, то есть использовалась только одна ЛА. Ключевые исходные параметры (клинические, инструментальные и лабораторные) в группах были сопоставимы и значимо не отличались. Только два параметра (ИМТ и частота использования ингибиторов АПФ в предоперационный период) отличались, однако учитывая рандо-мизированый характер исследования, нами это было расценено как случайность. С большой долей вероятности эти различия нивелируются с увеличением мощности исследования: при включении большего числа пациентов в исследование.
Не было различий по операционным характеристикам: операции с подключением ИК выполнялись в среднем в 90% случаях в обеих группах. Время ИК составило в обеих группах примерно 100 мин. Общее
Клинические исходы и осложнения
Таблица 3
|
Параметр, n (%) |
Артерии ( n =12) |
Вены ( n =15) |
ОШ |
95% ДИ |
p |
|
Госпитальная смерть |
0 (0) |
0 (0) |
— |
— |
— |
|
Дыхательная недостаточность |
0 (0) |
6,7 |
0,360 |
0,014–9,681 |
0,543 |
|
ТИА |
0 (0) |
0 (0) |
— |
— |
— |
|
Кровотечения |
0 (0) |
0 (0) |
— |
— |
— |
|
Нарушения ритма сердца |
1 (8,3) |
2 (13,3) |
1,182 |
0,065–21,18 |
0,909 |
|
ПОФП |
1 (8,3) |
1 (6,7) |
1,273 |
0,071–22,72 |
0,869 |
|
ОПП |
1 (8,3) |
3 (20) |
0,363 |
0,032–4,035 |
0,410 |
|
Инфекционные осложнения общие |
0 (0) |
0 (0) |
— |
— |
— |
|
Инфекционные осложнения раны |
0 (0) |
0 (0) |
— |
— |
— |
|
Имплантация электрокардиостимулятора |
0 (0) |
0 (0) |
— |
— |
— |
|
Гематома |
1 (8,3) |
1 (6,7) |
1,273 |
0,071–22,72 |
0,869 |
П р и м еч а н и е : ОШ — отношение шансов, ДИ — доверительный интервал.
количество кондуитов также статистически значимо не отличалось и составило в исследуемой группе 2,5 (2; 3), а в контрольной группе 3 (2; 4). В ранний послеоперационный период кардиотоническая поддержка в группах значимо не отличалась, но время ИВЛ в отделениях реанимации и интенсивной терапии было выше в группе артериальных кондуитов: 14 (12; 18) ч против 9,3 (5,8; 13) ч в контрольной группе ( p =0,034). Мы также не обнаружили статистически значимых различий по основным изучаемым событиям — первичной и вторичным конечным точкам исследования. Летальность отсутствовала. Чаще всего встречались такие осложнения, как ОПП, ПОФП, другие нарушения ритма сердца, возникновение гематом, ДН.
Перечисленные ранее нелетальные осложнения, такие как ОПП, ФП в ранний послеоперационный период, ДН, являются частыми осложнениями в кардиохирургии [12–14]. Причины развития данных осложнений многообразны и в основном связаны с возрастом, коморбидной патологией и объемом хирургического вмешательства. Изучая медицинскую литературу, становится ясно, что при выборе кондуита для первичной или последующей реваскуляризации миокарда необходимо уделить внимание его способности эффективно функционировать в течение продолжительного времени. Обсервационные исследования показали, что использование ЛА в качестве вторичного кондуита для АКШ приводит к более высокой выживаемости по сравнению БПВ [12].
Использование ЛВГА для шунтирования к ПМЖВ сегодня рекомендуется в соответствии с международными рекомендациями благодаря ее долговечности. Через 10 лет после операции АКШ проходимость ЛВГА достигает 93%, а через 15 лет — 88% [15]. Что использовать вторым и третьим кондуитом — вопрос остается спорным и нерешенным по сей день.
Рандомизированное исследование RSVP (Radial artery versus Saphenous Vein Patency randomized trial) проводилось с целью сравнения 5-летней проходимости кондуитов из ЛА с венозными кондуитами. В этом исследовании приняли участие 142 пациента. Через 5 лет 105 пациентам проведена шунтография, которая показала проходимость артериальных кондуитов у 98,3% пациентов против 86,4% при шунтировании БПВ. Стеноз наблюдался у 10% пациентов с трансплантатами ЛА, в то время как у пациентов с трансплантатами ПВ стеноз возникал в 23% случаев [16].
Международное исследование Radial Artery Database включило анализ данных пациентов из пяти рандомизированных клинических испытаний, в которых сравнивалось использование ЛА и ПВ для АКШ. Первичный отчет показал то, что при использовании ЛА наблюдались низкие показатели летальности, ИМ и повторной реваскуляризации миокарда по сравнению с венозными кондуитами при 5-летнем наблюдении [17]. В исследовании PREVENT-IV наблюдались 1923 пациента, которые перенесли операцию АКШ. Из них 117 шунтированы с использованием ЛА. Частота дисфункции артериального кондуита составила 23%, что было аналогично частоте дисфункции БПВ — 25,2% ( р >0,05) и было выше, чем частота дисфункции ЛВГА. Клинические исходы в виде общей летальности, ИМ и повторной реваскуляризации не отличались в обеих группах. Через 5 лет после АКШ у пациентов, которым выполнено шунтирование с ЛА, были схожие показатели по частоте острого нарушения мозгового кровообращения с пациентами, у которых проведено шунтирование БПВ [18].
В настоящее время недостаточно крупных рандомизированных исследований и метаанализов, сравнивающих использование ЛА и БПВ в качестве второго и третьего кондуита при АКШ [19, 20]. Между тем большинство проведенных небольших клинических исследований показывают более благоприятные результаты артериальной реваскуляризации.
Ограничения исследования. В этой работе, на наш взгляд, есть как слабые, так и сильные стороны. К ограничениям работы, безусловно, нужно отнести слабую статистическую мощность, связанную с малым количеством включенных пациентов на настоящий момент. Вероятно, с этим связано отсутствие статистической значимости по анализируемым исходам. Тем не менее это можно объяснить недавним началом исследования по времени и жесткими критериями включения и невключения, в результате чего из общей когорты в 112 человек за год в исследование отобраны только 27 пациентов. В этом смысле продолжение набора пациентов необходимо, чтобы исправить это ограничение.
К сильным сторонам работы нужно отнести проспективный и рандомизированный характер исследования, что подразумевает отсутствием влияния различного рода конфаундеров со стороны хирурга, принимающего решение о выборе кондуита. К убедительным факторам можно отнести выполнение работы в одном отделении, по одной методике как выполнения самой операции, так и забора кондуитов. Это способствует формированию более однородной гомогенной группы пациентов, отличающихся только видами изучаемых кондуитов.
Заключение. В этом предварительном анализе, согласно полученным нами статистическим данным, можно сделать вывод о том, что в первые дни после операции использование ЛА не обеспечивает значительных преимуществ по сравнению с использованием БПВ. Мы не обнаружили статистически значимых различий по основным изучаемым событиям — первичным и вторичным конечным точкам исследования. Летальность отсутствовала. Чаще всего встречались такие осложнения, как ОПП, ПОФП, другие нарушения ритма сердца, ДН. Для получения статистический значимых результатов необходимо продолжить исследование с увеличением числа включенных пациентов.
Вклад авторов: авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Сравнительная оценка хирургической реваскуляризации миокарда с использованием аутоартериальных и аутовенозных кондуитов у пациентов с ишемической болезнью сердца: госпитальные результаты
- Голухова Е.З. Отчет о научной и лечебной работе Национального медицинского исследовательского центра сердечно-сосудистой хирургии им. А. Н. Бакулева Минздрава России за 2021 год и перспективы развития. Бюллетень НЦССХ им. А. Н. Бакулева РАМН. 2022; Спецвып. (23): 12-111. DOI:10.24022/1810-0694-2022-23S
- Neumann FJ, Sousa-Uva M.AhlssonA, etal. ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019; 40 (2): 87-165. DOI:10.1093/eurheartj/ehy394
- Бокерия Л.А., Гудкова P. Г. Сердечно-сосудистая хирургия — 2015. Болезни и врожденные аномалии системы кровообращения. М.: НЦССХ им. А.Н. Бакулева; 2016.
- Бокерия Л.А., Шварц В.А., Петросян А.Д. Выбор кондуитов для коронарного шунтирования. Один вопрос — много мнений. Грудная и сердечно-сосудистая хирургия. 2022; 1 (64): 9-16. DOI:10.24022/0236-2791-2 022-64-1 -9-16
- Taggart DP. How I deploy arterial grafts. Ann Cardiothorac Surg. 2018; 7 (5): 690-7. DOI:10.21037/acs. 2018.09.06
- Izzat MB, West RR, Bryan AJ, Angelini GD. Coronary artery bypass surgery: Current practice in the United Kingdom. Br Heart J. 1994; 71 (4): 382-5. DOI:10.1136/hrt. 71.4.382
- Carpentier A, Guermonprez JL, Deloche A, et al. The aorta-to-coronary radial artery bypass graft. A technique avoiding pathological changes in grafts. Ann Thorac Surg. 1973; 16 (2): 111-21. DOI:10.1016/s0003-4975(10)65825-0
- Martinez-Gonzalez B, Reyes-Hernandez CG, Quiroga-Garza A, et al. Conduits used in coronary artery bypass grafting: A review of morphological studies. Ann Thorac Cardiovasc Surg. 2017; 23 (2): 55-65. DOI:10.5761/atcs.ra.16-00178
- Cao C, Manganas C, Horton M, et al. Angiographic outcomes of radial artery versus saphenous vein in coronary artery bypass graft surgery: A meta-analysis of randomized controlled trials. J Thorac Cardiovasc Surg. 2013; 146 (2): 255-61. DOM 0.1016/j.jtcvs.2012.07.014
- Бокерия Л.А., Пурсанов М.Г., Вартанов П. В., Лосев В. В. Отдаленные результаты операции коронарного шунтирования с использованием различных кондуитов. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2018; 19 (1): 5-13. DOI:10.24022/1810-0694-2018-19-1-5-13
- Петросян А.Д., Бокерия Л.А., Шварц В.А. и др. Артериальные и венозные кондуиты в хирургии ИБО Проспективное, рандомизированное клиническое исследование. XXIV Ежегодная сессия НМИЦ ССХ им. А.Н. Бакулева. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. 2021; 22 (S3): 51.
- Gaudino М, Benedetto U, Fremes S, et al. Association of radial artery graft vs saphenous vein graft with long-term cardiovascular outcomes among patients undergoing coronary artery bypass grafting. JAMA. 2020; 324 (2): 179-87. DOI:10.1001/jama.2020.8228
- Massoth C, Zarbock A, Meersch M. Acute kidney injury in cardiac surgery. Crit Care Clin. 2021; 37 (2): 267-78. DOI:10.1016/j.ccc.2020.11.009
- Baeza-Herrera LA, Rojas-Velasco G, Marquez-Murillo MF, et al. Atrial fibrillation in cardiac surgery. Fibrilacion auricular en cirugia cardiaca. Arch Cardiol Мех. 2019; 89 (4): 348-59. DOI:10.24875/ACM.19000134
- Lawton, JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization. J Am Coll Cardiol. 2022; (79): e21-129. DOI:10.1016/j. jaccas.2021.09.025
- Collins P, Webb CM, Chong CF, Moat NE. Radial Artery Versus Saphenous Vein Patency (RSVP) trial investigators. Radial artery versus saphenous vein patency randomized trial: Five-year angiographic follow-up. Circulation. 2008; 117 (22): 2859-64. DOI:10.1161/CIRCULATIONAHA.107.736215
- Gaudino M, Benedetto U, Fremes S, et al. RADIAL Investigators. Radial-artery or saphenous-vein grafts in coronary-artery bypass surgery. Engl J Med. 2018; 378 (22): 2069-77. DOI:10.1056/NEJMoa1716026
- Jawitz OK, Cox ML, Ranney D, et al. Outcomes following revascularization with radial artery bypass grafts: Insights from the PREVENT-IV trial. Am Heart J. 2020; (228): 91-7. DOI: 10.1016/j.ahj.2020.08.001
- Dimagli A, Soletti G Jr, Harik L, et al. Angiographic outcomes for arterial and venous conduits used in CABG. J Clin Med. 2023; 12 (5): 2022. DOI:10.3390/jcm12052022
- Gaudino M, Alexander JH, Bakaeen FG, et al. Randomized comparison of the clinical outcome of single versus multiple arterial grafts: The ROMA trial — rationale and study protocol. Eur J Cardiothorac Surg. 2017; 52: 1031-40. DOI:10.1093/ejcts/ezx358


