Сравнительная оценка нарушений функции легких в послеоперационном периоде при хирургическом лечении больных раком гортани и гортаноглотки в зависимости от метода анестезии
Автор: Чойнзонов Евгений Лхамацыренович, Авдеев Сергей Вениаминович, Кушнер Андрей Владимирович, Назарова Лилия Семеновна, Чижевская Светлана Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (37), 2010 года.
Бесплатный доступ
Функции внешнего дыхания были изучены у 46 пациентов раком гортани T2-4N0-1M0, которым выполнялось комбиниро- ванное лечение, включающее химио- и лучевую терапию, ларингэктомию с лимфодиссекцией. Больные были распределены в две группы: 22 пациента оперированы под ксеноновой анестезией в соотношении Хе:О2=70%:30%. 24 пациента оперированы ТВВА в комбинации N2O c O2 (60%:40%). Показатели ФВД были исследованы до операции, на 3-и и 7-е сут после операции спирометром «Microspiro HJ-601» (Япония). У больных, оперированных с использованием N2O, после операции наблюдалось достоверно значимое ухудшение скоростных показателей выдоха - на 50-55 %, связанное с выраженными обструктивными нарушениями. У больных, оперированных под ксеноновой анестезией, отмечено снижение скоростных показателей на 20-25 % по сравнению с исходными значениями. Различия статистически не значимы. Использование ксеноновой анестезии при операциях по поводу рака гортани и гортаноглотки способствует более быстрой адаптации организма к новому состоя- нию, что проявляется ранней компенсацией вентиляционных нарушений, возникающих в послеоперационном периоде.
Рак гортани, рак гортаноглотки, ларингэктомия, ксеноновая анестезия, функции внешнего дыхания
Короткий адрес: https://sciup.org/14055587
IDR: 14055587 | УДК: 616.22+616.321]-006.6-089:616-009.614:616.24-008.4-089.168.1
Текст научной статьи Сравнительная оценка нарушений функции легких в послеоперационном периоде при хирургическом лечении больных раком гортани и гортаноглотки в зависимости от метода анестезии
Несмотря на то, что в последние годы в лечении больных раком гортани и гортаноглотки применяются комбинированные методы – соче- тание хирургического вмешательства с химио- и лучевой терапией, основным методом является радикальная операция, которая выполняется под эндотрахеальным наркозом [2, 5, 6]. Проведение общей анестезии при хирургическом лечении рака гортани и гортаноглотки является довольно сложной задачей, так как пациенты с данной патологией нуждаются в специальной анестезиологической оценке состояния. Кроме того, их предоперационное ведение должно быть индивидуализировано в зависимости от сопутствующей патологии, среди которой наиболее распространенным заболеванием является хроническая обструктивная болезнь легких, прогрессирование которой вследствие суженного просвета гортани или трахеи может проявиться выраженной дыхательной недостаточностью [7, 8, 11].
Развитие вентиляционной недостаточности при экзофитных опухолях дыхательных путей обусловлено несколькими механизмами. Стеноз гортани и трахеи даже I степени вызывает нарушение функции внешнего дыхания по обструктивному типу и нарушение бронхиальной проходимости на протяжении всего бронхиального дерева. Уменьшение просвета дыхательных путей нарушает дренажную функцию бронхов и мукоцилиарное очищение. Этому способствует хронический трахеобронхит, часто имеющийся у данного контингента больных [9, 10]. Кроме того, в патогенезе дыхательной недостаточности у больных с опухолями дыхательных путей (и вообще с длительно существующим стенозом дыхательных путей любой этиологии) важную роль играют внелегочные механизмы. Уменьшение просвета дыхательных путей приводит к повышению сопротивления потоку газа на вдохе и выдохе за счет турбулентного характера воздушного потока. Стенозирование дыхательных путей, хронический бронхит, нарушение дренажной функции бронхов и как следствие гипоксия и гиперкапния вызывают нарушения кровообращения (повышение давления в малом круге и сердечную недостаточность), которые поддерживают и усугубляют дыхательную недостаточность, создавая порочный круг [1]. По данным D.G. Farwell [8], исходная патология дыхательной системы способствует увеличению периоперационных осложнений со стороны легких на 14,8 %, из них вклад гипоксии – 1,7 %, поддержки вентилятором >24 ч – 0,9 %, пневмонии – 7,7 %, ТЭЛА – 0,9 %, других причин – 1 %.
M.B. Ferrier et al. [9] при проведении многомерного анализа пришли к заключению, что продолжительность анестезии и сопутствующая патология являются наиболее существенными факторами в развитии общих осложнений в послеоперационном периоде при операциях на органах головы и шеи.
Существующие общие анестетики вызывают в послеоперационном периоде депрессию дыхания с уменьшением максимальной вентиляции легких (МВЛ), что может способствовать прогрессированию и развитию застойных явлений со стороны легких после операции. В данной ситуации методом выбора является газовый анестетик ксенон, который по своим физикохимическим и биологическим свойствам близок к идеальному анестетику. Ксенон не оказывает отрицательного влияния на функцию легких. Основным достоинством ксеноновой анестезии, по мнению многих авторов, является быстрый ввод и вывод из наркоза с восстановлением сознания, адекватного дыхания и физической активности. Раннее пробуждение и восстановление сознания после ксеноновой анестезии способствует ранней активизации пациентов, сохранению исходного уровня функции внешнего дыхания (ФВД) и механизмов естественного дренирования трахеобронхиального дерева в раннем послеоперационном периоде [3, 4].
Целью настоящей работы является исследование влияния ксеноновой анестезии на функциональное состояние внешнего дыхания больных раком гортани и гортаноглотки в раннем послеоперационном периоде на этапе хирургического лечения.
Материал и методы
Функция внешнего дыхания была изучена у 46 больных раком гортани и гортаноглотки T2–4N0–1M0. Наибольшее число пациентов было в возрасте от 50 до 69 лет (табл. 1), что соответствует статистическим данным о заболеваемости раком гортани и гортаноглотки. Из 46 больных раком гортани и гортаноглотки было 45 мужчин и 1 женщина. Состав исследуемых групп больных по полу, возрасту, стадии (табл. 2), морфологическому типу опухоли был идентичным. Имеющиеся различия в группах по некоторым вышеперечисленным признакам статистически
Таблица 1
|
Возраст больных |
Основная группа (n=22) |
Контрольная группа (n=24) |
Всего (n=46) |
|
До 40 лет |
3 (13,6%) |
4 (16,7 %) |
7 (15,2 %) |
|
40–49 лет |
4 (18,3 %) |
3 (12,5 %) |
7 (15,2 %) |
|
50–59 лет |
9 (41 %) |
12 (50 %) |
21 (45,6 %) |
|
60–69 лет |
6 (27,1 %) |
5 (20,8 %) |
11 (24 %) |
Таблица 2
|
Стадия опухоли |
Основная группа (n=22) |
Контрольная группа (n=24) |
Всего (n=46) |
|
T 2 N 0 M 0 |
4 (18,2 %) |
5 (21 %) |
9 (19,5 %) |
|
T2N1M0 |
2 (9,1 %) |
3 (12,5 %) |
5 (11 %) |
|
T3N0M0 |
7 (31,8 %) |
7(29 %) |
14 (30,5 %) |
|
T3N1M0 |
3 (13,6 %) |
3 (12,5 %) |
6 (13 %) |
|
T 4 N 0 M 0 |
4 (18,2 %) |
4 (16,5 %) |
8 (17,5 %) |
|
T4N1M0 |
2 (9,1 %) |
2 (8,5 %) |
4 (8,5 %) |
Таблица 3
|
Вид операции |
Основная группа (n=22) |
Контрольная группа (n=24) |
Всего (n=46) |
|
Ларингэктомия |
16 (72 %) |
17 (71 %) |
33 (72 %) |
|
Ларингэктомия + ФФИК с 1 стороны |
3 (14 %) |
5 (21 %) |
8 (17,5 %) |
|
Ларингэктомия + ФФИК с 2 сторон |
3 (14 %) |
2 (8 %) |
5 (10,5 %) |
Распределение больных по возрастным группам
Распределение больных в сравниваемых группах в зависимости от распространенности опухолевого процесса
Объем выполненных операций в сравниваемых группах
недостоверны, что позволяет провести сравнительный анализ результатов исследования.
Всем пациентам было выполнено комбинированное лечение, включающее неоадъювантную химиотерапию по схеме РС (паклитаксел + карбоплатин), с последующей лучевой терапией в режиме мультифракционирования дозы (1,3 Гр х 2 раза в день, СОД 36 Гр), и хирургическое вмешательство в объеме ларингэктомии с лимфодиссекцией (табл. 3).
Методом слепой рандомизации больные были распределены на две группы:
-
- основная группа – 22 пациента, которые оперированы под ксеноновой анестезией в соотношении Хе:О2=70 %:30 %.
-
- контрольная группа – 24 пациента, оперированы под внутривенной анестезией в комбинации N2O c O2 (60%:40%). Интубацию трахеи в обеих группах выполняли через предварительно наложенную трахеостому.
Спирографическое исследование проводилось с использованием спирографа «Microspiro»
(Япония). Исследование внешнего дыхания проводилось в условиях покоя, натощак. Для оценки функции внешнего дыхания был использован метод спирографии с регистрацией петли «поток – объем форсированного выдоха» (ПОФВ). Регистрация ПОФВ позволяет выявить начальные доклинические проявления обструкции бронхов и является методом дифференциальной диагностики преимущественного поражения центральных и периферических отделов дыхательных путей. В работе были проанализированы: жизненная емкость легких (ЖЕЛ), форсированная жизненная емкость легких (ФЖЕЛ), максимальная вентиляция легких (МВЛ), минутный объем дыхания (МОД), резерв дыхания (РД), объем форсированного выдоха за 1 сек (ОФвыд), индекс Тиффно (ОФвыд\ЖЕЛ), пиковая объемная скорость (ПОС), максимальная объемная скорость в момент выдоха первых 25 % ФЖЕЛ (МОС 25), в момент выдоха первых 50 % ФЖЕЛ (МОС 50), в момент выдоха первых 75 % ФЖЕЛ (МОС 75), средняя объемная скорость между 25 и 75 % объема ФЖЕЛ (СОС 25–75). Уровень бронхиальной обструкции мы определяли на основании результатов измерения ОФвыд, индекса Тиффно, максимальных и средних объемных скоростей форсированного выдоха. Нарушение бронхиальной проходимости в крупных бронхах характеризовалось снижением ОФвыд (менее 80 % от должных величин), индекса Тиффно (менее 70 % должной величины), МОС 25 (менее 60 % должной величины) и нормальными величинами МОС 50, МОС 75, СОС 25–75. Снижение показателей МОС 50, МОС 75, СОС 25–75 ниже 60 % должной величины при нормальных значениях показателей ОФвыд, индекса Тиффно, ПОС и МОС25 свидетельствовало о нарушенной проходимости бронхов малого калибра. Одновременное снижение значений параметров ОФвыд, индекса Тиффно, ПОС, МОС 25, МОС 50, МОС 75, СОС 25–75 являлось признаком генерализованной бронхиальной обструкции. Для характеристики степени вентиляционной недостаточности (ВН) в работе использовалась классификация, предложенная Ф.Ф. Тетеневым с соавт. (2000). Для оценки сердечно-сосудистой деятельности была использована клиническая картина, данные объективного обследования, метод электрокардиографии с оценкой стандартных параметров. Также на различных этапах лечения применялась рентгенография органов грудной полости и компьютерная томография.
Показатели ФВД были исследованы до операции, на 3-и и 7-и сут после операции спирометром «Microspiro HJ-601» (Япония). Для объективизации результатов данных ФВД после ларингоэктомии использовали специальный трахеостомический адаптер (патент РФ № 78652 от 10.12.08). Главные индексы ФВД (МОС25,50,75) определяли обструктивные и рестриктив,ны, е изменения. Статистическую обработку проводили с использованием программного пакета
«STATISTIKA-6.0». Достоверность различий в группах определяли с помощью log – rank теста. Достоверность различий между количественными показателями вычисляли по критерию t Стьюдента. Использовался непараметрический метод Краскелла–Уолиса (для независимых групп). В случае выявления различий между группами проводился анализ с помощью непараметрического метода для независимых групп Манна–Уитни с поправкой Бонферрони при оценке значения p.
Результаты и обсуждение
В результате проведенных исследований было выявлено, что все больные исходно имели вентиляционную недостаточность различной степени выраженности (табл. 4). Количество больных с ВН I–III степени примерно одинаково во всех группах, но преобладает ВН I степени. При анализе типов ВН установлено, что она обусловлена рестриктивными и обструктивными нарушениями (смешанный тип) у 12 (60,0 %) больных основной и у 11 (55,0 %) пациентов контрольной группы. Обструктивный тип ВН имел место у 14 (70,0 %) и 13 (65,0 %), а рестриктивный тип – у 2 (10,0 %) и 3 (15,0 %) соответственно. Сопутствующая бронхо-легочная патология была выявлена до операции у 15 (75,0 %) больных основной группы и у 16 (80,0 %) – контрольной группы.
До операции у больных в обеих сравниваемых группах ЖЕЛ в среднем составила 72,6 ± 2,6 % от должной, ФЖЕЛ – 73,2 ± 2,9 %, ОФвыд – 71,8 ± 3,8 %, МВЛ – 73,5 ± 3,1 %, МОД в среднем составил 122 ± 3,5 %, РД – 70 ± 2,7 %, ПОС – 61,2 ± 3,9 %, СОС 25–75 – 60,3 ± 4,1 %, максимальные объемные скорости выдоха: МОС 25 – 60,4 ± 3,1 %, МОС 50 – 61,5 ± 2,6 %, МОС 75 – 60,8 ± 2,4 %. В послеоперационном периоде (табл. 5) при проведении спирометрии через 5–7 дней после оперативного
Таблица 4
|
Степень ВН |
Основная группа (n=22) |
Контрольная группа (n=24) |
Всего (n=46) |
|
I степень |
12 (54,5 %) |
13 (55 %) |
25(54,3%) |
|
II степень |
6 (27,2 %) |
7 (29 %) |
13(28,2%) |
|
III степень |
4 (18,3 %) |
4 (16 %) |
8(17,5%) |
Выраженность вентиляционных нарушений у больных раком гортани и гортаноглотки до операции
Таблица 5
Динамика изменений показателей ФВД в зависимости от метода общей анестезии
|
Параметры ФВД |
До операции |
7 сут после операции |
||
|
Хе |
N2O |
Хе |
N2O |
|
|
ЖЕЛ, л |
4,11 ± 0,94 |
4,09 ± 0,46 |
3,50 ± 0,74 |
3,25 ± 0,64* |
|
ОФвыд, л/мин |
4,50 ± 0,45 |
4,46 ± 0,55 |
3,46 ± 0,57 |
2,03 ± 0,55* |
|
ПОС, л/мин |
5,16 ± 0,41 |
5,20 ± 0,40 |
4,96 ± 049 |
2,24 ± 0,40** |
|
МОС25, л/мин |
5,24 ± 0,50 |
5,21 ± 0,48 |
3,92 ± 0,55 |
2,40 ± 0,56** |
|
МОС50, л/мин |
3,92 ± 0,42 |
3,91 ± 0,41 |
4,92 ± 0,61 |
1,86 ± 0,02** |
|
МОС75, л/мин |
1,40 ± 0,21 |
1,95 ± 0,22 |
1,45 ± 0,24 |
0,60 ± 0,26** |
Примечание: * – различия статистически значимы по сравнению с исходным значением (р<0,05); ** – различия статистически значимы по сравнению с показателями основной группы (р<0,05).
лечения ЖЕЛ, характеризующая рестриктивные нарушения, снизилась в контрольной группе в среднем на 20 % (с 4,09 ± 0,46 до 3,25 ± 0,64), а в группе с использованием ксенона – на 15 % (с 4,11 ± 0,94 до 3,50 ± 0,74). Различия в группах не достоверны, хотя применение ксенона вызывает менее выраженные рестриктивные нарушения.
В контрольной группе с применением в качестве анестезии внутривенных анестетиков с закисью азота в послеоперационном периоде наблюдалось достоверно значимое ухудшение скоростных показателей выдоха, что указывает на наличие достаточно выраженных обструктивных нарушений. Так, в этой группе скоростные показатели выдоха уменьшились в среднем на 50–55 % по сравнению с дооперационными параметрами, различия статистически значимы (p<0,05). В группе же больных с использованием в качестве анестезии ксенона было отмечено снижение скоростных показателей выдоха в среднем на 20–25 % по сравнению с доопера-ционными, различия статистически не значимы (табл. 5). В группе контроля функциональные критерии обструктивных и рестриктивных нарушений были значимо ниже по сравнению с исходным уровнем. Это связано с выраженным ухудшением дренажной функции трахеобронхиального дерева, угнетением кашлевого рефлекса, накоплением в легких застойных участков, что клинически проявлялось в выраженном гипервентиляционном компоненте, связанном с компенсаторным учащением частоты и глубины дыхательных движений.
В исследовании было также отмечено, что СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2010. №1 (37)
анестезия ксеноном способствует значительно более быстрой адаптации организма к новому состоянию, что проявилось в улучшении вентиляционных нарушений, возникших в раннем послеоперационном периоде. Так, при спирографии через 7 сут после операции в группе больных с применением ксенона отмечено значительное увеличение скоростных показателей выдоха вследствие довольно быстрого
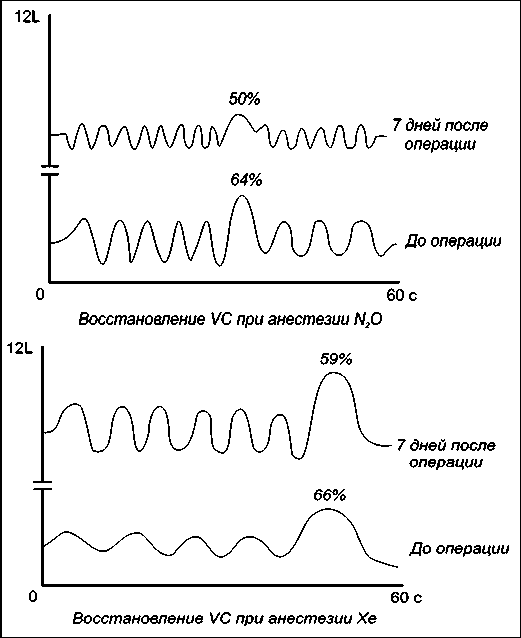
Рис. 1. Динамика изменений скоростных показателей ФВД на 7-е сут после операции в зависимости от метода анестезии восстановления дренажной функции бронхов (рис. 1). Установлено, что такие параметры, как ОФвыд, ПОС, МОС 25, 50, 75, в эти сроки были ниже дооперационных на 10–15 %, тогда как в группе с применением закиси азота аналогичные показатели выдоха оставались по-прежнему низкими (примерно на 30 % ниже по сравнению с дооперационными параметрами).
Анализируя течение раннего послеоперационного периода, в зависимости от способа анестезии следует отметить, что в целом из 31 больного с сопутствующей бронхо-легочной патологией у 18 (58,0 %) в послеоперационном периоде возникло обострение бронхита, у 4 (12,9 %) – острая пневмония. Из 22 наблюдений осложненного течения послеоперационного периода 17 (77,2 %) развились при использовании закиси азота и 5 (22,8 %) – при применении ксенонового наркоза. Различия статистически значимы (р≤0,05). При этом выявлены некоторые общие закономерности, у всех больных с респираторными осложнениями имелась сопутствующая бронхо-легочная патология, до операции отмечена та или иная степень вентиляционной недостаточности, причем ВН III степени – у 7 человек, которая проявлялась генерализованной обструкцией III степени. Обращает на себя внимание, что рестриктивные нарушения II степени (ЖЕЛ 59,2 ± 2,3 % от должных величин) выявлены во всех наблюдениях, эти пациенты были старше 60 лет.
Таким образом, отмечено, что имеющиеся до операции нарушения проходимости и дренажной функции бронхов способствуют развитию в послеоперационном периоде бронхо-легочных осложнений. Однако при использовании ксеноновой анестезии частота послеоперационных осложнений со стороны легких была достоверно меньше, почти в 3 раза, по сравнению с группой контроля. Использование ксеноновой анестезии при операциях по поводу рака горта- ни и гортаноглотки способствует более быстрой адаптации организма к новому состоянию, что проявляется быстрой компенсацией вентиляционных нарушений, возникающих в раннем послеоперационном периоде, и достоверному снижению послеоперационных осложнений со стороны дыхательной и сердечно-сосудистой систем.


