Сравнительная оценка пятилетних результатов билиопанкреатического шунтирования в модификациях SADI-S и Duodenal switch (Hess-Marceau)
Автор: Яшков Ю.И., Бордан Н.С., Малыхина А.И., Бекузаров Д.К.
Журнал: Московский хирургический журнал @mossj
Рубрика: Бариатрическая хирургия
Статья в выпуске: 1 (71), 2020 года.
Бесплатный доступ
Введение. Хотя в настоящее время операция билиопанкреатического шунтирования (БПШ) нечасто используется в метаболической хирургии, внедрение ее сравнительно новой модификации - SADI-S (Single Anastomosis Duodeno-Ileal + Sleeve) может возродить интерес хирургов к выполнению метаболических операций с гипоабсорбтивным компонентом. В литературе представлены лишь единичные публикации, посвященные сравнению эффективности двух видов пилоросохраняющих вариантов БПШ - модификации SADI-S и более известной модификации Hess-Marceau's - Duodenal Switch (BPD/DS).Цель настоящей работы: ретроспективная оценка пятилетних результатов операции SADI-S при длине общей петли 250 см (SADI-S 250) в сравнении со стандартной операцией БПШ в модификации Hess-Marceau (BPD/DS)Методы: в исследование были включены 226 пациентов, перенесших SADI-S 250 с продольной резекцией желудка (ПРЖ) в период с мая 2014 г по август 2019 г. Сахарный диабет 2-го типа (СД2) был диагностирован у 80 из них (35,4%). Пациенты, которым ПРЖ выполнялась ранее первым этапом, не были включены в исследование...
Билиопанкреатическое шунтирование, билиопанкреатическое отведение с выключением двенадцатиперстной кишки: одно-анастомозное билиопанкратической шунтирование, морбидное ожирение, сахарный диабет 2 типа, хирургическое лечение, продольная резекция желудка, процент потери избыточной массы тела, снижение массы тела, бариатрическая хирургия, метаболическая хирургия
Короткий адрес: https://sciup.org/142224464
IDR: 142224464 | УДК: 617-089 | DOI: 10.17238/issn2072-3180.2020.1.111-119
Текст научной статьи Сравнительная оценка пятилетних результатов билиопанкреатического шунтирования в модификациях SADI-S и Duodenal switch (Hess-Marceau)
SADI-S, как модификация БПШ и упрощенная альтернатива BPD/DS, впервые была описана A.Sanchez-Pernaute et al. в 2007 г. [8]. Дальнейшие публикации A.Sanchez Pernaute, A.Torres et al. показали ее высокую эффективность в отношении потери избыточной массы тела (ПИМТ), антидиабетического эффекта при малом числе осложнений и побочных эффектов, меньшей продолжительности операции, меньшей предрасположенности к развитию тонкокишечной непроходимости и ряде других преимуществ. Частота развития случаев белковой недостаточности, наблюдавшаяся этими авторами в 8% после SADI-S с длиной общей петли 200 см, была снижена путем удлинения общей петли до 250 см в последующей серии операций [9-11].
В более недавних публикациях другие авторы использовали иные названия при выполнении сходной техники операции: “Stomaсh Intestinal Pylorus Sparing” - SIPS (длина общей петли
-
- 300 см при диаметре калибровочного желудочного зонда 4042 F) [12], “Single-anastomosis loop Duodenal Switch” (SALDS) – DS с одним анастомозом, “Single-anastomosis-duodeno-jejunal bypass with SG” (SADJB-SG) - DS с одним анастомозом с ПРЖ и т.д. [13, 14].
В соответствии с положением IFSO, опубликованном в 2018 г, операция SADI-S/OADS, или, как ее еще называют-одно-анастомозный вариант BPD/DS была идентифицирована как модификация BPD/DS. Подчеркивалась необходимость проведения сравнительных исследований, особенно рандомизированных, между различными модификациями BPD/DS [15]. Существует всего несколько исследований, посвященных сравнению результатов SADI-S и операцией гастрошунтирования в классическом варианте [16,17], в то время как информация о сравнительной оценке BPD/DS в одно- или двух анастомозном вариантах остается очень скудной [18,19,22]. В данной статье мы проанализировали пятилетние результаты БПШ в модификации SADI-S, сопоставив их ретроспективно с соответствующими результатами БПШ в модификации Hess- Marceau's (BPD/DS) в серии операций, выполненных в период с 2003 г. по 2015 гг.
Материалы и методы. В период с ноября 2003 г по июнь 2015 г в клинике АО ЦЭЛТ (с 2011 г - Европейский центр высокого качества в области бариатрической и метаболической хирургии) было выполнено 528 операций BPD/DS из лапаротомного доступа. Начиная с мая 2014 г., мы начали выполнять на альтернативной основе БПШ в модификации SADI-S с длиной общей петли 250 см, по методике, описанной в 2007 г A.Sanchez-Pernaute с соавт. [8]. После получения первых положительных результатов SADI-S с июня 2015 года в нашей практике эта операция стала преобладающей среди бариатрических операций с шунтирующим компонентом. По август 2019 года в нашей базе данных были зарегистрированы 226 пациентов, перенесших БПШ в модификации SADI-S и 528 пациентов, перенесших BPD/DS (Табл. 1).
Сахарный диабет 2-го типа (СД2) был диагностирован у 80 (35,4 %) пациентов из группы SADI-S и у 138 из 528 (26,1 %) в группе перенесших BPD/DS.
Хотя мы обычно используем лапароскопический доступ для выполнения ПРЖ как самостоятельной операции, все модификации БПШ выполнялись открытым способом через срединный или поперечный (в первые годы освоения BPD/DS) разрезы. На этапе выполнения ПРЖ использовали зонд диаметром 36 F или 40F, но, как правило, оставляли дополнительное пространство
Таблица 1
Распределение пациентов, перенесших BPD/DS и SADI-S в разные периоды.
|
Ноябрь 2003-Май 2014 |
Maй 2014- Maй 2015 |
Июнь 2015 – Август 2019 |
Общее |
|
|
BPD/DS (n) |
489 |
33 |
6 |
528 |
|
SADI-S (n) |
- |
45 |
181 |
226 |
|
Общее |
754 |
Таблица 2
Данные о пациентах, перенесших SADI-S и BPD/DS
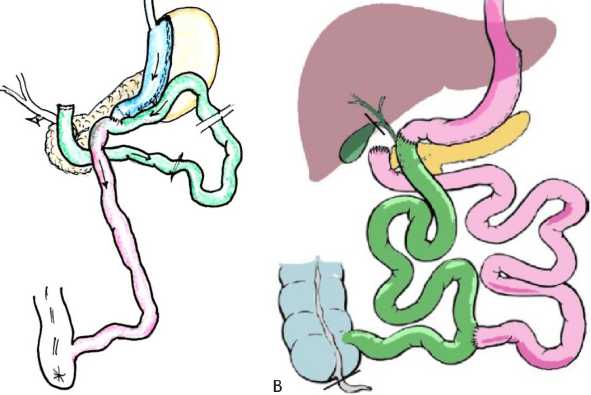
Рис. 1 Схемы операций SADI-S (A) и BPD-DS (B)
Таблица 3
Процент пациентов, прослеженных в различные сроки в течение 5-летнего периода наблюдения после SADI-S и BPD/
|
% прослеженных пациентов |
|||||||||
|
3 мес |
6 мес |
9 мес |
12 мес |
18 мес |
24 мес |
36 мес |
48 мес |
60 мес |
|
|
SADI-s |
94.6 |
94.0 |
91.0 |
91.9 |
84.6 |
79.1 |
71.6 |
83.0 |
90.0 |
|
BPD/ DS |
98.7 |
97.7 |
96.2 |
94.7 |
92.2 |
87.1 |
79.6 |
70.7 |
61.4 |
Всегда использовали общую анестезию в комбинации с перидуральной аналгезией, последняя продолжалась в течение 4-5 дней после операции. Пациентов активизировали через 2-4 часа после операции и при гладком течении выписывали на 5-6-й день. Всем пациентам проводилось превентивное лечение антибиотиками и Н-2 блокаторами, Антикоагулянты (низкомолекулярные гепарины) назначались всем оперированным в течение 30-ти дней после операции. С третьей недели пациенты начинали принимать витаминно-минеральные добавки, включающие препараты кальция с витамином D 2 г в сутки, сульфат железа 325 г в сутки, мультивитамины, витамины А, Е, К. Алгоритм послеоперационного наблюдения с лабораторным мониторингом был стандартным для бариатрических операций: каждые 3 месяца в течение 1-го года, каждые 6 месяцев в течение 2-го года и ежегодно после этого. Нам не удалось получить сведений от 4 из 226 пациентов (1,77%) в группе SADI-S и от 4 из 526 пациентов (0,76%) в группе перенесших BPD/DS. Таким образом, общий процент пациентов, прослеженных в отдаленные сроки, в группах составил соответственно 98,2 и 99,2%, хотя некоторые пациенты пропускали промежуточные контрольные сроки. Процент пациентов, прослеженных в различные сроки после обеих операций, представлен в табл. 3.
Данные о % ПИМТ, динамике метаболических показателей, осложнениях и частоте ревизий в группе SADI-S сравнивались с соответствующими результатами BPD/DS Hess - Marceau. ПИМТ (% EWL), согласно рекомендациям IFSO, подсчитывался по формуле:
Потерянная масса тела (в кг)
ПИМТ ( % EWL) = ---------------------------------х 100%,
Избыточная МТ до операции (начальная МТ - идеальная МТ)
где идеальная МТ была рассчитана как рост 2 (м2) х 25 (верхний уровень нормального ИМТ).
Информация о липидном профиле, уровне гликемии, HbA1C была получена из Российского национального бариатрического регистра, куда данные об оперированных нами пациентах вносились с 2014 года.
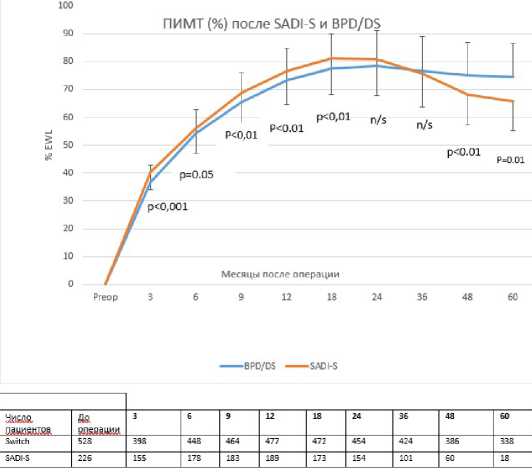
Рис. 2 Процент потери избыточной массы тела (ПИМТ) после SADI-s и BPD-DS в сроки наблюдения до 5 лет. Число пациентов, которые наблюдались в течение первых 5 лет в обеих группах, представлено в нижней части таблицы.
Для оценки статистической значимости параметров сравнения между группами был использован Т-test. Значение P <0,05 рассматривалось как статистически значимая разница.
Результаты
Динамика снижения избыточной МТ в группах SADI-S и BPD/DS представлена на рис. 2.
К концу первого – началу второго года после операций ПИМТ был незначительно, но статистически значимо лучше после SADI-S (77,0% против 73,3% в группе BPD/DS; p <00,1). По итогам 24-36 месяцев показатели % EWL после SADI-S и BPD/ DS были сопоставимы. К 4-му и 5-му годам больший % ПИМТ отмечался после BPD/DS, чем после SADI-S (75,0 % против 68,0 %, p <0.001 и 74,6 % против 65,8%
30-дневная летальность была минимальной в обеих группах
Таблица 4
Частота ранних (30-дней после операции) осложнений после SADI-S, по сравнению с BPD/DS
|
SADI-S (n-226) |
Switch (n-528) |
|
|
Ранние осложнения |
||
|
Раневая инфекция |
1 (0,44%) |
6 (1,13%) |
|
Пневмония |
1 (0,44%) |
5 (1 смертельный исход) |
|
Внутрибрюшной абсцесс, дренирование |
1 (0,44%) |
1 (0,19%) |
(0,44% после SADI-S и 0,38% после BPD/DS) при одном летальным исходе в период нахождения пациента в стационаре (0,13% на 754 оперированных). В группе SADI-S из 226 оперированных пациентов одна пациентка 47 лет умерла на 16-й день вскоре после релапаротомии по поводу поддиафрагмального абсцесса, выполненной в больнице по месту жительства. В группе BPD/ DS из 528 пациентов один пациент мужского пола в возрасте 45 лет, страдавший тяжелой формой сонного апноэ, умер от присоединившейся пневмонии, далее осложнившейся эвен-трацией на фоне выраженного кашля и остановкой сердца в ходе релапаротомии. Еще одна пациентка (женщина, 57 лет, исходный ИМТ-53,3 кг/м2) умерла от тромбоэмболии легочной артерии уже после выписки из клиники на 15 день после BPD/DS.
Частота осложнений, наблюдавшихся в течение 30 дней после операции, была ниже в группе SADI-S (2,65%) против 5,1% в группе BPD/DS (табл 4). У пациентов, перенесших SADI-S 250, отмечен меньший процент развития белковой недостаточности, а также поздней тонкокишечной непроходимости, по сравнению с BPD/DS. К данному периоду времени не было выявлено симптоматического дефицита кальция и остеопении после SADI-S. В то же время, у 7,5% пациентов в группе SADI отмечены симптомы билиарного и / или гастроэзофагеального рефлюкса, что явилось основным показанием для реконструкции SADI-S в BPD/DS. Так из девяти пациентов, которым после SADI-S потребовались повторные операции, у шести основанием для их выполнения явился именно билиарный рефлюкс). После БПШ в модификации Hess-Marceau повторные операции в сроки до 15 лет потребовались 13,3% из 528 пациентов, что составило 0,89% в год. Это были ревизии, направленные как на улучшение результатов первичной операции (n-31), так и для лечения побочных эффектов и осложнений после первичной бариатрической операции (n-39). В зависимости от причины (белковая недостаточность, дефицит кальция, непереносимость побочных явлений после операции) и общего состояния пациента после BPD/DS реконструктивные операции заключались в дополнительном (частичном или полном) включении БП в процесс пищеварения посредством переноса энтеро-энтеро анастомоза или создания дополнительного высокого межкишечного анастомоза между АП и БП.
Из 80 пациентов с СД2, перенесших SADI-S, 70 пациентов были прослежены в отдаленные сроки до пяти лет. Из 70 пациентов 65 (92,9%) достигли полной ремиссии СД2 (глюкоза <7,0 ммоль / л, HbA1C <6,5% [29]), еще у 5 (7,1%) наблюдалась частичная ремиссия СД2 через 3-4 года после операции. Эти пациенты продолжали принимать таблетированные сахароснижающие препараты, причем один из них вернулся к небольшим дозам инсулина. Из 138 пациентов с СД2, перенесших BPD/DS с 2003 года, в течение пятилетнего периода были прослежены 70 пациентов, причем у 65 из них (92,9%) отмечена полная ремиссия СД2, сохранявшаяся и после пятилетнего срока. У остальных 5 (7,1%) отмечена неполная ремиссия СД2 в окончательные сроки наблюдения. Рис. 3 и 4 иллюстрируют метаболические
p<0,05
HbAIc (%)
preoperatively 3 months 1 year 3 years
■ Switch eSADI-S P<0,05
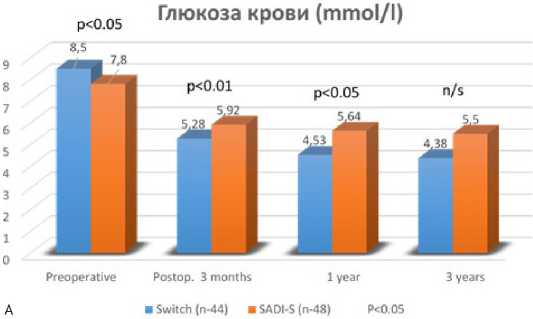
Рис. 3 Глюкоза в крови (A) и гликированный гемоглобин HbA1C (B) у пациентов с сахарным диабетом 2 типа после SADI-S (n-48) и BPD/DS (n-44)
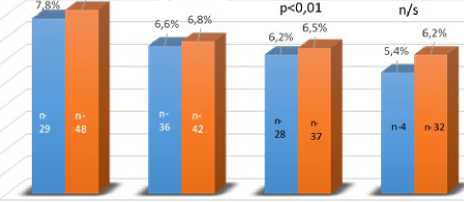
параметры пациентов, которые были включены в Российский национальный бариатрический регистр. Показатели глюкозы и гликированного гемоглобина (HbA1C) в крови после BPD/ DS в сроки от одного до трех лет были достоверно ниже, по сравнению c результатами после SADI-S (рис.3). Уровень общего холестерина (ОХС) в период до трех лет среди пациентов, включенных в Регистр, был также достоверно ниже после BPD/DS, хотя и после операции SADI-S отмечено значительное снижение исходной холестеринемии, по сравнению с дооперационными показателями. Уровень триглицеридемии во все периоды наблюдения был сопоставим при обоих видах операций (рис.4).
Клинические проявления билиарного рефлюкса и / или рефлюкс-эзофагита наблюдались у 17 (7,5%) пациентов после SADI-S, в то время как после BPD/DS клинически выраженного рефлюкса не было отмечено.
Дискуссия. Согласно IFSO Statement (2018), SADI-S в настоящее время рассматривается как разновидность билиопанкре-атического шунтирования с выключением двенадцатиперстной кишки - BPD/DS (Duodenal Switch). Для идентификации SADI-S как самостоятельной операции IFSO рекомендовала проведение сравнительных исследований в сопоставлении с BPD/DS [15]. По нашим сведениям, это первая публикация, касающаяся сравнительной оценки 5-летних результатов SADI-S в сравнении со значительной группой пациентов, перенесших BPD/DS (Hess-Marceau), при этом обе разновидности операции выполнялись одной и той же хирургической группой в одном и том же центре.
В единственной доступной публикации, посвященной промежуточным результатам проспективного рандомизированного исследования, сравнивались результаты лапароскопических операций SADI-S и BPD/DS, выполнявшихся в двух разных центрах Испании (один Центр специализировался на SADI-S, а другой-на BPD/DS), и было показано меньшее количество ранних осложнений (5% после SADI-S против 11% в группе BPD/DS), а также меньшее число повторных операций (3,1% против 6% соответственно) после операции SADI-S [18]. Наши 5-летние ретроспективные данные подтвердили, что внедрение в практику технически более простой модификации SADI-S позволила снизить частоту осложнений БПШ в первые 30-дней с 5,1 % в группе BPD/DS до 2,6% в группе пациентов, перенесших SADI-S. Более того, по нашим данным, практически вдвое (с 0,55% до 0,26 % в год) снизилась также частота белковой недостаточности, как и число случаев развития поздней тонкокишечной непроходимости (с 0,4% до 0,26% в год).
Хотя авторы и сторонники модификации SADI-S (A. Sanchez-Pernaute, A. Torres et al.) продемонстрировали ПИМТ около 100 % в своей первой серии операций с длиной ОП как 200 см, так и 250 см [11], по данным этих авторов, у 8% больных в серии операций с ОП 200 см, было отмечено развитие белковой недостаточности. Это дало основания в нашей работе при внедрении SADI-S ориентироваться на стандартную длину ОП равной 250 см. В нашей серии SADI-S 250 максимальный процент ПИМТ- составлял 81,0 % к двум годам после операции и был сопоставим с ПИМТ в BPD/DS - группе (78,5 %) к аналогичному периоду, но стабильность потери веса в сроки наблюдения 4 и 5 лет после операции SADI-S была меньше, чем в BPD/DS-группе. Необходимо дальнейшее наблюдение с большим количеством случаев и более длительным периодом наблюдения для оценки стабильности потери веса после SADI-s в течение последующих лет. Х. Zaveri et al [19] сообщили, что к
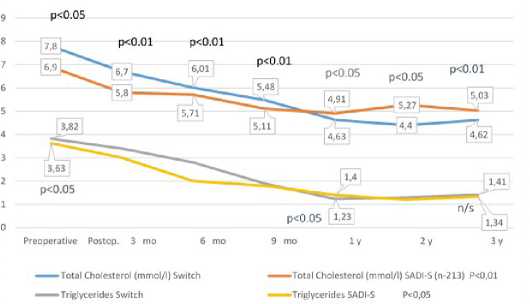
Рис. 4 Динамика липидного состава крови после SADI-S и BPD/DS
4-му году после SADI-S показатель ПИМТ составил 85,7% по сравнению с 68,0% в нашей группе с сопоставимым исходным ИМТ и количеством пациентов, доступных для послеоперационного контроля.
Полная ремиссия СД2 была достигнута у 92,9 % из 70 пациентов, перенесших SADI-S и прослеженных в отдаленные сроки. Сходный процент полной ремиссии СД2 был получен в группе BPD/DS в течение 15 лет наблюдения после BPD/DS в модификации Hess-Marceau. Ранее мы публиковали данные о 70 пациентах с СД2, наблюдавшихся в течение 5 и более лет после BPD/DS (Hess-Marceau), где в 98,6% случаев было зафиксировано достижение полной ремиссии СД2 в течение пятилетнего периода после операции [20].
A.Sanchez-Pernaute et al. выявили сопоставимую с нашими данными частоту ремиссии СД 2 после SADI-S (92,5; 96,4 и 75% до 1,3 и 5 лет соответственно), но у пациентов, получавших инсулин до операции, по данным этих авторов, процент больных с ремиссией был значительно меньше к тем же срокам (47;56 и 38,4% соответственно) [10]. Оба исследования, включая наше, показали частичную потерю антидиабетического эффекта через 3 и более лет после операции SADI-S, и некоторым пациентам пришлось вернуться к сахароснижающей терапии. Вероятно, что более короткая ОП после BPD/DS (60-100 см), в отличие от 250 см после SADI-S, обеспечивает не только более стабильное снижения МТ в сроки более 3 лет, но и более выраженный и устойчивый антидиабетический и гиполипидемический эффекты (рис 3 и 4). Возможно, что после операции SADI-S наряду с ОП, равной 250 см, небольшой (примерно 50-70 см) участок приводящей части БП может участвовать в процессе всасывания пищи. О такой возможности свидетельствует нередко наблюдаемая регургитация в приводящую петлю рентгеноконтрастного вещества, принятого per os, при проведении рентгенологического исследования желудочного рукава и анастомоза после операции SADI-S. Другой причиной увеличения абсорбции в подвздошной кишке в отдаленном периоде может быть т. н. «феномен кишечной адаптации», описанный ранее Скопинаро в его серии операций БПШ [21]. Так, при выполнении повторных операций мы, как правило, наблюдали гипертрофию ОП как при SADI-S 250, так и при BPD/DS, причем в последнем случае гипертрофировалась также и АП. Длина ОП, измеренная на растянутой петле и изначально рассчитанная как 250 см, спустя несколько лет увеличивалась до 300 и даже до 450 см, что, безусловно, со временем могло сказаться как на потере веса, так и на метаболической эффективности операции. Хотя в целом метаболический эффект SADI-S мы расцениваем как очень хороший, для пациентов с клинически выраженными проявлениями СД2, особенно находящихся на инсулинотера-пии, операция в варианте BPD/DS (Hess- Marceau) может быть более предпочтительной альтернативой, по сравнению с SADI-S.
Желчный рефлюкс является редким (7,5%), но вполне возможным побочным эффектом SADI-S, хотя последняя является пилоросохраняющей операцией. Его развитие могут определять изначальная недостаточность замыкательной функции привратника, малое (менее 2 см) расстояние от привратника до уровня пересечения ДПК, деформация дуоденоилеоанастомоза в процессе его формирования. Открытая техника наложения анастомоза позволяет выполнить его качественно практически во всех случаях, как при операциях BPD/DS, так и при SADI-S. Начиная с 2004 года, в серии из 754 пилоросохраняющих операций БПШ мы наблюдали лишь один случай несостоятельности дуоденоилеоанастомоза, связанный с прорезыванием подвешивающего шва.
Хотя в настоящее время SADI-S чаще используется как операция второго этапа после рукавной гастрэктомии или других бариатрических операций [23-25], опыт наш и некоторых других авторов позволяют рекомендовать эту модификацию БПШ и в качестве первичной бариатрической / метаболической операции не только у пациентов с сверхожирением, но и у пациентов с ИМТ менее 50 кг/м2, особенно когда требуется достижение метаболического эффекта при СД2. Сравнительное исследование A. Cottam et al. показало определенные преимущества SADI-S, по сравнению с гораздо более популярной операцией — гастрошунтированием по Ру (Roux-en-Y Gastric bypass) с точки зрения меньшей частоты рвоты, язв, необходимости послеоперационной эндоскопии. Потеря веса была аналогичной в сравниваемых группах, по крайней мере до 18 месяцев наблюдения [16,26].
Ревизионная хирургия после BPD/DS и SADI-S может быть предметом специального обсуждения в литературе. В наших наблюдениях основной причиной реконструкций после SADI-S был симптоматический билиарный рефлюкс (6 случаев). Все эти операции производились из мини-лапаротомии в ходе абдоминопластики; выполнялось отсечение приводящей петли (БП) вблизи дуоденоилеоанастомоза с наложением дополнительного межкишечного анастомоза по Ру, отступя 30-50 см от дуоденоилеоанастомоза (конверсия SADI-S в Switch). Наложение дополнительного илео-илеоанастомоза на Ру-петле может быть оптимальным решением при билиарном рефлюксе и при повторном наборе веса после SADI-S и, таким образом, BPD/DS может и в настоящее время иметь значение в метаболической хирургии.
Как и ожидалось, операция SADI-S продемонстрировала некоторые очевидные преимущества, по сравнению с BPD/DS: сокращение времени операции и упрощение за счет наложения одного анастомоза вместо двух. При SADI-S нет необходимости ушивать мезентериальные дефекты для профилактики внутренних грыж. Внедрение SADI-S как альтернативы BPD/ DS позволила существенно снизить частоту ранних послеоперационных осложнений, а также поздней тонкокишечной непроходимости. SADI-S представляется более «мягкой» операцией в плане частоты диареи, нежелательных метаболических эффектов, но не элиминирует полностью проблему билиарного рефлюкса, что, по нашим наблюдениям, и являлось основным показанием к выполнению повторных операций. Являясь более простым и безопасным вариантом, чем известная стандартная методика BPD/DS, SADI-S 250, на наш взгляд, не должна рассматриваться как экспериментальная или исследовательская операция [27]. Тем не менее, с точки зрения стабильности потери веса в сроки после трех лет наблюдения и устойчивости антидиабетического эффекта, а также как вариант повторной операции BPD/DS в модификации Hess-Marceau не следует исключать из арсенала операций метаболической направленности. Обе пилоросохраняющие модификации БПШ (одно - и двуханастомозный DS) в настоящее время и в перспективе можно рассматривать не только в качестве повторных, но и как первичные операции по аналогии с одно - и двуханастомозным желудочным шунтированием [28].
Список литературы Сравнительная оценка пятилетних результатов билиопанкреатического шунтирования в модификациях SADI-S и Duodenal switch (Hess-Marceau)
- Buchwald H., Estok R., Fahrbach K., et al. Weight and type 2 diabetes after bariatric surgery: systematic review and meta-analysis. Am J Med, 2009, 122(3), pp. 248-56. e5
- Angrisani L., et al. Bariatric surgery and endoluminal procedures: IFSO Worldwide Survey 2014. Obes Surg, 2017.
- Scopinaro N., Adami G.F., Marinari G.M., et al. Biliopancreatic diversion. World J Surg, 1998, 22(9), pp. 936-46.
- Hess D.S., Hess D.W. Biliopancreatic diversion with a duodenal switch. Obes Surg, 1998, 8(3), pp. 267-82.
- Marceau P. et al. Biliopancreatic diversion with gastrectomy as surgical treatment of morbid obesity. Obes Surg, 1991, 1(4), pp. 381-7.
- Hess D.S., Hess D.W., Oakley R.S. The biliopancreatic diversion with the duodenal switch: results beyond 10 years. Obes Surg, 2005, 15, pp. 408-16.
- Marceau P., Biron S., Hould F.S., et al. Duodenal switch: long-term results. Obes Surg, 2007, 17, pp. 1421-30.
- Sanchez-Pernaute A., Rubio Herrera M.A., Pe'rez-Aguirre E., et al. Proximal duodenal-ileal end-to-side bypass with sleeve gastrectomy: proposed technique. Obes Surg, 2007, 17, pp. 1614 - 1618.
- Sánchez-Pernaute, A., Herrera, M.A. R., Pérez-Aguirre et al. Single Anastomosis Duodeno-Ileal Bypass with Sleeve Gastrectomy (SADI-S). One to Th ee-Year Follow-up. Obesity Surgery, 2010, 20(12), pp.1720-1726.
- Sanchez-Pernaute A., Rubio M.A., Cabrerizo L., et al. Singleanastomosis duodenoileal bypass with sleeve gastrectomy (SADI-S) for obese diabetic patients. Surg Obes Relat Dis, 2015, 11, pp. 1092-1098.
- Sánchez-Pernaute, A., Rubio, M.Á., Pérez Aguirre, E., et al. Single-anastomosis duodenoileal bypass with sleeve gastrectomy: metabolic improvement and weight loss in fi st 100 patients. Surgery for Obesity and Related Diseases, 2013, 9(5), pp. 731-735.
- Mitzman B, Cottam D, Goriparthi R, et al. Stomach intestinal pylorus sparing (SIPS) surgery for morbid obesity: retrospective analyses of our preliminary experience. Obes Surg, 2016, 26, pp. 2098 -2104.
- Shoar S., Poliakin L., Rubenstein R. et al. Single Anastomosis Duodenoileal Switch (SADIS): a systematic review of effi acy and safety. Obes Surg, 2017, 27, pp.1302-8.
- Topart P., Becouarn G. The single anastomosis duodenal switch modifi ations: a review of the current literature on outcomes. Surg Obes Rel Dis, 2017, 13, pp.1306-12.
- Brown W.A., Ooi G., Higa K., et al. Single Anastomosis DuodenalIleal Bypass with Sleeve Gastrectomy/One Anastomosis Duodenal Switch (SADI-S/OADS) IFSO Position Statement. Obesity Surgery, 2018, 28, pp. 1207-16.
- Prachand V.N., Ward M., Alverdy J.C. Duodenal Switch Provides Superior Resolution of Metabolic Comorbidities Independent of Weight Loss in the Super-obese (BMI≥50 kg/m2) Compared with Gastric Bypass. Journal of Gastrointestinal Surgery, 2009, 14 (2), pp. 211-220.
- Lee Y, Ellenbogen Y, Doumouras AG et al. Single or double-anastomosis duodenal switch versus Roux-en-Y gastric bypass as a revisional procedure for sleeve gastrectomy: A systematic review and meta-analysis. Surgery for Obesity and Related Diseases, 2019, 15(4), pp. 556-566.
- Ruiz A.G., Santshez-Pernaute A., Badia A.C. et al. Laparoscopic Duodenal Switch: one or two loops? SOARD, 2015, pp. S56-S211.
- Zaveri H., Surve A., Cottam D., et al. Midterm 4-Year Outcomes with Single Anastomosis Duodenal-Ileal Bypass with Sleeve Gastrectomy Surgery at a Single US Center. Obes. Surg, 2018 Oct, 28(10), pp. 3062-3072.
- DOI: 10.1007/s11695-018-3358-x
- Ершова Е.В., Яшков Ю.И. Состояние углеводного и липидного обмена у пациентов с ожирением и сахарным диабетом 2 типа после билиопанкреатического шунтирования // Ожирение и метаболизм. 2013. №3(36). С. 28-36.
- Ershova Е.V., Yashkov Y.I. Status of carbohydrate and lipid metabolism in obese patients with type 2 diabetes mellitus after biliopancreatic di- version surgery. Obesity and metabolism (Rus), 2013, 3(36), pp. 28-36. (in Russ)
- Scopinaro N. Biliopancreatic Diversion: Mechanisms of Action and Long-Term Results. Obesity Surgery, 2006, 16(6), pp. 683-689.
- Cottam A., Cottam D., Portenier D., et al. A matched cohort analysis of stomach intestinal pylorus saving (SIPS) surgery versus biliopancreatic diversion with duodenal switch with two -year follow-up. Obes Surg, 2016, 27, pp. 454 - 461.
- Balibrea J.M., Vilallonga R., Hidalgo M. et al. Mid-Term Results and Responsiveness Predictors After Two-Step Single-Anastomosis Duodeno-Ileal Bypass with Sleeve Gastrectomy. Obes Surg, 2017, 27(5), pp. 1302-1308.
- Sánchez-Pernaute A., Rubio M.Á., Conde M., et al. Single-anastomosis duodenoileal bypass as a second step after sleeve gastrectomy. Surgery for Obesity and Related Diseases, 2015 a, 11(2), pp. 351-355.
- Wu A., Tian J., Cao L. et al. Single-anastomosis duodeno-ileal bypass with sleeve gastrectomy (SADI-S) as a revisional surgery. Surgery for Obesity and Related Diseases, 2018, 14 (11), pp. 1686-1690.
- Cottam A., Cottam D., Medlin W., et al. A matched cohort analysis of single anastomosis loop duodenal switch versus Roux-en-Y gastric bypass with 18-month follow up.
- Kim J. American Society for Metabolic and Bariatric Surgery statement on single-anastomosis duodenal switch. Surgery for Obesity and Related Diseases, 2016, 12(5), pp. 944-945.
- De Luca M., Tie T., Ooi G. et al. Mini Gastric bypass - one anastomosis gastric bypass (MGB-OAGB) - IFSO position statement. Obesity Surgery, 2018 (28), pp. 1188-1206.
- Buse J.B., Caprio S., Cefalu W.T. et al. How we defi e cure of Diabetes? Diabetes Care, 2009, 32, pp. 2133-5.


