Сравнительная оценка результатов хирургического лечения локализованного и местно-распространенного рака тела матки
Автор: Ушаков Игорь Иванович, Артошина Екатерина Александровна, Брюсов П.Г., Названцев И.В., Леваков С.А., Кедрова А.Г.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3 (3), 2010 года.
Бесплатный доступ
Представлен собственный опыт авторов и их оригинальные методики по выполнению тазовой и парааортальной лимфаденэктомии у больных раком тела матки (РТМ). После проведенного анализа 145 случаев хирургического стадирования РТМ выявлены неблагоприятные факторы, требующие расширения стандартного объема операции или дополнительного лечения.
Рак тела матки, факторы прогноза, тазовая и парааортальная лимфаденэктомия
Короткий адрес: https://sciup.org/14338336
IDR: 14338336
Текст научной статьи Сравнительная оценка результатов хирургического лечения локализованного и местно-распространенного рака тела матки
Актуальность совершенствования методов лечения рака тела матки (РТМ) обусловлена двумя причинами: двукратным приростом заболеваемости за последние 20 лет [1, 2] и повышением удельного веса редких морфологических форм опухоли, имеющих неблагоприятный отдаленный прогноз (железисто-плоскоклеточный, светлоклеточный, серозно-папиллярный и недифференцированный раки) [3]. Кроме того, в течение последних 10 лет отмечено снижение среднего возраста заболевших РТМ вследствие выявления заболевания в более молодом возрасте, от 50 до 60 лет [4].
Ключевую роль в выборе тактики лечения больных РТМ имеют правильные стандарты стадирования заболевания. Установление клинической стадии по исследованию длины полости матки зондом и данных общего обследования никогда не удовлетворяли клиницистов, так как почти у трети больных распространенность процесса устанавливалась неверно, а микрометастазы в яичники, тазовые и поясничные лимфатические узлы не выявлялись вообще. В связи с чем, в 1988 г. были пересмотрены рекомендации Международной федерации акушеров-гинекологов (FIGO), в которых предписывалось проводить определение стадии РТМ по результатам хирургического вмешательства. Эта классификация применяется до сих пор. В ней учитываются такие классические клинико-морфологические факторы прогноза, как глубина инвазии миометрия, распространение на шейку матки, метастазы в яичники, тазовые и поясничные лимфатические узлы, поражение органов малого таза, наличие опухолевых клеток в смывах из брюшной полости и отдаленных метастазов [5]. Определение стадии РТМ на основании клинических данных в настоящее время проводится только у тех больных, у которых хирургическое лечение невозможно [6]. Наряду с важными характеристиками первичной опухоли (степени дифференцировки и инвазии, ее объем) оценка метастатического поражения регионарных лимфатических узлов была признана в крупных международных исследованиях независимым фактором прогноза. Необходимость лимфаденэктомии у больных РТМ изучена в крупном-масштабном исследовании, включавшем 39 396 пациенток (средний возраст 65 лет). Из них 12 333 (31,3%) больных были оперированы с лимфаденэктомией, а остальные – в объеме простой экстирпации матки с придатками. 5-летняя выживаемость в общей группе составила 93,3; 85,4; 69,3 и 38,3% у больных РТМ с FIGO I-IV стадиями соответственно. 5летняя выживаемость в группе с лимфаденэктомией – 95,5; 90,4; 73,0 и 53,3% по сравнению с 96,6; 82,3; 61,2 и 28,2% в группе без лимфаденэктомии. Только при I стадии заболевания и высокой дифференцировке опухоли не было преимущества в выживаемости. Эти данные показали необходимость лимфаденэктомии у больных РТМ [28]. При I клинической стадии метастазы в тазовые лимфатические коллекторы после операции обнаруживаются у 10% больных, в поясничные – у 6%, что повышает риск прогрессирования в 6 и более раз [8]. По данным Онкогинекологической исследовательской группы (GOG), важнейшим прогностическим фактором при РТМ является наличие или отсутствие метастазов в поясничные лимфатические узлы [9]. Один из основных факторов в развитии рецидивов и прогрессирования РТМ – неадекватный объем оперативного вмешательства на регионарных лимфатических коллекторах и смежных тканях [10, 11]. Основным аргументом за расширение хирургического объема служат лучшие отдаленные результаты лечения и то, что лимфаденэктомия дает возможность не только удалить метастазы, но и определить основной фактор прогноза – наличие метастазов в лимфатических узлах, что позволит более точно определить группу пациенток, которые нуждаются в дальнейшей лучевой терапии или химиотерапии.
В связи с этим изучение и оценка целесообразности выполнения расширенной гистерэктомии с трансперитонеальной па-рааортально-тазовой лимфодиссекцией при РТМ представляется актуальной проблемой современной онкогинекологии.
Цель исследования – сравнительная оценка результатов хирургического лечения больных локализованным и местнораспространенным РТМ, включающего па-рааортально-тазовую лимфодиссекцию.
Материалы и методы
Исследование выполнено у 145 больных с гистологически верифицированным РТМ IA-IIIC стадий, которым проводили лечение в ГВКГ им. Н.Н. Бурденко МО РФ и в Онкологическом диспансере № 3 Восточного административного округа г. Москвы.
Возраст больных составлял от 30 до 89 лет (средний возраст 65 ± 5,8 лет). Большинство из них входили в возрастной промежуток 65-70 лет. На момент выявления РТМ 20 (13,79%) пациенток находились в репродуктивном периоде жизни, 28 (19,31%) – в пременопаузе и большинство (66,9%) – в постменопаузе. Среди больных РТМ IА-IIВ стадий отмечали значительное число пациенток пожилого и старческого возраста, в большинстве случаев с отягощенной сопутствующей патологией сердечно-сосудистой, дыхательной, пищеварительной, эндокринной систем. Опухоль тела матки в исследуемой группе ассоциировалась с умеренной степенью дифференцировки, 51,03% пациенток по классификации TNM были определены в группу T1aN0M0.
Основная жалоба при первичном обращении у 114 (79%) пациенток была на кро- вянистые выделения в менопаузе, мено-метроррагии – у 13 (9%).
Гистологическую верификацию диагноза проводили до операции. Морфологические формы опухоли: аденокарцинома – у 134 (92,4%) больных, светлоклеточный рак – у 2 (1,4%), серозный папиллярный рак – у 3 (2,1%); тяжелая атипическая гиперплазия эндометрия – у 6 (4,1%).
Всем больным РТМ выполнено хирургическое лечение в следующих объемах: экстрафасциальная экстирпация матки с придатками и резекция верхней трети влагалища (ЭМП), расширенная экстирпация матки с придатками (РЭМП). ЭМП выполнена у 82 (56,55%) больных – первая группа, 63 (43,45%) – РЭМП. В последней группе техника и хирургические подходы отличались. Например, 33 больным выполнена пангистерэктомия I типа с тазовой лимфодиссекцией и 30 – пангистерэктомия II типа с парааортально-тазовой лим-фодиссекцией.
Cтадирование больных РТМ проведено в соответствии с классификацией FIGO (1988) и Международного противоракового союза по системе TNM (2002) для рака тела матки (табл.1).
Распределение больных РТМ по стадиям (TNM, FIGO)
Таблица 1
|
TNM |
Число больных |
FIGO |
|
|
Абс. |
% |
||
|
Т1а N0M0 |
78 |
53,8 |
IA |
|
Т1b N0M0 |
27 |
18,6 |
IB |
|
Т1c N0M0 |
7 |
4,8 |
IC |
|
Т2а N0M0 |
12 |
8,4 |
IIA |
|
Т1b N0M0 |
3 |
2,1 |
IIB |
|
Т3а N0M0 |
2 |
1,4 |
IIIA |
|
Не определена |
16 |
11,1 |
– |
|
Всего |
145 |
100 |
– |
Тазовую лимфодиссекцию выполняли перед удалением матки с придатками. При удалении лимфатических узлов в области бифуркации нижней полой вены и аорты сохраняли срединную крестцовую вену, верхнее гипогастральное сплетение (рис. 1).
"J-I"-образным разрезом по Дире-Фон-танелли (Di Re-Fontanelli) вскрывали брюшину парааортальной области и боковых каналов. Техника операции разработана Di Re et al. в 1987г. (рис.2, 3).
При удалении лимфатических узлов слева от аорты нижнюю брыжеечную артерию сохраняли. Выделяли левые яичниковые сосуды, которые после перевязки и прошивания пересекали у основания и отводили к матке. Удаляли клетчатку и лимфатические узлы вдоль общих подвздошных, наружных подвздошных сосудов и в области обтураторной ямки. Бедренные и бедренно-половые нервы сохраняли с
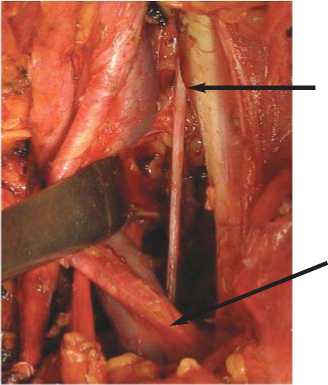
Обтураторный нерв
Общая подвздошная артерия
Рис. 3. Вид операционного поля после выполнения тазовой лимфодиссекции.
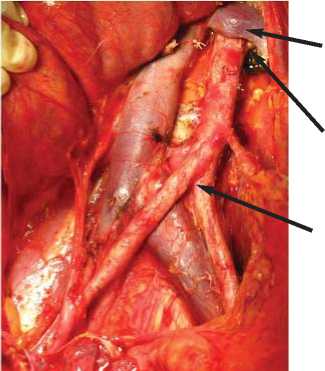
Левая почечная вена
Левая почечная артерия
Аорта
Рис. 1. Вид операционного поля после выполнения парааортальной лимфодиссекции.
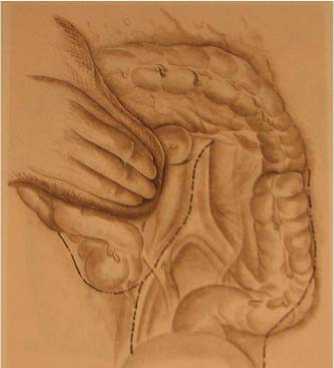
Рис. 2. Доступ к зоне парааортальной лимфодиссекции
Границами хирургической зоны являлись: латеральная – медиальный край наружной подвздошной артерии, медиальная – обтураторный нерв, задняя – запирательная мышца.
обеих сторон. Прослеживая ход внутренних подвздошных артерий, выделяли верхние пузырно-маточные артерии, после двукратной перевязки на протяжении пересекали маточные артерии и отводили медиально. Завершая мобилизацию мочеточников, рассекали переднюю часть пузырно-маточной связки, на протяжении рассекали крестцово-маточные связки. После отведения мочеточников пересекали кардинальные связки на уровне их середины.
Препарат удаляли после резекции 2-3 см дистальной части влагалища.
Результаты исследования
При сравнении времени операции и величины интраоперационной кровопотери в трех группах методом Краскела-Уоллиса отмечены статистически достоверные различия (р < 0,0001), что наблюдалось и при попарном сравнении общего времени операции больных второй и третьей групп (р = 0,0001; тест Манна-Уитни).
Время, затраченное на выполнение операции у больных первой группы составило 126,0 ± 25,9 (от 80 до 195) мин, во 2-й группе - 162,0 ± 53,6 (от 90 до 320) мин, в 3-й -290,0 ± 84,2 (от 23 до 410) мин.
В 1-й группе кровопотеря составила от 100 до 400 мл, в среднем 167,5 ± 42,9 мл, во 2-й – 235,8 ± 133,1 (от 80 до 800) мл, в 3-й – 460 ± 134,8 (от 200 до 800) мл.
При оценке времени лимфадиссекции наблюдались статистически достоверные различия, время затраченное на расширенную экстирпацию матки с придатками с па-рааортальной лимфаденэктомией составило 200,5 ± 62,7 (от 80 до 330) мин., а на операцию, ограниченную тазовой лимфаденэктомией, – 81,5 ± 25,5 (от 30 до 130) мин. (коэффициент корреляции Спирмена = 0,760, p<0,001; коэффициент корреляции Спирмена R=0,848; p < 0,001)
Количество удаленных лимфатических узлов во второй и третьей группах также достоверно отличалось. Среднее количество лимфатических узлов, удаленных при тазовой лимфодиссекции, было 11,8 ± 3,1 (от 5 до 17), парааортально-тазовой лим-фодиссекции – 28,9±9,5 (от 17 до 53).
Установлено, что выполнение парааор-тально-тазовой лимфодиссекции сопряжено с достоверно большей частотой верификации лимфогенной инвазии. Метастазы в лимфатических узлах в группе больных, которым выполнили тазовую лимфодиссек-цию, не обнаружены, а в группе с парааор-тально-тазовой лимфодиссекцией метастазы были диагностированы в 6,66% случаев (р = 0,04; точный критерий Фишера).
Интраоперационных осложнений в группах больных, в которых выполняли тазовую и парааортально-тазовую лимфо-диссекцию, не диагностировано. Интраоперационное осложнение при выполнении ЭМП диагностировано у 1 (1,22%) пациентки в виде ранения мочевого пузыря; несмотря на его ушивание во время операции, в послеоперационном периоде сформировался пузырно-влагалищный свищ.
Послеоперационные осложнения в груп- пе больных, после выполнения стандартных операций ЭМП встречались достоверно реже (7,3%), чем после выполнения тазовой лимфоденэктомии (24,2%) и парааор-тальной лимфаденэктомии (50%) – табл.2.
Средний объем лимфореи у больных второй группы составил 519,4 ± 185,1 (от 230 до 935) мл, в третьей группе – 1753,1 ± 964,5 (от 420 до 10870) мл (р = 0,0001; тест Манна-Уитни). При этом в обеих группах отмечена очень слабая корреляционная связь между количеством удаленных лимфатических узлов и объемом лимфореи в послеоперационном периоде (коэффициент корреляции Спирмена R = 0,233; p < 0,252; коэффициент корреляции Спирмена R = 0,062, р < 0,623).
Во второй группе больных продолжительность пребывания в стационаре составила 28,3 ± 11,6 (от 10 до 56) дней, в третьей группе – 31 ± 13,1 (от 14 до 63) дней (р = 0,0001; тест Манна-Уитни).
Не отмечено статистически достоверных различий между группами при оценке пребывания в стационаре больных трех групп, вычисленной методом Краскела-Уоллиса (р = 0,6).
Осложнения в послеоперационном периоде
Таблица 2
|
Послеоперационные осложнения |
1 группа |
2 группа |
3 группа |
|
Анемия |
1(1,21%) |
0 |
1(3,3%) |
|
Кровотечение |
0 |
0 |
1(3,3%) |
|
Мочеточниково-/или пузырно - влагалищный свищ |
1(1,21%) |
0 |
2(6,67%) |
|
Острый панкреатит |
0 |
0 |
1 (3,3%) |
|
Уретерогидронефроз |
0 |
0 |
2(6,67%) |
|
Лимфоцеле |
0 |
4(12,12%) |
6(20%) |
|
Парез кишечника |
0 |
0 |
1(3,3%) |
|
Тромбоэмболия ветвей мелких легочных артерий |
1(1,21%) |
1(3,03%) |
0 |
|
Расхождение, нагноение послеоперационных швов |
1(1,21%) |
2(6,06%) |
1(3,3%) |
|
Посткастрационный синдром |
2 (2,24%) |
1(3,03%) |
0 |
|
Всего |
6 (7,3%) |
8(24,2%) |
15 (50%) |
Изменение стадии заболевания в группе исследования после хирургического лечения диагностировано у 57,2%, степени дифференцировки – у 26%, гистологического типа опухоли – у 9,6% больных.
Заключение
Результаты исследования свидетельствуют о том, что хирургический метод на сегодняшний день остается наиболее точным в определении стадии рака тела матки.
При расширении объема хирургического лечения, включающего лимфодиссек-цию, статистически больше времени затрачивается на операцию, лимфодиссек-цию, увеличивается объем кровопотери, объем и длительность лимфореи, возрастает количество послеоперационных осложнений, но в целом это не отражается на длительности пребывания больных в стационаре и не повышает летальность в послеоперационном периоде.
Напротив, при удалении большего числа лимфатических узлов возрастает вероятность диагностики и удаления метастатически пораженных лимфатических узлов.
Таким образом, единственным точным методом оценки состояния регионарных лимфатических узлов является лимфодис-секция с последующим тщательным морфологическим исследованием.
Список литературы Сравнительная оценка результатов хирургического лечения локализованного и местно-распространенного рака тела матки
- Чиссов В.И., Старинский В.В. 60 лет онкологической службе России. ФГУ «МНИОИ им. П.А. Герцена Росмедтехнологий». -2009. -336 с.
- Давыдов М.И., Летягин В.П., Кузнецов В.В. Опухоли женской репродуктивной системы. М.: Медицинское информ. агентство, 2007. 376 с.
- Вишневская Е.Е. Особенности клинического течения рака эндометрия у больных репродуктивного возраста с распространенными стадиями заболевания//Рос. онкол. журн. 2005. № 3. С. 19-22.
- Воробьева Л.И Факторы прогноза и особенности рецидивирования начального рака эндометрия//Онкология. 2007. Т. 9, № 3. С. 198-200.
- Новикова Е.Г., Бойко А.В., Дунаева Е.А. и соавт. Оправдано ли "агрессивное" лечение у больных раком тела матки I стадии?//Сиб. онкол. ж. -2007. -Прил. С. 69-76.
- Кедрова А.Г., Кузнецов В.В., Нечушкина В.М. и соавт. Какие больные раком тела матки должны получать системную адъювантную химиотерапия после хирургического лечения?//Сиб. онкол. (Томск). 2007. Прилож. 1. С. 32-35
- Karnik Lee N, Wu H., Cheung M.K., Osann K. The impact of lymphadenectomy in women with endometrioid uterine cancer: A study of 39,396 women. ASCO 2006, abs. 5000
- Bassarak N., Blankenstein T., Br?ning A. et al. Is lymphadenectomy a prognostic marker in endometrioid adenocarcinoma of the human endometrium?//BMC Cancer. 2010.Vol. 10. P. 224.
- Todo Y., Kato H., Kaneuchi M. et al. Survival effect of para-aortic lymphadenectomy in endometrial cancer (SEPAL study): a retrospective cohort analysis//Lancet. 2010. Vol. 375 (9721). P. 1165-72.


