Сравнительная оценка стандартного эхокардиографического исследования и классификационной модели на основе параметров функциональной геометрии левого желудочка в диагностике систолической дисфункции трансплантированного сердца
Автор: Чумарная Т. В., Идов Э. М., Кондрашов К. В., Михайлов С. П., Климушева Н. Ф., Быков А. Н., Кочмашева В. В., Алуева Ю. С., Соловьева О. Э.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.35, 2020 года.
Бесплатный доступ
Цель. Целью данного исследования является сравнительная оценка состояния систолической функции левогожелудочка (ЛЖ) в течение длительного периода времени после трансплантации сердца (ТС) с использованиемпараметров функциональной геометрии ЛЖ.Материал и методы. Исследован 31 пациент после ортотопической ТС со сроком наблюдения до девяти лет после операции. Мы использовали линейный дискриминантный анализ (LDA) для построения классификационноймодели на основе классических эхокардиографических (ЭхоКГ) параметров систолической функции ЛЖ и на основе параметров функциональных геометрических индексов ЛЖ для возможного предсказания острого отторжения и прогрессирования хронической сердечной недостаточности (ХСН) трансплантированного сердца.Результаты. Модель, построенная с использованием параметров функциональной геометрии ЛЖ, показала высокую предсказательную способность для диагностики острого отторжения и развития сердечной недостаточности у пациентов с трансплантированным сердцем.Заключение. Математическая классификационная модель, базирующаяся на параметрах функциональнойгеометрии ЛЖ, может служить дополнительным инструментом для оценки острого отторжения и развития ХСН упациентов после ортотопической ТС.
Трансплантация сердца, функциональная геометрия, линейный дискриминантный анализ
Короткий адрес: https://sciup.org/149125347
IDR: 149125347 | УДК: 616.12-089.819.843-008.6-07:616.124.2]-073.43-8-079 | DOI: 10.29001/2073-8552-2020-35-1-107-116
Текст научной статьи Сравнительная оценка стандартного эхокардиографического исследования и классификационной модели на основе параметров функциональной геометрии левого желудочка в диагностике систолической дисфункции трансплантированного сердца
–116
Эффективность общепринятой консервативной и ресинхронизирующей терапии при прогрессировании хронической сердечной недостаточности (ХСН) у больных дилатационной и ишемической кардиомиопатией относительно невысока. Многие из этой большой популяции пациентов с терминальными формами ХСН считаются потенциальными реципиентами на трансплантацию сердца (ТС), которая до сих пор остается более доступным и эффективным способом продления жизни для пациентов в конечной стадии [1]. Однако у 20–40% реципиентов в течение первого года после ТС развивается острое клеточное отторжение [2]. Госпитальная (30-дневная) летальность после ТС составляет 5–10%, однолетняя выживаемость – 80%, а самой частой причиной смертности в течение 6 мес. является реакция острого отторжения трансплантата [3]. В дальнейшем основными причинами потери трансплантата являются хроническое отторжение и васкулопатия коронарных артерий [47].
Раннее выявление неблагоприятных изменений в функции трансплантата остается актуальной задачей для этой группы пациентов [8]. В настоящее время «золотым стандартом» для диагностики отторжения аллотрансплантата является катетеризационная эндомиокардиальная биопсия правого желудочка (ПЖ). Глубина и плотность лимфоцитарной инфильтрации, а также наличие некроза кардиомиоцитов в биоптате определяют степень клеточной реакции отторжения. Эта процедура инвазивна, несет в себе риск и может недооценивать ухудшение состояния трансплантата. Несмотря на то, что 70–80% реакций острого отторжения могут быть подавлены иммуносупрессивной терапией, острое отторжение остается самым грозным осложнением после трансплантации органа [9, 10]. Поиск неинвазивных методов для оценки состояния аллотрансплантата сердца является первоочередной задачей для клинической практики.
Цель данного исследования: оценка состояния систолической функции левого желудочка (ЛЖ) в течение длительного периода времени после ТС с использованием параметров функциональной геометрии ЛЖ и проверка гипотезы о том, что эти параметры могут быть использованы в качестве ранних предикторов дисфункции аллотрансплантата у пациентов с трансплантированным сердцем.
В повседневной клинической работе практического кардиолога наиболее доступным и широко используемым методом для оценки систолической функции ЛЖ является стандартное эхокардиографическое (ЭхоКГ) исследование, поэтому в статье представлено сравнение именно этого метода с методом ЭхоКГ, дополненным параметрами функциональной геометрии ЛЖ, без обсуждения и сравнения с другими современными ультразвуковыми методиками количественной оценки глобальной и региональной систолической и диастолической функции сердца, не принижая их значения в анализе показателей деформации миокарда, что предполагается на последующем этапе исследования.
Использование дополнительно при ЭхоКГ параметров функциональной геометрии ЛЖ для оценки систолической дисфункции, острого отторжения трансплантированного сердца или прогрессирования ХСН может помочь кардиологу и ультразвуковому диагносту более дифференцированно оценить эти состояния, не прибегая к более сложным методикам исследования.
Материал и методы
В исследование вошел 31 пациент после ортотопической ТС, у которых послеоперационный период составлял от одного до девяти лет. Средний возраст реципиентов составил 42 года, среди них было 12 (38,7%) больных с дилатационной кардиомиопатией и 19 (61,3%) пациентов с ишемической кардиомиопатией. Данные манометрии камер сердца реципиентов до операции представлены в таблице 1.
Двадцать пациентов с послеоперационным периодом до двух лет рассматривались на предмет острого отторжения. В среднем каждый пациент совершал пять визитов за весь срок наблюдения, таким образом, для этой группы пациентов была собрана информация о 105 визитах, из них в 38 случаях обнаружено острое отторжение, которое подтверждалось эндомиокардиальной биопсией.
Семнадцать пациентов входили в группу с послеоперационным периодом более двух лет и рассматривались на предмет прогрессирования ХСН. Общее число всех визитов пациентов в этой подгруппе составило 67 (в среднем четыре визита на пациента), из них 27 случаев II функциональный класс (ФК) ХСН, 25 случаев – III или IV ФК ХСН.
Отдельную группу составили 15 пациентов, у которых был определен II ФК ХСН, но в течение месяца у них наблюдалось прогрессирование ХСН и увеличение ФК.
Таблица 1. Инструментальные данные реципиентов до операции
Table 1. Recipient’s preoperative examination data
|
ФВ ЛЖ, % Left ventricle ejection fraction, % |
19,2 ± 2,1 |
После NO |
|
СИ, л/м2/мин Cardiac index, L/m2/min |
1,9 ± 0,3 |
– |
|
КДР ЛЖ, мм Left ventricle end diastolic dimension, mm |
67,4 ± 2,9 |
– |
|
КДО ЛЖ, мл Left ventricle end diastolic volume, mL |
276,7 ± 32 |
– |
|
Кардиоторакальный индекс Cardiothoracic index |
0,8 ± 0,2 |
– |
|
Na сыворотки крови, мэкв/л Ionized blood potassium, mEq/L |
115 ± 9,1 |
– |
|
PVR, ед. Wood PVR, Wood units |
4,9 |
3,0 |
Примечание: ФВ ЛЖ – фракция выброса левого желудочка, СИ – сердечный индекс, КДР – конечно-диастолический размер, КДО – конечно-диастолический объем, PVR, ед. Wood – сосудистое сопротивление малого круга в единицах Вуда.
Note: LV EF – left ventricular ejection fraction, CI – cardiac index, LV EDD – left ventricle end-diastolic dimension, LV EDV – left ventricle end-diastolic volume, PVR – pulmonary vascular resistance.
Для построения классификационных моделей рассматривались три тестовые группы пациентов с различной степенью систолической дисфункции. В частности, контрольная группа состояла из 24 здоровых добровольцев без признаков сердечно-сосудистых заболеваний, с нормальной систолической функцией (НСФ) ЛЖ. Вторая группа с умеренно сниженной систолической функцией (УССФ) ЛЖ и сохраненной фракцией выброса (фракция выброса > 50%) была представлена 52 пациентами, страдающими ишемической болезнью сердца. В третью группу со значительной систолической дисфункцией (ЗCCФ) ЛЖ (фракция выброса < 35%) вошли 25 пациентов с дилатационной кардиомиопатией.
Изменение конфигурации ЛЖ в течение сократительного цикла от конечной диастолы к конечной систоле является важным фактором оптимизации насосной функции сердца [9]. Эти изменения удобно обозначить понятием «функциональная геометрия» ЛЖ. Для количественного описания функциональной геометрии ЛЖ, в том числе определения пространственно-временных характеристик неоднородности сокращения, использован разработанный нами программный комплекс для покадровой обработки контуров ЛЖ, полученных в течение сократительного цикла методом двумерного ультразвукового исследования в четырехкамерной апикальной позиции на ультразвуковом аппарате (Ultrasound System Philips IE33) с последующим полуавтоматическим оконтуриванием эндокарда в программе Qlab. Систолическая функция ЛЖ оценивалась методом Симпсона. Вклад различных регионов стенки ЛЖ в глобальную фракцию выброса оценивался при помощи компьютерного автоматизированного анализа сегментарной кинетики стенки ЛЖ (рис. 1).
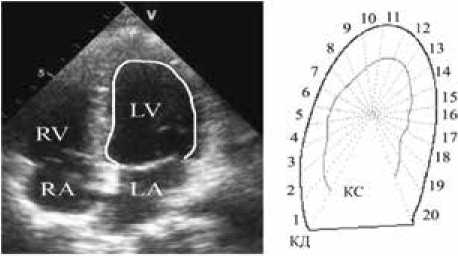
Рис. 1. Покадровая обработка контуров левого желудочка, полученных в течение сократительного цикла методом двумерного ультразвукового исследования в четырехкамерной апикальной позиции
Fig. 1. Frame-by-frame processing of the left ventricular contours obtained during the contractile cycle in classical two-dimensional apical four-chamber view
Сегменты
|
1–3 |
базально-боковые (ББ) |
|
4–8 |
срединно-боковые (СБ) |
|
9–10 |
верхушечно-боковые (ВБ) |
|
11–12 |
верхушечно-перегородочные (ВП) |
|
13–17 |
срединно-перегородочные (СП) |
|
18–20 |
базально-перегородочные (БП) |
В частности, вычислялись региональные фракции выброса – максимальные в цикле изменения площадей секторов, полученных в результате разделения контура стенки ЛЖ на сегменты. Асинхронизм сокращения регионов оценивался по относительному изменению времени достижения минимальной площади сектора (локальной систолы) по сравнению с глобальной систолой. Коэффициенты вариации индивидуальных значений региональной фракции выброса и регионального показателя асинхронизма пациента использовали как индексы пространственной и временной неоднородности движения стенки ЛЖ этого пациента.
Для количественной оценки изменения формы ЛЖ в течение сократительного цикла вычисляли следующие параметры функциональной геометрии ЛЖ: 1) классический индекс сферичности; 2) индекс Гибсона, который отражает степень близости контура к окружности; 3) индекс конусности, который отражает степень заостренности (конусности) верхушечной зоны; 4) индекс Фурье, который указывает на степень сложности формы и ее отклонения от окружности.
Статистический анализ полученных данных выполнен при помощи пакета SPSS 22.0. Нормальность рас- пределения показателей проверялась тестом Шапиро– Уилка на уровне значимости 0,05. Для всех величин гипотеза о нормальном распределении не была отклонена. Сравнение средних в двух группах осуществлялось с помощью t-критерия Стьюдента (на уровне значимости 0,05). Множественные межгрупповые сравнения проводились однофакторным дисперсионным анализом на уровне значимости 0,05 с последующим попарным сравнением групп с использованием t-критерия Стьюдента с поправкой Бонферрони (уровень значимости 0,017). Средние значения числовых показателей представлены со стандартным отклонением.
Для построения модели на основе паттернов систолической дисфункции в рассматриваемых группах нами использован линейный дискриминантный анализ (LDA). Были построены следующие модели: 1) на основе стандартных ЭхоКГ параметров; 2) на основе стандартных ЭхоКГ параметров и параметров деформации стенки ЛЖ (GLS); 3) на основе только параметров функциональной геометрии ЛЖ. Характеристики функциональной геометрии ЛЖ в группах с НСФ, УССФ, ЗССФ, использованных для построения классификационных моделей, приведены в таблице 2.
Таблица 2. Индексы левого желудочка
Table 2. Left ventricular indexes
|
Индексы Indexes |
НСФ NSF |
УССФ MDSF |
ЗССФ SDSF |
ТС (< 2 лет) ТС (> 2 лет) HT < 2 years HT > 2 years |
|||||
|
Без Отторжение II ФК Прогресс ХСН III и IV ФК отторжения Rejection FC II CHF progressing FC III & IV No rejection |
|||||||||
|
о Р 8 О о с 2 ’5 °- н га га с га ^ |
ФВ ЛЖ, % LV EF, % |
70 ± 2 |
65 ± 4 |
25 ± 2 *§ |
4 9 ± 1 * |
43 ± 1 * |
61 ± 4 |
60 ± 3 |
34 ± 2 * |
|
КДО, мл LV EDV, ml |
94 ± 2 |
100 ± 3 |
220 ± 14 *§ |
91 ± 3 |
100 ± 3 |
100 ± 4 |
99 ± 3 |
190 ± 15 * |
|
|
КСО, мл LV ESV, ml |
31 ± 2 |
41 ± 3 |
170±12*§ |
48 ± 2 |
61 ± 2 *§ |
43 ± 3 |
42 ± 3 |
150 ± 11 * |
|
|
ЗСЛЖ, мм PWTd, mm |
9 ± 0,2 |
9 ± 0,2 |
7 ± 0,3 * |
11 ± 0,3 |
12 ± 0,3 |
9 ± 0,2 |
9 ± 0,2 |
8 ± 0,3 * |
|
|
МЖП, мм SWTd, mm |
10 ± 0,2 |
10 ± 0,2 |
8 ± 0,3 * |
12 ± 0,3 |
13 ± 0,3 |
10 ± 0,2 |
10 ± 0,2 |
8 ± 0,3 * |
|
|
GLS, % |
–21 ± 2 |
–18 ± 2 |
-8 ± 3 *§ |
-15 ± 2 * |
-13 ± 2 * |
–18 ± 2 |
–17 ± 2 |
-10 ± 3 * |
|
|
5 ф ° Е Е о ф м -0 с га В о с S Z5 z = "? 5 1 1 га S га EZ |
КВ РФВ, % CVREF, % |
13 ± 1 |
22 ± 1 * |
46 ± 3 * § |
35 ± 1 * § |
43 ± 3 *§ |
25 ± 1 * |
41 ± 3 *§ |
47 ± 3 * |
|
КВ ПА, % CVIA, % |
12 ± 1 |
18 ± 1 * |
37 ± 2 *§ |
18 ± 1 * |
26 ± 2 *§ |
23 ± 1 * |
27 ± 2 *§ |
38 ± 2 * |
|
|
ИС КД SI ED |
0,55 ± 0,01 |
0,54 ± 0,0 |
0,64 ± 0,02 *§ |
0,49 ± 0,0 * |
0,49 ± 0,02* * |
0,49 ± 0,0 |
0,54 ± 0,02 |
0,64 ± 0,02 *§ |
|
|
ИС КС SI ES |
0,47 ± 0,01# |
0,43 ± 0,0# |
0,62 ± 0,02 #*§ |
0,41 ± 0,0# |
0,43 ± 0,02 #* |
0,41 ± 0,0# |
0,51 ± 0,02 #*§ |
0,61 ± 0,02 #*§ |
|
|
Δ ИС, % ΔSI, % |
15 ± 2 |
18 ± 2 |
3 ± 1 *§ |
16 ± 2 |
13 ± 1 |
15 ± 2 |
3 ± 1 *§ |
3 ± 1 * |
|
|
ИГ КД GI ED |
0,74 ± 0,01 |
0,72 ± 0,0 |
0,75 ± 0,01 |
0,68 ± 0,0 * |
0,75 ± 0,01 |
0,74 ± 0,0 |
0,75 ± 0,01 |
0,75 ± 0,01 |
|
|
ИГ КС GI ES |
0,68 ± 0,01# |
0,65 ± 0,0# |
0,75 ± 0,01 *§ |
0,62 ± 0,0#* |
0,75 ± 0,01 *§ |
0,66 ± 0,0# |
0,71 ± 0,01 * |
0,74 ± 0,01 * |
|
|
Δ ИГ, % Δ GI, % |
8 ± 0,1 |
9 ± 0,1 |
1 ± 0,01 *§ |
9 ± 0,1 |
1 ± 0,01 *ϯ |
8 ± 0,1 |
3 ± 0,01 *§ |
1 ± 0,01 *§ |
|
|
ИК КД ACI ED |
0,41 ± 0,004 |
0,43 ± 0,0 |
0,39 ± 0,01 *§ |
0,41 ± 0,0 |
0,39 ± 0,01 *§ |
0,41 ± 0,0 |
0,40 ± 0,01 |
0,39 ± 0,01 * |
|
|
ИК КС ACI ES |
0,44 ± 0,001# |
0,45 ± 0,0# |
0,39 ± 0,01 *§ |
0,43 ± 0,0# |
0,38 ± 0,01 *§ |
0,45 ± 0,0# |
0,39 ± 0,01 * |
0,39 ± 0,01 * |
|
|
Δ ИК, % ΔACI I, % |
4 ± 0,5 |
4 ± 0,5 |
0 ± 0,2 *§ |
4 ± 0,5 |
0 ± 0,2 * ϯ |
4 ± 0,5 |
1 ± 0,2 * |
0 ± 0,2 * |
|
|
ИФ КД FSPI ED |
0,19 ± 0,02 |
0,24 ± 0,0 * |
0,15 ± 0,01 *§ |
0,25 ± 0,0 * |
0,15 ± 0,01 *§ |
0,26 ± 0,0 * |
0,25 ± 0,01 * |
0,15 ± 0,01 * |
|
|
ИФ КС FSPI ES Δ ИФ, % Δ FSPI, % |
0,32 ± 0,02# 37 ± 3 |
0,37 ± 0,0#* 34 ± 3 |
0,19 ± 0,02 *§ 17 ± 6 *§ |
0,41 ± 0,0#* 32 ± 3 |
0,18 ± 0,02 *§ 16 ± 5 * |
0,39 ± 0,0#* 33 ± 3 |
0,29 ± 0,02 * 15 ± 4 * |
0,19 ± 0,02 * 16 ± 6 * |
|
Примечание: ФВ ЛЖ - фракция выброса левого желудочка, КДО - конечно-диастолический объем, КСО - конечно-систолический объем, ЗСЛЖ – задняя стенка левого желудочка, МЖП – межжелудочковая перегородка, GLS (Global Longitudinal Strain) – деформация стенки левого желудочка, КВ РФВ – коэффициент вариации региональных фракций выброса (индекс пространственной неоднородности), КВ ПА – коэффициент вариации показателя асинхронизма (индекс временной неоднородности), ИС КС – индекс сферичности конечной систолы, ИГ – индекс Гибсона, ИК КД – индекс конусности конечной диастолы, ИК КС – индекс конусности конечной систолы, ИФ – индекс Фурье; # p < 0,05 между КД и КС, Δ – относительное изменение между конечной диастолой и конечной систолой; * – p < 0,017 между патологией и НСФ; § – р < 0,017 между УССФ и ЗССФ; Ϯ – p < 0,05 между ТС без отторжения и с отторжением.
Note: LV EF – left ventricular ejection fraction, LV EDV – left ventricular end-diastolic volume, LV ESV – left ventricular end-systolic volume, SWTd – septal wall thickness in diastole, PWTd – left ventricular posterior wall thickness in diastole, GLS – global longitudinal strain, CVREF – coefficient of variance of regional ejection fraction, CVIA – coefficient of variance of asynchronism indicator (temporal discontinuity index), SI ED – end-diastolic sphericity index, SI ES – end-systolic sphericity index, ΔSI – change in sphericity index between end diastole and end systole, GI ED – end-diastolic Gibson index, GI ES – end-systolic Gibson index, ΔGI – change in Gibson index between end diastole and end systole, ACI ED – end-diastolic conicity index, ACI ES – end-systolic conicity index, ΔACI I – change in conicity index between end diastole and end systole, FSPI ED – end-diastolic Fourier index, FSPI ES – end-systolic Fourier index, ΔFSPI – change in Fourier index between end diastole and end systole, FC – functional class; * – p < 0.017 for differences between patients with pathology and healthy individuals; § – р < 0.017 for differences between patients with moderately and severely decreased systolic function; Ϯ – p < 0.05 for differences between transplanted hearts with and without rejection.
Результаты
Классификационные модели
Используя линейный дискриминантный анализ, мы построили три классификационные модели, основанные на данных тренировочного набора из групп пациентов с НСФ, УССФ и ЗССФ. Первая модель использовала данные стандартного протокола ЭхоКГ и показала точность классификации 13% для пациентов с НСФ, 96% – для группы пациентов с УССФ и 100% – для группы пациентов с ЗССФ
(рис. 2А). Таким образом, эта модель не смогла разделить группы с НСФ и УССФ. После включения в модель параметра GLS качество классификации улучшилось, показывая точность классификации 45% для группы с НСФ, 90% – с УССФ и 100% - с ЗССФ. Но эта модель также не могла четко разделить группы с НСФ и УССФ (рис. 2В). Третья модель, построенная только с использованием характеристик функциональной геометрии ЛЖ, стратифицировала данные всех трех групп с точностью 100% (рис. 2С).
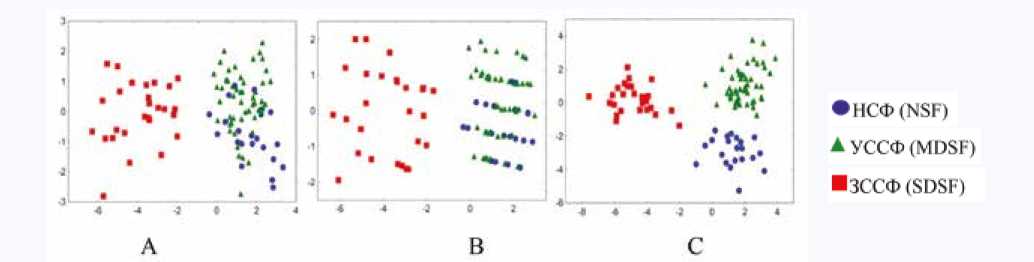
Рис. 2. Классификационные модели. А) Модель, основанная на стандартном ЭхоКГ протоколе. B) Модель, основанная на стандартном ЭхоКГ протоколе и GLS. C) Модель, основанная на параметрах функциональной геометрии левого желудочка. По оси абсцисс указана первая дискриминантная функция, по оси ординат – вторая дискриминантная функция, полученные с помощью линейного дискриминантного анализа
Fig. 2. Linear discriminant analysis classification models. A) Model based on standard protocol. B) Model based on standard protocol and global longitudinal strain assessment. C) Model based on the left ventricular functional geometry parameters. The first linear discriminant analysis discriminant function is presented on the axis of abscissas; the second linear discriminant analysis discriminant function is presented on the axis of ordinates
Стратификация пациентов с трансплантированным сердцем
Каждая из трех моделей LDA использовалась для классификации данных пациентов с ТС и послеоперационным периодом менее двух лет с точки зрения возможности прогнозирования острого отторжения аллотрансплантата (рис. 3). Модель, основанная на параметрах стандартного протокола ЭхоКГ, отнесла 94% случаев без отторжения в группу с УССФ и только 21% случаев острого отторжения – в группу с ЗССФ, остальные случаи – в группу с УССФ (рис. 3A). Точность стратификации не улучшилась при использовании модели, основанной на стандартном протоколе ЭхоКГ и GLS. Эта модель отнесла 94% случаев без отторжения в группу с УССФ, 24% случаев острого отторжения – в группу с ЗССФ, остальные случаи – в группу с УССФ (рис. 3B).
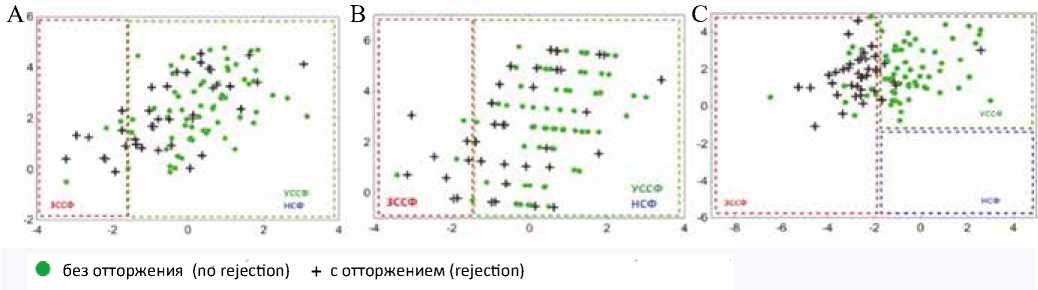
Рис. 3. Диаграмма рассеяния канонических корней LDA моделей у пациентов с трансплантацией сердца с острым отторжением. А) Модель, основанная на стандартном ЭхоКГ протоколе. B) Модель, основанная на стандартном ЭхоКГ протоколе и GLS. C) Модель, основанная на параметрах функциональной геометрии левого желудочка. Зеленый круг – случай без отторжения; черный крест – случай острого отторжения
Fig. 3. Scatterplot of canonical scores in heart transplant patients with acute rejection. A) Standard protocol model. B) Standard protocol and global longitudinal strain model. C) Left ventricular functional geometry model. Green circles correspond to cases without rejection; black crosses indicate cases of acute rejection
Таким образом, модели, основанные на стандартном протоколе ЭхоКГ, показали низкую точность в стратификации данных между группой с острым отторжением аллографта и группой без отторжения.
Модель, построенная с использованием данных функциональной геометрии ЛЖ, отнесла 90% случаев с острым отторжением в группу с ЗССФ, а 82% случаев без отторжения – в группу с УССФ (рис. 3C), тем самым показывая высокую точность стратификации и высокую мощность в прогнозировании острого отторжения.
Данные пациентов после ТС с послеоперационным периодом более двух лет были классифицированы с использованием моделей LDA с точки зрения возможности прогнозирования прогрессирования ХСН (рис. 4). Все модели продемонстрировали высокую точность стратификации данных в соответствии с классификацией ХСН.
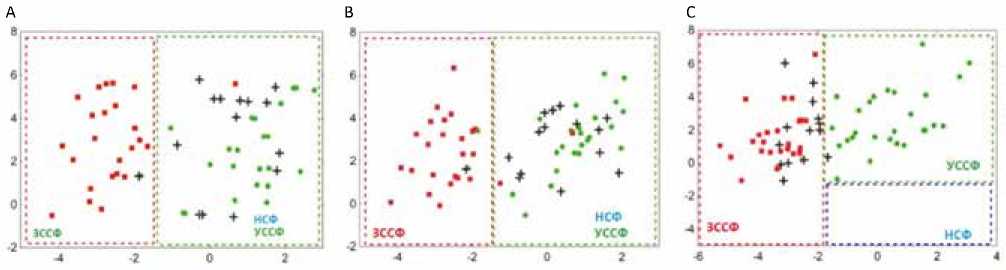
+ прогрессирующая ХСН (progressing CHF)
II ФК ХСН (class II CHF)
III–IV ФК ХСН (class III–IV CHF)
Рис. 4. Диаграмма рассеяния канонических корней LDA моделей у пациентов с трансплантацией сердца с прогрессированием хронической сердечной недостаточности. А) Модель, основанная на стандартном ЭхоКГ протоколе. B) Модель, основанная на стандартном ЭхоКГ протоколе и GLS. C) Модель, основанная на параметрах функциональной геометрии левого желудочка. Зеленый круг – случаи со II функциональным классом хронической сердечной недостаточности; красный квадрат – случаи с III– IV функциональным классом хронической сердечной недостаточности; черный крест – случаи прогрессирования хронической сердечной недостаточности
Fig. 4. Scatterplot of canonical scores in heart transplant patients examined for progressive chronic heart failure. A) Standard protocol model. B) Standard protocol and global longitudinal strain model. C) Left ventricular functional geometry model. Green circles correspond to cases with functional class II chronic heart failure; red squares correspond to the cases of functional class III–IV chronic heart failure; black crosses indicate cases of worsening of chronic heart failure
Более 90% случаев пациентов II ФК ХСН были классифицированы как группа с УССФ, больше чем 90% случаев пациентов III и IV ФК ХСН – как группа с ЗССФ. Наивысшая точность в 100% классификации была продемонстрирована моделью LDA, основанной на данных функциональной геометрии ЛЖ.
Мы использовали модели LDA для классификации данных 15 случаев, которые были оценены за месяц до ухудшения состояния, но уже через месяц после визита было подтверждено прогрессирование ХСН с повышением ФК ХСН. Модели, основанные на стандартных ЭхоКГ характеристиках и GLS, отнесли только один из 15 случаев в группу с ЗССФ, тогда как остальные пациенты были классифицированы в группу с УССФ ЛЖ. Напротив, модель, основанная на данных функциональной геометрии, классифицировала 14 из 15 случаев в группу с ЗССФ, тем самым предсказав прогрессирование ХСН до явного ухудшения состояния пациентов.
Обсуждение
ТС до сих пор остается более доступным способом продления жизни для пациентов с ХСН в терминальной стадии. На разных этапах послеоперационного периода функциятрансплантированного сердца зависит от острого отторжения аллотрансплантата, хронического отторжения, васкулопатии. Все эти факторы могут вызвать ремоделирование ЛЖ, что существенно влияет на прогноз состояния пациента с трансплантированным сердцем. Ранняя диагностика острого отторжения трансплантата или развития ХСН после операции ТС является чрезвычайно актуальной, ибо временной фактор манифестирования отторжения считается решающим в определении характера лечения и его эффективности.
В Центре сердца и сосудов ГБУЗ СО «Свердловская областная клиническая больница № 1» были обследованы 286 пациентов с синдромом дилатированного сердца, из которых 60 пациентов были рассмотрены в качестве реципиентов для ТС, им была выполнена ортотопическая ТС. В представленной статье дается анализ течения послеоперационного периода у 31 пациента в сроки до девяти лет.
Нами учитывались следующие признаки дисфункции трансплантированного сердца при стандартном протоколе ЭхоКГ исследования:
-
• Нарастание дилатации ПЖ и/или ЛЖ.
-
• Систолическая и/или диастолическая дисфункция.
-
• Нарастание гипертрофии ЗСЛЖ и/или снижение сердечного индекса.
-
• Появление митральной, или трикуспидальной недостаточности.
-
• Появление выпота в перикарде.
-
• Расширение нижней полой вены.
-
• Изменение функциональной геометрии ЛЖ.
Однако не всегда присутствует достаточный набор ЭхоКГ признаков, чтобы по их совокупности можно было признать появление острого отторжения трансплантата или прогрессирование ХСН. На сегодня «золотым стандартом» для диагностики отторжения аллотрансплантата является эндомиокардиальная биопсия. Но инвазивность метода, не всегда удачно взятый для оценки биопсийный материал и сложность интерпретации биоптата свидетельствуют о необходимости поисков и совершенствования новых неинвазивных методов оценки острого отторжения трансплантированного сердца и прогнозирования ХСН в отдаленном послеоперационном периоде. Таким методом может быть предложенная математическая классификационная модель систолической дисфункции ЛЖ на основе параметров функциональной геометрии сердца, включающая индекс сферичности, индекс формы Фурье, индекс конусности; индексы пространственно-временной неоднородности. Динамические изменения в конфигурации ЛЖ в течение сердечного цикла вносят существенный вклад в эффективную работу сердца [10]. Эти изменения называют «функциональной геометрией» ЛЖ. Было продемонстрировано, что при сердечной патологии, молекулярном и клеточном ремоделировании миокарда существенно меняется координация пространственно-временных движений сегментов стенки ЛЖ.
Пациенты с трансплантированным сердцем были стратифицированы нашей моделью LDA. Для пациентов после ТС менее двух лет после операции модель, построенная по характеристикам стандартного протокола, смогла определить только 21% случаев острого отторжения; модель, построенная по характеристикам функциональной геометрии, 90% случаев острого отторжения. Для пациентов с послеоперационным периодом более двух лет рассматривались характеристики ЛЖ в течение месяца до явного ухудшения состояния пациента. Модель со стандартными характеристиками ЭхоКГ смогла правильно классифицировать только 1% таких случаев, в то время как модель, построенная по характеристикам функциональной геометрии, 99%. Таким образом, модель LDA с учетом параметров функциональной геометрии ЛЖ может облегчить диагностику отторжения и выявить ухудшение состояния аллотрансплантата.
Выводы
Классификационная модель LDA, построенная на основе параметров функциональной геометрии ЛЖ, продемонстрировала высокую эффективность в прогнозировании острого отторжения аллографта и неблагоприятных исходов прогрессирования ХСН у пациентов с трансплантированным сердцем.
Использование математической классификационной модели систолической дисфункции ЛЖ для оценки острого отторжения трансплантированного сердца или прогрессирования ХСН может служить дополнительным фактором для объективной оценки этих состояний.
Список литературы Сравнительная оценка стандартного эхокардиографического исследования и классификационной модели на основе параметров функциональной геометрии левого желудочка в диагностике систолической дисфункции трансплантированного сердца
- Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П., Коротеев А.В., Ревишвили А.Ш., Беленков Ю.Н. и др. Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр). Журнал Сердечная Недостаточность. 2010;11(1):3-62.
- McMurray J.J., Adamopoulos S., Anker S.D., Auricchio A., Böhm M., Dickstein K. et al. ESC for the diagnosis and treatment of acute and chronic heart failure 2012: Тhe Task Force Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2012;33(14):1787-1847. DOI: 10.1093/eurheartj/ehs104
- Sabia C., Picascia A., Grimaldi V., Amarelli C., Maiello C., Napoli C. The epigenetic promise to improve prognosis of heart failure and heart transplantation. Transplant. Rev. 2017;31(4):249-256. DOI: 10.1016/j.trre.2017.08.004
- Болезнь коронарных артерий пересаженного сердца; под ред. академика Шумакова В.И. М: Медицинское информационное агентство; 2008:160.
- Иммуносупрессия при трансплантации солидных органов; под редакцией С.В. Готье. Тверь: Триада; 2011:472.
- Markhasin V.S., Solovyova O., Chumarnaya T.V., Sukhareva S.V. Problem of heterogeneity of myocardial. Russian Journal of Physiology. 2009;95(9):919-943.
- Mangini S., Alves B.R., Silvestre O.M., Pires P.V., Pires L.J., Curiati M.N. et al. Heart transplantation: review. Einstein (Orlando). 2015;13(2):310-318. DOI: 10.1590/S1679-45082015RW3154
- Alraies M.C., Eckman P. Adult heart transplant: indications and outcomes. J. Тhorac. Disease. 2014;6(8):1120-1128. DOI: 10.3978/j.issn.2072-439.2014.06.44
- Sengupta P.P., Korinek J., Belohlavek M., Narula J., Vannan M.A., Jahangir A. et al. Left ventricular structure and function: basic science for cardiac imaging. J. Am. Coll. Cardiol. 2006;48(10):1988-2001. DOI: 10.1016/j.jacc.2006.08.030
- Chumarnaya T., Alueva Y.S., Kochmasheva V., Mihailov S., Revishvili A.Sh., Tsyv'ian P.B. et al. Features of the Left ventricular functional geometry in patients with myocardial diseases with varying degrees of systolic dysfunction. Bulletin of Experimental Biology and Medicine. 2016;162(1):30-34. DOI: 10.1007/s10517-016-3537-5


