Сравнительная оценка токсичности водной суспензии нано- и микродисперсного диоксида кремния в субхроническом эксперименте
Автор: Землянова М.А., Звездин В.Н., Довбыш А.А., Акафьева Т.И.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования
Статья в выпуске: 1 (5), 2014 года.
Бесплатный доступ
В субхроническом эксперименте на белых крысах-самцах линии Wistar изучены негативные эффекты и выполнена сравнительная оценка токсичности водной суспензии нано- и микродисперсного диоксида кремния. Установлено, что при внутрижелудочном введении в течение 90 дней в дозе 14,6 мг/кг, соответствующей прогнозируемой пороговой дозе (LOAEL), водная суспензия нанодисперсного диоксида кремния вызывает иммунораздражающий, цитолитический и воспалительный эффекты, верифицированные отклонением биохимических, гематологических показателей и морфологическими изменениями тканей органов или систем-мишеней (печень, желудок, тощая и ободочная кишка, иммунная система). Микроразмерный диоксид кремния вызывает преимущественно воспалительный эффект в слизистой оболочке желудка, тощей и ободочной кишки.
Диоксид кремния, наночастицы, микрочастицы, негативные эффекты, субхроническая токсичность, внутрижелудочное введение, экспериментальные исследования
Короткий адрес: https://sciup.org/14237857
IDR: 14237857 | УДК: 615.9,
Текст научной статьи Сравнительная оценка токсичности водной суспензии нано- и микродисперсного диоксида кремния в субхроническом эксперименте
Согласно прогнозным оценкам Исследовательской службы Конгресса США (Congressional Research Service), на сегодняшний день мировая промышленность использует нанотехнологии в процессе производства 80 групп потребительских товаров и свыше 600 видов сырьевых материалов, комплектующих изделий и промышленного оборудования [12]. Динамичное развитие глобального сектора промышленного производства нанопорошков, наибольшая доля которого приходится на диоксид кремния (до 40 % всего мирового объема производства нанопорошков) [3], обусловливает лидирующие позиции в их применении в наиболее перспективных отраслях промышленности: нанооптике, наноэлектронике, нанобиотехнологии, фармации и др.
В связи с широкомасштабным развитием мирового рынка нанотехнологической продукции проблемы нанотоксикологии и биобезопасности используемых наноматериалов выходят на одно из первых мест
по важности и, соответственно, по числу работ в этой области. Анализ имеющегося экспериментального материала о биологических эффектах наночастиц и наноматериалов, представленного в зарубежных и отечественных публикациях [7, 9], позволяет сделать теоретическое предположение о том, что токсичность частиц в нанораз-мерном состоянии выше, чем таковая аналогичных по химическому составу частиц в микро- и макрометровом диапазоне. При этом данные, касающиеся сравнительной оценки токсичности вещества в нано-и микродисперсном виде в условиях хронического и субхронического воздействия, крайне малочисленны и разобщены. Учитывая появление массово выпускаемого продукта, контактировать с которым предполагается широкой категории населения, актуальным является выявление и сравнительная оценка негативных эффектов многократного воздействия нанодис-персного диоксида кремния на организм.
Целью проведенных работ являлось исследование и сравнительная оценка субхронической токсичности водной суспензии нано- и микродисперсного диоксида кремния при внутрижелудочном введении.
Материалы и методы. Для проведения исследований использовали водную суспензию нанодисперсного диоксида кремния (SiO 2 x 0,14H 2 O), полученную методом синтеза наноструктур – метод жидкокристаллического темплатирования, позволяющего получать материалы с уникальными текстурноструктурными характеристиками (высокой удельной поверхностью, однородным распределением пор по размерам и их упорядоченностью) [6, 11]. Матриксом суспензии являлась бидистиллированная вода. Для сравнительного анализа эффектов субхронической токсичности использовали водную суспензию микродисперсного диоксида кремния (SiO2 x 0,08H 2 O), синтезированную методом Штобера [10] (синтез выполнен в лаборатории многофазных дисперсных систем Института технической химии Уральского отделения РАН).
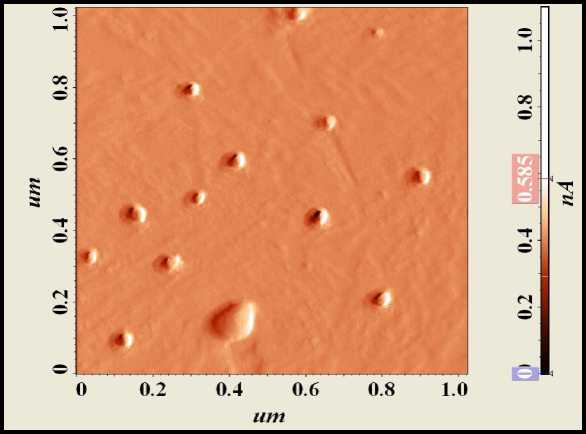
а

б
Рис. 1. Изображение синтезированных частиц нанодисперсного диоксида кремния: а – атомно-силовая микроскопия;
б – электронная микроскопия
Наночастицы в исследуемом образце имели 67 % частиц эллипсовидной формы размером в меньшей из осей 25–35 нм и 33 % частиц сферической формы диаметром 25 нм (рис. 1).
Микрочастицы диоксида кремния являлись частицами «традиционной» дисперсности» (размер 1,63–2,35 мкм в 100 % случаев) несферической формы. Нанодис-персный диоксид кремния имел удельную площадь поверхности частиц 96,96 м2/г, соответствующую таковой поверхности частиц наноразмерного диапазона аморфного диоксида кремния (от 50 до 380 м2 на 1 г вещества), и превышал в 7,6 раза удельную площадь поверхности микроразмерно-го аналога (12,54 м2/г).
Концентрация кремния в водной суспензии наноразмерного диоксида кремния, определяемая методом атомно-абсорбционной спектрометрии с ацетилено-воздушным пламенем на анализаторе Perkin Elmer 3110 (Perkin Elmer Inc., США), составила 65 мг/см3, микродисперсного аналога – 40 мг/см3.
Непосредственно перед проведением аналитических исследований для предотвращения образования агрегатов и агломератов в жидкой фазе в условиях старения для равномерного распределения частиц SiO 2 в объеме проводили ультразвуковую обработку суспензии на ультразвуковом гомогенизаторе Sonopuls Hd 3200 Bandelin (Германия) при комнатной температуре в течение 2 минут в режиме непрерывной пульсации на 65%-ной мощности.
Экспериментальные исследования осуществляли на белых крысах-самцах линии Wistar массой 190 ± 20 г в количестве 30 особей (по десять животных в группе), приобретенных в питомнике «Андреевка» ФГБУ «Научный центр биомедицинских технологий» РАН (Правила лабораторной практики: приказ Минздравсоцразвития России № 708н от 23 августа 2010 г.). Работа с экспериментальными животными выполнена в соответствии с Руководством по уходу и использованию лабораторных животных (ILAR, DELS) [5]. Животных содержали в стандартных условиях вивария на полусинтетическом рационе, пищевая и биологическая ценность которого полностью удовлетворяли физиологические потребности. Доступ к пище и воде не ограничивали. Все животные до начала эксперимента находились в карантине не менее 14 суток.
Сравнительный анализ эффектов субхронической токсичности выполнен при введении веществ в дозе 14,6 мг/кг веса тела (1/250 ЛД50), соответствующей прогнозируемой пороговой дозе подострого эксперимента (LOAEL), установленной расчетным методом по результатам оценки острой токсичности водной суспензии на-норазмерного диоксида кремния [4]. Вод- ную суспензию нанодисперсного диоксида кремния вводили животным внутрижелу-дочно через зонд в объеме 0,3 ± 0,1 см3 (группа 1 – опытная), микродисперсного диоксида кремния – в объеме 0,6 ± 0,1 см3 (группа 2 – сравнения). Животным контрольной группы вводили внутрижелудоч-но через зонд бидистиллированную воду в максимальном объеме 0,6 ± 0,1 см3 (группа 3 – контроль). Длительность эксперимента составила 90 дней.
У животных всех групп проводили отбор крови из хвостовой вены и определяли гематологические и биохимические показатели до начала (исходный фон) и на 90-й день эксперимента. Перечень анализируемых показателей, составленный с учетом результатов предварительной оценки опасности нанодисперсного диоксида кремния, позволял выявить развитие негативных эффектов и оценить функциональное состояние органов/или систем-мишеней:
-
– системы крови и кроветворных органов (концентрация гемоглобина, гематокрит, общее количество эритроцитов, средний объем эритроцита и концентрация гемоглобина в эритроците в цельной крови);
-
– иммунной системы (относительное число эозинофилов, лимфоцитов, эозинофильно-лимфоцитарный индекс крови);
-
– печени (содержание малонового диальдегида (МДА), гидроперекиси липидов (ГЛ), активность антиоксидантного статуса (АОС); супероксиддисмутазы (СОД), аланинаминотрансферазы (АЛАТ), аспартатаминотрансферазы (АСАТ), гамма-глутамил-транспептидазы (ГТП) в сыворотке крови);
-
– ЖКТ (количество лейкоцитов, лейкоцитарная формула цельной крови; уровень С-реактивного белка и протеинограм-ма сыворотки крови).
Определение изучаемых показателей выполнено в соответствии с протоколом использования автоматического гематологического (Coulter Ac*T 5diff AL, Beсkman Culter, США), биохимического (Konelab20, Thermo Scientific, Finland), иммунофер-ментного (Infinite-F50, Tecan, Австрия) анализаторов.
Для оценки достоверности различий полученных данных использовали t -критерий Стьюдента (сравнение групп опыта и контроля по количественным признакам). Различия полученных результатов являлись статистически значимыми при р ≤ 0,05 [2].
Выведение животных из эксперимента осуществляли на 90-й день щадящим методом эвтаназии при помощи углекислого газа. Для изучения морфологических изменений тканей внутренних органов у экспериментальных животных выполняли отбор висцеральных органов (легкие, сердце, желудочно-кишечный тракт, печень, селезенка, почки) методом полной эвисцерации по Шору. Извлечение головного мозга, бедренной кости для гистологического анализа производили специализированным инструментом.
Морфологическое исследование включало фиксацию материала в 10%-ном забу-ференном нейтральном формалине, обезвоживание в спиртах восходящей концентрации, пропитывание фрагментов органов хлороформом и парафином, а затем заливку гомогенизированной средой Histomix. Срезы толщиной 4 мкм изготавливали на санном микротоме JUNG SM 2000R (Leica, Германия) и окрашивали по общепринятой методике гематоксилином и эозином. Полученные гистологические препараты исследовали в светооптическом микроскопе Axiostar (Carl Zeiss, Германия).
Результаты и их обсуждение. Исследование и сравнительная оценка отклонений гематологических и биохимических показателей крови, морфологических изменений тканей внутренних органов позволило установить негативные эффекты, характеризующие токсическое действие тестируемых веществ.
У экспериментальных животных группы 1 выявлен цитолитический эффект, реализующийся через активацию перекисного окисления липидов мембран клеток, по достоверному увеличению уровня МДА и гидроперекиси липидов в сыворотке крови в 1,5 и 1,9 раза соответственно относительно контрольных значений ( р = 0,001) (таблица).
У животных, получавших микродис-персный аналог, наблюдалось достоверное увеличение уровня гидроперекиси липидов в сыворотке крови в 1,3 раза относительно контроля ( р = 0,039). На фоне активации перекисного окисления липидов у животных группы 1 установлено истощение резервов антиоксидантной защиты. Об этом
Биохимические и гематологические показатели крови, токсические эффекты при внутрижелудочном введении крысам линии Wistar нано- и микродисперсного диоксида кремния в течение 90 дней
|
Эффект |
Показатель |
Нанодисперсный диоксид кремния |
Микродисперсный диоксид кремния |
Контроль |
|
Цитолитический |
МДА, мкмоль/см3 |
3,4±0,4* |
2,4±0,3 |
2,3±0,2 |
|
ГЛ, моль/дм3 |
59,7±16,6* |
40,2±3,8* |
30,9±3,0 |
|
|
СОД, нг/см3 |
3,7±0,6* |
5,5±0,4 |
5,5±0,1 |
|
|
АОС, мкмоль/дм3 |
81,3±8,4* |
170,6±4,5 |
174,6±17,3 |
|
|
АЛАТ, Е/дм3 |
65,5±18,52* |
54,8±8,8 |
55,7±4,3 |
|
|
АСАТ, Е/дм3 |
122,3±59,3 |
130,5±27,7 |
129,1±13,1 |
|
|
ГТП, Е/дм3 |
4,1±0,4 |
3,7±0,5 |
3,9±0,4 |
|
|
Орган-мишень |
Печень |
– |
– |
|
|
Воспалительный |
СРБ, мг/дм3 |
8,3±0,7* |
7,4±0,7* |
5,25±0,21 |
|
Орган-мишень |
Желудок, тощая и ободочная кишка |
Желудок, тощая и ободочная кишка |
– |
|
|
Иммунораздражающий |
Эозинофильно-лимфоцитарный индекс, усл. ед. |
0,02±0,006* |
0,0034±0,006 |
0,0032±0,003 |
|
Орган-мишень |
Селезенка |
– |
– |
Примечание: *– статистически достоверные различия с показателем в контроле ( р ≤ 0,05).
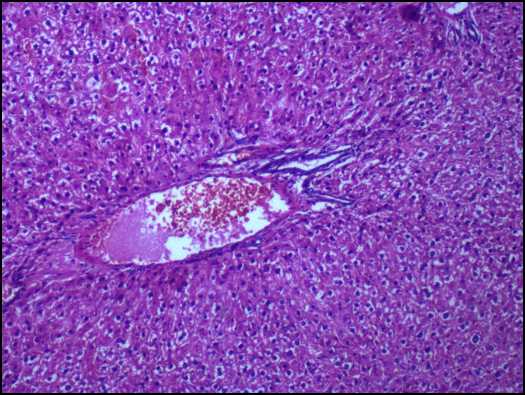
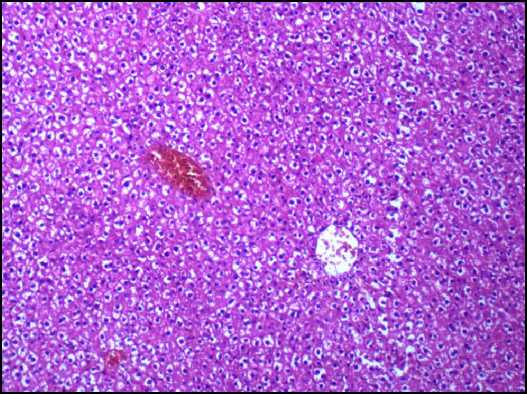
Рис. 2. Печень крысы на 90-й день эксперимента при внутрижелудочном введении тестируемых веществ в дозе 14,6 мг/кг. Окраска гематоксилином и эозином: а - нанодисперсный диоксид кремния, ув. х 400; б - микродисперсный диоксида кремния, ув. х 200
свидетельствует достоверное снижение активности СОД и АОС сыворотки крови в 1,5 и 2,2 раза относительно значений контрольной группы (р = 0,001-0,007). Показатели антиоксидантной системы животных группы 2 в течение всего эксперимента соответствовали контрольному уровню.
Установленные изменения свидетельствуют о развитии оксидантно-антиоксидантного дисбаланса, что, в свою очередь, может вызвать структурные нарушения в билипидном слое клеточных мембран за счет преимущественного окисления ненасыщенных жирных кислот [8]. Следствием этого является нарушение ассоциации и активности мембраносвязанных ферментов, окисление SH-групп трансмембранных белков и образование комплексов окисленных липидов с белками, способствующих полимеризации белковых молекул [1]. Указанный спектр молекулярной патологии ведет к разрушению субклеточных и клеточных мембран гепатоцитов (эффект цитолиза), что может приводить к повышению активности в сыворотке крови внутриклеточных ферментов. Начальные проявления цитолитического эффекта зарегистрированы у животных группы 1 по увеличению активности АЛАТ в сыворотке крови в 1,2 раза (р = 0,041). У животных группы 2 активность данного фермента соответствовала показателю контрольной группы. Подтверждением повышения цитолитической ак- тивности является изменение морфологической структуры клеток печени. Показано, что у экспериментальных животных группы 1 гепатоциты находятся в состоянии мелкоочаговой гидропической дистрофии, цитоплазма части клеток (особенно субкап-сулярно) оптически прозрачна. В группе животных, получавшей микродисперсный аналог, не установлено увеличения активности внутриклеточных ферментов в сыворотке крови и морфологических изменений клеток печени (рис. 2).
У животных контрольной группы (данные не приведены) в гистологических препаратах тощей кишки отмечается сохранность структуры стенки, кишечные ворсинки тонкие, с рыхлой стромой, прослеживаются бокаловидные клетки. В гис-
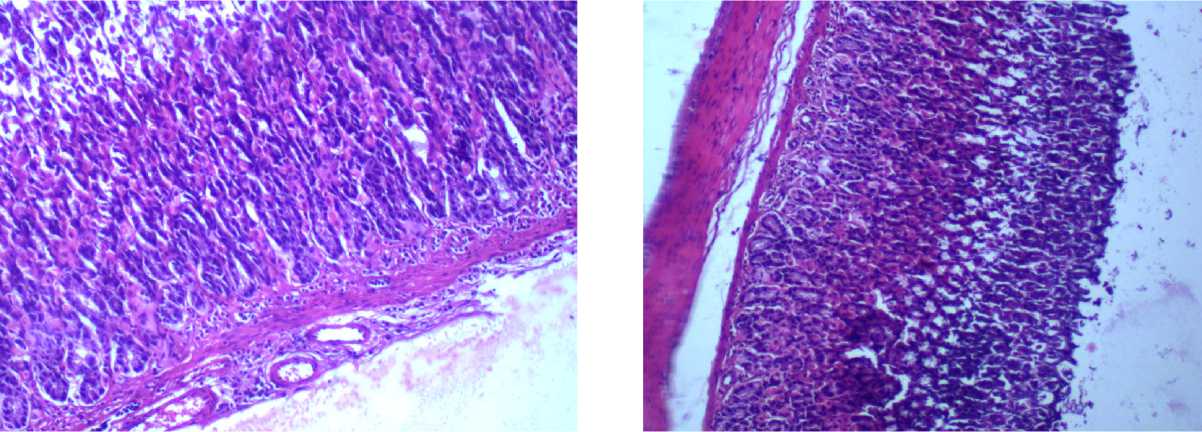
а б
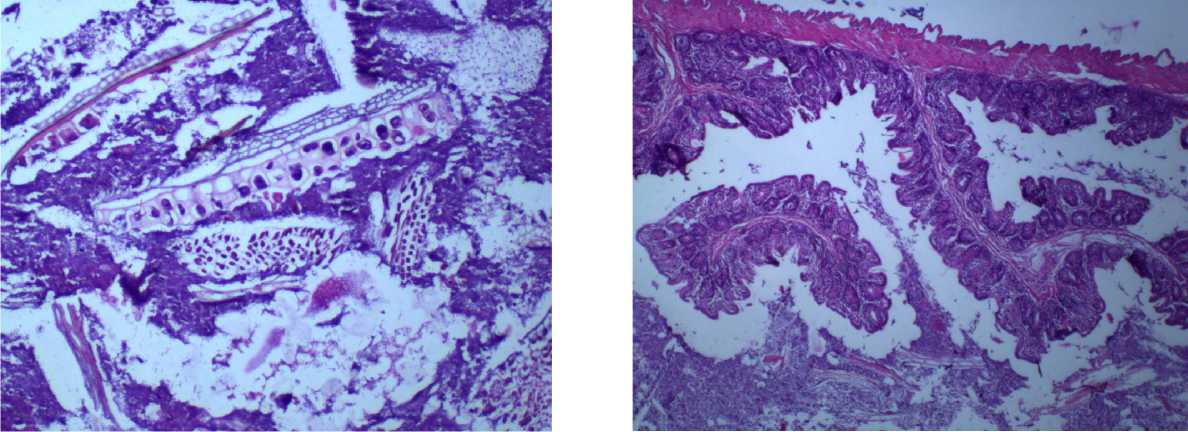
Рис. 3. Желудок крысы на 90-й день эксперимента при внутрижелудочном введении тестируемых веществ в дозе 14,6 мг/кг. Окраска гематоксилином и эозином, ув. х 400: а — нанодисперсный диоксид кремния; б – микродисперсный диоксида кремния
а б
а
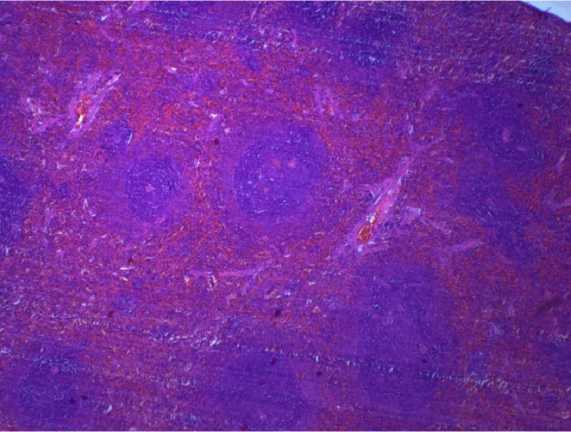
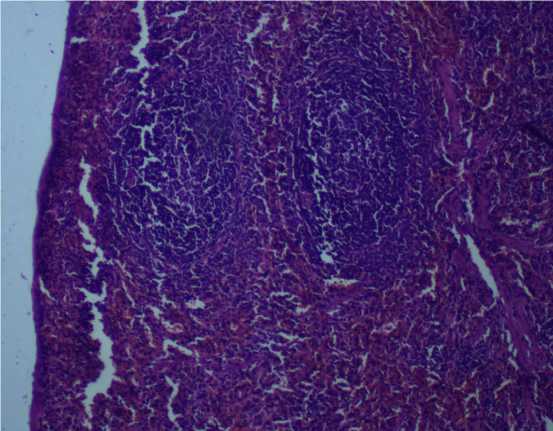
Рис. 5. Селезенка крысы на 90-й день эксперимента при внутрижелудочном введении тестируемых веществ в дозе 14,6 мг/кг. Окраска гематоксилином и эозином: а – нанодисперсный диоксид кремния, ув. х 200; б — микродисперсный диоксида кремния, ув. х 400
Рис. 4. Ободочная кишка крысы на 90-й день эксперимента при внутрижелудочном введении тестируемых веществ в дозе 14,6 мг/кг. Окраска гематоксилином и эозином, ув. х 200: а – нанодисперсный диоксид кремния; б – микродисперсный диоксида кремния
б
тологических препаратах ободочной кишки визуализируется неизмененная структура стенки.
О развитии иммунораздражающего эффекта у животных группы 1 свидетельствует достоверное снижение эозинофильнолимфоцитарного индекса цельной крови в 1,5 раза относительно значений контрольной группы ( р = 0,004–0,043). Данный токсический эффект подтверждается наличием скоплений лимфоцитов, макрофагов, лейкоцитов и плазматических клеток в пульпарных тяжах селезенки. В группе животных, получавших микродисперсный диоксид кремния, отклонений данного показателя и патологических изменений в ткани селезенки по сравнению с контролем не обнаружено (рис. 5).
Полученные результаты согласуются с вышеупомянутым теоретическим предположением о большей степени токсичности наноразмерных частиц диоксида кремния по сравнению с его микроразмерным аналогом, что необходимо учитывать при решении задач гигиенического регламентирования содержания наноразмерных частиц в воде и пищевых продуктах.
Список литературы Сравнительная оценка токсичности водной суспензии нано- и микродисперсного диоксида кремния в субхроническом эксперименте
- Блюгер А.Ф., Майоре А.Я. Проблемы перекисного окисления липидов в гепатологии//Успехи гепатологии. -1978. -№ 7. -С. 22-54.
- Гланц С. Медико-биологическая статистика/под ред. Н.Е. Бузикашвили и соавт. -М.: Практика, 1998. -459 с.
- Нанопорошки: описание и объемы производства: маркетинговый отчет Исследовательской компании «Abercade». -2008. -URL: http://www.abercade.ru/research/analysis/66.html (дата обращения: 19.02.2014).
- Токсиколого-гигиеническая оценка безопасности водной суспензии нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования/Н.В. Зайцева, М.А. Землянова, В.Н. Звездин, Е.В. Саенко//Анализ риска здоровью. -2013. -№ 1. -С. 65-72.
- Guide for the care and use of laboratory animals. Eighth Edition. Committee for the Update of the Guide for the Care and Use of Laboratory Animals; Institute for Laboratory Animal Research (ILAR); Division on Earth and Life Studies (DELS); National Research Council of the national academies. -Washington: The national academies press, 2011.
- Meynen V., Cool P., Vansant E.F. Verified syntheses of mesoporous materials//Microporous and mesoporous materials. -2009. -Vol. 125. -P. 170-223.
- Nanotoxicology (editorial)/K. Donaldson, V. Stone, C.K. Tran et al.//Occupat. and Environm. Med. -2004. -Vol. 61. -P. 727-728.
- Predictive tests to evaluate oxidative potential engineered nanomaterials: Nanotechnology and nanotoxicology/M. Ghiazza, E. Carella, M. Tomatis, M. Corazzari, M. Cristina. -Grenoble, 2012.
- Reactivity of engineered inorganic nanoparticles and carbon nanostructures in biological media/N.G. Bastus, E. Casals, V.S. Socono, V. Puntes//Nanotoxicology. -2008. -Vol. 2. -P. 99-112.
- Smart Control of Monodisperse Stolber Silica Particles: Effect of Reactant Addition Rate on Growth Process/K. Nozawa, H. Gailhanou, L. Raison, P. Panizza//Langmuir. -2005. -Vol. 21. -P. 1516-1523.
- Vallet-Regi M., Balas F., Arcos D. Mesoporous Materials for Drug Delivery//Angew. Chem. Int. Ed. -2007. -Vol. 46. -P. 7548-7558.
- World Nanotechnology: Innovation and Technology Trends. Nanotechnology Industry Market Research Reports. 2012. -URL: http://www.reportlinker.com/ci02344-p2/Nanotechnology.html/mode/public 319_1.pdf (дата обращения: 12.01.2014).


