Сравнительная посегментарная оценка молекулярных особенностей слизистой оболочки толстой кишки при ворсинчатых аденомах
Автор: Короткевич А.Г., Титов С.Е., Жилина Н.М., Деменков П.С., Веряскина Ю.А., Бондарев О.И.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.9, 2024 года.
Бесплатный доступ
Цель. Определить частоту проявления одиночных ворсинчатых аденом по сегментам толстой кишки и выполнить сравнение молекулярно-генетических особенностей ворсинчатых аденом со слизистой оболочкой индексного сегмента и между разными сегментами толстой кишки, а также характеристиками неизмененной слизистой оболочки аналогичных сегментов толстой кишки.Материал и методы. Сплошное поперечное ретроспективное исследование результатов 3086 колоноскопий. В исследовании изучены 347 клеточных образцов: ворсинчатых аденом - 109, слизистой оболочки индексного сегмента - 101, нормальной слизистой оболочки - 137. Детекцию миРНК и мРНК выполняли с помощью ПЦР в реальном времени. Детекцию соматических мутаций проводили с помощью аллель-специфичной ПЦР с гидролизуемым зондом.
Колоноскопия, ворсинчатые аденомы, колоректальный рак, генные мутации, мирнк
Короткий адрес: https://sciup.org/142243832
IDR: 142243832 | УДК: 616.345-006.55-079 | DOI: 10.5922/2223-2427-2024-9-4-2
Текст научной статьи Сравнительная посегментарная оценка молекулярных особенностей слизистой оболочки толстой кишки при ворсинчатых аденомах
To cite this article: Korotkevich AG, Titov SE, Zhilina NM, Demenkov PS, Veryaskina YA, Bondarev OI. Comparative segmental evaluation of molecular features of colonic mucosa in villous adenomas. Surgical practice (Russia). 2024;9(4):16—32.
Гистологическое строение аденом толстой кишки (ТК) имеет вполне определенное значение в понимании онкориска / малигнизации [1; 2]. Известно, что увеличение доли ворсинчатого (папиллярного) компонента существенно повышает риск раковой трансформации [2—4]. Ворсинчатые аденомы (ВА) составляют от 5 до 15 % всех аденом [2], однако далеко не все ВА трансформируются в колоректальный рак (КРР). В ряде случаев в ТК встречаются разные гистологические типы аденом, как и сочетание аденом с колоректальным раком (КРР) [5].
Существует мало исследований, изучающих связь между характеристиками аденомы при исходной колоноскопии и КРР, и еще меньше исследований, в которых проводят анализ КРР по сегментам ТК [1]. Вместе с тем показано, что ВА чаще поражают дистальные отделы ТК [3]. В связи с мнением о преобладании частоты КРР в дистальных отделах ТК и связи с дисплазией возникает вопрос о связи именно ВА с КРР этой локализации [1]. С другой стороны, частота КРР в правой и левой половинах ТК имеет стабильно сохраняющиеся незначительные различия [6]. Некоторые авторы объясняют это преимущественным значением зубчатого пути КРР, особенно для правой половины ТК [4; 7; 8]. Важный вопрос об изменениях слизистой оболочки (СО) в индексных для ВА сегментах ТК и их идентичности изменениям в ВА остается открытым.
До сих пор внимание исследователей было обращено к поиску первопричины возникновения КРР, в том числе на уровне СО ТК [1; 9; 10]. Мы в своем исследовании проверяли факт и тождественность молекулярных изменений в ВА и СО индексного сегмента ТК. Воз- можно, поиск различий или подтверждение одинаковости изменений на молекулярном уровне помогут в совершенствовании программ скрининга КРР или создании инструментов прогнозирования риска КРР.
Целью исследования было определение частоты одиночных ВА по сегментам ТК и сравнение молекулярно-генетических особенностей ВА со СО индексного сегмента и между разными сегментами ТК, как и характеристиками неизмененной СО аналогичных сегментов ТК.
Материал и методы
Сплошное поперечное ретроспективное исследование результатов 3086 колоноскопий в отделении эндоскопии НГКБ № 29 им. А. А. Луцика в 2019—2020 гг. Проспективное исследование (2022—2023) СО ТК у 109 пациентов с ворсинчатыми аденомами. Исследование одобрено локальным этическим комитетом НГКБ № 29 от 19.04.2022 г. Материал был получен в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации, принятой на 18-й Генеральной ассамблее ВМА, (Хельсинки, Финляндия, июнь 1964 г.), с последующими редакциями и положениями действующего законодательства РФ. От каждого пациента было получено информированное добровольное согласие, все данные были деперсонализированы. Использовали эндоскопы высокого разрешения с функцией виртуальной хромоскопии. Биоптаты из каждого отдела толстой кишки помещали на предметное стекло, делали мазок, высушивали. Биоптат СО брали не ближе 10 см от аденомы из индексного сегмента. В мазках определяли относительные уровни экспрессии миРНК и мРНК. Всего в рамках данной работы было исследовано 347 клеточных образцов: ворсинчатых аденом — 109, СО индексного сегмента — 101, нормальной СО — 137 (табл. 1).
Таблица 1. Использованные в работе образцы
Table 1. Samples used in the study
|
Отдел ТК |
Количество образцов |
|||||||
|
Ворсинчатая аденома |
Слизистая индексного сегмента |
Нормальная слизистая |
Всего |
|||||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
|
Слепая кишка |
4 |
4 |
4 |
4 |
21 |
14 |
29 |
8 |
|
Поперечная ободочная кишка |
6 |
6 |
6 |
6 |
31 |
23 |
43 |
12 |
|
Нисходящая ободочная кишка |
7 |
6 |
10 |
10 |
31 |
23 |
48 |
14 |
|
Сигмовидная кишка |
81 |
74 |
76 |
76 |
30 |
22 |
187 |
54 |
|
Прямая кишка |
11 |
10 |
5 |
5 |
24 |
18 |
40 |
12 |
|
Итого |
109 |
100 |
101 |
100 |
137 |
100 |
347 |
100 |
Для некоторых сравнений (при отсутствии различий между сегментами) образцы поперечной, нисходящей и сигмовидной ободочной кишки объединяли под аббревиатурой ПНС.
Выделение РНК. Цитологический препарат соскребали со стекла в пробирку и добавляли 600 мкл лизирующего буфера (4 М гуанидинизотиоцианат, 25 мМ цитрат натрия, 0,3 % саркозил, 3 % ДТТ). Далее выделение проводили, как описано в статье В. В. Анищенко [11].
Первичный отбор набора миРНК для анализа был осуществлен на основании анализа литературы. В итоге был сформирован список из 9 миРНК-маркеров, связанных с развитием КРР: миР-135b-5p, -141-3p, -143-3p, -200a-3p, -20a-5p, -21-5p, -31-5p, -34a-5p, -92a-3p, в качестве референса для них использовалась малая ядерная (мя) РНК U6, а также миРНК-16-5卩 и -191Kp. Помимо миРНК в данной работе в качестве маркеров были использованы мРНК следующих генов: MUC2, CDX2, NOX1, LGR5, SMAD4, MS4A12, TIMP1, Ki-67, TERT с нормировкой на гены домашнего хозяйства PGK1и PUM1.
Детекция миРНК и мРНК с помощью ОТ-ПЦР-РВ. Для выявления зрелых миРНК и малой РНК U6 использовали метод, предложенный С. Chen с соавт. в 2005 г. Метод включает в себя 面 ратную транскрипцию зрелой миРНК с помощью длинного праймера со шпилькой, с последующей детекцией полученной кДНК с помощью ПЦР в реальном времени (ПЦР-РВ) [12]. Для каждой миРНК отдельно проводили реакцию обратной транскрипции с последующей ПЦР-РВ. Нормировку содержания миРНК проводили на среднее содержание малой ядерной РНК U6, а также миРНК-16 и -191 в 面 разце с помощью метода 2 -叫 13]. Выявление мяРНКиб осуществлялось по той же схеме stem-loopOT-ПЦР, которая использовалась для миРНК. По-луколичественную оценку содержания мРНК проводили методом ОТ-ПЦР-РВ со специфическими 叩 аймерами и флуоресцентно-мечеными зондами для выявления мРНК соответствующих генов и генов домашнего хозяйства PGK1 и PUM1, используемых для нормировки данных. Уровень относительной экспрессии рассчитывали с помощью метода 2–ΔCq.
Детекцию соматических мутаций осуществляли с помощью аллель-специфичной ПЦР с гидролизуемым зондом. Протокол ПЦР: предварительный прогрев при 95°С — 2 мин, 50 циклов: денатурация при 94°С — 10 с, отжиг и элонгация: 60°С — 15 с.
Статистический анализ проведен с использованием пакета IBM SPSS Statistics-22 и STATISTICA 10 (TIBCO Software, США). По результатам исследования создана база данных, выполнен ее первичный анализ. Сравнение двух независимых выборок по количественному признаку делали при помощи критерия Манна 一 Уитни, качественных признаков при помощи критерия χ 2. Критический уровень значимости был принят равным 0,000308 с учетом поправки Бонферрони.
Результаты
Общая частота ВА в структуре всех выявленных эпителиальных новообразований представлена на рисунке 1.
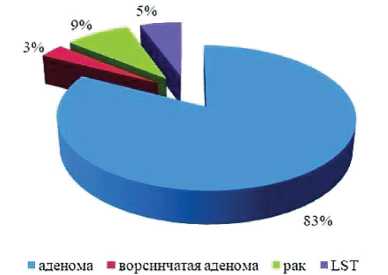
Рис. 1. Структура выявленных эпителиальных новообразований ТК
Fig. 1. Structure of detected colorectal epithelial neoplasms
Анализ частоты ВА по отделам кишки показал преобладание ВА в сигмовидной кишке. Вместе с тем доля ВА в структуре эпителиальных новообразований поперечной и восходящей кишки были одинаковы, но достоверно от нисходящей и 叩 ямой кишки не отличались (рис. 2).
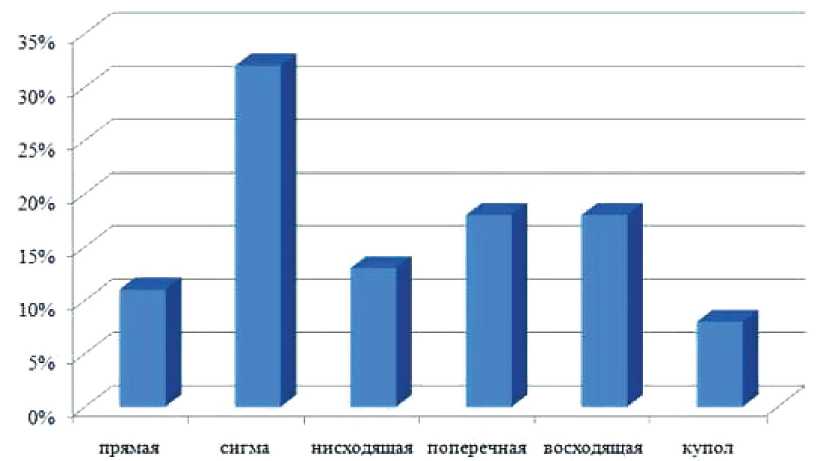
Рис. 2. Частота одиночных ВА по сегментам ТК
Fig. 2. Frequency of single VAs by colon segments
Гистологическая оценка ВА в соотношении с их диаметром подтвердила известную зависимость увеличения доли тяжелой дисплазии от размера ВА (рис. 3).
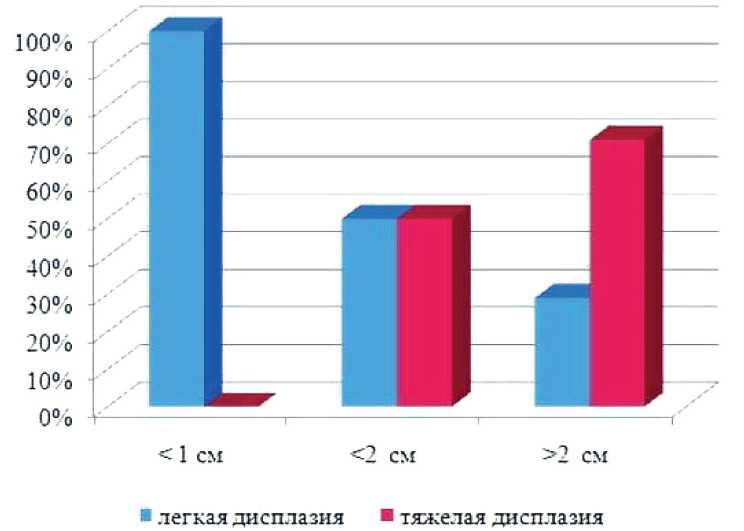
Рис. 3. Частота и тяжесть дисплазии в зависимости от диаметра ВА Fig. 3. Frequency and severity of dysplasia as a function of VA diameter
В исследуемой выборке образцов мы выявляли соматические мутации в 600-м кодоне гена BRAF, 12/13-м и 61-м кодонах генов KRAS и NRAS, а также статус микросателлитной нестабильности (MSI/MSS). Среди ворсинчатых аденом чаще всего выявлялась мутация в 12/13-х кодонах гена KRAS — 37,6 %, далее по частоте встречаемости следует мутация в 600-м кодоне гена BRAF — 4,6 % и мутация в 61-м кодоне гена KRAS — 2,8 %, остальные мутации, включая микросателлитную нестабильность, встретились в 1,8 % случаев. Также мутации в 12/13-м кодонах гена KRAS встретились в 1,2 % нормальной СО ТК (пациенты без
ВА) и 3,0 % СО ТК пациентов с ВА, в последней группе в 1 % случаев обнаружилась мутация в 12/13-м кодонах гена NRAS. Распределение выявленных мутаций между разными типами образцов и разными отделами ТК приведены на рисунке 4.
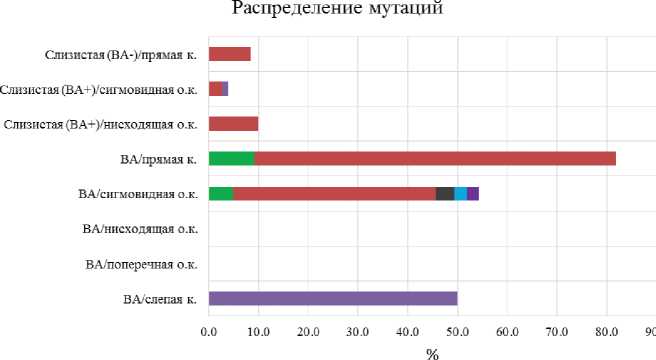
■ BRAF ■ KRAS-12,13 ・KRAS-Q61 ・NRAS-12 』 3 «NRAS-Q61 "MSS/MSI
Рис. 4. Распределение мутаций в разных типах образцов и в разных отделах ТК
Примечание: слизистая (ВА +) — нормальная слизистая ТК пациентов с ворсинчатыми аденомами; слизистая (ВА–) — нормальная слизистая ТК пациентов безворсинчатых аденом; к. — кишка; о. к. — ободочная кишка.
Fig. 4. Distribution of mutations in different types of samples and in different parts of the colon
Mucosa (ВA +): normal colonic mucosa of patients with villous adenomas; Mucosa (ВA –): normal colonic mucosa of patients without villous adenomas; к. stands for the intestine; о. к. for the colon.
С помощью ОТ-ПЦР-РВ мы определили относительную экспрессию 9 миРНК и 9 бе-лок-кодирующих генов, связанных с развитием КРР. В таблицах 2—4 приведены данные по статистической значимости различий между экспрессией миРНК/мРНК в участках СО, относящихся к разным типам образцов и разным отделам толстой кишки.
Таблица 2. Уровень значимости статистических различий при попарном сравнении экспрессии миРНК/мРНК в разных типах образцов, относящихся к слепой кишке
Table 2. Significance level of statistical differences in pairwise comparisons of miRNA/mRNA expression in different types of specimens related to the cecum
|
Маркер |
Значение P при сравнении групп |
||
|
ВА |
ВА |
Слизистая (ВА +) |
|
|
Слизистая (ВА +) |
Слизистая (ВА –) |
Слизистая (ВА –) |
|
|
миР-135b |
2,86E-02 |
1,58E-04* |
0,543083 |
|
миР-141 |
2,86E-02 |
6,32E-04 |
0,409170 |
|
миР-143 |
2,86E-02 |
1,11E-03 |
0,914783 |
Окончание табл. 2
|
Маркер |
Значение P при сравнении групп |
||
|
ВА |
ВА |
Слизистая (ВА +) |
|
|
Слизистая (ВА +) |
Слизистая (ВА –) |
Слизистая (ВА –) |
|
|
миР-200a |
2,86E-02 |
4,27E-03 |
0,496443 |
|
миР-20a |
2,86E-02 |
3,16E-04 |
0,747826 |
|
миР-21 |
2,86E-02 |
6,32E-04 |
0,914783 |
|
миР-31 |
2,86E-02 |
1,58E-04* |
0,409170 |
|
миР-34a |
2,86E-02 |
1,58E-04* |
0,914783 |
|
миР-92a |
2,86E-02 |
8,38E-03 |
0,543083 |
|
MUC2 |
1,000000 |
0,113360 |
2,85E-03 |
|
CDX2 |
0,885714 |
0,231304 |
0,113360 |
|
NOX1 |
2,86E-02 |
1,58E-04* |
0,914783 |
|
LGR5 |
2,86E-02 |
4,27E-03 |
0,203162 |
|
SMAD |
0,685714 |
0,409170 |
0,295178 |
|
MS4A12 |
2,86E-02 |
1,58E-04* |
0,591937 |
|
TIMP1 |
0,114286 |
3,07E-02 |
0,747826 |
|
Ki-67 |
0,342857 |
0,081423 |
0,971383 |
|
TERT |
0,114286 |
0,543083 |
0,409170 |
Примечание: * выделены значимые (p < 0,000308) различия.
Таблица 3. Уровень значимости статистических различий при попарном сравнении экспрессии миРНК/мРНК в разных типах образцов, относящихся к поперечной, нисходящей, сигмовидной ободочной кишке
Table 3. Significance level of statistical differences in pairwise comparison of miRNA/mRNA expression in different types of samples related to the transverse / descending / sigmoid colon
|
Маркер |
Значение P при сравнении групп |
||
|
ВА |
ВА |
Слизистая (ВА +) |
|
|
Слизистая (ВА +) |
Слизистая (ВА –) |
Слизистая (ВА –) |
|
|
миР-135b |
1,67E-20* |
5,70E-30* |
1,53E-11* |
|
миР-141 |
0,072850 |
0,596234 |
6,11E-03 |
|
миР-143 |
4,25E-09* |
2,09E-17* |
2,45E-03 |
|
миР-200a |
5,17E-04 |
2,87E-03 |
0,350145 |
|
миР-20a |
2,19E-09* |
1,98E-05* |
1,62E-04* |
|
миР-21 |
2,76E-11* |
4,40E-17* |
0,096994 |
|
миР-31 |
9,85E-13* |
3,41E-13* |
0,467419 |
|
миР-34a |
9,20E-17* |
3,41E-19* |
0,340242 |
|
миР-92a |
7,02E-06* |
4,58E-06* |
0,353008 |
|
MUC2 |
2,87E-03 |
0,088404 |
4,98E-03 |
|
CDX2 |
4,87E-03 |
4,85E-05* |
0,108661 |
Окончание табл. 3
|
Маркер |
Значение P при сравнении групп |
||
|
ВА |
ВА |
Слизистая (ВА +) |
|
|
Слизистая (ВА +) |
Слизистая (ВА –) |
Слизистая (ВА –) |
|
|
NOX1 |
2,58E-04* |
2,60E-10* |
6,72E-04 |
|
LGR5 |
4,67E-10* |
9,32E-15* |
1,86E-02 |
|
SMAD |
0,061857 |
0,496729 |
0,155162 |
|
MS4A12 |
2,85E-20* |
1,24E-24* |
0,065429 |
|
TIMP1 |
1,80E-20* |
3,50E-27* |
3,65E-02 |
|
Ki-67 |
6,26E-05* |
1,68E-12* |
1,26E-02 |
|
TERT |
3,28E-05* |
4,31E-16* |
1,61E-09* |
Примечание: * выделены значимые (p < 0,000308) различия.
Таблица 4. Уровень значимости статистических различий при попарном сравнении экспрессии миРНК/мРНК в разных типах образцов, относящихся к прямой кишке
Table 4. Significance level of statistical differences in pairwise comparison of miRNA/mRNA expression in different types of samples related to the rectum
|
Маркер |
Значение P при сравнении групп |
||
|
ВА |
ВА |
Слизистая (ВА +) |
|
|
Слизистая (ВА +) |
Слизистая (ВА –) |
Слизистая (ВА –) |
|
|
миР-135b |
4,58E-04 |
4,65E-07* |
1,57E-02 |
|
миР-141 |
8,70E-03 |
0,084873 |
2,70E-02 |
|
миР-143 |
0,221154 |
9,49E-03 |
0,633826 |
|
миР-200a |
0,377289 |
0,051794 |
0,518395 |
|
миР-20a |
5,49E-03 |
6,66E-07* |
0,414231 |
|
миР-21 |
8,70E-03 |
1,30E-06* |
0,245093 |
|
миР-31 |
5,49E-03 |
1,54E-05* |
0,801280 |
|
миР-34a |
4,58E-04 |
4,79E-09* |
0,674464 |
|
миР-92a |
5,49E-03 |
6,30E-04 |
0,482304 |
|
MUC2 |
1,000000 |
0,370496 |
0,555699 |
|
CDX2 |
3,21E-03 |
4,34E-02 |
0,180708 |
|
NOX1 |
1,92E-02 |
1,64E-02 |
0,245093 |
|
LGR5 |
8,70E-03 |
1,54E-05* |
0,058979 |
|
SMAD |
1,000000 |
0,152209 |
0,322934 |
|
MS4A12 |
4,58E-04 |
4,79E-09* |
0,977694 |
|
TIMP1 |
3,21E-03 |
3,24E-04 |
0,758301 |
|
Ki-67 |
1,000000 |
0,237932 |
0,322934 |
|
TERT |
2,75E-02 |
0,098978 |
0,162098 |
Примечание: * выделены значимые (p < 0,000308) различия.
Наибольшее количество отличий было получено для поперечной, нисходящей, сигмовидной ободочной кишки (ПНС), что, видимо, связано с наибольшим количеством образцов в этой группе. Наибольшее количество статистически значимых различий было выявлено для миРНК-135b, -31, -34a и гена MS4A12. Только для ПНС была зафиксирована статистически значимая разница между СО пациентов с ВА и СО пациентов без ВА для миРНК-135b, -20a и гена TERT.
С использованием данных относительной экспрессии миРНК и мРНК были рассчитаны значения AUC ROC для оценки способности различения ВА и неизмененной СО соответствующего отдела ТК с помощью каждого молекулярного маркера в отдельности (табл. 5).
Таблица 5. AUC ROC всех миРНК и мРНК, рассчитанные для оценки способности различения ВА и неизмененной СО соответствующего отдела ТК
Table 5. AUC ROC for all miRNAs and mRNAs, calculated to assess their ability to distinguish between villous adenomas and unaltered mucosa in the respective colon segment
|
Маркер |
Слепая кишка |
ПНС |
Прямая кишка |
|
миР-135b |
1,000* |
0,983* |
0,966* |
|
миР-141 |
0,976* |
0,522 |
0,687 |
|
миР-143 |
0,964* |
0,860* |
0,773 |
|
миР-200a |
0,929* |
0,627 |
0,710 |
|
миР-20a |
0,988* |
0,681 |
0,964* |
|
миР-21 |
0,976* |
0,857* |
0,955* |
|
миР-31 |
1,000* |
0,809* |
0,920* |
|
миР-34a |
1,000* |
0,880* |
1,000* |
|
миР-92a |
0,905* |
0,695 |
0,848 |
|
MUC2 |
0,762 |
0,572 |
0,598 |
|
CDX2 |
0,702 |
0,673 |
0,718 |
|
NOX1 |
1,000* |
0,768 |
0,756 |
|
LGR5 |
0,857 |
0,829* |
0,922* |
|
SMAD |
0,643 |
0,529 |
0,653 |
|
MS4A12 |
1,000* |
0,935* |
1,000* |
|
TIMP1 |
0,839 |
0,958* |
0,864* |
|
Ki-67 |
0,792 |
0,802* |
0,627 |
|
TERT |
0,524 |
0,838* |
0,701 |
Примечание: * выделены значения AUCROC > 0,8 и 95 % ДИ < 0,25.
Значения AUCROC, равные 1 для слепой и прямой кишки, связаны, по-видимому, с небольшим объемом выборок для этих отделов, тем не менее для ПНС, где объем выборки значительный, AUCROC > 0,9 получился для трех маркеров: миР-135b, MS4A12 и TIMP1.
Сравнение между разными отделами ТК медиан относительных уровней экспрессии наиболее интересных маркеров: генов NOX1, LGR5, S4A12, TIMP, Ki-67 и TERT и миРНК-135b, -20a, -21, -31 и -34a — представлено на рисунках 5 и 6.
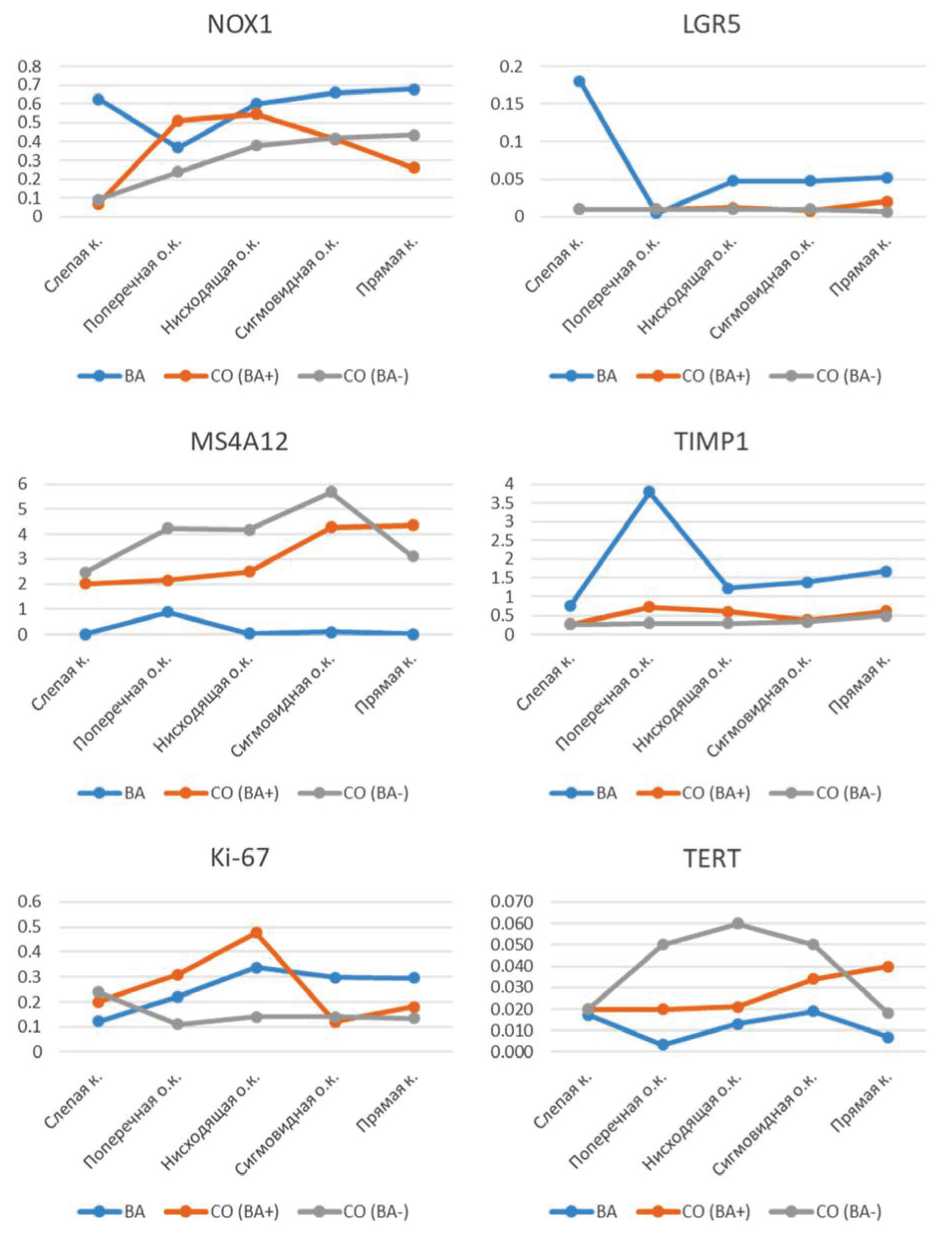
Рис. 5. Медианные значения экспрессии генов NOX1, LGR5, MS4A12, TIMP1, Ki-67 и TERT в разных отделах ТК
Примечание: ВА — ворсинчатая аденома; СО (ВА +) — нормальная слизистая ТК пациентов с ВА; СО (ВА –) — нормальная слизистая ТК пациентов без ВА; к. — кишка; о. к. — ободочная кишка.
Fig. 5. Median expression values for NOX1, LGR5, MS4A12, TIMP1, Ki-67 and TERT genes in different parts of the colon
Villous adenoma (VA); mucosa (BA +), normal colonic mucosa of patients with VA; mucosa (BA –), normal colonic mucosa of patients without VA; к. stands for the intestine; о. к. stands for the colon.
MS4A12
TIMP1
Ki-67
TERT
Рис. 6. Медианные значения экспрессии миРНК-135b, -20a, -21, -31 и -34aв разных отделах ТК
Примечание: ВА — ворсинчатая аденома; СО (ВА +) — нормальная слизистая ТК пациентов с ВА; СО (ВА –) — нормальная слизистая ТК пациентов без ВА; к. — кишка; о. к. — ободочная кишка
Fig. 6. Median expression values for miRNA-135b, -20a, -21, -31 and -34a in different parts of the colon
Villousadenoma (VA); mucosa (BA +), normal colonic mucosa of patients with VA; mucosa (BA –), normal colonic mucosa of patients without VA; к. stands for the intestine; о. к. stands for the colon.
Обсуждение
Аденоматозные полипы формируются преимущественно спорадически. Спорадический характер этих полипов является результатом либо мутации в генах, отвечающих за аденоматозный путь развития клетки, либо нарушения репарации ДНК [2; 8]. ВА, как тубу-ловорсинчатые (с долей ворсинчатого компонента < 75 %), так и ворсинчатые (с долей ворсинчатого компонента > 75 %), могут быть связаны с развитием поздних форм неоплазии [2; 3]. Считается, что ВА чаще появляются в ректосигмоидной области, но могут возникать и в других отделах ТК [1; 2]. Это подтверждается и нашими данными. Более крупные ВА с выраженной дисплазией преимущественно концентрируются в дистальном отделе толстой кишки (в левой ободочной и прямой кишке), в частности в нисходящей и сигмовидной частях [3].
Наша оценка частоты встречаемости ВА по сегментам ТК показала существенное преобладание их только в сигмовидной кишке, в прочих сегментах ВА встречались одинаково часто. Вместе с тем сочетания ВА и КРР отличаются по локализации, имеют явную связь с возрастом и дистальным расположением в ТК [4; 10].
Помимо собственно ворсинчатого строения аденом повышение риска развития КРР связано с диаметром опухоли и с их количеством [2; 3; 14]. Возможно, именно большой диаметр ВА, сопровождающийся тяжелой дисплазией, является причиной запущенного КРР. Тем не менее папиллярная структура новообразования определяет условный потенциал злокачественности, требующий поиска и изучения факторов, реализующих развитие КРР. В наших наблюдениях все ВА имели признаки дисплазии разной степени.
Конечно, регулярная колоноскопия доказала свою эффективность в предупреждении КРР путем выявления и удаления всех эпителиальных новообразований [1; 3]. Вместе с тем для формирования групп риска и программ индивидуальной профилактики, на наш взгляд, важным является поиск предикторов в СО, позволяющих при первичном эндоскопическом осмотре и анализе биоптата СО сформировать эти группы.
Сравнение молекулярно-генетических характеристик ВА и СО индексного сегмента показало достоверные различия экспрессии для довольно большого количества маркеров — миР-135b, -143, -20a, -21, -31, -34a, -92a, NOX1, LGR5, MS4A12, TIMP1, Ki-67, TERT, но только для сигмовидной кишки, что, видимо, связано с достаточно большим количеством образцов в этой группе.
Аналогичное сравнение характеристик СО индексного и аналогичного нормального сегмента ТК показало наиболее выраженные изменения СО в ПНС. Там была зафиксирована статистически значимая разница между СО пациентов с ВА и СО пациентов без ВА для миРНК-135b, -20a и гена TERT. В других отделах СО не имела существенных изменений в сравнении с нормальной. Также можно отметить, что направление изменений экспрессии исследованных маркеров в различных отделах СО пациентов с ВА было гораздо ближе к таковому в СО пациентов без ВА, чем собственно в ВА. Исключений для данного наблюдения три, и они относятся к экспрессии белок-кодирующих генов, а не миРНК: экспрессия гена NOX1 в поперечной и нисходящей ободочной кишке, экспрессия генаTERTв поперечной, нисходящей и сигмовидной ободочной кишке и экспрессия гена Ki-67 в поперечной и нисходящей ободочной кишке.
Другими словами, молекулярно-генетическая характеристика ВА не соответствует как СО индексного сегмента, так и нормальной СО соответствующего сегмента ТК. Это ставит под сомнение теорию предраковых полей, созданную на основе анализа метахронных аденом [15].
Заключение
Таким образом, осмотр и биопсия неизмененной СО даже в 叩 еделах индексного сегмента не могут дать представление о риске развития ВА. С другой стороны, выявленные различия в СО по трем молекулярным маркерам, особенно по экспрессии гена TERT, позволяют выделить ПНС как область высокого риска формирования ВА на основе изменений СО этих сегментов ТК.
Список литературы Сравнительная посегментарная оценка молекулярных особенностей слизистой оболочки толстой кишки при ворсинчатых аденомах
- Harewood R, Wooldrage K, Robbins EC, Kinross J, von Wagner C, Cross AJ. Adenoma characteristics associated with post-polypectomy proximal colon cancer incidence: a retrospective cohort study. British Journal of Cancer. 2022;126(12):1744—1754. https://doi.org/10.1038/s41416-022-01719-4
- Myers DJ, Arora K. Villous Adenoma. 2023. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan. https://www.ncbi.nlm.nih.gov/books/NBK470272/ (дата обращения: 10.07.2024).
- Bains L, Lal P, Vindal A, Singh M. Giant villous adenoma of rectum- what is the malignant potential and what is the optimal treatment? A case and review of literature.World Journal of Surgical Oncology. 2019;17(1):109. https://doi.org/10.1186/s12957-019-1650-4
- Лейфер О. В., Иванов И. В., Савчук К. С., Коростелев М. Ю. Рак толстой кишки: вопросы онкогенеза и эпидемиологии на примере Новгородской области. Вестник Новгородского государственного университета. 2021;3(124):103—106. [Leyfer OV, Ivanov IV, Savchuk KS, Korostelev MY. Colon cancer: issues of oncogenesis and epidemiology using the example of the Novgorod region. Bulletin of Novgorod State University. 2021;3(124):103—106 (in Russ.). https://doi.org/10.34680/2076-8052.2021.3(124).103-106]
- Hao Y, Wang Y, Qi M, He X, Zhu Y, Hong J. Risk Factors for Recurrent Colorectal Polyps. Gut Liver. 2020;14(4):399—411. https://doi.org/10.5009/gnl19097
- Федянин М. Ю., Трякин А. А., Тюляндин С. А. Локализация первичной опухоли толстой кишки: есть ли принципиальные отличия? Онкологическая колопроктология. 2017;7(3):35—48. [Fedyanin MY, Tryakin AA, Tyulyandin SA. Localization of the primary colon tumor: are there any fundamental differences? Oncological proctology. 2017;7(3):35—48 (in Russ.). https://doi.org/10.17650/2220-3478-2017-7-3-35-48]
- Unlu M, UzunE, BengiG, Sagol O, Sarioglu S. Molecular characteristics of colorectal hyperplastic polyp subgroups. Turkish Journal of Gastroenterology. 2020;31(8):573—580. https://doi.org/10.5152/tjg.2020.19322
- Taherian M, Lotfollahzadeh S, Daneshpajouhnejad P, Arora K. Tubular Adenoma. 2023. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan. https://www.ncbi.nlm.nih.gov/books/ NBK553180/ (дата обращения: 10.06.2024).
- Planutis K, Planutiene M, Nguyen AV, Moyer MP, Holcombe RF. Invasive colon cancer, but not non-invasive adenomas induce a gradient effect of Wnt pathway receptor frizzled 1 (Fz1) expression in the tumor microenvironment. Journal of Translational Medicine. 2013;11:50. https://doi.org/10.1186/1479-5876-11-50
- Song M, Emilsson L, Bozorg SR, Nguyen LH, Joshi AD, Staller K, Nayor J, Chan AT, Ludvigsson JF. Risk of colorectal cancer incidence and mortality after polypectomy: a Swedish record-linkage study. The Lancet Gastroenterology & Hepatology. 2020;5(6):537—547. https://doi.org/10.1016/S2468-1253(20)30009-1
- Анищенко В. В., Архипова А. А., Титов С. Е., Полоз Т. Л., Бубнов И. В. Анализ экспрессии миРНК и мРНК в клеточном материале слизистой оболочки желудка, полученного при эзофагогастродуоденоскопии, для выявления дисплазии и рака желудка. Хирургическая практика. 2021;(4):53—60. [Anishchenko VV, Arkhipova AA, Titov SE, Poloz TL, Bubnov IV. Analysis of the expression of miRNA and mRNA in the cellular material of the gastric mucosa obtained during esophagogastroduodenoscopy to detect dysplasia and gastric cancer. Surgical practice. 2021;(4):53—60 (in Russ.). https://doi.org/10.38181/2223-2427-2021-4-53-60]
- Chen C, Ridzon DA, Broomer AJ. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Research. 2005;33:e179. https://doi.org/10.1093/nar/gni178
- Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2– ΔΔCt method. Methods. 2001;25:402—408. https://doi.org/10.1006/meth.2001.1262
- Koyuncuer A, Zen T. New Classification of Benign Epithelial Tumors: Colorectal Polyps and Synchronous Neoplasms: An Update and Critical Assessment: An Analysis of 678 Consecutive Cases and 1137 Polyps. Medeniyet Medical Journal. 2023;38(1):39—44. https://doi.org/10.4274/MMJ.galenos.2023.22755
- Rosser R, Corfe BM, Chapple KS. Metachronous Colorectal Adenomas Occur Close to the Index Lesion. Journal of Clinical Gastroenterology. 2023;57(9):937—944. https://doi.org/10.1097/MCG.0000000000001758


