Сравнительное исследование функционирования различных аутоартериальных и венозных графтов по данным шунтографии после изолированного коронарного шунтирования
Автор: Вечерский Ю.Ю., Андреев С.Л., Затолокин В.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.25, 2010 года.
Бесплатный доступ
В работе приводится анализ 242 постоперационных коронарошунтографий (172 артериальных и 70 венозных). Срок наблюдения: от 6 мес. до 10 лет, в среднем 18,2±2,4 мес. Исследовались артериальные шунты, где использовалась внутригрудная артерия in situ (ВГА in situ) в количестве 117, ВГА свободным графтом - 6, лучевая артерия (ЛА) - 49, большая подкожная вена (БПВ) - 70. В зависимости от сосудистого трансплантата самый высокий процент проходимости у ВГА in situ - 89 (76%) из 117 шунтов (р=0,232), второе место занимает ЛА - 35 (71%) из 49 (p=0,232). Самый высокий процент окклюзий выявлен в случае использования БПВ - 29 (41,4%) из 70 (p=0,028). По результатам выявлена высокая проходимость артериальных кондуитов, шунтируемых русло левой коронарной артерии: передняя нисходящая артерия (ПНА) + диагональная артерия (ДА) - 12 (92,3%) из 13 (p=0,001), ПНА - 51 (83,6%) из 61 (p=0,001), ДА - 7 (77,8%) из 9 (p=0,001). Высокий процент окклюзий наблюдается при использовании артериального графта на правой коронарной артерии (ПКА) - 14 (25,9%) из 54 (p=0,004), на задней межжелудочковой ветви (ЗМЖВ) - 6 (21,4%) из 28 (p=0,004), на ветви тупого края (ВТК) - 2 (28,6%) из 7 (p=0,004). Проходимость артериальных графтов (ЛА), шунтируемых коронарные артерии (КА) со стенозом более 70%, составила 85,7% (30 пациентов из 35). Проходимость артериальных графтов (ЛА), шунтируемых КА со стенозом менее 70%, составила 35,7% (5 пациентов из 14). Таким образом, отмечен лучший прогноз по функционированию артериальных шунтов в послеоперационном периоде, что оправдывает их использование и дальнейшее изучение в коронарной хирургии.
Аутоартериальное шунтирование, лучевая артерия, феномен "струны"
Короткий адрес: https://sciup.org/14919285
IDR: 14919285 | УДК: 616.127-089.844:615.849.19
Текст научной статьи Сравнительное исследование функционирования различных аутоартериальных и венозных графтов по данным шунтографии после изолированного коронарного шунтирования
Появившееся за последнее время стремление рекомендовать всем больным атеросклерозом венечных артерий операцию аутоартериальное аортокоронарное шунтирование оправдывается физиологическими особенностями заболевания. Внутренняя грудная артерия, используемая в качестве маммарокорнарного шунта, оказалась более патентная в сравнении с венозными граф- тами как в ближайшем, так и отдаленном периодах [3–6]. Логично использовать артериальные графты для тотальной артериальной реваскуляризации, чтобы избежать гиперплазию интимы, атеросклероз и дальнейшую окклюзию, которые неизбежно развиваются в венах.
Сообщения о хороших результатах использования лучевой артерии (ЛА), опубликованные C. Acar с соавт. (1992) [7], а также A. Calafiore с соавт. (1995) [8] и другими, вдохновили использовать ЛА в качестве дополнитель- ного графта после левой ВГА и правой ВГА. Бесспорными преимуществами ЛА стали такие качества как структура стенки, сопоставимый с венечными артериями диаметр просвета, достаточная длина, устойчивость к давлению и превосходное заживление ран на предплечье по сравнению с ранами на нижних конечностях. Поэтому ЛА представляет собой более подходящий сосуд для шунтирования коронарных артерий по физиологическим, анатомическим и гемодинамическим характеристикам.
Но так как лучевая артерия – это артерия мышечного типа, есть некоторые особенности ее биофизического поведения, такие как чувствительность к внешним воздействиям и конкурирующему току крови. Поэтому авторы по-разному относятся к применению ЛА, некоторые – благоприятно [9, 10], а другие – нет [11].
Цель исследования: задокументировать отдаленную патентность графтов из ЛА после операции аортокоронарного шунтирования (АКШ) и выяснить причины возникающих проблем с артериальными шунтами.
Материал и методы
В период с 2000 по 2010 гг. 364 пациента подверглись мультиартериальному коронарному шунтированию с использованием внутренних грудных (правой и левой) и лучевой артерий. Были собраны все постоперационные ангиограммы у тех больных, которым было установлено более двух артериальных шунтов, то есть у пациентов, подвергшихся мультиартериальному коронарному шунтированию. В исследование вошли также пациенты, которым коронаровентрикулография (КВГ) выполнялась по симптоматическим причинам: стенокардия, атипичные грудные боли, инфаркт и одышка.
Коронарошунтография выполнена 112 пациентам в возрасте 53,4±8,0 лет; 7 женщин и 105 мужчин. Срок наблюдения: от 0,5 до 10 лет, в среднем 4,6 ± 1,5 года. В качестве шунтов использовались ВГА “in situ” в количестве 117, ВГА свободным графтом – 6, ЛА – 49, БПВ – 70 [1, 2].
Распределение артериальных и венозных кондуитов на коронарные артерии показано в таблице 1 и на рисунке 1.
Левая ВГА “in situ” использовалась в основном на ПНА – 60 случаев, в качестве секвенциального шунта – в 13 случаях. У остальных пациентов ПНА была не поражена. Правая ВГА “in situ” в основном использовалась на ПКА – 33 случая. ЛА использовалась в качестве аортокоронар-
Таблица 1
Структура коронарных шунтов
|
Шунты |
Коронарные артерии |
||||||
|
ПНА |
ПКА |
ЗМЖВ |
ВТК |
ДА |
ДА +ПНА |
Всего |
|
|
ВГА “in situ” |
60 |
33 |
5 |
2 |
4 |
13 |
117 |
|
ВГА свободная |
3 |
3 |
6 |
||||
|
ЛА |
1 |
18 |
20 |
5 |
5 |
49 |
|
|
БПВ |
1 |
6 |
7 |
36 |
20 |
70 |
|
|
Всего |
62 |
60 |
35 |
43 |
29 |
13 |
242 |
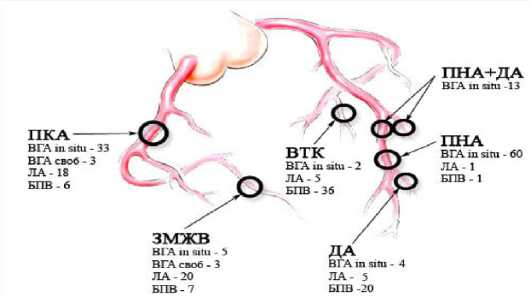
Рис. 1. Распределение артериальных шунтов по коронарным артериям ного шунта на ПКА (18 случаев), ЗМЖВ (20 случаев), ВТК (5 случаев). Дополнительно использовалась БПВ для достижения полной реваскуляризации миокарда, как показано на рисунке 1. В качестве дополнительного артериального шунта после правой и левой ВГА использовалась ЛА.
Всем пациентам перед операцией проводился тест Алена для определения кровоснабжения кисти вне ЛА. За 5 дней до операции для профилактики спазма артериальных шунтов все пациенты получали антагонисты кальциевых каналов (фелодип, амлодипин). После операции эти препараты назначались еще в течение 6 мес. с той же целью.
ЛА забиралась с недоминантной руки. Во время забора и после ЛА и обе ВГА обрабатывались снаружи и инт-ралюминально спазмолитиками (папаверин 1 мг/мл в гепаринизированном растворе при температуре 37 °C) с последующим замачиванием в данном растворе на 15– 20 минут. Все шунты, указанные на рисунке 1, были подвергнуты ангиографическому исследованию в отдаленные сроки после операции (от 6 мес. до 10 лет, в среднем 18,2±2,4 мес.). Проблемными артериальными графтами считались: окклюзия, феномен “струны” (кондуит менее 1 мм в диаметре на всем протяжении) и стеноз, превышающий 60% в теле шунта или в анастомозах.
Всего было исследовано 242 шунта – 172 артериальных и 70 венозных. Оценена проходимость шунтов в зависимости от сосудистого трансплантата; определена проходимость артериальных шунтов в зависимости от расположения и степени стеноза целевой коронарной артерии.
Статистическая обработка полученных результатов проводилась с использованием компьютерного пакета программ “SPSS 10”. Проверку статистических гипотез проводили с использованием теста Крускал–Уолиса. За критический уровень статистической значимости принимали р<0,05.
Результаты
В таблице 2 представлена проходимость шунтов в зависимости от сосудистого трансплантата.
В зависимости от сосудистого трансплантата самый высокий процент проходимости у ВГА “in situ” – 89 (76%) из 117 шунтов (p=0,232), второе место занимает ЛА – 35 (71%) из 49 (p=0,232). Самый высокий процент окклюзий выявлен у БПВ – 29 (41,4%) из 70 (p=0,028). Проходимость ВГА “свободным графтом” также высока – 5 (83,3%) из 6, но статистически не значима из-за малого количества таких шунтов, включенных в исследование.
В таблице 3 представлена проходимость артериальных шунтов в зависимости от расположения шунтируемых коронарных артерий.
Выявлена высокая проходимость артериальных кондуитов, шунтируемых русло левой коронарной артерии: ПНА+ДА – 12 (92,3%) из 13 (p=0,001), ПНА – 51 (83,6%) из 61 (p=0,001), ДА – 7 (77,8%) из 9 (p=0,001). Высокий процент окклюзий наблюдается при использовании артериального графта на ПКА – 14 (25,9%) из 54 (Р=0,004), на ЗМЖВ – 6 (21,4%) из 28 (p=0,004), на ВТК – 2 (28,6%) из 7 (p=0,004).
На рисунках 2 и 3 представлена проходимость артериальных шунтов в зависимости от степени стеноза КА.
Анализу подверглись две группы пациентов, где в качестве артериального шунта использовалась ЛА: пациенты с закрытыми артериальными шунтами – окклюзированными артериальными графтами (ОККЛ), n =14, и пациенты с функционирующими артериальными шунтами – патентными (ПАТ), n=35.
На рисунке 3 на оси ординат указана степень стеноза “зашунтированных” коронарных артерий, на оси абсцисс – две совокупности артериальных шунтов: ОККЛ – 14,
Таблица 2
Проходимость шунтов в зависимости от сосудистого трансплантата
Таблица 3
Проходимость артериальных шунтов в зависимости от шунтируемых коронарных артерий
|
Проходимость |
Коронарная артерия |
p |
|||||
|
ПНА+ДА |
ПНА |
ПКА |
ЗМЖВ |
ДА |
ВТК |
||
|
Проходимость полная |
12(92,3%) |
51(83,6%) |
36(66,6%) |
19(67,8%) |
7(77,8%) |
4 (57,1%) |
0,001 |
|
Проходимость частичная |
1(7,7%) |
4(6,6%) |
4(7,5%) |
3(10,8%) |
1(11,1%) |
1 (14,3%) |
0,157 |
|
Непроходимость (окклюзия) |
0(0%) |
6(9,8%) |
14(25,9%) |
6(21,4%) |
1(11,1%) |
2 (28,6%) |
0,004 |
|
Всего |
13(100%) |
61(100%) |
54(100%) |
28(100%) |
9(100%) |
7(100%) |
|
|
Проходимость |
Шунт |
p |
|||
|
ВГА |
ЛА |
БПВ |
|||
|
“in situ” абс. (%) |
свободная абс. (%) |
абс. (%) |
абс. (%) |
||
|
Проходимость полная |
89 (76) |
5 (83,3) |
35 (71) |
40 (57,1) |
0,232 |
|
Проходимость частичная |
8 (7) |
1 (16,7) |
5 (10,7) |
1 (1,5) |
1,000 |
|
Непроходимость (окклюзия) |
20 (17) |
– (0) |
9 (18,3) |
29 (41,4) |
0,028 |
|
Всего |
117 (100) |
6 (100) |
49 (100) |
70 (100) |
|
ПАТ – 35, расположенные в зависимости от степени стеноза КА, которую они реваскуляризируют. График показывает перекрест между обеими группами и дальнейшее увеличение количества ПАТ пропорционально увеличению диаметра стеноза КА. Проходимость артериальных графтов (ЛА), шунтируемых КА со стенозом более 70%, составила 85,7% (30 пациентов из 35). Проходимость артериальных графтов (ЛА), шунтируемых КА со стенозом менее 70%, составила 35,7% (5 пациентов из 14).
Примеры шунтографий. На артериальных шунтографиях (рисунки 4–7) видно, что диаметр артериального шунта соответствует диаметру КА, стенка шунта ровная с гладким переходом в КА. Хорошо заполняется дистальное русло КА.
На рисунках 8–11 показано сравнение графтов (артериальных и венозных), используемых для реваскуляризации одноименных коронарных артерий.
Диаметр венозных графтов по сравнению с артериальными значительно шире по диаметру КА, с участками варикозного расширения. Заметен резкий переход венозного шунта в КА. Все эти особенности венозных шунтов создают патологическое, вихревое движение крови, что в конечном итоге приводит к тромбированию.
На рисунках 12–15 показан “феномен струны” – диффузное сужение артериального шунта менее 1 мм, который встретился в 6 случаях. Резко суженный по всей длине артериальный шунт анатомически патентный, он заполняет дистальное русло КА. Но это предвестник начинающегося нарушения оттока крови по артериальному шунту, что зачастую приводит к закрытию шунта [16]. В литературе описаны случаи спонтанной инверсии диффузно-спазмированного артериального шунта из ЛА через 6 мес. после его обнаружения [17]. “Феномен струны” в раннем послеоперационном периоде и в отдаленные сроки является одной из проблем артериального шунтирования, требующей дальнейшего изучения для выяснения причин и предотвращения такого рода осложнений.
Проходимость ВГА “in situ” – 76% (89 из 117; p=0,232), ЛА – 71% (35 из 49; p=0,232). Самый высокий процент окклюзий выявлен у БПВ – 41,4% (29 из 70; p=0,028). Проходимость шунтов, функционирующих на КА, стеноз которых был менее 70%, оказалась 28% (7 пациентов из 21) по сравнению с 90% (64 пациента из 71) шунтирующих КА, стеноз которых превышал 70%.
Высокая проходимость артериальных кондуитов, шунтируемых русло левой КА: ПНА+ДА – 92,3% (12 из 13; p=0,001), ПНА – 83,6% (51 из 61; p=0,001), ДА – 77,8% (7 из 9; p=0,001). Высокий процент окклюзий при использовании артериального графта на ПКА – 25,9% (14 из 54; p=0,004), на ЗМЖВ – 21,4% (6 из 28; p=0,004), на ВТК – 28,6% (2 из 7; p=0,004).
Проходимость артериальных графтов (ЛА), шунтируемых КА со стенозом более 70%, составила 85,7% (30 пациентов
Рис. 2. Степень стеноза коронарной артерии
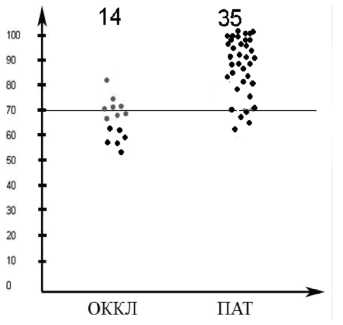
Рис. 3. Ось ординат - степень стеноза КА
Рис. 4. АКШ на ПКА. ЛА, 5 лет после операции
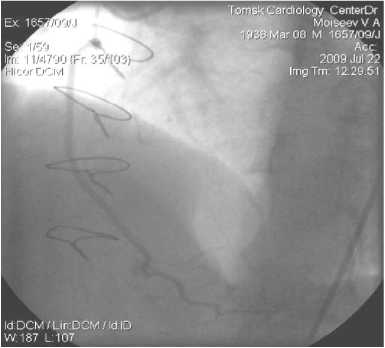
Рис. 5. АКШ на ЗМЖВ. ЛА, 4,5 года после операции
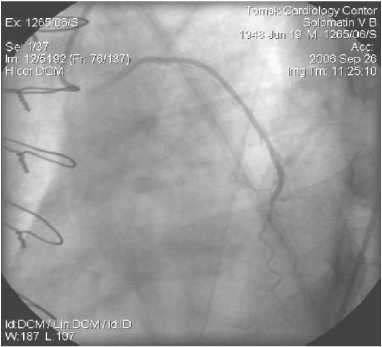
Рис. 6. АКШ на ДА. ЛА, 6 мес. после операции
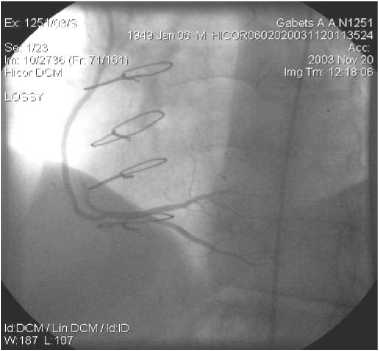
Рис. 7. МКШ на ПКА. Правая ВГА, 3 года после операции. Примечание: МКШ – маммарокоронарное шунтирование
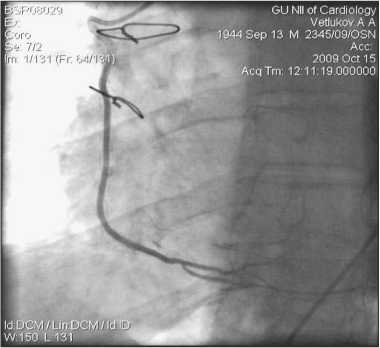
Рис. 8. АКШ на ПКА. ЛА, 7 лет после операции
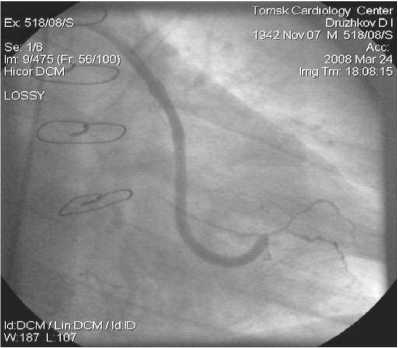
Рис. 9. АКШ на ПКА. БПВ, 3,5 года после операции
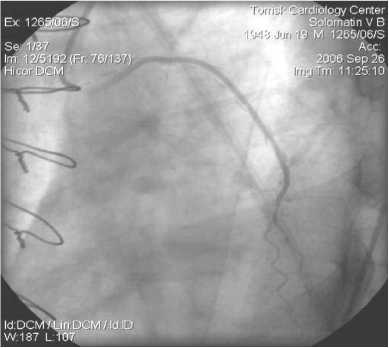
Рис. 10. АКШ на ДА. ЛА, 6 мес. после операции
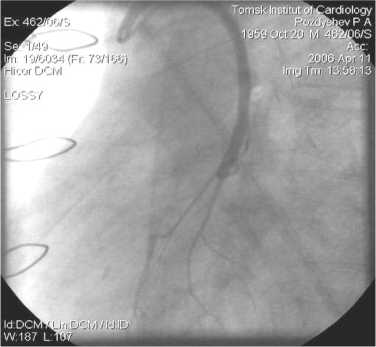
Рис. 11. АКШ на ДА. БПВ, 2 года после операции
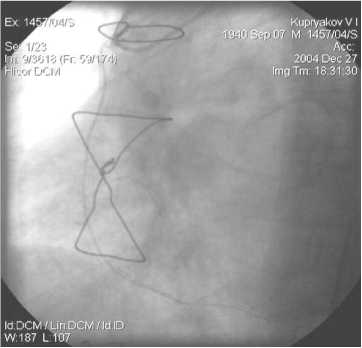
Рис. 12. АКШ на ПКА. ЛА, 6 мес. после операции
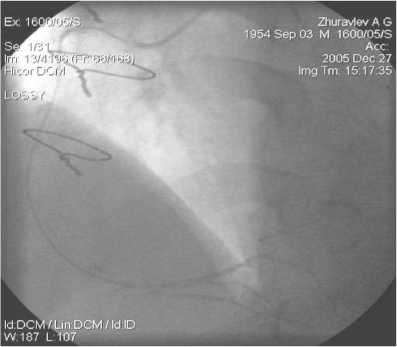
Рис. 13. АКШ на ПКА. ЛА, 1,5 года после операции
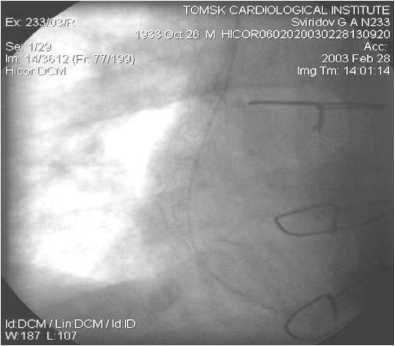
Рис. 14. МКШ на ПКА. Правая ВГА, 1 год после операции
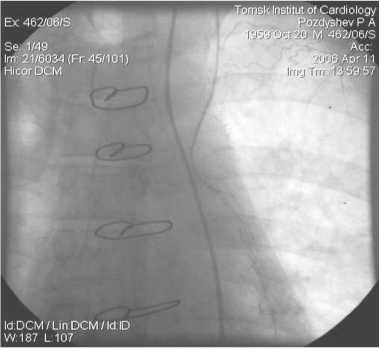
Рис. 15. МКШ на ПНА. Левая ВГА, 2 года после операции
из 35). Проходимость артериальных графтов (ЛА), шунтируемых КА со стенозом менее 70%, составила 35,7% (5 пациентов из 14).
Заключение
Интерес к ЛА начал расти с 1992 г., когда вышли в свет сообщения об отдаленных благоприятных результатах (3–5 лет) после операций АКШ с использованием ЛА [7, 8, 12]. В настоящее время интерес к использованию ЛА в качестве дополнительного артериального шунта еще более возрос. В современных рандомизированных исследованиях патентность БПВ намного уступает таковой при использовании артерий свободным графтом [13–15]. Но существует сообщение о плохих результатах использования ЛА [11], и это, скорее всего, нерешенность вопросов о технике забора артерии, об отношении к мышечной природе ЛА, разработке стратегии профилактики спазмирования в до- и послеоперационном периодах.
Мы избегаем использовать ЛА с признаками начинающегося кальциноза. ЛА забирается вместе с сопровождающими ее венами, минимизируя воздействие на адвен-тицию сосуда. Некоторые авторы описывают хорошие результаты скелетизированной артерии, освобожденной от соединительно-тканного футляра [15]. Описаны небольшие результаты о предпочтительности использования проксимальной части ЛА, так как дистальная часть содержит более выраженный мышечный слой, имеет меньший диаметр и более склонна к кальцинированию [16].
Мы всегда используем блокаторы кальциевых каналов (фелодип, нормодипин, амлодипин, 5 мг 1 раз в день) за пять дней до операции, интраоперационно местно и внутривенно для профилактики спазмирования до момента снятия зажима с аорты и подачи системного давления в артериальный шунт. Послеоперационное использование блокаторов кальциевых каналов (фелодип, амлодипин, нормодипин) эмпирическое, и оно основано на единичных инцидентах спазма артериального шунта в послеоперационном периоде.
Существует тенденция к уменьшению патентности ЛА в качестве артериального шунта, как указывалось выше, при шунтировании умеренно суженных КА. Мы считаем, это связано главным образом с конкурирующим током крови. Отдаленные результаты по данным коронарошун-тографий подтверждают это, и желательно избегать шунтировать КА артериальным кондуитом, стеноз которых менее 70%, отдавая предпочтение использованию ЛА в качестве кондуита для окклюзированных и субтотально стенозированных КА.
Следует обратить внимание, что большинство пациентов подвергались ангиографическому исследованию после операции по симптоматическим показаниям (типичная сетнокардия, атипичная боль в грудной клетке, инфаркт миокарда и необъяснимые приступы одышки). Если подвергнуть исследованию всех пациентов, в том числе асимптоматических пациентов, суммарное количество которых превышает 360, то, как мы предполагаем, подтверждений патентности ЛА в качестве дополнительного артериального кондуита было бы намного больше.
Таким образом, отмечен лучший прогноз по функционированию артериальных шунтов в послеоперационном периоде, что оправдывает их использование и дальнейшее изучение в коронарной хирургии.
Список литературы Сравнительное исследование функционирования различных аутоартериальных и венозных графтов по данным шунтографии после изолированного коронарного шунтирования
- Вечерский Ю.Ю., Шипулин В.В., Андреев С.Л., Затолокин В.В. Оценка соответствия длины правой внутригрудной артерии в качестве кондуита "in situ" для маммарокоронарного шунтирования правой коронарной артерии у больных ишемической болезнью сердца//Сибирский медицинский журнал. -2009. -Т. 24, № 1, выпуск 1. -С. 8-11.
- Шипулин В.М., Вечерский Ю.Ю., Шандаков П.И. Способ обеспечения «сухого» операционного поля при коронарном шунтировании на работающем сердце в зоне наложения анастамоза с помощью модифицированного микрососудистого зажима//Сибирский медицинский журнал. -2009. -Т. 24, № 1. -С. 103-105.
- Loop F.D., Lytle B.W., Cosgrove D.M. et al. Influence of the internal mammary-artery graft on 20-year survival and other cardiac events//N. End. J. Med. -1986. -Vol. 314. -P. 1-6.
- Lytle B.W., Blackstone E.H., Sabik J.F., Houghtaling P., Loop F.D., Cosgrove D.M. The effect of bilateral internal thoracic artery grafting on survival during 20 postoperative years//Ann. Thorac. Surg. -2004. -Vol. 78. -P. 2005-2014.
- Rankin J.S., Tuttle R.H., Wechsler A.S., Teichmann T.L., Glower D.D., Califf R.M. Techniques and benefit of multiple internal mammary artery bypass at 20 year of follow up//Ann. Thorac. Surg. -2007. -Vol. 83. -P. 1008-1015.
- Barne H.B., Barnett M. Fifteen to 21 year angiographic assessment of internal thoracic artery as a bypass conduit//Ann. Thorac. Surg. -1994. -Vol. 57. -P. 1526-1528.
- Acar C., Jebara V., Portoghese M. et al. Revival of the radial artery for coronary artery bypass grafting//Ann. Thorac. Surg. -1992. -Vol. 54. -P. 652-659.
- Califore A., Teodori G., Di Giammarco G. et al. Coronary revascularization with the radial atery: new interest for an old conduit//J. Card. Surg. -1995. -Vol. 10. -P. 140-146.
- Verma S., Szmitko P.E., Weisel R.D. et al. Should radial arteries be used routinely for coronary artery bypass grafting?//Circ. -2004. -Vol. 110. -P. 40-46.
- Totoulis J., Buxton B.F., Fuller J.A. Patencies of 2127 arterial for coronary artery bypass grafting: clinical and angiographic results at five years//J. Thorac. Cardiovas. Surg. -1998. -Vol. 116. -P. 981-989.
- Khot U.N., Friedman D.T., Pettersson G., Smedira N.G., Li J., Ellis S.G. Radial artery bypass grafts have an increased occurrence of angiographically severe stenosis and occlusion compared with left internal mammary arteries and saphenous vein grafts//Circ. -2004. -Vol. 109. -P. 2086-2091.
- Brodman R.S., Frame R., Camacho M., Hu E., Chen A., Hollinger I. Routine use of unilateral and bilateral radial arteries for coronary artery bypass graft surgery//J. Am. Coll. Cardiol. -1996. -Vol. 28. -P. 959-963.
- Desai N.D., Naylor C.D., Kiss A. et al. Impact of patient and target vessel characteristics on arterial and venous bypass graft surgery: insight from a randomized trial//Circ. -2007. -Vol. 115. -P. 684-691.
- Collins P., Webb C.M., Chong C.F., Moat N.E. Radial artery versus saphenous vein patency randomized trial. 5 year angiographic follow up//Circ. -2008. -Vol. 117. -P. 2859-2864.
- Mussa S., Choudhary B.P., Taggart D.P. Radial artery conduits for coronary artery bypass grafting: current perspective//J. Thorac. Cardiovasc. Surg. -2005. -Vol. 129. -P. 250-253.
- Chowdhury U.K., Airan B., Mishra P.J. et al. Histology and morphometry of radial artery conduits: basic study and clinical application//Ann. Thorac. Surg. -2004. -Vol. 78. -P. 1614-1622.
- Brian F., Buxton B.F., Philip A.R., Hayward P.A.R. "Reply to the Letter to the Editor. Are we allowed to declare radial artery graft with a 'string sign" for a patent conduit?" Question from Dusko Nezic, Aleksandar Knezevic and Milan Cirkovic//Eur. J. Cardio-Thorac. Surg. -2009. -Vol. 36. -P. 605-606.


