Сравнительное исследование эффектов мезенхимальных стволовых клеток при различных методах доставки в экспериментальной модели фиброза легких
Автор: Аверьянов Александр Вячеславович, Коноплянников Анатолий Георгиевич, Забозлаев Фдор Георгиевич, Сотникова Анна Геннадьевна, Данилевская Олеся Васильевна, Коноплянников Михаил Анатольевич, Татарский Алексей Романович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.9, 2018 года.
Бесплатный доступ
Обоснование. Одним из перспективных направлений лечения идиопатического легочного фиброза является трансплантация мезенхимальных стволовых клеток. В экспериментальных исследованиях на мелких животных используются внутривенный и эндобронхиальный (инсталляции) методы доставки клеточного препарата, в то время как у человека наиболее простым и доступным является ингаляционный способ доставки лекарств. Цель - определение оптимального типа небулайзера для сохранения жизнеспособных мезенхимальных стволовых клеток (МСК) при распылении с последующим сравнением эффектов ингаляционного и внутривенного методов доставки на стандартной модели блеомицинового легочного фиброза у кроликов. Методы. На первом этапе проводилась оценка выживаемости МСК ex vivo после 10-минутной небулизации через компрессорный, ультразвуковой и сетчатый (меш) небулайзеры. В дальнейшем использовался небулайзер, продемонстрировавший сохранность наибольшего числа клеток после распыления. На втором этапе, после бронхоскопической инсталляции блеомицина, 5 кроликов получили в заднюю правую долю внутривенную трансплантацию 2*106 аллогенных МСК, 5 - 2*107 МСК ингаляционно через компрессорный небулайзер; по 5 животных использовались в качестве здорового и блеомицинового контроля без лечения...
Мезенхимальные стволовые клетки, легочный фиброз, кролики, небулайзер
Короткий адрес: https://sciup.org/143166566
IDR: 143166566 | DOI: 10.17816/clinpract944-14
Текст научной статьи Сравнительное исследование эффектов мезенхимальных стволовых клеток при различных методах доставки в экспериментальной модели фиброза легких
(For citation: Averyanov AV, Konoplyannikov AG, Zabozlaev FG, Sotnikova AG, Danilevskaya OV, Konoplyannikov MA, Tatarsky AR. Comparative Study of the Effects of Mesenchymal Stem Cells with Different Delivery Methods in an Experimental Model of Lung Fibrosis. Journal of Clinical Practice. 2018;9(4):04–14. doi: –14)
ОБОСНОВАНИЕ
Идиопатический легочный фиброз — хроническое прогрессирующее заболевание неизвестной этиологии, характеризующееся развитием фиброзной трансформации легочной паренхимы, преимущественно у лиц старшего возраста [1]. Несмотря на относительно низкую распространенность, заболеваемость идиопатическим легоч- ным фиброзом неуклонно возрастает, в среднем на 5% в год, что во многом обусловлено общим старением населения [2]. До эры антифиброзных препаратов медиана выживаемости пациентов с идиопатическим легочным фиброзом от момента постановки диагноза составляла 2,5–3,5 года [3]. Одним из перспективных подходов к лечению идиопатического легочного фиброза и других

2niR клиническая
S поактика
фиброзных заболеваний легких рассматривается трансплантация различных видов стволовых клеток (чаще мезенхимальных), которые за счет паракринных эффектов способны предотвратить или замедлить развитие фиброза в экспериментальных моделях [4–6]. Так, в одном из недавних исследований мезенхимальные клетки жировой ткани демонстрировали антифиброзный эффект, превосходящий таковой у эталонного препарата пирфенидона [7]. Следует заметить, что подавляющее большинство доклинических исследований было выполнено на мышиной модели блеомицининдуцированного легочного фиброза, а клеточный препарат вводился чаще всего внутривенно. Между тем для человека ингаляции являются одним из наиболее распространенных способов доставки лекарственных препаратов в легкие. Однако в отношении клеточных продуктов их доставка путем распыления через разные типы ингаляторов ранее не изучалась, не оценивалась сохранность клеток после распыления гетерогенными физическими методами, не проводилось сравнение эффектов при разных путях поступления биологического материала в легкие.
В данной работе были поставлены задачи изучения выживаемости мезенхимальных стволовых клеток (МСК) при различных методах небулизации с последующим выбором оптимального ингаля- тора и сравнительного анализа эффектов клеточного препарата на модели легочного фиброза у кроликов при разных путях доставки в легкие — ингаляционном и внутривенном.
МЕТОДЫ
Этапы исследования
Исследование состояло из 2 этапов.
На первом этапе мы оценивали выживаемость МСК после их распыления через разные типы небулайзеров. Были использованы 3 небулайзе-ра производства компании OMRON Healthcare (Япония): компрессорный (струйный) CompAir NE-C24; ультразвуковой UltraAir NE-U17 и сетчатый (меш-небулайзер) MicroAir U22. В камеру для препарата помещали суспензию из 5 мл 2*106 МСК в 0,9% натрия хлорида (NaCl), добавляя по мере необходимости в течение периода небулизации. Распыление производили в герметичный пластиковый контейнер в течение 10 мин, откуда забирался 1 мл аэрозольного конденсата для последующей оценки выживаемости клеток. Жизнеспособность МСК определяли при помощи окрашивания клеток 0,4% раствором трипаново-го синего (Invitrogen Gibco, США) с последующим их подсчетом в автоматическом счетчике клеток Countess Automated Cell Counter (Invitrogen, США) согласно инструкции производителя.
Рис. 1. Дизайн второго этапа исследования
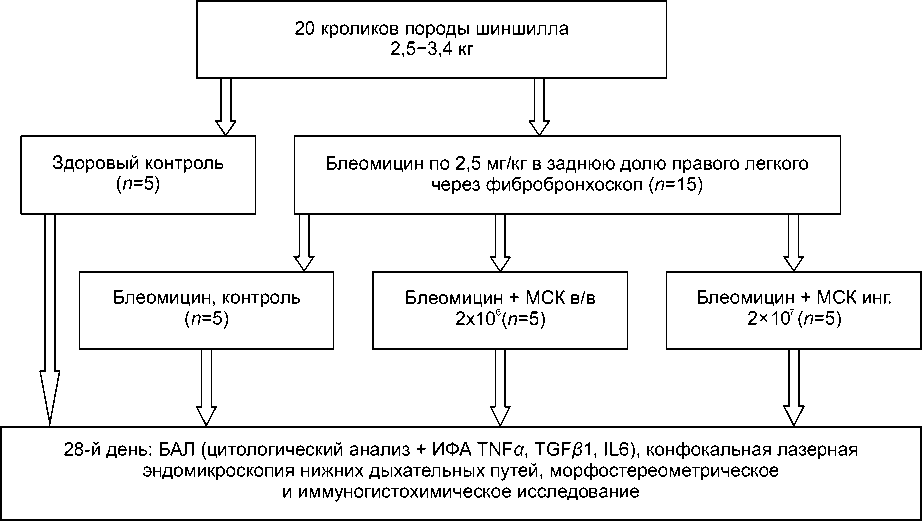
Примечание. МСК — мезенхимальные стволовые клетки, БАЛ — бронхоальвеолярный лаваж, ИФА — иммуно-ферментный анализ.
На втором этапе сравнивались эффекты внутривенного и ингаляционного (через выбранный ингалятор с наименьшим повреждением МСК) способов введения МСК в отношении развития локального фиброза легких, индуцированного эндобронхиальным введением блеомицина (рис. 1). Эксперимент выполнен на 20 половозрелых кроликах породы шиншилла весом 2,5-3,4 кг. 15 кроликам под внутривенным наркозом (нембутал, 50 мг/кг) в положении лежа на спине была выполнена фибро-бронхоскопия ультратонким фибробронхоскопом диаметром 2,5 мм (модель Karl Storz 6000V, Германия). Каждому животному в заднюю долю правого легкого был инстиллирован раствор блеомицина (Веро-Блеомицин, ЛЭНС-фарм, Россия) в дозе 2,5 мг/кг в 3 мл 0,9% NaCl. На следующий день 5 животных получили внутривенное введение в ушную вену 2 млн МСК в 5 мл 0,9% NaCl; еще 5 кроликов подверглись ингаляционному введению 20 млн МСК в 5 мл 0,9% NaCl, распыленных через компрессорный небу-лайзер CompAir NE-C24 (OMRON Healthcare, Япония) с использованием неонатальной маски. Оставшиеся 10 животных использованы в качестве контроля блеомицинового фиброза (5) и здорового контроля (5). Исследования на животных были согласованы ЛЭК Медицинского радиологического научного центра (МРНЦ) Минздрава России (протокол №7 от 15.06.2012).
Клеточный препарат
В исследовании были использованы аллогенные МСК костного мозга кроликов. МСК извлекали из костного мозга животных, согласно традиционному протоколу [8]. Кролики был эвтаназированы передозировкой пентобарбитала натрия (раствор Nebutal, Boehringer Ingelheim, Германия). Костный мозг выделяли из большеберцовой и бедренной костей животных и ресуспендировали в 2 мл натрий-фосфатного буфера (Phosphate buffered saline, PBS; Gibco, Invitrogen). Суспензию костного мозга наслаивали на 3 мл раствора фиколла (плотность 1,077 г/мл; Histopaque-1077, Sigma-Aldrich Co., США) с последующим градиентным центрифугированием при 400 g в течение 30 мин в 15-миллиметровой центрифужной пробирке (Corning, США). Моноядерный средний слой собирали и затем дважды промывали с использованием среды DMEM-F12 (Gibco, Invitrogen, США) с добавлением 1% антибиотика/ан-тимикотика (Gibco, Invitrogen). Затем изолированные мононуклеарные клетки культивировали в ростовой среде DMEM-F12 (Gibco, Invitrogen, США), c добав- лением 10% фетальной бычьей сыворотки (Gibco, Invitrogen), 1% антибиотика/антимикотика (Gibco, Invitrogen) и 1% GlutaMAX-I (Gibco, Invitrogen, США) в культуральных флаконах T75 (Nunc, США). Клетки инкубировали при 5% СО2 и 37ºС в СО2-инкубато-ре SANYO (Япония). Смену среды с целью удаления неадгезивных клеток производили на 3-й день от начала культивирования. Последующие смены среды проводили с интервалом 3 дня. При достижении 90% конфлюентности клетки пассировали с использованием 0,25% трипсина-ЭДТА (Gibco, Invitrogen, США). Полученные по результатам проточной ци-тофлуориметрии с использованием соответствующих антител (BD Biosciences, США) и проточного цитометра Partec CyFlow Space (Германия) МСК кролика демонстрировали фенотип, характерный для МСК взрослого организма — CD29+, CD44+, CD73+, CD90+, CD34-, CD45-.
На 28-й день всем кроликам перед эвтаназией проводилась фибробронхоскопия описанным ранее методом с бронхоальвеолярным лаважом заднедолевого бронха справа 3 мл 0,9% NaCl; полученная жидкость отправлялась на цитологический и серологический анализ. Для цитологического исследования проводилось цитоцентрифугирование подготовленного образца бронхоальвеолярного лаважа с окраской по Романовскому–Гимзе и световой микроскопией. Оценивались общий ци-тоз (число всех клеток в мкл) и процентные фракции клеток.
Уровни фактора некроза опухоли альфа (tumor necrosis factor alpha, TNF α ), трансформирующего фактора роста бета 1 (transforming growth factor beta 1, TGF β 1) и интерлейкина 6 (interleukin 6, IL6). в жидкости бронхоальвеолярного лаважа оценивались при помощи иммуноферментного анализа на автоматическом планшетном ИФА-анализаторе ВЕР 2000 (Германия).
Морфологическоеи иммуногистохимическое исследование
Извлечение обоих легких производилось незамедлительно после эвтаназии животных. После вскрытия грудной полости на трахею и крупные кровеносные сосуды шейной области накладывались лигатуры с целью минимизации контаминации легочной паренхимы кровью. Легкие извлекали из грудной полости, проводили краевую резекцию около 1 см3 ткани из задней доли правого легкого для исследования методом конфокальной лазерной эндомикроскопии, наклады- вали зажим на место отсечения, наполняли через трахею под давлением 25 см вд.ст. 10%-ным раствором нейтрального формалина, а затем заднюю правую долю помещали в отдельные емкости с 10%-ным нейтральным формалином объемом, десятикратно превышающим объем фиксируемых органов. После 48-часовой фиксации исследуемого материала легочную ткань заключали в парафиновые блоки с последующим приготовлением гистологических срезов толщиной 5 мкм и окраской гематоксилином и эозином по стандартной методике. Микроскопическое исследование производилось с помощью светового микроскопа (Nicon Eclipse 50i, Япония). Морфологические признаки фиброза легких оценивали полуколичественным методом при помощи девятибалльной шкалы Эш-крофтa (Ashcroft) от 0 баллов (отсутствие признаков фиброза) до 8 (тотальный фиброз без сохраненных альвеолярных пространств) [9]. Оценивалось 20 случайных полей зрения из препаратов исследуемых легких каждого животного с определением средней величины степени фиброза в баллах.
Для приготовления препаратов для иммуногистохимического исследования из парафиновых блоков изготавливали гистологические срезы толщиной 3 мкм, которые монтировали на высокоадгезивные стекла (Polysine Slides, Menzel GmbH & Сo KG; Германия). Депарафинирование, регидратацию, демаскировку антигена, окраску производили при помощи специализированной автоматизированной системы Ventana BenchMark ULTRA (США). Для оценки степени аккумулирования коллагена как маркера легочного фиброза в качестве первичных антител использовали моноклональные кроличьи антитела против Collagen IV (GTX). Оценку иммуногистохимической реакции оценивали по 10 случайным полям зрения полу-количественным методом (до 5% экспрессии — 0 баллов; 5–39% — 1 балл; 40–69% — 2 балла; более 70% — 3 балла).
Статистический анализ
Статистическая обработка результатов проводилась при помощи пакета прикладных программ Statistica for Windows StatSoft Inc., версия 7.0. Данные таблиц представлены как выборочное среднее ± стандартное отклонение. Достоверность различий оцениваемых показателей между исследуемыми группами вычислялась методом однофакторного дисперсионного анализа (ANOVA). Различия считались статистически достоверными при p <0,05.
РЕЗУЛЬТАТЫ
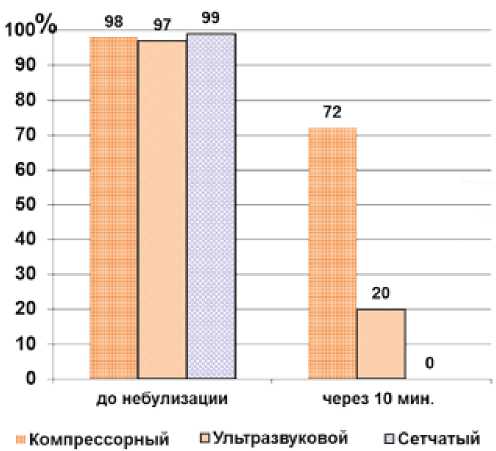
Исходно в подготовленной для распыления суспензии содержалось более 95% живых клеток. Наилучшие результаты были достигнуты при использовании обычного компрессорного небулай-зера (72% жизнеспособных клеток), в то время как после небулизации ультразвуковым прибором данный показатель составлял только 20%, а после прохождения через сетчатый небулайзер живых МСК не определялось (рис. 2).
Рис. 2. Жизнеспособные мезенхимальные стволовые клетки после 10-минутного распыления с помощью небулайзеров трех разных типов
На втором этапе при оценке морфологических изменений ткани легких в исследуемых группах у всех животных с эндобронхиально введенным блеомицином наблюдались выраженное утолщение межальвеолярных перегородок, инфильтрация их и стенок сосудов нейтрофилами и лимфоцитами, а также частичная деградация структуры ацинуса (рис. 3). В группах, получивших внутривенное или ингаляционное лечение МСК, эти изменения хотя и присутствовали, но были выражены существенно меньше, чем в контрольной группе, подвергшейся введению блеомицина без клеточной терапии. Помимо описанных изменений, здесь выявлены массивные поля фиброза с участками полной облитерации альвеол и сосудистого русла. При полуколичественной оценке степени фиброза у животных, получивших лечение МСК, выраженность фиброза была достоверно меньше, чем в контрольной группе блеомицинового фиброза — 2,34 и 2,11 против 4,15 баллов (табл. 1). Похожая картина наблюдалась и при определении степени
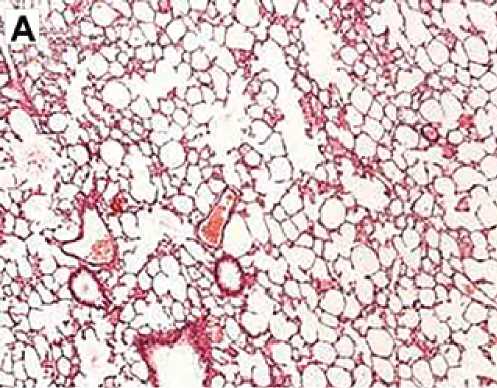
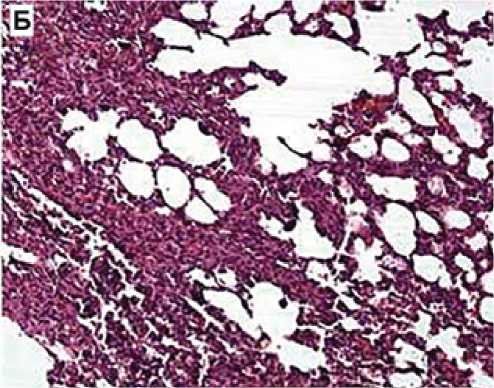
Рис. 3. Репрезентативные гистологические срезы ткани легкого в группах исследования
Блеомициновый контроль
Контроль
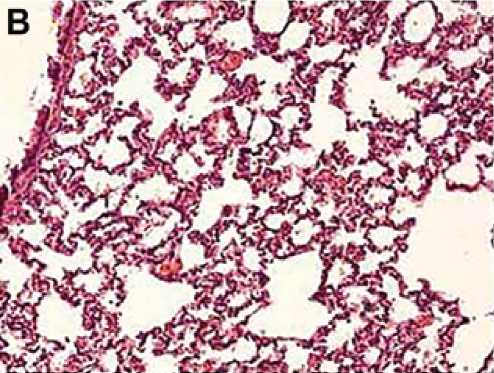
Блеомицин + МСК в/в
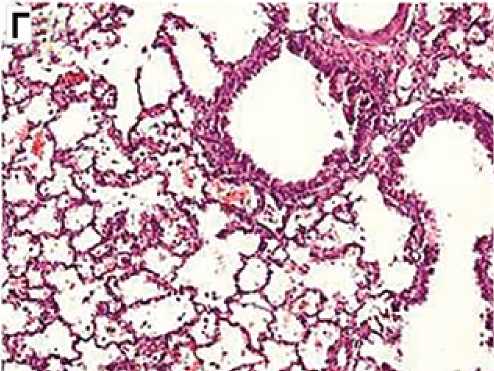
Блеомицин + МСК инг.
Примечание. А — неизмененная ткань легкого с тонкими межальвеолярными перегородками, слабым венозным полнокровием, без признаков интерстициального фиброза. Окраска гематоксилином и эозином. х 4о. б — паренхима легкого с утолщением межальвеолярных перегородок за счет выраженного распространенного фиброза, диффузной лимфоидной инфильтрацией с примесью гранулоцитов, венозным полнокровием и очаговыми кровоизлияниями. Окраска гематоксилином и эозином. x ioo. в — межальвеолярные перегородки с умеренно выраженным венозным полнокровием, неравномерным слабовыраженным фиброзом и лимфо-гистиоцитарной инфильтрацией. Окраска гематоксилином и эозином. x ioo. г — умеренно выраженное венозное полнокровие, стенки мелких бронхиол и сосудов не утолщены. Межальвеолярные перегородки со слабовыраженным интерстициальным фиброзом, очаговыми кровоизлияниями, единичными десквамированными альвеолоцитами. Окраска гематоксилином и эозином. x ioo.
экспрессии коллагена: максимальная — в группе блеомицинового повреждения без лечения (2,1 против 0,15 балла в здоровой группе), в то время как у животных, получивших МСК, данный показатель был существенно ниже — 0,79 балла при внутривенной терапии и 0,51 балла при ингаляционной доставке (рис. 4). Цитокиновый профиль жидкости бронхоальвеолярного лаважа оказался менее информативным в связи с тем, что TNFα и IL6 (пг/мл) у здоровых кроликов не определялись, а показатели TGFβ1 хотя и были количественно выше в группах, получивших блеомицин, но не отличались достоверно между собой (см. табл. 1).
Результаты цитологического анализа жидкости бронхоальвеолярного лаважа представлены в табл. 2. Общий цитоз в группе блеомицина без лечения был достоверно выше, чем у здорового контроля (567 против 365 кл/мкл), однако данный показатель в группах лечения МСК хотя и имел тенденцию к снижению, не достиг статистически значимых величин. Подобные изменения наблюдались и в клеточных фракциях.
иническая
эактика
Рис. 4. Иммуногистохимические маркеры коллагена IV типа в исследуемых группах
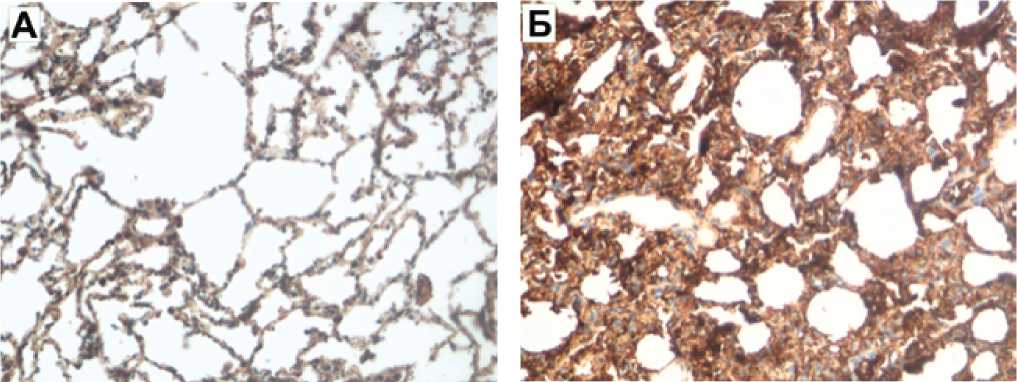
Контроль Блеомициновый контроль
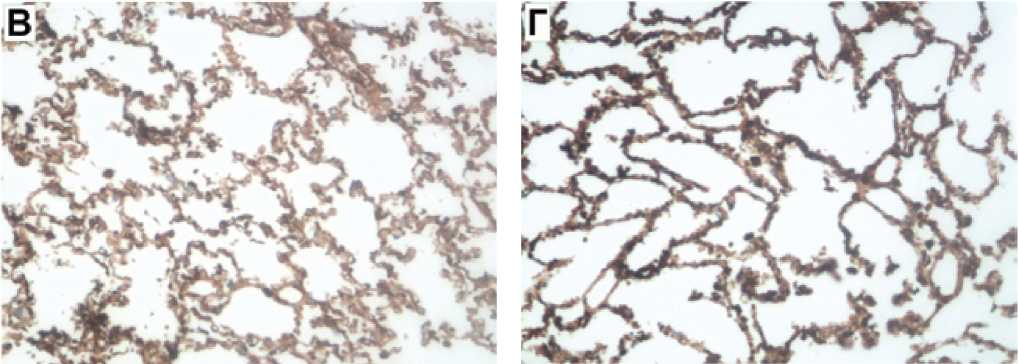
Блеомицин + МСК в/в
Блеомицин + МСК инг.
Примечание. А — в группе контроля: слабый (до 15-20%, «+») уровень иммуноэкспрессии Collagen IV*; х200. б — в группе контроля с блеомицином: выраженный (>70%, «+++») уровень иммуноэкспрессии Collagen IV*; х200. в — в группе блеомицин с МСК внутривенно: слабый (до 25%, «+») уровень иммуноэкспрессии Collagen IV*; х200. г — в группе блеомицин с ингаляцией МСК: слабый (20%, «+») уровень иммуноэкспрессии Collagen IV*; х200. — структурный компонент базальных мембран. МСК — мезенхимальные стволовые клетки.
Таблица 1
Морфостереометрические показатели, экспрессия коллагена и уровень цитокинов в жидкости бронхоальвеолярного лаважа в группах исследования
|
Показатель |
Здоровый контроль |
Блеомицин, контроль |
Блеомицин + МСК в/в |
Блеомицин + МСК инг. |
|
Шкала фиброза Эшкрофта, балл |
0,24±0,11 |
4,15±1,8** |
2,34±1,6* |
2,11±1,3* |
|
Экспрессия коллагена, балл |
0,15+0,20 |
2,1+0,65** |
0,79+0,55 |
0,51+0,29* |
|
TNF α , пг/мл |
Не определился |
122±65 |
95±77 |
101±36 |
|
TGF β 1, пг/мл |
26±11 |
56±32 |
44±24 |
51±18 |
|
IL6, пг/мл |
Не определился |
44±36 |
Не определился |
Не определился |
Примечание. * — р <0,05 в сравнении с группой блеомицина без лечения, ** — р <0,01 в сравнении со здоровым контролем. МСК — мезенхимальные стволовые клетки, в/в — внутривенное введение препарата, инг. — ингаляционное введение препарата.
Таблица 2
|
Показатель |
Здоровый контроль |
Блеомицин, контроль |
Блеомицин + МСК в/в |
Блеомицин + МСК инг. |
|
Общее число клеток/мкл |
365±72 |
567±112* |
495±122 |
528±129 |
|
Нейтрофилы, % |
3±3 |
13±5** |
10±5* |
10±9 |
|
Макрофаги, % |
85±11 |
65±18 |
78±15 |
76±17 |
|
Лимфоциты, % |
10±4 |
21±12* |
12±11 |
14±9 |
|
Эозинофилы, % |
2±4 |
3±3 |
1±4 |
1±3 |
|
Эритроциты, % |
2±5 |
2±4 |
2±2 |
1±1 |
Примечание. * — р <0,05 в сравнении со здоровым контролем, ** — р <0,01 в сравнении со здоровым контролем. МСК — мезенхимальные стволовые клетки, в/в — внутривенное введение препарата, инг. — ингаляционное введение препарата.
Цитологический состав жидкости бронхоальвеолярного лаважа в группах исследования
ОБСУЖДЕНИЕ
Нами впервые установлено, что при использовании наиболее простых и доступных компрессорных небулайзеров степень повреждения распыляемых клеток существенно меньше, чем при применении ультразвуковых ингаляторов, тогда как меш-тех-нология (сетчатый небулайзер) фактически полностью разрушает жизнеспособные клетки. Объяснить подобные результаты, по видимому, можно, учитывая механику распыления. При компрессорной небулизации струя сжатого воздуха проходит через камеру с лекарственным (в нашем случае с клеточным) препаратом, преобразуя его в аэрозоль. В ультразвуковых небулайзерах распыление идет за счет колебаний ультразвука, создаваемых генератором. Сами ультразвуковые волны, вызывая эффекты кавитации и нагревания [10], вероятно, являются губительными для живых клеток. Более современная меш-технология распыления не предусматривает контакта распыляемого препарата с ультразвуковыми волнами, которые передают колебания на специальную микропористую мембрану (сетку) с размером пор в несколько мкм, а уже через нее идет просеивание распыляемого раствора (суспензии) с преобразованием в мелкодисперсный аэрозоль [11]. Судя по полученным в нашей работе результатам, такая технология, наиболее прогрессивная для ингаляции лекарственных растворов, является губительной для живых клеток. Однако, с учетом того, что в основе эффективности клеточной терапии, по-видимому, лежат паракринные механизмы, а не приживаемость введенных клеток и регенерация тканевых структур, мы не беремся утверждать, что применение разных типов небулайзеров для доставки клеточных продуктов в дыхательные пути будет иметь разное клиническое значение.
Последующие результаты касались эффектов клеточной терапии при внутривенном и ингаляционном пути введения (через компрессорный не-булайзер) аллогенных МСК. В качестве экспериментальных животных мы использовали кроликов породы шиншилла. Следует отметить, что кролики филогенетически ближе к человеку, имеют схожие с приматами строение бронхиального дерева и особенности функционирования иммунной системы в отличие от мелких грызунов [12]. Еще одним преимуществом кроличьей модели легочного фиброза является возможность выполнения у них прицельного бронхоальвеолярного лаважа из пораженной зоны. В качестве индуктора фиброза легких был выбран цитостатик блеомицин, наиболее часто используемый в доклинических исследованиях [13]. Из существующих путей введения блеомицина (инъекционный, интраперитонеальный, интратрахеальный, эндобронхиальный) мы использовали последний — единственный из них, позволяющий получить локальный фиброз одной и той же области с минимальной травмати- зацией остальных отделов легких и сниженным уровнем системной воспалительной реакции. Это достижимо только путем выполнения фиброброн-хоскопии, невозможной у мелких животных.
Как показали результаты морфологического, иммуногистохимического и цитологического исследований, оба пути введения оказались одинаково эффективными в отношении сдерживания развития фиброза легких и отложения коллагена в интерстициальном пространстве. Уровни про-воспалительных и профиброгенного цитокинов в жидкости бронхоальвеолярного лаважа хотя и имели тенденцию к уменьшению у животных, получивших лечение МСК, но не достигли статистической разницы, что, предположительно, связано как с ограниченным числом образцов для тестирования, так и достаточно большим сроком после блеомицинового повреждения (4 нед). Анализ клеточного состава бронхоальвеолярного лаважа выявил достоверное увеличение общего цитоза с увеличением фракций нейтрофилов и лимфоцитов у животных с блеомициновой травмой, не получивших лечения. В группах клеточной терапии достоверного отличия от здорового контроля не установлено, за исключением повышенного содержания нейтрофилов у кроликов с внутривенным введением клеточного препарата (хотя и более низкого, чем у животных без лечения). Эти данные в целом свидетельствуют о местных противовоспалительных эффектах как ингаляционного, так и внутривенного пути введения МСК. Практически во всех образцах, как в контроле, так и в группах лечения, мы выявили небольшое присутствие эритроцитов, нетипичное для клеточного состава бронхоальвеолярного лаважа, которое связываем с локальной травмой слизистой оболочки фибробронхоскопом во время его проведения по воздухоносным путям.
В целом наше исследование подтвердило противовоспалительные и антифиброзные эффекты при трансплантации МСК, которые наблюдались в других экспериментальных работах на более мелких животных [6, 14–16].
Терапевтический механизм действия МСК при легочном фиброзе окончательно не установлен. Доминирующим на сегодняшний день является мнение о ведущей роли паракринных эффектов клеточной терапии. Миграция экзогенно введенных клеток в зону повреждения происходит через локальную продукцию хемоаттрактантов — гранулоцитарного и гранулоцитарно-макрофагаль- ного колониестимулирующих факторов [17, 18]. Достигнув места поражения, МСК экспрессируют самостоятельно или влияют на продукцию противовоспалительных, антифиброзных, ангиогенных факторов, а также подавляют экспрессию про-воспалительных цитокинов (IL1β, TGFβ,VEGF, IL6, TNFα, NO-синтаза), что, по-видимому, и определяет терапевтический эффект [15, 19]. В пользу паракринных механизмов действия МСК свидетельствует и факт похожих результатов, достигаемых при введении кондиционной среды от МСК и про-гениторных клеток в моделях легочного фиброза [20, 21].
Еще одним возможным, хотя и малоизученным, механизмом противовоспалительного и антифи-брозного действия МСК является межклеточный трансфер, когда экзогенно введенные клетки прикрепляются к поврежденному эпителию дыхательных путей и через организуемые межклеточные контакты передают цитоплазматические факторы и митохондрии, препятствующие апоптозу и способствующие восстановлению поврежденной клетки [22, 23].
ЗАКЛЮЧЕНИЕ
Наше исследование, с одной стороны, доказало целесообразность применения компрессорного ингалятора для доставки максимума жизнеспособных клеток в дыхательные пути, с другой — продемонстрировало сопоставимые положительные морфологические, иммуногистохимические и цитологические эффекты внутривенного и ингаляционного путей введения аллогенных МСК костного мозга на модели блеомицининдуциро-ванного легочного фиброза у кроликов. Позитивные результаты клеточной терапии на более крупных животных, чем в предшествующих исследованиях, а также приемлемая для человека технология доставки клеток в дыхательные пути позволяют надеяться на возможность перехода от доклинических к клиническим исследованиям данного направления.
Список литературы Сравнительное исследование эффектов мезенхимальных стволовых клеток при различных методах доставки в экспериментальной модели фиброза легких
- Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011; 183(6): 788-824 DOI: 10.1164/rccm.2009-040GL
- Navaratnam V, Fleming KM, West J, et al. The rising incidence of idiopathic pulmonary fibrosis in the U.K. Thorax. 2011; 66(6): 462-467 DOI: 10.1136/thx.2010.148031
- American Thoracic Society; European Respiratory Society. American Thoracic Society/European Respiratory Society international multidisciplinary consensus classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med. 2002; 165(2): 277-304 DOI: 10.1164/ajrccm.165.2.ats01
- Toonkel RL, Hare JM, Matthay MA, Glassberg MK. Mesenchymal stem cells and idiopathic pulmonary fibrosis. Potential for clinical testing. Am J Respir Crit Care Med. 2013; 188(2): 133-140 DOI: 10.1164/rc-cm.201207-1204PP
- Moodley Y Ilancheran S, Samuel C, et al. Human amnion epithelial cell transplantation abrogates lung fibrosis and augments repair. Am J Respir Crit Care Med. 2010; 182(5): 643-651 DOI: 10.1164/rc-cm.201001-0014OC
- Murphy S, Lim R, Dickinson H, et al. Human amnion epithelial cells prevent bleomycin-induced lung injury and preserve lung function. Cell Transplant. 2011; 20(6): 909-923 DOI: 10.3727/096368910X543385
- Reddy M, Fonseca L, Gowda S, et al. Human adipose-derived mesenchymal stem cells attenuate early stage of bleomycin induced pulmonary fibrosis: comparison with pirfenidone. Int J Stem Cells. 2016; 9(2): 192-206 DOI: 10.15283/ijsc16041
- Awad HA, Butler DL, Boivin GP, et al. Autologous mesenchymal stem cell-mediated repair of tendon. Tissue Eng. 1999; 5(3): 267-277 DOI: 10.1089/ten.1999.5.267
- Ashcroft T, Simpson JM, Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale. J Clin Pathol. 1988; 41(4): 467-470.
- Yeo LY Friend JR, McIntosh MP, et al. Ultrasonic nebulization platforms for pulmonary drug delivery. Expert Opin Drug Deliv. 2010; 7(6): 663-679 DOI: 10.1517/17425247.2010.485608
- Martin AR, Finlay WH. Nebulizers for drug delivery to the lungs. Expert Opin Drug Deliv. 2015; 12(6): 889-900 DOI: 10.1517/17425247.2015.995087
- Kamaruzaman NA, Kardia E, Kamaldin N, et al. The rabbit as a model for studying lung disease and stem cell therapy. Biomed Res Int. 2013; 2013: 691830 DOI: 10.1155/2013/691830
- Degryse AL, Lawson WE. Progress toward improving animal models for idiopathic pulmonary fibrosis. Am J Med Sci. 2011; 341(6): 444-449 DOI: 10.1097/MAJ.0b013e31821aa000
- Cargnoni A, Gibelli L, Tosini A, et al. Transplantation of allogeneic and xenogeneic placenta-derived cells reduces bleomycin induced lung fibrosis. Cell Transplant. 2009; 18(4): 405-422 DOI: 10.3727/096368909788809857
- Lee SH, Jang AS, Kim YE, et al. Modulation of cytokine and nitric oxide by mesenchymal stem cell transfer in lung injury/fibrosis. Respir Res. 2010; 11: 16 DOI: 10.1186/1465-9921-11-16
- Lan YW, Choo KB, Chen CM, et al. Hypoxia-preconditioned mesenchymal stem cells attenuate bleomycin-induced pulmonary fibrosis. Stem Cell Res Ther. 2015; 6: 97 DOI: 10.1186/s13287-015-0081-6
- Rojas M, Xu J, Woods CR, et al. Bone marrow-derived mesenchymal stem cells in repair of the injured lung. Am J Respir Cell Mol Biol. 2005; 33(2): 145-152 DOI: 10.1165/rcmb.2004-03300C
- Xu J, Mora A, Shim H, et al. Role of the SDF-1/CXCR4 axis in the pathogenesis of lung injury and fibrosis. Am J Respir Cell Mol Biol. 2007; 37(3): 291-299 DOI: 10.1165/rcmb.2006-01870C
- Ortiz LA, Dutreil M, Fattman C, et al. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury. Proc Natl Acad Sci U S A. 2007; 104(26): 11002-11007 DOI: 10.1073/pnas.0704421104
- Cargnoni A, Piccinelli EC, Ressel L. Conditioned medium from amniotic membrane-derived cells prevents lung fibrosis and preserves blood gas exchanges in bleomycin-injured mice-specificity of the effects and insights into possible mechanisms. Cytotherapy. 2014; 16(1): 17-32 DOI: 10.1016/j.jcyt.2013.07.002
- Rathinasabapathy A, Bruce E, Espejo A, et al. Therapeutic potential of adipose stem cell-derived conditioned medium against pulmonary hypertension and lung fibrosis. Br J Pharmacol. 2016; 173(19): 2859-2879 DOI: 10.1111/bph.13562
- Islam MN, Das SR, Emin MT, et al. Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury. Nat Med. 2012; 18(5): 759-765 DOI: 10.1038/nm.2736
- Sinclair KA, Yerkovich ST, Hopkins PM, Chambers DC. Characterization of intercellular communication and mitochondrial donation by mesenchymal stromal cells derived from the human lung. Stem Cell Res Ther. 2016; 7(1): 91 DOI: 10.1186/s13287-016-0354-8


