Сравнительное исследование ряда коммерческих маркеров рака мочевого пузыря в реальной клинической практике
Автор: Аполихин О.И., Сивков А.В., Рощин Д.А., Перепечин Д.В., Лощилов Ю.А., Никонова Л.М., Касатонова Е.В., Положенцева М.О.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
В настоящее время в Российской Федерации отмечается прирост заболеваемости раком мочевого пузыря (РМП). Улучшение результатов лечения зависит от эффективности диагностики на ранних стадиях опухолевого процесса. Использование опухолевых маркеров является современным подходом, на роль которых было предложено несколько групп соединений (опухолевые антигены, маркеры пролиферации, адгезии, ангиогенеза и ряд других). Научный поиск позволил внедрить в практику более десятка диагностических тестсистем, которые были более эффективны, нежели цитологическое исследование мочи (ЦИМ), однако также имели серьезные ограничения. Так на частоту ложноположительных результатов при использовании тест-систем сильно влияет наличие гематурии и сопутствующего воспаления. Данное исследование было посвящено сравнительному анализу использования трех систем (UBC, BTA, NMP- 22, CYFRA 21-1) для диагностики рака мочевого пузыря по сравнению с ультразвуковой диагностикой и ЦИМ. Чувствительность UBC (ИХА) составила -62,2%, специфичность - 57,8%; UBC (ИФА) -64,4% и 57,8%; BTA (ИХА) - 68,9% и 55,6%; BTA (ИФА) - 73,3% и 57,8%; NMP-22 - 48,9% и 68,9%; CYFRA 21-1 - 21,4% и 84,4%; ЦИМ -20,5% и 93,3%; УЗИ - 91,1% и 86,7%, соответственно. Было взято две контрольных группы: больные с хроническим воспалением уротелия и условно здоровые лица. В группе контроля хронического воспаления частота ложноположительных анализов составило: UBC (ИХА) - 80%; UBC (ИФА) - 66,6%; BTA (ИХА) - 96,7%; BTA (ИФА) - 90%; NMP-22 - 30%. Важно отметить, что «идеального» маркера РМП и палитры маркеров, как альтернативы ЦИМ не существует. На результаты исследования влияет целый ряд факторов, отражающийся на чувствительности и специфичности онкомаркеров в различных клинических ситуациях. Важным вопросом является использование опухолевого маркера как альтернативы цистоскопии при динамическом наблюдении за больными после органосохранного лечения по поводу мышечно-неинвазивного рака. Основываясь на наших данных, мы склоняемся к тому, что комбинация маркера и УЗИ в группе хорошего или промежуточного прогноза по шкале Европейского общества урологов потенциально может быть альтернативой цистоскопии.
Рак мочевого пузыря, опухолевые маркеры, динамическое наблюдение
Короткий адрес: https://sciup.org/142188001
IDR: 142188001
Текст научной статьи Сравнительное исследование ряда коммерческих маркеров рака мочевого пузыря в реальной клинической практике
A constant upwards trend is observed in Russian federation with regard to the bladder cancer (BCA) incidence. Early diagnostics plays a crucial role for the treatment efficacy. Biomarkers are contemporary used for diagnostics with some substances considered to be feasible for this application (tumor antigens, proliferation, adhesion and angiogenesis markers, etc.) More than 10 test systems were integrated in the clinic, which were more effective than urine cytology (UC), but nevertheless had some limitations. Thus, hematuria and inflammation are often leading to false positives.
This study concentrated at the comparison of four test systems (UBC, BTA, NMP-22, CYFRA 21-1) for BCA diagnostics with conventional bladder ultrasound and UC. Sensitivity and specificity were following: UBC (ICA) – 62.2% and 57.8%, UBC (IFA) – 64.4% and 57.8%, BTA (ICA) – 68.9% and 55.6%, BTA (IFA) – 73.3% and 57.8%, NMP-22 – 48.9% and 68.9%, CYFRA 21-1 – 21.4% and 84.4%, UC – 20.5% and 93.3%, ultrasound – 91.1% and 86.7%.
Two control groups were used: urothelial chronical inflammation patients and healthy volunteers. Chronic inflammation group presented with false positives at the rate of: UBC (ICA) – 80%; UBC (IFA) – 66.6%; BTA (ICA) – 96.7%; BTA (IFA) – 90%; NMP-22 – 30%.
It is important to state that ideal marker or set of the markers for BCA as alternative to UC are lacking. Different clinical factors could influence the sensitivity and specificity of these tests. One of the most important questions is whether if one or several markers could be used for the follow up of patients after transurethral resection due to non-muscle invasive cancer for recurrence control as alternative to cystoscopy.
Based on our data patients in the EAU good and intermediate risk groups could benefit from the combination of the markers and ultrasound as alternative to cystoscopy for recurrence control.
О.И. Аполихин, А.В. Сивков, Д.А. Рощин, Д.В. Перепечин,
Ю.А. Лощилов, Л.М. Никонова, Е.В. Касатонова, М.О. Положенцева
НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИРЦ» Минздрава России

настоящее время в Российской Федерации отмечается прирост заболеваемости раком мочевого пузыря (РМП) [1]. К факторам, от которых зависит эффективность лечения и на которые можно по влиять, относятся ранняя диагностика опухоли, адекватность и правильность проводимого лечения, своевременное выявление рецидивов, оптимальная программа динамического наблюдения [2, 3].
В древности врачи стремились найти «панацею» – лекарство от всех болезней. В настоящее время научная мысль направлена на поиск «идеального» опухолевого маркера. Данное понятие включает в себя 100% специфичность и чувствительность, корреляцию с размером опухоли, стадией заболевания. «Идеальный» маркер подходит для быстрой диагностики субклинической первичной или рецидивной опухоли и оценки эффективности лечения.
Применение опухолевых маркеров РМП целесообразно при обследовании лиц группы риска уротелиального рака, с подозрением на опухоль мочевого пузыря или для оптимизации динамического наблюдения пациентов после органосохраняющего лечения [4, 5].
Исторически наиболее ранним методом лабораторной диагностики РМП является цитологическое исследование мочи (ЦИМ), которое позволяет визуально выявить наличие опухолевых клеток. Данный метод имеет небольшую чувствительность
(30-35%) и специфичность (40-44%), а его диагностическая ценность при высокодифференцированных опухолях невысока. К другим недостаткам относят зависимость результатов исследований, от квалификации диагноста, ложноотрицательные результаты из-за малого числа клеток, ложноположительные результаты вследствие повреждений уротелия: дистрофических, десквамативных, дисплас-тических и метапластических [6-8].
Такое положение вещей потребовало разработки новых методов диагностики РМП, лишенных указанных выше недостатков. В качестве маркеров было изучено несколько групп соединений: опухолевые антигены, маркеры пролиферации, адгезии, ангиогенеза и ряд других. Научный поиск позволил внедрить в практику до десятка диагностических тест-систем, более эффективных, нежели ЦИМ, однако, также имеющих серьезные ограничения, т.к. на частоту ложноположительных результатов при использовании многих тест-систем оказывают влияние гематурия и сопутствующее воспаление [9-11].
При анализе литературы можно отметить, что крупные исследования, изучавшие данную проблему, разнородны, в связи с чем их не всегда можно положительно оценить с точки зрения доказательной медицины, в частности, различны оценки степени дифференцировки опухоли по классификациям ВОЗ от 1998 и 2004 годов. Важной проблемой остается оценка эффективности применения опухолевых маркеров при рутинной диагностике.
В связи с изложенным, целью нашего исследования стало изучение роли ряда коммерческих маркеров в первичной и дифференциальной диагностике РМП в реальной клинической практике. Для достижения поставленной цели были сформулированы следующие задачи:
-
- изучить диагностическую ценность наиболее широко применяемых опухолевых маркеров РМП, в сравнении с ЦИМ и трансабдоминальным ультразвуковым исследованием мочевого пузыря (УЗИ);
-
- изучить частоту ложноположительных и ложноотрицательных результатов, в том числе при хроническом воспалении уротелия;
-
- изучить частоту ложноположительных результатов у лиц без РМП и хронического воспаления уротелия.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошли 100 пациентов из реальной клинической практики: мужчин – 72 (72%), женщин – 28 (28%). Пациенты были разделены на три группы, в зависимости от нозологической формы (рис. 1).
Основная группа исследования состояла из 45 больных РМП в возрасте 24 – 79 (63 ±12,3) лет и стадией заболевания T1NxM0. Из них у 18 – опухоль была первичной. Еще 27 пациентов находились на динамическом наблюдении после ранее перенесен-
Больные с
Больные раком мочевого пузыря (исследуемая группа) п=45
хроническим воспалением
уротелия (группа контроля-1) п=ЗО
Рис. 1. Группы исследования ного лечения по поводу мышечно-неинвазивного РМП в различные сроки. Гистологическое строение опухоли во всех случаях было представлено уротелиальным раком. Распределение больных по степени дифференцировки было следующим: G1- 17 (37,8%), G2 – 24 (53,3%), G3 – 4 (8,9%). Пациенты, у которых был рецидив РМП в анамнезе, получили комбинированное лечение в объеме трансуретральной резекции мочевого пузыря с внутрипузырной химиотерапией митомицином или доксорубицином.
В контрольную группу I включили 30 пациентов в возрасте 18-65 (52 ±14,5) лет с хроническим воспалением уротелия вследствие коралловидного нефролитиаза. Мужчин было 23 (76,7%), женщин – 7 (23,3%), у всех больных подтверждено наличие коралловидных конкрементов: в правой почке – у 12 (40%); в левой – у 12 (40%); двухсторонних – у 6 (20%). Ни у кого в группе не было онкологических заболеваний в анамнезе. Им проводили УЗИ, компьютерную томографию (КТ) органов брюшной полости с контрастированием, осуществляли забор материала для определения онкомаркеров. Далее пациентам в связи с МКБ выполняли перкутанную нефролитолапаксию с пиелоскопией на стороне операции и цистоскопией. Такое всестороннее обследование позволило с высокой вероятностью исключить наличие опухолевого поражения уротелия. Посев мочи был положительным в 10 слу-
Больные, без воспалительных заболеваний (группа контроля-2) п=25
чаях (33,3%), титр возбудителей варьировал от 104 до 107. Высеянные возбудители: e. coli; e. faecium, proteus mirabilis, psevdomonas aureginosa, serratia marcescens, kl. рneumoniae. Контроль уровня маркеров РМП после операции не проводили.
Контрольная группа II составили 25 человек в возрасте 18-48 (32±8,1) лет, мужчин – 17 (68%), женщин – 8 (32%), с отсутствием воспалительных заболеваний мочевых путей в анамнезе. Это были доноры, которых готовили в клинике для родственной аллотрансплантации почки или мужчины с секреторной формой бесплодия, не имевшие мочевой инфекции или заболеваний передающихся половым путем в анамнезе. Участникам группы провели УЗИ, а пациентам донорам еще и КТ органов брюшной полости с контрастированием. У всех пациентов значение общего анализа мочи были в пределах референсных значений. Рост микрофлоры в посеве мочи отсутствовал.
Исследуемые маркеры и методы диагностики РМП. Всем пациентам, включенным в исследование, выполняли УЗИ брюшной полости, малого таза и забрюшинного пространства, цитологическое исследование и общий анализ мочи, а также исследование опухолевых маркеров: BTA, UBC, NMP-22, CYFRA 21.1, причем UBC и BTA изучали в двух формах тест-систем: на основе иммунохроматогра-фического (ИХА) экспресс-анализа и иммуноферментного (ИФА). Определение BTA, UBC, NMP-22 осуществляли в одной порции мочи, а CYFRA 21.1 – в сыворотке крови методом ИФА (таб. 1). Иммуноферментный анализ более трудоемкий и длительный, однако позволяет определить количественное содержание маркера.
В ходе настоящей работы изучали следующие тест-системы:
-
- набор для определения NМP-22 ИХА методом "NMP-22 BladerChek Test", (Аlere Scarborough Inc., США);
-
- набор для определения BTA ИХА методом, "BTA stat test," (Polymedco Inc., США);
-
- набор для определения UBC □
Таблица 1. Тест-системы, изученные в оригинальном исследовании
Тест
Характеристика теста
Среда исследования
Метод исследования
UBC
растворимый фрагмент цитокератинов 8 и 18
моча
ИХА – экспресс-тест ИФА
BTA
одноцепочечный белок, ассоциированный с фактором Н комплемента человека (hCFHrg), обладающий свойствами росткового фактора
моча
ИХА – экспресс-тест ИФА
NMP-22
белок ядерного матрикса
моча
ИХА
CYFRA 21.1
растворимый фрагмент цитокератина 19
кровь
ИФА
Таблица 2. Положительные и отрицательные результаты изучаемых методов, в зависимости от наличия или отсутствия РМП
Опухоль присутствовала (n=45)
Опухоль отсутствовала (n=45)
Метод
Результат положительный
Результат отрицательный
Результат положительный
Результат отрицательный
UBC (ИХА)
28
17
19
26
UBC (ИФА)
29
16
19
26
BTA (ИХА)
31
14
20
25
BTA (ИФА)
33
12
19
26
NMP-22
22
23
14
31
CYFRA 21-1
9
33
7
38
ЦИМ
8
31
3
42
УЗИ
41
4
6
39
ИХА методом, "UBC Rapid» (IDL, Швеция);
-
- набор для определения BTA ИФА методом (Polymedco Inc., США);
-
- набор для определения UBC ИФА методом (IDL, Швеция);
-
- набор для определения CYFRA 21.1 на иммунохимическом анализаторе «Architect» (Abbott, США).
Для ИФА исследований использовали автоматический 2-х планшетный иммуноферментный анализатор "GEMINI" (Stratec Biomedical Systems AG, Швейцария).
Более подробные данные о вышеперечисленных широко применяемых в реальной клинической практике за рубежом маркерах РМП, были представлены нами в опубликованном ранее обзоре [12].
Цитологический анализ осадка мочи осуществляли в препаратах, окрашенных по Романовскому-Гимза в автоматическом режиме на аппарате «Эмкостейкер–авто» (АФОМК8-Г-01). Затем окрашенные препараты были проанализированы одним высококвалифицированным специалистом с использованием светооптического микроскопа «Leica DFC 320» и регистрацией изображений цифровой фотокамерой в соответствии с международными стандартами. Ультразвуковые ис- следования выполняли на аппарате «Aloka 5000» (Япония) с использованием конвексного мультичастотного датчика 2,5-5,0 MHz. В качестве верифицирующего метода выступала цистоскопия с биопсией под флуоресцентным или уз-коспектровым контролем.
РЕЗУЛЬТАТЫ
Пациентам основной группы, в общей сложности, выполнено 90 «циклов» обследования: в 45 из которых первичная или повторная опухоль присутствовала. Проанализированы распределение положительных и отрицательных результатов исследования маркеров РМП, цитологического исследования мочи и УЗИ пациентов основной группы, в зависимости от наличия или отсутствия опухоли (таб. 2).
Специфичность (%)

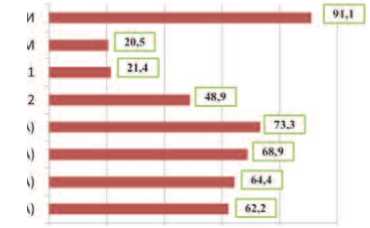
Рис. 2. Чувствительность и специфичность маркеров, ЦИМ и УЗИ при РМП
На первом этапе обработки материала мы рассчитали показатели чувствительности и специфичности тестов вне зависимости от того, была ли опухоль первичной и визуализировалась лучевыми методами, или требовалось контрольное обследование пациентов, ранее перенесших оперативное лечение. При этом каждый диагностический «цикл» рассматривался как самостоятельная единица наблюдения (рис. 2).
Наибольшая, среди маркеров РМП специфичность, отмечена у CYFRA 21.1 – 84,4%, однако чувствительность теста оказалась достоверно более низкой, чем у маркеров, определяемых в моче – 21,4% (p<0,05). Высокая специфичность (93,3%) при низкой чувствительности (31,1%) была характерна для ЦИМ. ИХА-тест NMP-22 показал относительно высокую специфичность (68,9%) при относительно небольшой чувствительности – 48,9%. Наиболее сбалансированными были диагностические показатели маркеров UBC (чувствительность – 62,2-64,4%; специфичность – 57,8%) и BTA (чувствительность – 68,9-73,3%; специфичность – 55,657,8%). При определении этих маркеров выявлены незначительные отличия между тестами на базе ИФА и ИХА, в пользу первого метода. Специфичность ИФА и ИХА тестов достоверно не отличалась. УЗИ продемонстрировало наибольшую чувствительность и специфичность, что можно объяснить классом аппаратуры, заведомой онкологической настороженностью и высокой квалификацией УЗИ-специалистов. Полученные данные подчеркивают обязательность применения ультразвукового исследования мочевого пузыря,
Чувствительность (%)
как при первичной диагностике (скрининге) РМП, так и при динамическом наблюдении.
При анализе результатов исследования, мы не обнаружили статистических различий в частоте положительных и отрицательных результатов тест-систем при первичном и рецидивном РМП, что может быть связано как с истинным отсутствием различий, так и небольшим объемом статистической выборки.
Отдельную группу составили 18 пациентов, у которых у которых удалось проследить результаты применения маркеров при динамическом наблюдении после проведенного ор-гано-сохраняющего лечения мышечно-неинвазивного РМП. Сроки контрольного обследования колебались в пределах от 6 до 24 месяцев.
Основной задачей данного фрагмента исследования была попытка оценить: может ли УЗИ в комбинации с неинвазивными тестами стать альтернативой контрольной цистоскопии. Случайным образом отобранные пациенты относились к группе хорошего или промежуточного прогноза РМП по шкале Европейского общества урологов (EAU). Проводили забор комплекса опухолевых маркеров перед операцией, далее осуществляли повторное исследование комплекса маркеров РМП перед каждой цистоскопией. У 15 (83,3%) пациентов при контрольных обследованиях рецидива РМП не выявлено. В одном случае (5,6%) зарегистрировано ложноположительное повышение BTA (ИХА), еще у одного пациента (5,6%) было отмечено повышение уровня UBC (ИХА и ИФА).
У трех больных (16,7%) при динамическом наблюдении был выявлен ре-
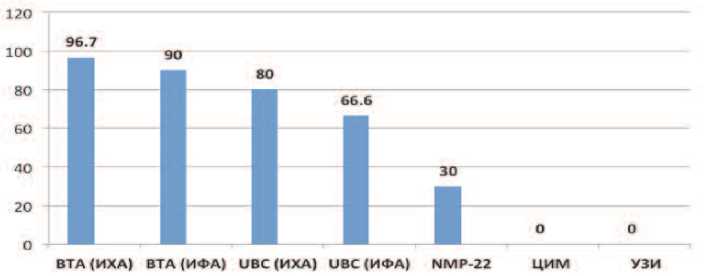
Рис. 3. Частота ложноположительных результатов маркеров РМП при хроническом воспалении уротелия
цидив опухоли мочевого пузыря. При этом дважды имели место ложноотрицательные результаты тестов: у одного пациента с рецидивом высокодифференцированного уротелиального рака не отмечено повышения уровня NMP-22; у другого – с умереннодифференцированным раком – повышения UBC (ИХА). При этом данных за наличие опухоли по ЦИМ и УЗИ не отмечено.
Следующим этапом описываемого исследования стала оценка влияния хронического воспаления уротелия на результаты применения изучаемых маркеров и методов диагностики РМП (рис. 3).
Обращает на себя внимание крайне высокая частота ложноположительных результатов определения и BTA (90,0-96,7%) и UBC (66,6-80,0%) обоими методами на фоне воспалительного процесса в уротелии. Сопоставление данных ИХА и ИФА показало, что в последнем случае ложноположительные результаты встречаются реже. Частота ложноположительных результатов для NMP-22 составила 30%, тогда как они отсутствовали при ЦИМ и УЗИ.
В группе контроля II ни у одного из обследованных лиц положительных тестов маркеров РМП выявлено не было, т.е. в случае интактного уротелия, в отличие от группы контроля I, ложноположительные результаты отсутствовали.
ОБСУЖДЕНИЕ
В большинстве клинических исследований, посвященных лабораторной диагностике РМП, как правило, анализируют искусственно отобранные (в соответствии с протоколом)
группы больных, у которых производили диагностику с использованием одной-двух тест-систем. Работ по сравнительному изучению чувствительности и специфичности комплекса из 5 опухолевых маркеров, определенных в одной порции мочи, в доступной литературе нами не найдено. Данное исследование выполнено на реальном клиническом материале, что обуславливает несколько более скромные результаты чувствительности и специфичности изученных маркеров по сравнению с данными исследований в специально отобранных группах [8, 12].
Особенностью настоящей работы является то, что в одной из контрольных групп изучены результаты тестирования пациентов с хроническим воспалением уротелия. Как было продемонстрировано, в этой группе отмечена чрезвычайно высокая частота ложноположительных результатов BTA и UBC тестов. Вероятно у лиц с присутствующей мочевой инфекцией применение указанных тестов нецелесообразно. Исследований с дизайном, аналогичным для контрольной группы I, в доступной литературе нами не найдено. Высокую частоту ложноположительных тестов маркеров РМП при наличии хронического воспаления можно объяснить перестройкой уротелия, наличием сопутствующих микрогематурии и лейко-цитоурии. Влияние предшествующих вмешательств на диагностическую ценность тест-системы отмечают так же M. Balci и соавт., использовавшие NMP-22 и ЦИМ для выявления резидуальной опухоли перед повторной трансуретральнной резекцией мочевого пузыря (ТУР). Авторы отметили ограниченную эффективность данного метода, как при отдельном использовании тестов, так и при их комбинации ЦИМ [13].
Высокая чувствительность при низкой специфичности опухолевых маркеров либо обратное соотношение, в своих работах отмечали М. Babjuk и соавт. в 2008 году. Авторы сделали вывод о недостаточной чувствительности лабораторной диагностики □ для выявления опухолевого рецидива [14]. По мнению B. Nisman и соавт., более целесообразно комбинировать использование маркеров РМП с УЗИ [15]. Полученные нами данные также свидетельствуют о возможности комбинации опухолевого маркера и УЗИ при динамическом наблюдении за больными после органосохраняющего лечения.
Возможно на итоги применения тест-систем маркеров РМП может влиять и характер опухоли (рецидивный, первичный), что еще в 2002 г. отмечали P. Quek и соавт. [16]. Однако в настоящем исследовании нам не удалось статистически достоверно выявить различия при диагностике первичных и рецидивных новообразований.
Исходя из полученных данных, можно предложить для обсуждения следующие рекомендации по использованию опухолевых маркеров на различных этапах диагностики РМП:
Первичная диагностика рака. При первичной диагностике РМП в настоящее время наиболее оптимальными методами являются УЗИ и цистоскопия. Определение уровня маркеров РМП возможно до проведения цистоскопии. Однако относительно невысокая специфичность и чувствительность большин-
Таблица 3. Оптимизация динамического наблюдения за больными РМП после органосохраняющего лечения с использованием опухолевых маркеров
|
Группа риска по развитию рецидива РМП по классификации EAU |
Число баллов |
Путь оптимизации с использованием опухолевых маркеров |
|
Низкий риск |
0 |
Комбинация УЗИ + исследование опухолевых маркеров (BTA, NMP-22 или UBC) – реальная альтернатива цистоскопии |
|
Промежуточный риск |
1-4 |
Комбинация УЗИ + исследование опухолевых маркеров (BTA, NMP-22 или UBC) возможна как альтернатива цистоскопии |
|
Промежуточный риск |
5-9 |
Комбинация УЗИ + исследование опухолевых маркеров дискуссионная; возможно сокращение частоты цистоскопий |
|
Высокий риск |
10-17 |
Комбинация УЗИ + исследование опухолевых маркеров не является альтернативной цистоскопии |
Таблица 4. Сравнительный анализ использования опухолевых маркеров при раке мочевого пузыря [5, 11, 12, 17]
|
Тест |
Метод |
Чувствительность (%) |
Специфичность (%) |
Мнение FDA |
|
ЦИМ |
Микроскопия |
16-90 |
около 90 |
Одобрен |
|
ВТА |
Количественный ИФА/экспресс-тест |
57-88 |
48-92 |
1997/1998: одобрен для диагностики и мониторинга |
|
NMP-22 |
Количественный ИФА/ИХА |
47-100 |
60-90 |
2002: одобрен для диагностики и мониторинга 2003: одобрен для скрининга в группах риска |
|
UBC |
Количественный ИФА/ИХА |
66-87 |
83-90 |
нет |
ства исследованных коммерческих тестов не позволяет отказаться от цистоскопии и биопсии на этапе первичной диагностики. В пользу этого же говорит и высокая частота ложноположительных результатов маркеров РМП при сопутствующем инфекционно-воспалительном процессе в уротелии, например, при сопутствующей МКБ и т.п.
Скрининг. Управление по контролю за продуктами питания и лекарствами (FDA), США, зарегистрировало только NMP-22 в качестве теста, который можно использовать для скрининга и диагностики РМП у лиц групп риска, например, контактирующих с известными канцерогенами или курящих. В России базовым методом выявления РМП в ходе профосмотров остается УЗИ (возможно в комбинации с ЦИМ).
Динамическое наблюдение группы хорошего прогноза. Мы не получили статистического различия между результатами исследования опухолевых маркеров (BTA, NMP-22 или UBC). В связи с этим представляется оправданным применение одного из этих маркеров в сочетании с УЗИ до контрольной цистоскопии, через 6 месяцев после операции и далее после проведенного ор-гано-сохраняющего лечения. В случае отрицательного результата обоих исследований от очередной цистоскопии возможно воздержаться. При этом следует иметь в виду, что в сроки до 3-х месяцев после операции (особенно после внут-рипузырного введения химиопрепарата) или сохраняющегося воспалительного процесса в мочевом пузыре, велика вероятность ложноположительного повышения уровня маркеров. ЕАУ рекомендует после года наблюдения в дальнейшем проводить цистоскопию раз в год в течение 5 лет. Выполнение одного из тестов (BTA, NMP-22 или UBC) в комбинации с УЗИ каждые 6 месяцев может стать реальной альтернативой цистоскопии. Наличие признаков опухоли хотя бы по результатам одного из этих исследований является показанием к цистоскопии (таб. 3).
Группа плохого прогноза. Пациенты данной группы являются потенциальными кандидатами на радикальную цистэктомию, поэтому сокращение числа цистоскопий при динамическом наблюдении нецелесообразно. Этим больным часто проводят BCG-терапию, которая может способствовать длительному повышению уровня маркеров РМП в моче, что ограничивает их применение для динамического наблюдения [17].
Группа промежуточного прогноза. EAU не дает специальных рекомендаций относительно данной группы больных. Согласно «Алгоритмам диагностики и лечения злокачественных новообразований» все пациенты должны быть обследованы в течение первого года раз в три месяца, далее в течение 2-4 лет – раз в 6 мес., далее – 1 раз в год [19]. Согласно нашему мнению в группе больных промежуточного риска, которые набрали 1-4 балла по шкале EAU, при отрицательном результате УЗИ и опухолевого маркера, проведение цистоскопии может быть отложено (таб. 4).
ЗАКЛЮЧЕНИЕ
Ни один из изученных в настоящей работе тестов не соответствует критериям «идеального» опухолевого маркера. На результаты их применения оказывает действие целый ряд факторов, влияющих на вариабельность чувствительности и специфичности в различных клинических ситуациях. На частоту ложно-положительных результатов исследования сильное влияние оказывает наличие воспалительных заболеваний мочевыводящих путей, гематурия, предшествовавшие трансуретральные вмешательства, внутрипузырное введение химиопрепаратов или вакцины BCG.
При первичной диагностике РМП определение маркеров не способно заменить цистоскопию. При динамическом наблюдении после органосохраняющего лечения мышечно-неинвазивного РМП, более предпочтительной является комбинация опухолевого маркера (BTA, NMP-22 или UBC) и УЗИ в группе хорошего или промежуточного прогноза, при числе баллов по шкале EAU 1-4. При более агрессивной опухоли выполнение регулярной цистоскопии при динамическом наблюдении обязательно.
Необходима разработка новых и более эффективных (чувствительных и специфичных) тест-систем для ранней диагностики РМП, с минимальными ограничениями по влиянию сопутствующего воспалительного процесса и ранее перенесенного лечения. □
Резюме:
Список литературы Сравнительное исследование ряда коммерческих маркеров рака мочевого пузыря в реальной клинической практике
- Злокачественные новообразования в России в 2012 году (заболеваемость и смертность). . М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России. 2014. -250 с.
- Oosterlinck W. The management of superficial bladder cancer. // BJU. Intern. 2001. Vol. 87. P. 135-140.
- Mueller J1, Schrader AJ, Schrader M, Schnoeller T, Jentzmik F. Management of muscle-invasive bladder cancer. // Minerva Urol Nefrol. 2013. Vol. 65. N 4. P.235-248.
- Trivedi D, Messing EM. Commentary: the role of cytologic analysis of voided urine in the workup of asymptomatic microhematuria.//BMC Urol. 2009. N.9. P. -13.
- Puerta-Gil P, Garcia-Baquero R, Jia AY, Ocana S, Alvarez-Mùgica M, Alvarez-Ossorio JL, Cordon-Cardo C, Cava F, Sanchez-Carbayo M. miR-143, miR-222, and miR-452 are useful as tumor stratification and noninvasive diagnostic biomarkers for bladder cancer//Am J Pathol. 2012. Vol. 180, N 5. P. -1808-1815.
- Tetu B. Diagnosis of urothelial carcinoma from urine.//Mod Pathol. 2009 Vol. 22, (Suppl 2). P.-53-59.
- Nakamura K, Kasraeian A, Iczkowski KA, Chang M, Pendleton J, Anai S, Rosser CJ. Utility of serial urinary cytology in the initial evaluation of the patient with microscopic hematuria. // BMC Urol. 2009. Vol. 9, P. 9 -12.
- Raitanen MP, Aine R, Rintala E, Kallio J, Rajala P, Juusela H, Tammela TL. // Differences between local and review urinary cytology in diagnosis of bladder cancer. An interobserver multicenter analysis. //Eur Urol. 2002. Vol. 41. N3. P. - 284-289.
- Abogunrin F, O'Kane HF, Ruddock MW, Stevenson M, Reid CN, O'Sullivan JM, Anderson NH, O'Rourke D, Duggan B, Lamont JV, Boyd RE, Hamilton P, Nambirajan T, Williamson KE. The impact of biomarkers in multivariate algorithms for bladder Cancer diagnosis in patients with hema-turia//Cancer. 2012. Vol. 118. N 10. P. 2641-2650.
- Hanke M, Hoefig K, Merz H, Feller AC, Kausch I, Jocham D, Warnecke JM, Sczakiel G. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-
- are related to urinary bladder cancer. // Urol Oncol. 2010. Vol. 28, N 6. P. 655-661.
- Ritter R, Hennenlotter J, Kühs U, Hofmann U, Aufderklamm S, Blutbacher P, Deja A, Hohneder A, Gerber V, Gakis G, Stenzl A, Schwentner C, Todenhöfer T. Evaluation of a new quan-titative point-of-care test platform for urine-based detection of bladder cancer. // Urol Oncol. 2014. Vol. 32, N 3. P 337-344.
- Сивков А.В., Рощин Д. А., Перепечин Д.В., Никонова Л.М., Положенцева М.О., Молекулярно -генетические маркеры рака мочевого пузыря в клинической практике.//Экспериментальная и клиническая урология. N 3. С. 48 -54.
- Balci M, Tuncel A, Guzel O, Aslan Y, Sezgin T, Bilgin O, Senel C, Atan A. Use of the nuclear matrix protein 22 Bladder Chek test in the diagnosis of residual urothelial cancer before a second transurethral resection of bladder cancer.//Int Urol Nephrol. 2015 Vol. 47, N.3 P 473-477.
- Babjuk M, Soukup V, Pesl M, Kostirova M, Drncovâ E, Smolova H, Szakacsova M, Getzen-berg R, Pavlik I, Dvoracek J. Urinary cytology and quantitative BTA and UBC tests in surveillance of patients with pTapT1 bladder urothelial carcinoma. // Urology. 2008. Vol. 71, N 4. P 718-722.
- Nisman B, Yutkin V, Peretz T, Shapiro A, Barak V, Pode D. The follow-up of patients with non-muscle-invasive bladder cancer by urine cytology, abdominal ultrasound and urine CYFRA 21-1: a pilot study.//Anticancer Res. Vol. 29, N. 10. P 4281-4285.
- Quek P, Chin CM, Lim PH. The role of BTA stat in clinical practice. // Ann Acad Med Singapore. 2002. Vol. 31, N 2, P 212-216.
- Klap J, Schmid M, Loughlin KR. Biomarkers in patients treated with BCG: an update. Can J Urol. 2014; Vol. 21, N. 4, P 7335-43.
- Алгоритмы диагностики и лечения злокачественных новообразований.// Изд. 2-е, переработанное и дополненное. М.: ФГУ «МНИОИ им. П.А. Герцена Минздравсоцразвития России», 2010. 543 c.
- Родина И.А. Исследование значимости опухолеассоциированных маркеров UBC, Tu M2-PK и TPS в онкоурологии: Дисс.. канд. мед. наук., М., 2006. 126 c.


