Сравнительное изучение устойчивости к септориозу и физиологических показателей у разных сортов пшеницы
Автор: Яруллина Любовь Георгиевна, Касимова Рита Ильшатовна, Шпирная Ирина Андреевна, Ахатова Альбина Рашитовна, Ибрагимов Ринат Исмагилович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Экология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Проведено сравнительное изучение ряда показателей (экспрессионная активность генов анионной пероксидазы и оксалатоксидазы, а также активность пектиназ и их ингибиторов). у растений пяти сортов пшеницы, которые по предварительным данным различались по устойчивости к заражению патогенными грибами. По всем функциональным признакам устойчивые сорта превосходили чувствительные. Полученные данные указывают на перспективность использования таких признаков для отбора устойчивых форм растений.
Устойчивость к патогенам, экспрессия генов, оксалатоксидаза, пероксидаза, ингибиторы пектиназ, пектиназы
Короткий адрес: https://sciup.org/148202038
IDR: 148202038 | УДК: 581.1
Текст научной статьи Сравнительное изучение устойчивости к септориозу и физиологических показателей у разных сортов пшеницы
В естественных условиях растения испытывают на себе действие разнообразных неблагоприятных факторов как биотической, так и абиотической природы, и их выживание зависит от способности защитить себя от всех этих воздействий. С точки зрения интересов человека, важным аспектом устойчивости растений является сохранение их урожайности на фоне взаимодействия с различными патогенами. Важным подходом к изучению взаимодействия механизмов, обеспечивающих устойчивость к биотическим стрессам, может быть сравнение связанных с ними физиологических показателей у разных сортов пшеницы.
В настоящее время доказано, что важную роль во взаимоотношениях растений и патогенов играют активные формы кислорода (АФК), в том числе перекись водорода (Н 2 О 2 ) [1-3]. АФК не только непосредственно ингибируют рост патогена, накапливаясь в высоких концентрацией в зоне поражения, но участвуют в ускорении лигнификации и других модификациях клеточной стенки, обеспечивающих усиление их барьерной функции, а также индуцируют экспрессию защитных генов. Ок-салатоксидаза и пероксидазы играют важную роль в генерации АФК при заражении [4, 5]. Их активация и сопряженная генерация Н 2 О 2 под воздействием салициловой кислоты и хитоолигосахаридов повышали устойчивость пшеницы к возбудителям твердой головни и корневой гнили [6, 7]. Роль ок-салатоксидазы в защите от грибных патогенов определяется также тем, что при ее участии разрушаются продуцируемые грибами оксалаты, являющиеся агентами, направленными против защитных реакций растений.
Мы провели сравнительное изучение ряда по-
казателей у растений пяти сортов пшеницы, которые по предварительным данным различались по устойчивости к заражению патогенными грибами. В лабораторных условиях устойчивость растений к фитопатогенам оценивали по степени проявления поражения листьев при их инфицировании возбудителем септориоза. Одновременно оценивали ряд признаков, связанных с формированием устойчивости растений к инфицированию. В качестве показателей, имеющих отношение к защите растений от заражения, мы оценивали экспрессионную активность генов анионной пероксидазы и оксала-токсидазы, а также активность пектиназ и их ингибиторов. Как известно, эти белки относят к связанным с патогенезом (PR proteins). Изучение этих показателей не только могло прояснить их роль в формировании устойчивости растений, но и проверить возможность их использования в процессе отбора устойчивых форм растений.
Исследования проводили в лабораторных условиях на растениях мягкой пшеницы ( Triticum aesti-vum, сорта Башкирская 26, Казахстанская 10, Омская 35, Омская 36, Симбирка). Семена проращивали в темноте в течение 2-3 сут на дистиллированной воде. 3-суточные проростки пересаживали на разбавленный раствор Кнопа (1:2) и выращивали на светоплощадке с фотопериодом 16 ч/сут.
Для заражения листьев и оценки их устойчивости к фитопатогену полностью развернутые листья 7-суточных проростков срезали, помещали во влажную камеру, срезы прикрывали ватой, смоченной в растворе бензимидазола (40 мг/л) [8]. Листья выдерживали при комнатной температуре в темноте в течение 24 ч, переносили на искусственное освещение с фотопериодом 16 ч/сут. Отрезки листьев инокулировали суспензией пикноспор Sep-toria nodorum Berk. (106 спор/мл), которые были выделены авторами из местной популяции гриба. Инокулированные листья выдерживали при комнатной температуре в темноте в течение 24 ч, переносили на искусственное освещение с фотопе- риодом 16 ч/сут.
Интенсивность развития гриба на эпидермисе листьев оценивали в течение 120 ч, экспрессию генов оксалатоксидазы и пероксидазы через 24 и 48 ч после инокуляции. В качестве контроля использовали неинфицированные листья растений.
Тотальную РНК выделяли с помощью тризола (Molecular Research Center, Inc, США). Для получения кДНК на основе мРНК проводили реакцию обратной транскрипции с использованием M-MuLV обратной транскриптазы (Fermentas, Литва), согласно протоколам фирм-поставщиков. Концентрацию ДНК и РНК измеряли при А260/A280 на спектрофотометре Smart SpecTM Plus (Bio-Rad), предварительно растворив образцы в Тris-EDTA буфере. Перед амплификацией концентрации всех образцов выравнивались.
Для анализа экспрессии генов, кодирующих пероксидазу и оксалатоксидазу, с помощью программы «Primer Select» (DNAStar) были подобраны высокоспецифичные праймеры.
Праймеры к анионной пероксидазе T.aestivum :
Anper (F) 5’-ttc-gac-aag-cag-tac-tac-cac-aa- 3’
Anper (R) 5’-ccg-aag-tcc-gag-aag-aac-tg- 3’ которые фланкируют консервативный участок гена пероксидазы размером 220 п.н.
Праймеры к оксалатоксидазе T.aestivum:
OxO (F) 5’-atg-act-tcc-tct-tct-cgt-cca-ag- 3’
OxO (R) 5’-gga-gct-gaa-gag-tgt-caa-tgg- 3’, которые фланкируют консервативный участок гена ок-салатоксидазы размером 410 п.н.
В качестве положительного контроля использовали реакцию амплификации гена, кодирующего конститутивно экспрессирующийся белок «домашнего хозяйства» ADP-RF (house-keeping gene) пшеницы:
F 5’-gac- cac-cat-cct-cta-caa-g-3’
R 5’-agc-agc-aca-gca-tca-c-3’
Отрицательным контролем служила реакция с добавлением всех реагентов за исключением кДНК. Уровень экспрессии гена оценивали по интенсивности свечения полос, полученных при электрофоретическом разделении ПЦР-продуктов в 1-2% агарозном геле или 7% ПААГ, на анализаторе гелей («Bio-Rad», США) с помощью компьютерной программы TotalLab. В качестве маркеров использовали фрагменты ДНК фага l после расщепления рестрикта-зами Bgl I и MassRuler DNA Ladder, Low Range (Fermentas, Литва).
Активность пектолитических ферментов определяли использую гелевые пластины, приготовленные по [9], с яблочным пектином в 0.2M ацетатном буфере (pH 5.6) в качестве субстрата. Раствор пектина смешивали с раствором агарозы в ацетатном буфере и затем добавляли ацетат кальция. В конечном итоге, концентрация ингредиентов в смеси была следующей: агароза 1.5%, пектин 1%, ацетат кальция 0.5%. Для определения активности пектиназ и их ингибиторов листья растирали с кварцевым песком и экстрагировали дистиллированной водой в соотношении 1:5 в течение 2 ч при 40С. Экстракт фильтровали через фильтровальную бумагу и центрифугировали дважды при 3500 g в течение 10 мин. 20 μl супернатанта добавляли в лунки гелевых пластин. Для осуществления гидролиза иммобилизованного пектина кюветы с гелевыми пластинами прикрывали крышкой и инкубировали 9 ч при 370C. Действие пектиназ оценивали, обрабатывая пластины 10% ацетатом меди. Области геля, содержащие гидролизованный пектин, проявлялись как светлое пространство на голубом фоне. Активность фермента рассчитывали, измеряя размер области геля с гидролизованным субстратом вокруг лунок. Активность фермента, катализирующего гидролиз субстрата в области геля размером 1 мм2 принимали за условную миллиединицу (mU). Для определения активности ингибиторов пектиназ растительный экстракт смешивали с равным объемом 100 μg ml-1 пектиназы из Aspergillus niger (Sigma, USA) и добавляли в лунки. Активность ингибитора рассчитывали как разницу между значениями для 50 μg ml-1 пектиназы Aspergillus niger и смеси пектиназы с растительным экстрактом. Количество ингибитора, уменьшающего активность фермента на 1 mU, принимали за 1 миллиединицу ингибиторной активности (mIU).
Опыты проводили в 3 биологических повторах. В каждом варианте опыта фиксировали по 5 листьев. Компьютерный анализ аминокислотных и нуклеотидных последовательностей проводили с помощью пакета компьютерных программ Lasergene фирмы “DNASTAR, Inc.” (США). Статистическую обработку проводили по стандартным программам. Данные на графиках представляют собой средние величины и их стандартные ошибки.
Наблюдение за ростом возбудителя септориоза на эпидермисе листьев разных сортов пшеницы выявило различия в степени развития гриба. Так, на листьях пшеницы сорта Казахстанская 10 уже через 24 ч после инфицирования в местах нанесения спор появлялись слабые хлорозы и некрозы. Признаки развития септориоза на листьях растений сорта Омская 36, Симбирка, Башкирская 26, Казахстанская 10 наблюдались через 48 ч после инфицирования в виде слабого обесцвечивания листьев с последующим их побурением, а через 72 ч после инокуляции симптомы септориоза проявлялись в виде бурых пятен с пушистым налетом мицелия. В листьях растений сорта Омская 35 в указанные сроки симптомы болезни были слабо выражены.
В таблице 1 изученные сорта ранжированы по интенсивности развития возбудителя септориоза S. nodorum , которую оценивали по площади инфекционного пятна спустя 120 ч после инокуляции. Как видно из таблицы 1, листья пшеницы сорта Казахстанская проявляли наиболее выраженные симптомы заболевания, в то время как у сорта Омская 35 они были выражены в наименьшей степени.
Таблица 1 . Площадь инфекционного пятна в листьях пшеницы различных сортов пшеницы
|
Cорта пшеницы с различной полевой устойчивостью |
Площадь инфекционного пятна, мм2 |
|
Омская 35 |
7,3 ± 0,3 |
|
Омская 36 |
9,1± 0,4 |
|
Симбирка |
12,6±0,9 |
|
Башкирская 24 |
15,9 ±1,1 |
|
Казахстанская 10 |
19,6 ±1,3 |
Таким образом, наибольшую устойчивость к инфицированию возбудителем септориоза проявляли растения пшеницы сорта Омская 35, наименьшую – сорта Казахстанская 10. Сорта пшени- цы Омская 36, Симбирка и Башкирская 26 занимали по степени инфицируемости растительных тканей патогенным грибом S. nodorum промежуточное положение.
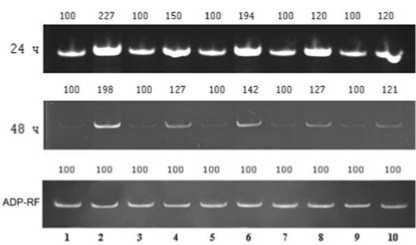
Рис. 1 . Экспрессия гена анионной пероксидазы (TC 151917) в листьях пшеницы разных сортов при инфицировании S. nodorum ( S. n .) через 24 и 48 ч.
1 – Омская 35, 2 – Омская 35 + S. n. , 3 – Омская 36, 4 – Омская 36 + S. n., 5 – Симбирка, 6 – Симбирка + S. n., 7 – Башкирская 26, 8 – Башкирская 26 + S. n., 9 – Казахстанская 10, 10 – Казахстанская 10 + S. n.
Заражение индуцировало повышение уровня экспрессии гена анионной пероксидазы в листьях растений сорта Омская 35, Омская 36 и Симбирка (рис. 1). В наибольшей степени это проявлялось у сорта Омская 35. Из сравнения данных, полученных через 24 и 48 ч после инокуляции, видно, что со временем уровень экспрессии продолжал возрастать у растений пшеницы сортов Омская 35 и 36
и снижался у сорта Симбирка. В листьях растений сортов Башкирская 26 и Казахстанская 10 достоверных изменений экспрессии гена анионной пероксидазы под влиянием заражения не было выявлено.
Заражение повышало экспрессию гена оксала-токсидазы у всех изученных сортов (рис. 2).

Рис. 2 . Экспрессионная активность гена оксалатоксидазы (AJ556991.1) в инфицированных и контрольных листьях растений пшеницы сортов различной устойчивости. 24 и 48 ч после инфицирования. Обозначения как на рис. 1
Хотя со временем уровень экспрессии этого гена в основном снижался, он оставался выше, чем в контроле. Экспрессия была максимальной в листьях растений сорта Омская 35 и минимальной у сортов Башкирская 26 и Казахстанская 10.
В отсутствие заражения различия между сортами по пектолитической активности были небольшими (табл. 2). Максимально высокое значение у сорта Омская 35 лишь в 1.2 раза превышало минимальный уровень у сорта Симбирка.
Таблица 2 . Активность пектиназ в инфицированных и контрольных листьях растений пшеницы различных сортов
|
Сорт |
Активность пектиназ в контрольных растениях, Е/ г |
Активность пектиназ в инфициров. растениях, Е/ г |
|
Омская 35 |
109 ± 5,45 |
87 ± 4,35 |
|
Омская 36 |
99 ± 4,95 |
68 ± 3,4 |
|
Симбирка |
89 ± 4,45 |
104 ± 5,2 |
|
Башкирская 26 |
104 ± 5,2 |
117 ± 5,85 |
|
Казахстанская 10 |
94 ± 4,7 |
103 ± 5,15 |
При заражении различия между сортами увеличились, и соотношение между максимальным уровнем у растений сорта Башкирская 26 и минимальным у сорта Омская 36 было уже 1.6. Это возрастание различий было следствием того, что у одних сортов (Симбирка, Башкирская 26 и Казахстанская 10) пектолитическая увеличилась, что могло быть следствием ферментативной активности патогена, а у других (Омская 35 и 36) – снизилась. Возможно, в результате повышения активности ингибитора пектиназ (рис. 3).
В отсутствие заражения у растений сорта Казахстанская 10 активность ингибитора пектиназы была достоверно ниже, чем у всех остальных сортов, и хотя она возрастала при заражении до уровня, зафиксированного в листьях растений сорта Башкирская 26, была ниже, чем у всех изученных сортов. В результате заражения активность ингибитора возрастала в листьях пшеницы сорта Омская 35 и снижалась у сорта Симбирка. Эти вызванные заражением изменения в уровне активности ингибитора привели к появлению сильной отрицательной корреляция между этим показателем и тяжестью заболевания растений (r=-0.95).
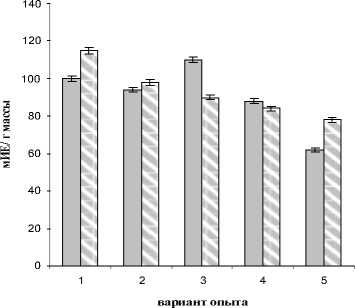
□ Контроль
□ Инфицирование
Рис. 3. Активность ингибитора пектиназы в растениях пшеницы различных сортов при инфицировании S. nodo- rum.
1 – Омская 35, 2 – Омская 36, 3 – Симбирка, 4 – Башкирская 26, 5 – Казахстанская 10
Таким образом, в нашей работе уровень повышения экспрессии гена оксалатоксидазы коррелировал с устойчивостью растений к грибным патогенам. Уровень экспрессии гена пероксидазы резко возрастал при заражении устойчивых растений (Омская 35 и 36) и не менялся у чувствительных к заражению растений сортов Башкирская 26 и Казахстанская 10. Представляет интерес то, что индуцируемый заражением уровень экспрессии гена ок-салатоксидазы достигал максимума раньше, чем пероксидазы (через 24 и 48 ч после заражения соответственно). Эти результаты указывают на более раннее проявление роли оксалатоксидазы.
Таким образом, по всем перечисленным функциональным признакам (уровень индукции экспрессии генов пероксидазы и оксталатоксидазы, активность пектиназ и их ингибиторов на фоне заражения) устойчивые сорта превосходили чувстви- тельные, что указывает на перспективность использование таких признаков для отбора устойчивых форм растений.
Работа проведена при финансовой поддержке гранта РФФИ_поволжье_а № 11-04-97037 и ФЦП ГК № 01201353578.
-
1. Shirasu K., Schulze-Lefert P. Regulators of cell death in disease resistance // Plant Mol. Biol. 2000. V. 44. N 3. P. 371385.
-
2. Тарчевский И.А., Чернов В.М. Молекулярные аспекты фитоиммунитета // Микология и фитопатология. 2000. Т. 34. Вып. 3. С. 3-10.
-
3. Ramputh A.I., Arnason J.T., Cass L., Simmonds J.A. Reduced herbivory of the European corn borer ( Ostrinia nubi-lalis ) on corn transformed with germin, a wheat oxalate oxidase gene // Plant Sci. 2002. V. 162. P. 431-440.
-
4. Яруллина Л.Г., Трошина Н.Б., Максимов И.В., Хайруллин Р.М. Участие оксалатоксидазы в неспецифичной защит-
ной активации окисления ортофенилендиамина в проростках пшеницы при стрессе // Агрохимия. 2003. № 12. С. 55-59.
-
5. Максимов И.В., Валеев А.Ш., Черепанова Е.А., Яруллина Л.Г. Продукция активных форм кислорода в листьях пшеницы, инфицированных разновирулентными штаммами S. nodorum Berk. // Прикладная биохимия и микробиология. 2009. Т. 46. № 4. С. 481-486.
-
6. Трошина Н.Б., Яруллина Л.Г., Валеев А.Ш., Максимов И.В. Индукция салициловой кислотой устойчивости пшеницы к Septoria nodorum Berk. // Известия РАН. 2007. № 5.
-
7. Бурханова Г.Ф., Яруллина Л.Г., Максимов И.В. Пути регуляции хитоолигосахаридами защитных реакций в рас-
тениях пшеницы при инфицировании Bipolaris sorokiniana // Физиология растений. 2007. Т. 54. С. 119126.
-
8. Пыжикова Г.В., Карасева Е.В. Методика изучения возбудителей септориоза на изолированных листьях пшеницы // С.-х. биология. 1986. №.12. С.112-114.
-
9. Шпирная И.А., Умаров И.А., Шевченко Н.Д., Ибрагимов Р.И. Определение активности гидролаз и их ингибиторов с использованием субстратов, иммобилизованных в геле агарозы // Прикладная биохимия и микробиология. 2009. Т. 45. № 4. С. 497-501.
COMPORATIVE RESEARCH OF RESISTANCE TO SEPTORIA AND PHYSIOLOGICAL FEATURES IN DIFFERENT WHEAT VARIETY
Список литературы Сравнительное изучение устойчивости к септориозу и физиологических показателей у разных сортов пшеницы
- Shirasu K., Schulze-Lefert P. Regulators of cell death in disease resistance//Plant Mol. Biol. 2000. V. 44. N 3. P. 371-385.
- Тарчевский И.А., Чернов В.М. Молекулярные аспекты фитоиммунитета//Микология и фитопатология. 2000. Т. 34. Вып. 3. С. 3-10.
- Ramputh A.I., Arnason J.T., Cass L., Simmonds J.A. Reduced herbivory of the European corn borer (Ostrinia nubilalis) on corn transformed with germin, a wheat oxalate oxidase gene//Plant Sci. 2002. V. 162. P. 431-440.
- Яруллина Л.Г., Трошина Н.Б., Максимов И.В., Хайруллин Р.М. Участие оксалатоксидазы в неспецифичной защитной активации окисления ортофенилендиамина в проростках пшеницы при стрессе//Агрохимия. 2003. № 12. С. 55-59.
- Максимов И.В., Валеев А.Ш., Черепанова Е.А., Яруллина Л.Г. Продукция активных форм кислорода в листьях пшеницы, инфицированных разновирулентными штаммами S. nodorum Berk.//Прикладная биохимия и микробиология. 2009. Т. 46. № 4. С. 481-486.
- Трошина Н.Б., Яруллина Л.Г., Валеев А.Ш., Максимов И.В. Индукция салициловой кислотой устойчивости пшеницы к Septoria nodorum Berk.//Известия РАН. 2007. № 5.
- Бурханова Г.Ф., Яруллина Л.Г., Максимов И.В. Пути регуляции хитоолигосахаридами защитных реакций в растениях пшеницы при инфицировании Bipolaris sorokiniana//Физиология растений. 2007. Т. 54. С. 119-126.
- Пыжикова Г.В., Карасева Е.В. Методика изучения возбудителей септориоза на изолированных листьях пшеницы//С.-х. биология. 1986. №.12. С.112-114.
- Шпирная И.А., Умаров И.А., Шевченко Н.Д., Ибрагимов Р.И. Определение активности гидролаз и их ингибиторов с использованием субстратов, иммобилизованных в геле агарозы//Прикладная биохимия и микробиология. 2009. Т. 45. № 4. С. 497-501.


