Сравнительные исследования выхода однонитевых разрывов и щелочнолабильных сайтов ДНК при воздействии 365 нм ультрафиолетового и рентгеновского излучений на лимфоциты периферической крови человека
Автор: Сметанина Н.М., Пустовалова М.В., Бушманов А.Ю., Осипов А.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Генетика
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Цель; сравнить количественный выход однонитевых разрывов (ОР) и щелочнолабильных сайтов (ЩС) ДНК, индуцированных 365 нм ультрафиолетовым (УФ) и рентгеновским излучениями в лимфоцитах периферической крови человека in vitro. Материал и методы. Выделение лимфоцитов крови человека проводили путем центрифугирования в градиенте плотности фикол-верографин. Облучение клеток проводили на УФ-установке BLX-365 (длина волны 365±10 нм) и рентгеновской биологической установке РУБ РУСТ-М1. Анализ ОР и ЩС ДНК проводили с использованием метода ДНК-комет в щелочных условиях. Результаты. Впервые показано, что выход ОР и ЩС ДНК в лимфоцитах крови человека при воздействии 365 нм УФ излучения в дозе 10 кДж/м2 соответствует эффекту рентгеновского излучения ~ в дозе 1 Гр. Заключение. Воздействие 365 нм УФ излучения в дозе 1 кДж/м2 на лимфоциты периферической крови человека индуцирует -100 ОР ДНК на клетку.
365 нм уф излучение, лимфоциты, метод днк-комет, однонитевые разрывы днк, рентгеновское излучение
Короткий адрес: https://sciup.org/14917842
IDR: 14917842 | УДК: 577.34:
Текст научной статьи Сравнительные исследования выхода однонитевых разрывов и щелочнолабильных сайтов ДНК при воздействии 365 нм ультрафиолетового и рентгеновского излучений на лимфоциты периферической крови человека
1Введение. Основное внимание исследователей биологических эффектов ультрафиолетового (УФ) излучения долгие годы было сосредоточено на коротковолновом (менее 280 нм) излучении, вызывающем серьезные повреждения ДНК и других макромолекул, но почти полностью поглощаемом озоновым слоем Земли. УФ излучение с длинами волн 315–400 нм (согласно международной классификации — УФ-A), более 90% которого достигает земной поверхности, считалось относительно безвредным. В последние десятилетия было показано, УФ-А излучение, обладающее большой проникающей способностью и воздействующее на глубокие слои кожи, может индуцировать развитие злокачественных новообразований [1–2]. В отличие от коротковолнового и средневолнового (280–315 нм), УФ-A излучение слабо поглощается ДНК и индуцирует повреждения ее структуры преимущественного через генерацию активных форм кислорода и азота [3–4].
Большинство работ по изучению биологического действия УФ-А излучения сосредоточенно на эффектах в клетках базального слоя кожи. Однако, в отличие от более коротковолнового УФ излучения, УФ-А излу-
чение проникает в глубокие слои кожи и оказывает воздействие на дерму, которая богата капиллярами. При этом происходит облучение клеток периферической крови, в том числе и лимфоцитов. Тем не менее, до настоящего времени, работы, посвященные изучению ДНК повреждающего действия УФ-А излучения на лимфоциты крови, были единичны [5–7].
Цель нашей работы : исследования количественного выхода однонитевых разрывов (ОР) и щелочнолабильных сайтов (ЩС) ДНК, индуцированных 365 нм УФ излучением в лимфоцитах периферической крови человека в сравнении с выходом этих повреждений при воздействии рентгеновского излучения.
Выбор рентгеновского излучения в качестве агента сравнения был обусловлен хорошей изученностью механизмов его ДНК повреждающего действия.
Материал и методы. Для исследований использовалась кровь физически здоровых мужчин-доноров в возрасте 21–28 лет. Забор периферической крови проводили в K2ЭДТА-вакутейнеры (Vacuette). У всех доноров было получено согласие на проведение данного исследования.
Выделение лимфоцитов крови человека проводили путем центрифугирования в градиенте плотности фикол-верографин (Histopaque, Sigma-Aldrich) в соответствии с прилагаемой инструкцией. После выделения лимфоциты отмывали и ресуспензировали в фосфатно-солевом буфере до конечной концентрации 1x106 клеток/мл.
200 мкл суспензии клеток смешивали с 600 мкл 1 % раствора легкоплавкой агарозы (Thermo Scientific, TopVision Low Melting Point Agarose) в фосфатно-солевом буфере (рН 7,4) при температуре 37,5ºС. 75 мкл полученной смеси наносили на предварительно покрытые слоем 1 % нормоплавкой агарозы предметные стекла, накрывали покровными стеклами и оставляли на 10 мин при 4ºC до образования плотного геля.
Слайды с иммобилизованными в агарозу клетками помещали в холодный (4ºС) фосфатно-солевой буфер (рН 7,4). Жизнеспособность клеток контролировали с помощью двойной флуоресцентной окраски акридиновым оранжевым и йодистым пропидием согласно общепринятой методике [8]. В этих условиях клетки сохраняли жизнеспособность (не более 5% погибших клеток) в течение нескольких часов. Время самих экспериментов не превышало 15 мин.
Облучение клеток рентгеновскими лучами в дозах 1–5 Гр проводили на рентгеновской биологической установке РУБ РУСТ-М1 (Россия) при мощности дозы 0,85 Гр/мин и температуре 4˚C (для охлаждения использовались термогранулы LAB ARMOR BEADS).
Для ультрафиолетового облучения использовали установку BLX-365 (Bio-Link), длина волны 365±10 нм. Облучение проводилось при 4°С в дозах 5–20 кДж/м2. Интенсивность излучения — 2,92 кДж/м2 за 1 мин.
Анализ ОР и ЩС ДНК проводили с использованием метода ДНК-комет в щелочных условиях [9, 10]. Коротко: сразу после облучения (10–15 сек) агарозные слайды переносили в холодный (4˚C) лизирующий буфер (2.5 M NaCl, 100 мM Na2EDTA, 20 мM Tris-HCl, pH 10.0, 1% Triton X-100 и 10% DMSO) и выдерживали в течение 1 ч в темноте при 4˚C. После лизиса клеток слайды помещали в холодный (4˚C) щелочной раствор (300 мM NaOH, 1 мM EDTA, рН>13) и выдерживали 20 мин для расплетания (щелочной денатурации) нитей ДНК. Электрофорез проводили в щелочном буфере при напряжении 0,75 В/см при комнатной температуре в течение 20 мин. После электрофореза проводили нейтрализацию для ренатурации (восстановления нативности) ДНК (3-кратная промывка в 0,4 М Трис-НСl буфере, рН 7.4). Затем слайды слегка подсушивали и фиксировали в 70% этаноле в течение 10 мин. Для окраски ДНК использовали SybrGreen I (Invitrogen). Визуализацию и документирование микроизображений ДНК-комет проводили с помощью микроскопа люминесцентного микроскопа Axioscop-40 FL (Carl Zeiss) и видеосистемы на основе цифровой камеры MRс 5 (Carl Zeiss) с программой AxioVision 4.8 (Carl Zeiss). На каждом слайде регистрировали по 100 комет. Обрабатывали по 3 слайда от каждого донора на экспериментальную точку. Для анализа и обработки ДНК-комет использовали программу СASP 1.2.2 (СASPlab). В качестве критерия поврежденности ДНК использовали % ДНК в хвосте.
Статическая обработка результатов проводилась с использованием пакета статистических программ Statistica 8.0 (StatSoft). Результаты исследований представлены как среднее арифметическое результатов трех независимых экспериментов ± стандартная ошибка.
Результаты. Для того чтобы минимизировать вклад клеточных метаболических процессов (продукция свободных радикалов в митохондриях, эксцизионная репарация ДНК) в наблюдаемые эффекты, облучение клеток проводилось при низкой температуре (4°С), а сам анализ повреждений ДНК выполнялся сразу (10–15 сек) после облучения. Для количественной оценки ОР и ЩС ДНК была использована щелочная версия метода ДНК-комет (метод гель-электрофореза ДНК единичных клеток). Этот метод отличается высокой чувствительностью и позволяет анализировать изменения количества ОР и ЩС ДНК при дозах редкоионизирующего излучения всего 5–10 сГр [11]. После щелочной денатурации (рН>13) ДНК, иммобилизованных в агарозу клеток проводится электрофорез, во время которого петли и фрагменты ДНК мигрируют в геле агарозы к аноду, создавая своеобразный «хвост». Таким образом, % ДНК в хвосте ДНК-комет отражает степень повреж-денности ДНК.
На рис. 1 представлены результаты исследований выхода ОР и ЩС ДНК в лимфоцитах периферической крови человека при их облучении in vitro рентгеновским излучением в дозе 1–5 Гр. Зависимость «доза — эффект» хорошо описывается линейной функцией у =5,94+6,60 x (R2=0,99), где у — % ДНК в хвосте комет, а x — доза облучения в Гр.
При воздействии 365 нм УФ излучения в дозах 5–20 кДж/м2 также наблюдается линейное увеличение % ДНК в хвосте комет во всем изученном диапазоне доз (рис. 2). Зависимость «доза — эффект» для УФ излучения аппроксимируется линейной функцией
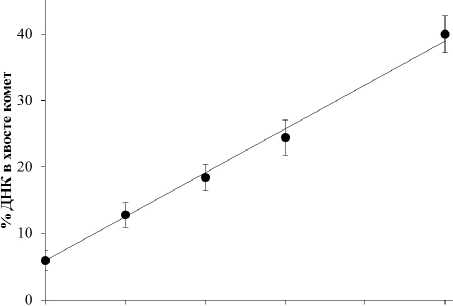
Доза, Гр
Рис. 1. Зависимость изменений относительного количества ОР и ЩС ДНК (% ДНК в хвосте) в лимфоцитах периферической крови человека от дозы рентгеновского излучения
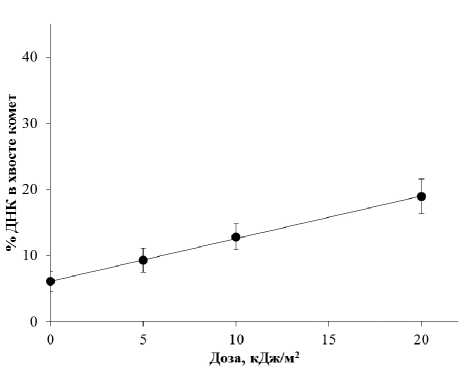
Рис. 2. Зависимость изменений относительного количества ОР и ЩС ДНК (% ДНК в хвосте) в лимфоцитах периферической крови человека от дозы ультрафиолетового излучения с длиной волны 365 нм у=6,08+0,65x (R2=0,99), где у — % ДНК в хвосте комет, а x — доза облучения кДж/м2.
Обсуждение. Ионизирующее излучение повреждает ДНК как при прямом попадании кванта или частицы в молекулу ДНК (непосредственная передача энергии молекуле ДНК и молекулам воды, вплотную прилегающим к ДНК), так и косвенно, индуцируя свободные радикалы (преимущественно HO•), вызывающие главным образом модификацию оснований и однонитевые разрывы ДНК. Известно, что около 70% повреждений ДНК можно предотвратить добавлением низкомолекулярных антиоксидантов, нейтрализующих HO• [12].
В живых клетках энергия УФ-А излучения поглощается различными фотосенсибилизаторами, например эндогенным меланином [13], белками, содержащими порфирины, гемы, хиноны или флавины [14]. В процессе фотоокислительной реакции I типа возбужденный сенсибилизатор принимает электрон (или атом водорода) непосредственно от находящейся вблизи молекулы. По реакции I типа в ДНК происходит в основном окисление наиболее реакционного основания — гуанина с образованием 8-оксо-7,8-дигидрогуанина (8-оксо-гуанина) [15]. В ходе фотоокислительной реакции II типа происходит образование синглетного кислорода (основной путь) и супероксид-анион радикала (минорный путь) [16]. Синглетный кислород, взаимодействуя с ДНК, также в конечном счете индуцирует образование 8-ок-со-гуанина [17], в то время как супероксид-анион в реакциях спонтанной и ферментативной дисмутации образует перекись водорода, которая затем в реакциях Фентона и Габера — Вейса генерирует ОН• радикал, индуцирующий ОР и ЩС ДНК [18]. Таким образом, механизм образования ОР и ЩС ДНК при воздействии УФ-А излучения сходен с механизмом действия редкоионизирующего излучения.
При сравнительном анализе кривых «доза — эффект», полученных при воздействии рентгеновского и 365 нм УФ излучений (см. рис. 1 и 2 соответственно), нами было показано, что эффект воздействия 365 нм УФ излучения в дозе 10 кДж/м2 соответствует эффекту рентгеновского излучения в дозе 1 Гр. Известно, что при воздействии редкоионизирующего излучения в дозе 1 Гр в клетке образуется ~1000 ОР ДНК [19], то есть мы можем предварительно заключить, что воздействие 365 нм УФ излучения в дозе 1 кДж/м2 в расчете на одну клетку индуцирует ~100 ОР ДНК.
Заключение. В результате сравнительных исследований количественного выхода ОР и ЩС ДНК, индуцированных 365 нм УФ излучением и рентгеновским излучением в лимфоцитах периферической крови человека, впервые было показано, что выход ОР и ЩС ДНК при воздействии 365 нм УФ излучения в дозе 10 кДж/м2 соответствует эффекту рентгеновского излучения ~ в дозе 1 Гр. На основании результатов проведенных исследований и литературных данных о выходе ОР ДНК при воздействии редкоио-низирующего излучения сделано заключение о том, что воздействие 365 нм УФ излучения в дозе 1 кДж/м2 индуцирует ~100 ОР ДНК на клетку.
Список литературы Сравнительные исследования выхода однонитевых разрывов и щелочнолабильных сайтов ДНК при воздействии 365 нм ультрафиолетового и рентгеновского излучений на лимфоциты периферической крови человека
- Chronic UVA irradiation of human HaCaT keratinocytes induces malignant transformation associated with acquired apoptotic resistance/Y.Y. He, J. Pi, J.L. Huang [et al.]//Oncogene. 2006. Vol. 25. P. 3680-3688
- Ridley A.J., Whiteside J.R., McMillan T. J., Allinson S. L. Cellular and sub-cellular responses to UVA in relation to carcinogenesis//Int. J. Radiat. Biol. 2009. Vol. 85 (3). P. 177-195
- UV irradiation increases ROS production via PKCdelta signaling in primary murine fibroblasts/O. Bossi, M. Gartsbein, M. Leitges [etal.]//Cell Biochem. 2008. Vol. 105(1). P. 194-207
- Cooper K. L, Liu K.J., Hudson L.G. Enhanced ROS production and redox signaling with combined arsenite and UVA exposure: contribution of NADPH oxidase//Free Radical Biol. Med. 2009. Vol. 47 (4). P. 381-388
- Najafzadeh M., Baumgartner A., Gopalan R. [et al.] In vitro sensitivities to UVA of lymphocytes from patients with colon and melanoma cancers and precancerous states in the micronucleus and the Comet assays//Mutagenesis. 2012. Vol. 27 (3). P. 351-357
- DNA damage after acute exposure of mice skin to physiological doses of UVB and UVA light/A.R. Svobodova, A. Galandakova, J. Sianska [et al.]//Arch. Dermatol. Res. 2012. Vol. 304(5). P. 407-412
- Сметанина H.M., Пустовалова M.B., Осипов A. H. Модифицированный метод ДНК-гало для оценки повреждений ДНК, индуцированных различными генотоксическими агентами//Радиационная биология: Радиоэкология. 2013. Т. 53, № 4. С. 389-393
- Mascotti К., McCullough J., Burger S. R. HPC viability measurement: trypan blue versus acridine orange and propidium iodide//Transfusion. 2000. Vol. 40 (6). P. 693-696
- Оценка молекулярных и цитогенетических эффектов хронического воздействия низкоинтенсивного у-излучения у мышей/А. Н. Осипов, А. Л. Елаков, П. В. Пучков [и др.]//Генетика. 2002. Т. 38, № 10. С. 1345-1350
- Мязин А.Е., Осипов А. Н., Елаков А. Л., Сыпин В. Д., Шевченко В. А. Оценка методом ДНК-комет однонитевых разрывов ДНК лимфоцитов селезенки в отдаленные сроки после острого облучения мышей в сублетальных и среднелетальных дозах//Радиационная биология: Радиоэкология. 2002. Т. 42, вып. 6. С. 731-734
- Comparison in vivo study of genotoxic action of high versus very low dose-rate y-irradiation/A. N. Osipov, D.Y. Klokov, A. L. Elakov [et al.]//Nonlinearity in Biology, Toxicology and Medicine. 2004. Vol. 2, № 3. P. 223-232
- Roots R., Okada S. Protection of DNA molecules of cultured mammalian cells from radiation-induced single strand scissions by various alcohols and SH compounds//Int. J. of Radiat. Biol. 1972. Vol. 21. P. 329-342
- UVcausationofmelanomainXiphophorusisdominated by melanin photosensitized oxidant production/S. R. Wood, M. Berwick, R.D. Ley [et al.]//Proc. Natl. Acad.Sci. USA. 2006. Vol. 103. P. 4111-4115
- Kawanishi S., Hiraku Y. Sequence-specific DNA damage induced by UVA radiation in the presence of endogenous and exogenous photosensitizers//Curr. Probl. Dermatol. 2001. Vol. 29. P. 74-82
- Cadet J., Douki T. Oxidatively generated damage to DNA by UVA radiation in cells and human skin//J. Invest. Dermatol. 2011. Vol. 131 (5). P. 1005-1007
- Ridley A.J., Whiteside J.R., McMillan T. J., Allinson S. L. Cellular and sub-cellular responses to UVA in relation to carcinogenesis//Int. J. Radiat. Biol. 2009. Vol. 85 (3). P. 177-195
- Singlet oxygen induces oxidation of cellular DNA/J. L. Ravanat, P. Di Mascio, G. R. Martinez [et al.]//J. Biol. Chem. 2001. Vol. 276. P. 40601-40604
- Cadet J., Douki T, Ravanat J. L., Di Mascio P. Sensitized formation of oxidatively generated damage to cellular DNA by UVA radiation//Photochem. Photobiol. Sci. 2009. Vol. 8 (7). P. 903-911
- Ward J. F. DNA damage produced by ionizing radiation in mammalian cells: identities, mechanisms of formation, and reparability//Prog. Nucleic Acid Res.Mol. Biol. 1988. Vol. 35. P. 95-125.


