Сравнительный анализ интеграции аутологичных и аллогенных криоконсервированных сухожилий в канале бедренной кости на модели лабораторных животных
Автор: Будаев А.А., Тропская Н.С., Боровкова Н.В., Файн А.М., Титова Г.П., Макаров М.С., Ваза А.Ю., Пономарев И.Н., Кислякова Е.А., Кислицына О.С., Офицеров А.А., Кисель Д.А., Сторожева М.В., Сластинин В.В., Каниболоцкий А.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Донорство и трансплантация органов и тканей
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Актуальность. Трансплантаты на основе аллогенных сухожилий являются востребованными при проведении пластики связок коленного сустава. В НИИ СП им. Н.В. Склифосовского разработан способ криоконсервирования аллогенных сухожилий, включающий стерилизацию сверхкритическим диоксидом углерода. Доказано, что криоконсервированные сухожилия сохраняют нормальную структуру волокон без значительной потери механических свойств. Для последующего клинического применения важной является оценка интеграции криоконсервированных аллогенных сухожилий внутри костного канала на модели экспериментальных животных. Цель исследования: провести сравнительный анализ изменения морфологии аутологичных и аллогенных сухожилий в канале бедренной кости у крыс и определить влияние трансплантации сухожилия на физическую активность животных.Материал и методы. Исследование проводили на белых беспородных крысах-самцах. Сформировано три группы животных: контрольная (животные без трансплантации сухожилия), 1-я опытная группа - животные с трансплантацией аутологичного сухожилия, 2-я опытная группа - животные с трансплантацией аллогенного сухожилия. У животных опытных групп формировали сквозной канал в дистальном метаэпифизе бедренной кости и помещали туда трансплантат сухожилия хвоста размером 0,5×0,1 см. Для оценки физической активности животных использовали тредмил-тест и определяли максимальную дистанцию, которую животные могли пробежать через 3 и 6 недель после трансплантации. Структуру трансплантатов оценивали на гистологических препаратах в проходящем свете, окрашенных гематоксилин-эозином и по Ван-Гизону. Для оценки сохранности коллагеновых волокон определяли интенсивность автофлуоресценции коллагена.Результаты. По данным тредмил-теста, дистанция, пробегаемая животными обеих опытных групп, достоверно не отличалась от значений в контрольной группе. При гистологическом анализе через 3 недели в обеих опытных группах в структуре трансплантата обнаружены признаки декомпактизации волокон при отсутствии воспалительной инфильтрации и сохранении тесного контакта с трабекулами кости. Интенсивность автофлуоресценции коллагеновых волокон была близкой к норме. Через 6 недель у животных обеих опытных групп выявляли участки сращения трансплантата с собственной костью, активно формировались шарпеевские волокна. В обеих группах в зоне контакта сухожилий с костью визуализировали многочисленные мелкие сосуды диаметром до 10 мкм. Инфильтрация трансплантатов клетками воспаления отсутствовала или была очень незначительной, активной миграции фибробластов в область сухожилия также не наблюдали. В опытных группах трансплантаты сухожилий имели зоны декомпактизации волокон. В зоне контакта с костью автофлуоресценция волокон сухожилий была резко увеличена, что говорит о химическом расщеплении коллагена. Через 3 и 6 недель после трансплантации в обеих опытных группах наблюдали эффект фиксации (интеграции) сухожилия с костной тканью.Выводы. Трансплантаты аллогенных сухожилий не вызывали выраженной воспалительной или иммунной реакции у экспериментальных животных. Через 6 недель после трансплантации аутологичных и аллогенных сухожилий имелась интеграция трансплантатов внутри канала бедренной кости. Аллогенные сухожилия, консервированные по предложенной методике, способны интегрироваться в ткани реципиента без выраженных структурно-функциональных нарушений. По данным тредмил-теста, дистанция, пробегаемая животными обеих опытных групп, статистически значимо не отличалась от значений в контрольной группе (без трансплантации сухожилия) через 3 и 6 недель.
Трансплантаты сухожилий, тредмил-тест, коллагеновые волокна, автофлуоресценция, интеграция
Короткий адрес: https://sciup.org/143182956
IDR: 143182956 | УДК: 617-089.844:615.36:611-013.85-032 | DOI: 10.20340/vmi-rvz.2024.2.TX.1
Текст научной статьи Сравнительный анализ интеграции аутологичных и аллогенных криоконсервированных сухожилий в канале бедренной кости на модели лабораторных животных
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that the rules for the treatment of animals are observed when they are used in biomedical research.
Cite as: Budaev A.A., Tropskaya N.S., Borovkova N.V., Fayn A.M., Titova G.P., Makarov M.S., Vaza A.Yu., Ponomarev I.N., Kislyakova E.A., Kis-litsyna O.S., Ofitserov A.A., Storozheva M.V., Slastinin V.V., Kanibolotskiy A.A., Kisel' D.A. Comparative analysis of the integration of autologous and allogeneic cryopreserved tendons in the femoral canal on a model of laboratory animals. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2024;14(2):131–139.
Актуальность
Артроскопическая пластика связок коленного сустава является одной из самых часто выполняемых операций в России за последние 5 лет [1]. Это направление также является актуальным в общемировой практике [2-4]. В качестве пластического материала, как правило, используют собственные (аутологичные) ткани [3, 4]. В то же время перспективным направлением является использование аллогенных трансплантатов, которое позволяет избежать дополнительной травматизации пациента и сокращает время хирургического вмешательства. Ограничения к широкому использованию аллогенных сухожилий для пластики обусловлены отсут- ствием стандартных методик их консервирования и стерилизации [1–7]. Применяемый в некоторых банках тканей метод консервации, основанный на де-целлюляризации сухожилий с последующей лиофилизацией и стерилизацией гамма лучами, нарушает нативную организацию межклеточного матрикса сухожилий, в первую очередь, гликозаминогликанов и эластиновых волокон. Это приводит к снижению механических характеристик и функциональных параметров трансплантатов [5–8]. В связи с этим актуальным является выбор эффективного способа консервирования трансплантатов сухожилий. На базах ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ» и ФГБУН ИНЭОС им. А.Н. Несмеянова РАН предло- жен способ стерилизации сухожилий, который включает обработку сухожилий криоконсервантом, стерилизацию сверхкритическим диоксидом углерода в криопакете с последующим хранением при – 80 °С [9]. Показано, что консервированные таким образом трансплантаты сохраняли структуру волокон без значительной потери механических свойств [10]. На следующем этапе необходимо оценить изменение структуры консервированных аллогенных сухожилий в костном канале на модели in vivo. Интеграция ткани сухожилий включает процессы перестройки коллагеновых волокон, реваскуляризации и ревитализации матрикса, внедрение коллагеновых волокон в кость [11]. Также было важно оценить двигательную активность у животных с трансплантатами сухожилий. Исследование этих процессов является очень важным для разработки трансплантатов аллогенных сухожилий с высокой клинической эффективностью.
Цель работы: провести сравнительный анализ изменения морфологии аутологичных и аллогенных сухожилий в канале бедренной кости у крыс и определить влияние трансплантации сухожилия на физическую активность животных.
Материал и методы
При выполнении исследования были соблюдены требования приказа МЗ СССР № 755 от 12.08.1977 г. «О мерах по дальнейшему совершенствованию ор- ганизационных форм работы с использованием экспериментальных животных», приложения к приказу МЗ СССР № 755 от 12.08.1977 г. «Правила проведения работ с использованием экспериментальных животных» и Федерального закона, принятого Государственной Думой 01.12.1999 г., «О защите животных от жестокого обращения». Содержание экспериментальных животных и уход за ними в условиях вивария были стандартными и соответствовали требованиям Европейской конвенции (Страсбург, 1986) и Хельсинской декларации Всемирной медицинской ассоциации о гуманном обращении с животными.
Также было получено разрешение комитета по биомедицинской этике Государственного бюджетного учреждения здравоохранения «Научноисследовательский институт скорой помощи имени Н.В. Склифосовского Департамента здравоохранения города Москвы» протокол № 2-23 от 28.03.2023 г.
Исследование проводили на 25 белых беспородных крысах-самцах, массой тела от 250 до 300 г. Сформировано три группы животных: контрольная (животные без трансплантации сухожилия, n = 5), и две опытные группы: 1 группа – животные с трансплантацией аутологичного сухожилия (n = 10), 2 группа – животные с трансплантацией аллогенного сухожилия (n = 10). У животных опытных групп формировали сквозной канал в дистальном метаэпифизе бедренной кости и помещали туда трансплантат сухожилия хвоста размером 0,5 х 0,1 см (рис. 1).
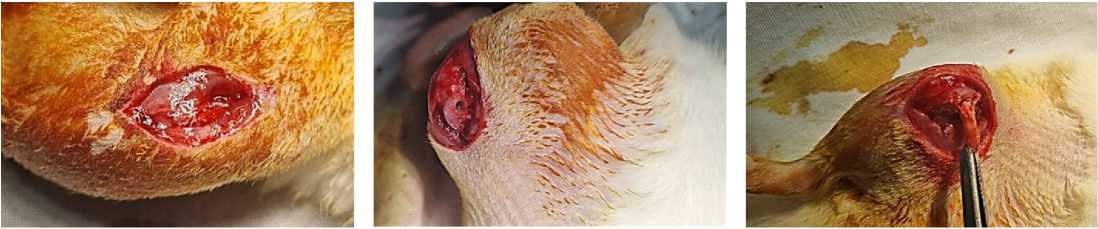
А Б В
Рисунок 1. Этапы операции: А – хирургический доступ, Б – формирование сквозного канала, В – установка трансплантата Figure 1. The stages of the operation: A – surgical access, Б – formation of a through channel, В – graft installation
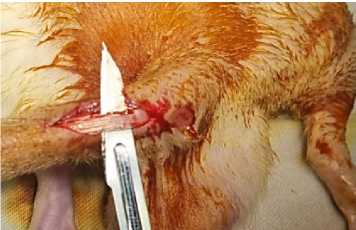
Рисунок 2. Эксплантация аутологичного сухожилия хвоста крысы
Figure 2. Explantation of an autologous rat tail tendon
В первой опытной группе (10 животных) в канал помещали фрагмент аутологичного сухожилия хвоста, забранного непосредственно перед трансплантацией (рис. 2). Во второй опытной группе (10 животных) трансплантировали аллогенные сухожилия, заготовленные заранее (рис. 3).
До трансплантации аллогенные сухожилия стерилизовали сверхкритическим диоксидом углерода с медленной декомпрессией газа, и хранили при температуре –80 °С с криоконсервантом (10 % диметилсульфоксид). Размораживали аллогенные трансплантаты непосредственно перед экспериментом при +4 °С и отмывали физиологическим
0,9 % раствором хлорида натрия в течении 10 минут. Выведение животных осуществляли через 3 и 6 недель после операции по 5 крыс в каждой опытной группе. Перед выведением животных из эксперимента оценивали визуально и пальпаторно болезненность донорской зоны, заживление послеоперационных ран. Гистологические препараты области трансплантации сухожилия готовили по стандартной методике с окрасками гематоксилин-эозином и по Ван-Гизону. Для оценки сохранности коллагеновых волокон определяли интенсивность автофлуоресценции коллагена, MFI (фут-кандел) [12].
Для оценки физической активности животных использовали установку Treadmill Panlab (Harvard Apparatus, США) (рис. 4). В ходе тестирования применили протокол с постепенным наращиванием скорости вращения ленты тредмила – каждые 30 сек на 5 м/мин до достижения скорости 40 м/мин [13, 14]. Стимуляцию в виде электроимпульса постоянного тока проводили с силой тока 1,2 А при касании животным края платформы. Во всех группах число стимуляций составляло от 30 до 60. В ходе тестирования оценивали дистанцию, которую пробежало животное за время тестирования (м). Точкой окончания теста для каждого животного была невозможность продолжать бег.
Для статистической обработки вычисляли медиану (Ме), 1-й и 3-й квартили (25 %; 75 %). Для сравнения количественных данных использовали U-критерий Манна – Уитни для независимых переменных. Различия считали достоверными при р < 0,05.
Результаты
В послеоперационном периоде при физикальном исследовании крыс было отмечено, что наличие донорской раны на хвосте у крыс 2-й опытной группы негативно сказывалось на их подвижности (крысы щадили хвост, он не помогал держать равновесие при движениях) на обоих сроках наблюдения.
По данным тредмил-теста, дистанция, пробегаемая животными обеих опытных групп, статистически значимо не отличалась от значений в контрольной группе (без трансплантации сухожилия) через 3 и 6 недель (табл. 1).
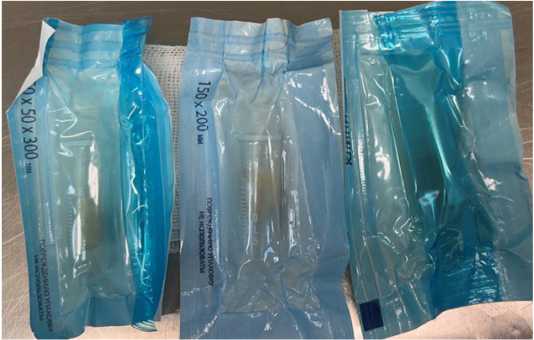
Рисунок 3. Упакованные и простерилизованные образцы аллогенных сухожилий крысы
Figure 3. Packaged and sterilized samples of rat allogeneic tendons

А

Б
Рисунок 4. Установка для оценки физической активности животных: закрытая куполом беговая дорожка (А) и блок управления (Б) Figure 4. Installation for assessing the physical activity of animals: a dome-enclosed treadmill (A) and a control unit (Б)
Таблица 1. Сравнительный анализ физической активности животных
Table 1. Comparative analysis of physical activity of animals
|
Группы |
Средняя дистанция, пробегаемая животными, м Me (25; 75) % |
p-критерий |
|
|
Контроль (интактные животные) |
49 (19; 69) |
– |
|
|
Животные с аутологичным трансплантатом Животные с аллогенным трансплантатом |
3 недели |
59 (22; 158) |
p 1 = 0,54 |
|
6 недель |
39 (24; 64) |
p 1 = 0,12 |
|
|
3 недели |
48 (28; 108) |
p 1 = 0,79 p 2 = 0,92 |
|
|
6 недель |
56 (53; 98) |
p 1 = 0,35 p 2 = 0,14 |
|
Примечание: р 1 – относительно контроля; р 2 – относительно группы с аутологичным трансплантатом.
Таким образом, результаты тредмил-теста у животных всех трёх сравниваемых групп существенно не изменялись и соответствовали нормальным значениям, приводимым в литературных источниках [14].
При гистологическом анализе через 3 недели в обеих опытных группах на препаратах в проходящем свете и при автофлуоресценции коллагена подтверждена локализация трансплантата сухожилия в костном канале. Гистологически в структуре аутотрансплантата обнаружены признаки разобщения пучков коллагена в центре с разволокнением коллагеновых волокон по периферии в зоне контакта с костью и снижением их фуксинофилии (рис. 5).
В структуре части аллотрансплантата в отдельных участках терялась регулярная ориентация коллагеновых волокон, резко снижалась фуксинофилия при сохранении тесного контакта сухожилий с трабекулами кости (рис. 6).
При этом в обеих группах инфильтрация клетками воспаления отсутствовала или была слабовыра-женной. Оценка автофлуоресценции показала, что коллагеновые волокна сохраняли параллельную ориентацию (рис. 7). Средняя интенсивность автофлуоресценции (MFI) коллагеновых волокон транс- плантата соответствовала норме или была близкой к норме (32–37 фут-кандел).
Через 6 недель у животных обеих опытных групп гистологически выявлены участки сращения трансплантата с собственной костью. Заметно увеличилось обнаружение крупных интенсивно фуксинофильных пучков коллагена (шарпеевских волокон) вблизи места введения трансплантата в костную ткань (рис. 8).
В обеих группах в зоне контакта сухожилий с костью отмечены многочисленные мелкие сосуды диаметров до 10 мкм. При этом инфильтрация трансплантатов клетками воспаления отсутствовала или была очень незначительной, миграция фибробластов в область сухожилия также не выявлена. В обеих группах трансплантаты сухожилий имели зоны, где наблюдали диффузное разволокнение пучков коллагена на четко контурирующиеся волокна с сохранением их фукси-нофилии, с отсутствием капсулы от костной ткани и врастанием трабекул губчатой кости в сухожилие (эффект ремоделирования) (рис. 9).
Подобные изменения наблюдали и в аллотрансплантатах, отличавшиеся интенсивной васкуляризацией сухожилия вне контакта с костью (рис. 10, А, Б).
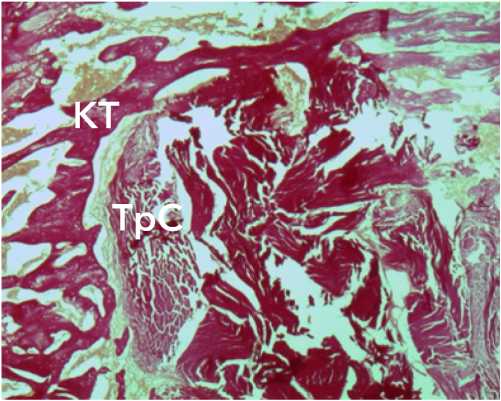
Рисунок 5. Морфологические изменения аутотрансплантата через 3 недели после трансплантации: краевое разобщение коллагеновых волокон. Окраска по Ван-Гизону. Ув.×34. Условные обозначения: КТ – костные трабекулы, ТрС – трансплантат сухожилия
Figure 5. Morphological changes in the autograft 3 weeks after transplantation: marginal separation of collagen fibers. Van Gieson staining. Magn.×34. Legend: CT – bone trabeculae, TrS – tendon graft
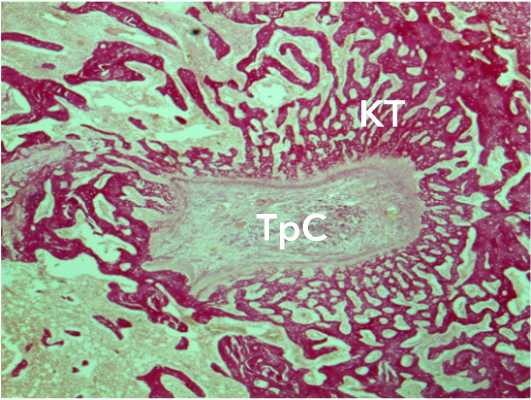
Рисунок 6. Морфологические изменения аллотрансплантата через 3 недели после трансплантации: зона фрагментации и снижения фуксино-филии коллагеновых волокон. Окраска по Ван-Гизону. Ув.×34. Условные обозначения: КТ – костные трабекулы, ТрС – трансплантат сухожилия Figure 6. Morphological changes in the allograft 3 weeks after transplantation: zone of fragmentation and decreased fuchsinophilia of collagen fibers. Van Gieson staining. Magn .×34. Legend: CT – bone trabeculae, TrS – tendon graft
Б
КТ
ТрС
КТ
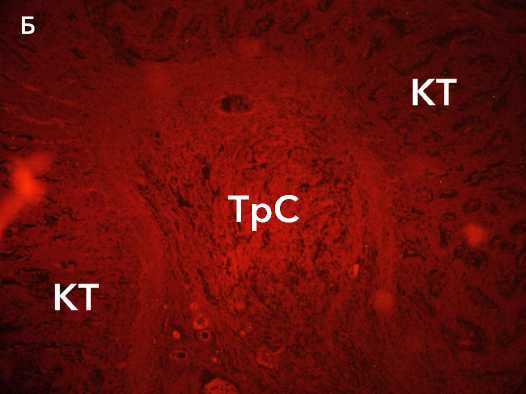
Рисунок 7. Автофлуоресценция коллагеновых волокон в составе аутотрансплантата (А) и аллотрансплантата (Б) через 3 недель после трансплантации. Ув. х 100. Условные обозначения: КТ - костные трабекулы, ТрС - трансплантат сухожилия
Figure 7 . Autofluorescence of collagen fibers in the autograft (A) and allograft (Б) 3 weeks after transplantation. Magn. × 100. Legend:
CT – bone trabeculae, TrS – tendon graft
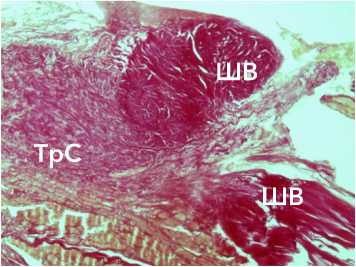
Рисунок 8. Формирование крупных коллагеновых волокон (шар-пеевские волокна) в области контакта аутотрансплантата с костью. Окраска по Ван-Гизону. Ув. х 34. Условные обозначения: ШВ - шар-пеевские волокна, ТрС – трансплантат сухожилия
Figure 8. Formation of large collagen fibers (Sharpey's fibers) in the area of contact of the autograft with the bone. Van Gieson staining. Magn.×34. Legend: SHV – Sharpey fibers, TrS – tendon graft
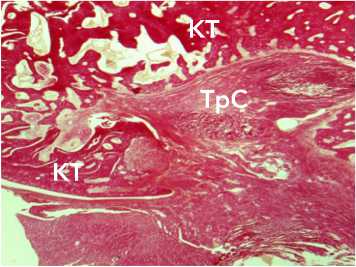
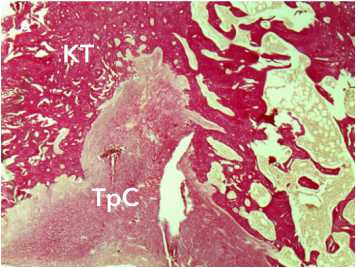
Рисунок 9. Морфологические изменения аутотрансплантата через 6 недель после трансплантации. Окраска по Ван-Гизону. Ув. х 34. Наблюдается разобщение пучков коллагеновых волокон и тесный контакт с трабекулами кости. Условные обозначения: КТ – костные трабекулы, ТрС – трансплантат сухожилия
Figure 9. Morphological changes in the autograft 6 weeks after transplantation. Van Gieson staining. Magn.×34. There is separation of the collagen fiber bundles and close contact with the bone trabeculae. Legend: CT – bone trabeculae, TrS – tendon graft
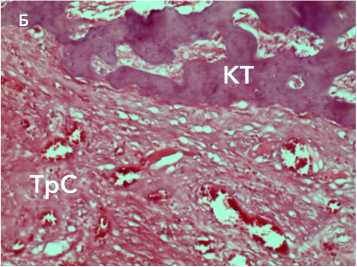
Рисунок 10. Морфологические изменения аллотрансплантата через 6 недель после трансплантации: А – разобщение пучков коллагеновых волокон и тесный контакт трансплантата с трабекулами кости, окраска по Ван-Гизону, ув. х 34; Б - васкуляризация трансплантата сухожилия, окраска гематоксилином и эозином, ув. х 100. Условные обозначения: КТ - костные трабекулы, ТрС - трансплантат сухожилия Figure 10. Morphological changes in the allograft 6 weeks after transplantation: A – separation of collagen fiber bundles and close contact of the graft with bone trabeculae, Van Gieson staining, magnification ×34; B – vascularization of the tendon graft, staining with hematoxylin and eosin, Magn. × 100. Legend: CT – bone trabeculae, TrS – tendon graft
А
КТ
ТрС
КТ
ТрС
КТ
Б
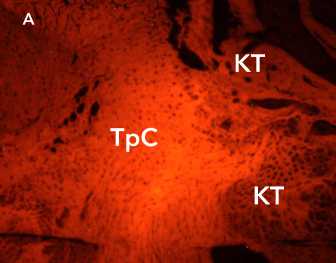
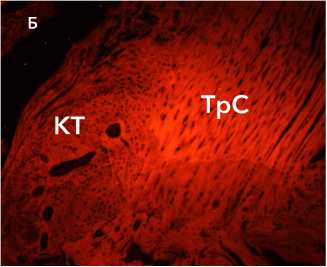
Рисунок 11. Автофлуоресценция коллагеновых волокон в составе аутотрансплантата (А) и аллотрансплантата (Б) через 6 недель после трансплантации. Ув. х 100. Условные обозначения: КТ – костные трабекулы, ТрС – трансплантат сухожилия
Figure 11. Autofluorescence of collagen fibers in the autograft (A) and allograft (B) 6 weeks after transplantation. Magn .×100. Legend: CT – bone trabeculae, TrS – tendon graft
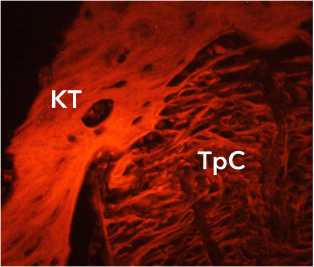
ТрС
КТ
Рисунок 12. Декомпактизация и химическая деформация волокон аллотрансплантата через 6 недель после трансплантации. Автофлуоресценция коллагена. Ув. х 400. Условные обозначения: КТ – костные трабекулы, ТрС – трансплантат сухожилия Figure 12. Decompaction and chemical deformation of allograft fibers 6 weeks after transplantation. Autofluorescence of collagen. Magn ×400. Legend: CT – bone trabeculae, TrS – tendon graft
В зоне тесного контакта трансплантатов сухожилий с костью значение MFI собственных коллагеновых волокон сухожилий было заметно увеличено и превышало 50–60 фут-кандел, что говорит о химическом расщеплении коллагена (рис. 11, А, Б).
В структуре сухожилий выявлены многочисленные участки, где MFI коллагеновых волокон снижался до 15–20 фут-кандел. Снижение MFI указывает на декомпактизацию волокон, которая может быть вызвана перестройкой сухожилия. У животных с аллогенными трансплантатами уровень MFI был неравномерным по всей длине волокон, выявлены области со сниженным MFI, а также короткие фрагменты отдельных волокон с яркостью более 60 фут-кандел (рис. 12).
Таким образом, на основании гистологического и гистохимического (окраска по Ван-Гизону) изучения экспериментального материала ауто- и аллотрансплантата сухожилия через 3 и 6 недель после операции независимости от разной степени выраженности деградации коллагена был достигнут эффект фиксации (интеграции) сухожилия с костной тканью, врастающей в сухожилие.
Обсуждение
По данным литературы, процесс ремоделирования сухожилий, трансплантированных в костный канал, начинается через 4 недели с момента операции [6–8]. Этот процесс включает активную миграцию клеток, в т.ч. мультипотентных, активный рост сосудов. Большую роль в процессе ремоделирования играют факторы роста и цитокины. Их источником могут быть разные клетки: фибробласты, остеобласты, мультипотентные клетки, эндотелиоциты, макрофаги [11]. В проведённом исследовании нам не удалось выявить выраженную миграцию клеток через 6 недель с момента трансплантации. С другой стороны, на гистологических препаратах отчетливо выявлялись шарпеевские волокна и многочисленные новообразованные сосуды, которые можно было видеть, как в проходящем свете, так и при регистрации автофлуоресценции коллагена. Примечательно, что в зоне роста сосудов коллагеновые волокна были подвержены химическому расщепле- нию, что выражалось в значительном увеличении MFI таких волокон. Аллогенные сухожилия не стимулировали развитие иммунологической или воспалительной реакции. Считается, что иммуногенность трансплантатов в значительной степени тормозит их ремоделирование [11]. В нашем исследовании мы не наблюдали инфильтрации области аллогенных крио-консервированных сухожилий лимфоцитами, что указывает на их низкую иммуногенность. Рост шар-пеевских волокон является нормальным процессом регенерации кости [7]. Аутологичные и аллогенные трансплантаты не препятствовали восстановлению кости у исследуемых животных. Анализ двигательной активности по результатам тредмил-теста показал, что двигательная активность через 6 недель после операции полностью восстанавливалась. Значимой разницы между исследуемыми группами не выявлено. Таким образом, реабилитационной период после трансплантации аллогенных сухожилий требовал столько же времени, как и после использования аутологичных трансплантатов.
Выводы
Трансплантаты аллогенных сухожилий, помещённые в канал дистального метаэпифиза бедренной кости, не вызывали выраженной воспалительной или иммунной реакции у экспериментальных животных. Через 6 недель после трансплантации аутологичных и аллогенных сухожилий наблюдалась интеграция трансплантатов внутри канала бедренной кости. В области интеграции аутологичных и аллогенных сухожилий наблюдался рост сосудов. Через 6 недель у экспериментальных животных обеих групп отмечен ранний этап ремоделирования трансплантатов сухожилий на фоне сохранения двигательной активности животных. Аллогенные сухожилия, консервированные по предложенной методике, способны интегрироваться в ткани реципиента без выраженных структурно-функциональных нарушений. Оценка двигательной активности показала, что наличие трансплантата сухожилий в костном канале значимо не влияла на двигательную активность животных.
Список литературы Сравнительный анализ интеграции аутологичных и аллогенных криоконсервированных сухожилий в канале бедренной кости на модели лабораторных животных
- Пупынин Д.Ю., Лычагин А.В., Грицюк А.А. Результаты применения динамической внутрисвязочной стабилизации при разрыве передней крестообразной связки. Кафедра травматологии и ортопедии. 2022;4(50):45-51. Pupynin D.Y., Lychagin A.V., Gritsyuk A.A., The results of the application of dynamic intraligamentous stabilization in case of rupture of the anterior cruciate ligament. Department of Traumatology and Orthopedics. 2022;4:45-51. (In Russ). https://doi.org/10.17238/2226-2016-2022-4-45-51
- Dai W, Leng X, Wang J, Cheng J, Hu X, Ao Y. Quadriceps Tendon Autograft Versus Bone-Patellar Tendon-Bone and Hamstring Tendon Autografts for Anterior Cruciate Ligament Reconstruction: A Systematic Review and Meta-analysis. Am J Sports Med. 2022;50(12):3425-3439. https://doi.org/10.1177/03635465211030259
- Rousseau R., Labruyere C., Kajetanek C., Deschamps O., Makridis K.G., Djian P. Complications After Anterior Cruciate Ligament Reconstruction and Their Relation to the Type of Graft: A Prospective Study of 958 Cases. Am. J. Sports Med. 2019;47:2543-2549. https://doi.org/10.1177/0363546519867913
- Runer A, Csapo R, Hepperger C, Herbort M, Hoser C, Fink C. Anterior Cruciate Ligament Reconstructions With Quadriceps Tendon Autograft Result in Lower Graft Rupture Rates but Similar Patient-Reported Outcomes as Compared With Hamstring Tendon Autograft: A Comparison of 875 Patients. Am J Sports Med. 2020;48(9):2195-2204. https://doi.org/10.1177/0363546520931829
- Шангина О.Р., Булгакова Л.А. Структурные особенности лиофилизированных тканей и возможности их клинического применения. Практическая медицина. 2019;17(1):20-23. Shangina O.R., Bulgakova L.A. Structural peculiarities of lyophilized tissues and possibilities of their clinical application. Practicheskaya Medicina. 2019;17(1):20-23. (In Russ).
- Scheffler S.U., Unterhauser F.N., Weiler A. Graft remodeling and ligamentization after cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2008;16:834-842. https://doi.org/10.1007/s00167-008-0560-8
- Edwards J.H., Jones G.L., Herbert A., Fisher J., Ingham E. Integration and functional performance of a decellularised porcine superflexor tendon graft in an ovine model of anterior cruciate ligament reconstruction. Biomaterials. 2021;279:121204. https://doi.org/10.1016/j.biomaterials.2021.121204
- Yun H.W., Jin Y.J., Shin D.I., Noh S., Kim K.M., Park J.Y., Lim S., Park D.Y. Fibrocartilage extracellular matrix augmented demineralized bone matrix graft repairs tendon-to-bone interface in a rabbit tendon reconstruction model. Biomater Adv. 2023;152:213522. https://doi.org/10.1016/j.bioadv.2023.213522
- Будаев А.А., Николаев А.Ю., Хохлов А.Р., Боровкова Н.В., Бондарев В.Б., Файн А.М., Черненькая Т.В., Макаров М.С., Ваза А.Ю., Андреев Ю.В., Сторожева М.В. Способ и установка для стерилизации трансплантатов сухожилий. Патент на изобретение RU 2802139 C1, 22.08.2023. Заявка № 2022128646 от 04.11.2022. Budaev A.A., Nikolaev A.Yu., Khohlov A.R., Borovkova N.V., Bondarev V.B., Fain A.M., Chernen'kaya T.V., Makarov M.S., Vaza A.Yu., Andreev Yu.V., Storozheva M.V. Method and construction for tendon graft sterilization. RF patent 2802139 C1, 22.08.2023. (In Russ).
- Будаев А.А., Боровкова Н.В., Файн А.М., Николаев А.Ю., Макаров М.С., Сторожева М.В., Скуратовская К.И., Ваза А.Ю., Фомичева И.В., Черненькая Т.В., Каниболоцкий А.А. Оценка эффективности стерилизации аллогенных трансплантатов сухожилий сверхкритическим диоксидом углерода. Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье. 2023;13(4):145-153. Budaev A.A., Borovkova N.V., Fayn A.M., Nikolaev A.Yu., Makarov M.S., Storozheva M.V., Skuratovskaya K.I., Vaza A.Yu., Fomicheva I.V., Chernen'kaya T.V., Kanibolotskiy A^. Evaluation of the effectiveness of allogeneic tendon graft sterilization with supercritical carbon dioxide. Bulletin of the Medical Institute "REAVIZ" (REHABILITATION, DOCTOR AND HEALTH). 2023;13(4):145-153. (In Russ). https://doi.org/10.20340/vmi-rvz.2023.4.TX.2
- De Girolamo L, Ragni E, Cucchiarini M, van Bergen CJA, Hunziker EB, Chubinskaya S. Cells, soluble factors and matrix harmonically play the concert of allograft integration. Knee Surg Sports Traumatol Arthrosc. 2019;27(6):1717-1725. https://doi.org/10.1007/s00167-018-5182-1
- Makarov M.S., Storozheva M.V., Borovkova N.V. Collagen fiber autofluorescence level in evaluating the biological properties of tissue grafts. Sov-remennye tehnologii v medicine. 2017;9(2):83-90. https://doi.org/0.20340/vmi-rvz.2023.4.TX.2/10.17691/stm2017.9.2.10
- Пушкина Т.А., Токаев Э.С., Попова Т.С., Мурашев А.Н., Тропская Н.С., Кислякова Е.А., Шашкова И.Г., Жеребцов А.В. Доклинические исследования эффективности специализированного продукта спортивного питания для коррекции физической работоспособности и психофизиологического состояния при интенсивных нагрузках. Спортивная медицина: наука и практика. 2017;7(3);5-13. Pushkina T., Tokaev E., Popova T., Murashev A., Tropskaya N., Kislyakova E., Shashkova I., Zherebtsov A. Non-clinical studies of the effectiveness of specialized sports nutrition product for correction of physical efficiency and psycho-physiological condition during intensive loads. Sports medicine: research and practice. 2017;7(3):5-13. (In Russ). https://doi.org/10.17238/ISSN2223-2524.2017.3.5.
- Карпов А.А., Аникин Н.А., Черепанов Д.Е., Михайлова А.М., Краснова М.В., Смирнов С.С., Буненков Н.С., Чефу С.Г., Ивкин Д.Ю., Моисеева О.М., Галагудза М.М. Модель хронической тромбоэмболической легочной гипертензии у крыс, вызванная повторным внутривенным введением би-одеградируемых микросфер из альгината натрия. Регионарное кровообращение и микроциркуляция. 2019;18(1):86-95. Karpov A.A., Anikin N.A., Cherepanov D.E., Mihailova A.M., Krasnova M.V., Smirnov S.S., Bunenkov N.S., Chefu S.G., Ivkin D.Y., Moiseeva O.M., Galagudza M.M. Model of chronic thromboembolic pulmonary hypertension in rats, caused by repeated intravenous administration of biodegradable microspheres from sodium alginate. Regional hemodynamics and microcirculation. 2019;18(1):86-95. (In Russ). https://doi.org/10.24884/1682-6655-2019-18-1 -86-95


