Сравнительный анализ эффективности простого и многокомпонентного методов щелочной децеллюляризации на примере очистки волокнистого внеклеточного матрикса дермы
Автор: Калмыкова Нина Владимировна, Демьяненко Илья Александрович, Шевлягина Наталья Владимировна, Андреевская Светлана Георгиевна, Суслов Анатолий Петрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.24, 2016 года.
Бесплатный доступ
Щелочная децеллюляризация является одним из наиболее распространенных методов получения очищенного внеклеточного матрикса (BKM). Тем не менее, в литературе отсутствуют работы, посвященные сравнительному анализу эффективности различных методов щелочной очистки BKM. B настоящей работе было проведено сравнительное исследование влияния простого метода децеллюляризации раствором гидроксида натрия и многкомпонентного метода несколькими различными растворами на основе гидроксида натрия и сульфата натрия на биохимические, морфологические и термомеханические характеристики волокнистого внеклеточного матрикса дермы крупного рогатого скота (KPC), а именно быка домашнего Bos taurus taurus. Показано, что оба метода вызывают эффективное удаление клеточных компонентов из BKM. Однако в образцах, очищенных мнокомпонентньм методом выявлено меньшее количество остаточной дцДНК. Результаты морфологического и термомеханического исследований свидетельствуют о том, что применение многокомпонентной децеллюляризации по сравнению с простой обработкой гидроксидом натрия приводит к уменьшению дезорганизации волокнистой сети BKM с сохранением структуры коллагеновых волокон, а также к увеличению эластичности материала...
Децеллюляризация, внеклеточный матрикс, дерма
Короткий адрес: https://sciup.org/143177144
IDR: 143177144
Текст научной статьи Сравнительный анализ эффективности простого и многокомпонентного методов щелочной децеллюляризации на примере очистки волокнистого внеклеточного матрикса дермы
Введение. Биологические свойства очищенного от клеточных компонентов внеклеточного матрикса (ВКМ) различных тканей, включающие способность к индукции пролиферации, миграции и дифференцировки клеток, а также к активации процессов ремоделирования собственных тканей организма реципиента, обуславливают интенсивное использование медицинских изделий и препаратов на его основе в регенеративной медицине и пластической хирургии [1]. Описано множество способов децеллюляризации тканей путем разнообразных химических и физических воздействий [2]. С одной стороны, применяемая для очистки ВКМ методика в идеале должна обеспечивать максимальную сохранность его трехмерной ультраструктуры, пространственной топологии и химического состава. Однако, поскольку преобладающим источником для изготовления большинства децеллюляризированых матриксов для медицинского применения являются ксеногенные ткани [3], то процедура получения очищенного ВКМ должна обеспечивать отсутствие реакции отторжения ксенотрансплантата при его имплантации в ткани пациента. В связи с этим распространение получили методики децеллюля-ризации на основе обработки ВКМ растворами на основе щелочей. Щелочные растворы вызывают эффективный гидролиз и солюбилизацию клеточных компонентов, а также белков и гликопротеинов ВКМ, чье присутствие в матриксе может провоцировать неблагоприятный ответ организма реципиента. В то же время, использование щелочных растворов может вызывать существенные изменения структурных и термомеханических характеристик матрикса за счет частичных гидролиза и денатурации молекул коллагена, разрушения межмолекулярных сшивок, модификации боковых групп аминокислот, дезорганизации пучков волокон коллагена вследствие чрезмерного набухания [4, 5, 6, 7, 8, 9]. В этой связи, при осуществлении децеллюляризации ВКМ щелочами необходимо контролировать pH используемых растворов и продолжительность очистки для обеспечения приемлемых целостности структуры, биологических, химических и физических параметров. Кроме того, в ряде работ предложено вносить в щелочные растворы для очистки соли сульфатов, что препятствует избыточному набуханию пучков волокон коллагена ВКМ [7, 10, 11]. Таким образом, исследования оптимальных условий получения децеллюляризованного ВКМ путем обработки растворами на основе щелочей является актуальными. В то же время в литературе отсутствуют работы, посвященные сравнительному анализу эффективности различных методов щелочной очистки ВКМ, а также их влияния на его морфологию и основные физические характеристики.
Цель исследования - сравнительная характеристика морфологических, биохимических и термомеханических показателей децеллюля-ризированного ВКМ сетчатого слоя дермы КРС, полученного путем простой щелочной очистки раствором гидроксида натрия и многокомпонентной щелочной очистки несколькими различными растворами на основе гидроксида натрия и сульфата натрия.
Материал и методы исследования.
Изготовление децеллюляризированного ВКМ.
Для изготовления децеллюляризованного ВКМ дермы использовали кожу крупного рогатого скота (КРС), а именно быка домашнего Bos taurus taurus, полученную на предприятии ООО «ПОКС». Забор кожи проводили из чепрачной зоны животных возрастом 16-18 месяцев, имеющих массу шкуры 22-25 кг. Перед химической обработкой кожу промывали водой для удаления механических включений. Затем при помощи двоильной машины удаляли гиподерму и сосочковый слой дермы. Полученный сетчатый слой дермы толщиной 4 мм разрезали на лоскуты размером 20х20 см, которые использовали в дальнейшей работе.
Инкубацию фрагментов дермы в растворах проводили при температуре 20°С в лабораторных стаканах на орбитальном шейкере «SkyLine» (ELMI, Латвия) при 250 об/мин. Соотношение объема растворов к массе образца составляло 20 мл/г.
Процесс децеллюляризации дермы осуществляли двумя различными способами. Каждая экспериментальная группа состояла из четырех лоскутов. Также для исследования использовали четыре фрагмента сетчатого слоя дермы, не прошедшего химическую обработку.
Фрагменты лоскутов первой экспериментальной группы (однокомпонентный метод очистки) обрабатывали раствором 1М NaОH на дистиллированной воде в течении 20-и часов. При этом каждый час проводили замену раствора на свежий. Затем лоскуты дермы извлекали и промывали дистиллированной водой до достижения pH смыва нейтральных значений.
Лоскуты второй экспериментальной группы (многокомпонентный метод очистки) подвергали последовательной обработке 4-я растворами [12]. Сначала образцы инкубировали в солевом растворе 0,35М NaOH в течение 20 часов, затем 20 часов обрабатывали раствором 1,25М NaOH и 1,5М Na2SО4 и отмывали дистиллированной водой в течение 30 мин. После этого лоскуты помещали в раствор 1,3М Na2SO4 на 20 часов и отмывали дистиллированной водой в течение 30 мин. На заключительном этапе для отмывки от солей образцы обрабатывали раствором 1М H3BO3 на протяжении 20 часов, и отмывали дистиллированной водой до достижения pH смыва нейтральных значений. На всем протяжении химической обработки проводили замену всех растворов на свежеприготовленные каждый час.
По окончании процесса очистки образцы обеих экспериментальных групп лиофильно высушивали на приборе Hetosicc (Дания).
Гистологическое исследование.
Для морфологической оценки эффективности удаления клеточных компонентов, а также влияния химической обработки на структуру ВКМ полученные образцы подвергали гистологическому исследованию. Для этого вырезали фрагменты децеллюляризованного различными способами ВКМ, а также сетчатого слоя дермы до обработки, размером 5х5 мм2. Данные фрагменты фиксировали 10% формалином на фосфатном буфере в течение 72 часов. После этого образцы обезвоживали по стандартной методике и заливали в заливочную среду на основе парафина Histomix Extra (Биовитрум, Россия). На микротоме Microm HM 325 (Thermo Scientific, США) изготавливали гистологические срезы толщиной 3 мкм, которые монтировали на предметные стекла с полилизиновым покрытием. Срезы окрашивали гематоксилином и эозином и заключали под покровное стекло в заливочную среду Bio-Mount (Bio Optica, Италия). Полученные препараты анализировали при помощи микроскопа NikonNi-U (Nikon, Япония). Микрофотографии получали при помощи цифровой камеры Nikon DS-Fi1 (Nikon, Япония), вмонтированной в тринокулярную насадку микроскопа.
Сканирующая электронная микроскопия.
Для анализа пространственной структуры образцов ВКМ использовали метод сканирующей электронной микроскопии. Для исследования иссекали фрагменты образцов размером 4х1 мм2 и закрепляли их на алюминиевом столике микроскопа при помощи силикатного клея. Затем образцы анализировали с помощью сканирующего двулучевого электронного микроскопа Quanta 200 3D (FEI Company, USA) с предварительным напылением золотом на модуле “SPI-MODULE Sputter Coater” (SPI Supplies, USA). Толщина слоя золота (проба 999) составила 7 нм. Исследование напыленных образцов проводили в режиме высокого вакуума, при ускоряющем напряжении сканирующего микроскопа 5 кВ. Получали и анализировали изображения перпендикулярно расположенных верхней и боковой поверхностей фрагментов ВКМ. На изображениях верхней поверхности при помощи программы Scadium OLYMPUS (Германия) производили подсчет количества пор и их диаметра на площади образца равной 7,82 мкм2.
Электрофорез в ПААГ в присутствии додецилсульфата натрия по Лэммли.
Для качественной оценки целостности α-цепей молекул тропоколлагена проводили исследование полученных децеллюляризованных ВКМ, а также контрольного образца коллагена
I типа (Sigma, США) методом электрофореза в ПААГ [13]. Для этого образцы в концентрации 10 мг/мл нагревали при 95°C в течение 5 мин в 1М Tris-HCl буфере (pH 6,8), содержавшем 10% SDS, 40% глицерина 14,5 М 2-меркаптоэтанола и 0,01% бромфенолового синего. Затем 7 мкл раствора вносили в лунки концентрирующего геля. Образцы подвергали 1,5 часовому электрофоретическому разделению в концентрирующем (5%) и разделяющем (7,5%) ПААГ в буфере (pH 8,3), содержавшем 25 mM Tris, 250 mM glycine и 0,1% SDS. Напряжение и сила тока при этом составляла 80 V, 20 мА и 120 V, 40 мА в концентрирующих и разделяющих гелях соответственно. После разделения гели инкубировали в растворе уксусная кислота / этанол / вода в соотношении 1:4:5 в течение 15 минут. Затем 20 мин окрашивали в том же растворе с добавлением 0.4% Coomassie Blue R250. Гель отмывали 60 мин в 5% уксусной кислоте и инкубировали в дистиллированной воде в течение ночи при постоянном покачивании.
Количественное определение дцДНК в образцах очищенного ВКМ.
Содержание дцДНК является показателем, свидетельствующим об эффективности удаления клеточных компонентов при получении очищенного ВКМ [14]. Для количественной оценки дцДНК при помощи набора «ДНК-сорб-С» (АмплиСенс, Россия) проводили выделение тотальной ДНК из фрагментов образцов массой 25 мг. Количество выделенной двухцепочечной ДНК определяли флуориметрически на приборе Qubit 2.0 (Invitrogen, США), используя набор реагентов Qubit dsDNA HS Assay Kit (Invitrogen, США). После этого рассчитывали содержание ДНК в нг / мг сухой массы образца.
Определение термомеханических свойств.
Термомеханические свойства являются важным показателем, определяющим возможности применения биосовместимых материалов [15, 16, 17]. Для исследования влияния щелочной децеллюляризации на термомеханические характеристики очищенного ВКМ проводили определение температуры сваривания (Т), удлинения при разрыве, а также предела прочности при растяжении. Определение температуры сваривания проводили на фрагментах образцов, размером 6х0,3 см2 после предварительной инкубации в 10-и кратном объеме дистиллированной воды в течение 18-и часов при температуре 20°С при помощи прибора по ГОСТ 938.25-73. Образец насаживали на крючки прибора. В емкость прибора наливали 100 мл дистиллированной воды. Прибор с водой и образцом плотно закрывали крышкой. Затем включали подогрев и определяли Т сваривания двух образцов. За Т сваривания принимали среднее арифметическое результатов испытания двух фрагментов одного образца.
Удлинение при разрыве, а также предел прочности при растяжении анализировали на фрагментах образцов, размером 12х2 см, при помощи разрывной машины РТ-250 (Россия) по ГОСТ 938.11-69. В разрывную машину типа РТ-250 устанавливали образец, зажимая головные части образца между зажимами точно посередине. Во время проведения испытания фиксировали момент появления трещин на поверхности образца, фиксировали величину нагрузки и величину по шкале удлинений при разрыве. Предел прочности при растяжении σ в Па вычисляли по формуле
σ =
P
F
(P-нагрузка при разрыве (устанавливают по шкале разрывной машины), F-площадь поперечного сечения образца на участке разрыва в м2).
Удлинение при разрыве в процентах вычисляли по формуле:
ε= ∆ι×100
ι
(∆l-удлинение, соответствующее заданному напряжению, в мм, l-первоначальная рабочая длина образца в мм).
Статистическая обработка результатов.
Статистическую обработку результатов проводили с использованием программы STATISTICA 7.0. Данные на диаграммах и таблице представлены в виде среднего арифметического значения ± стандартное отклонение. Для оценки статистической значимости отличий между двумя экспериментальными группами применяли непараметрический критерий Манна-Уитни. Статистически значимыми считали различия при р<0,05 (на диаграммах и таблице обозначены звездочкой).
Результаты исследования и их обсуждение.
Обработка растворами щелочей известна, как один из наиболее эффективных методов получения децеллюляризированного ВКМ из плотных волокнистых соединительных тканей [9]. В настоящей работе нами было проведено сравнительное исследование влияния одно- и многокомпонентной методик щелочной очистки ВКМ на его основные биохимические, морфологические и термомеханические характеристики. В качестве однокомпонентного метода применяли обработку простым высокощелочным раствором 1М NaOH. Ранее применение данного раствора в сочетании с обработкой трипсином было успешно использовано для децеллюляризации дермы [18]. В качестве сложного многокомпонентного метода использовали методику [12], включающую
-
(1) предварительную обработку ткани слабощелочным раствором 0,35 М NaOH, (2) обработку высокощелочным раствором 1,25 М NaOH и 1,5М Na2SО4, обработку слабокислыми растворами (3) 1,3 М Na2SO4 и (4) 1 М H3BO3.
Согласно опубликованным данным, наиболее часто источником децеллюляризированного ВКМ для производства медицинских изделий являются дерма кожи, подслизистая оболочка тонкого кишечника и перикард ксеногенного происхождения [19]. В настоящей работе для данной цели нами был использован сетчатый слой дермы кожи КРС, что обусловлено простотой его получения в необходимых количествах и высокой коммерческой доступностью.
Данные литературы свидетельствуют о том, что наличие остаточных клеточных фрагментов в очищенном ВКМ в значительной степени способствует развитию неблагоприятной тканевой реакции при его имплантации [20]. Гистологическое исследование образцов ВКМ не выявило наличия в них клеток или же клеточных фрагментов как после однокомпонентной, так и после многокомпонентной щелочной очистки (рис. 1). При этом среднее значение содержания дцДНК в образцах составило 13,1 и 7,2 нг/мг сухой массы соответственно (рис. 2). В то же время количество дцДНК в сетчатом слое дермы до децеллюля-ризации составило в среднем 3295 нг/мг сухой массы (данные не показаны). Содержание дцДНК в очищенном ВКМ в количестве менее 50 нг/мг сухой массы ранее было предложено в качестве критерия эффективной децеллюляризации [1]. Таким образом, результаты как гистологического, так и биохимического исследования свидетельствуют об эффективности удаления клеток из ВКМ дермы кожи обоими методами. В то же время статистический анализ выявил достоверное снижение количества дцДНК в ВКМ, очищенном многокомпонентным методом по сравнению с однокомпонентным, что свидетельствует о более эффективном удалении остаточных клеточных компонентов. Известно, что высокая ионная сила раствора способствует диссоциации ДНК и белков [21]. В связи с этим можно предположить, что наблюдаемое снижение количества остаточной ДНК может быть обусловлено повышением ионной силы растворов за счет внесения в них сульфата натрия.
Щелочную децеллюляризацию относят к одному из самых «жестких» методов очистки ВКМ [1, 9]. С одной стороны, гидролизующая активность щелочей обеспечивает иммунологическую безопасность получаемого биосовместимого материала за счет солюбилизации клеточных компонентов и гликопротеинов, содержащих эпитоп галактоза-альфа(1-3)галактоза (aGal)
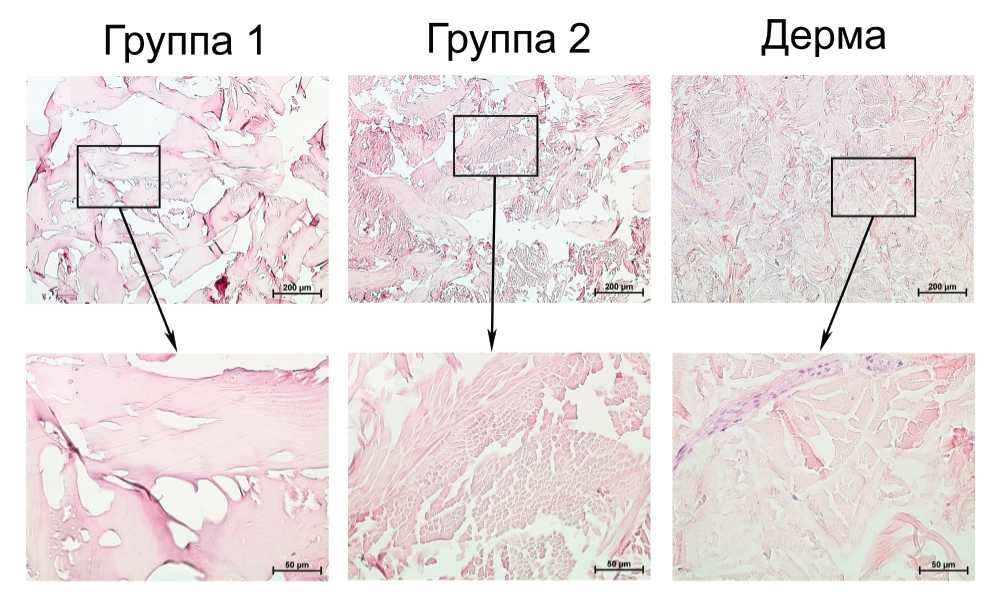
Рис. 1. Репрезентативные микрофотографии поперечных гистологических срезов сетчатого слоя дермы КРС (дерма) и ВКМ, полученных методами простой (группа 1) и многокомпонентной очистки (группа 2). Окраска гематоксилном и эозином.
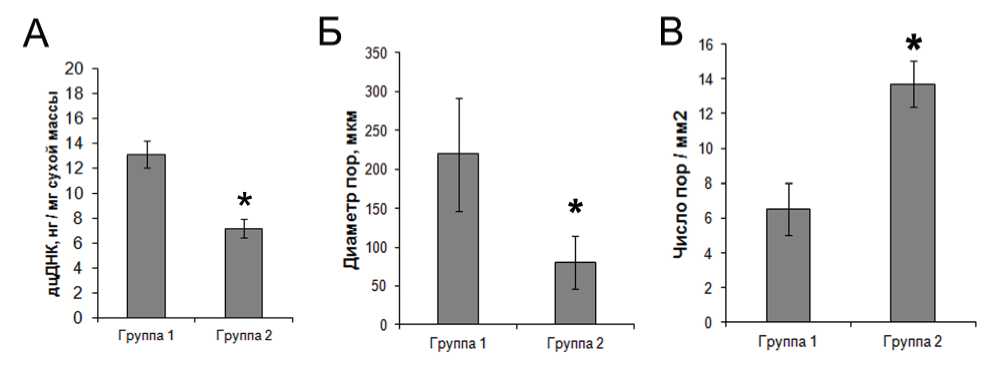
Рис. 2. Содержание дцДНК (А), а также размер (Б) и количество пор (В) во ВКМ, полученных методами простой (группа 1) и многокомпонентной очистки (группа 2). * - p<0,05 (по сравнению с группой 1).
-
[18] . С другой стороны, чрезмерное воздействие щелочи может привести к гидролизу белков матрикса, что окажет значительное влияние на его структуру и биологические свойства. Анализ результатов электрофоретического разделения полученных образцов очищенного ВКМ в ПААГ в денатурирующих условиях (рис. 3) показал наличие на электрофореграммах полос, характерных для димеров (β полоса - α1α2 или α1α1) и моно-
- меров молекул α цепей тропоколлагена (α1 и α2 полосы), возникающих при разделении коллагена I типа [22]. Полученные данные свидетельствуют о значительном преобладании данного белка в ВКМ, очищенном при помощи обеих методик. Кроме того, в обоих случаях электрофореграммы указывают на отсутствие значительного гидролиза цепей, составляющих молекулы тропоколлагена. Таким образом, используемые методы щелочной
Маркер Коллаген Группа 1 Группа 2 I типа
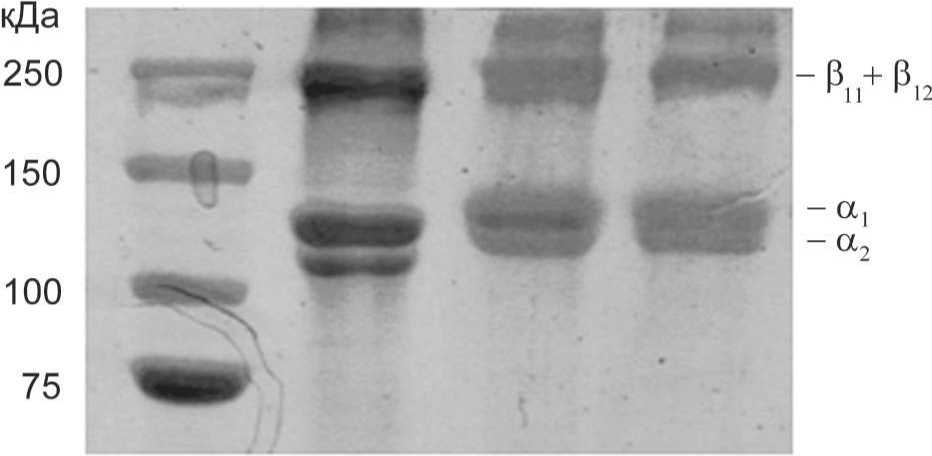
Рис. 3. Результаты электрофоретического разделения в ПААГ образцов ВКМ, полученных методами простой (группа 1) и многокомпонентной очистки (группа 2), а также контрольного образца коллагена I типа (коллаген I типа).
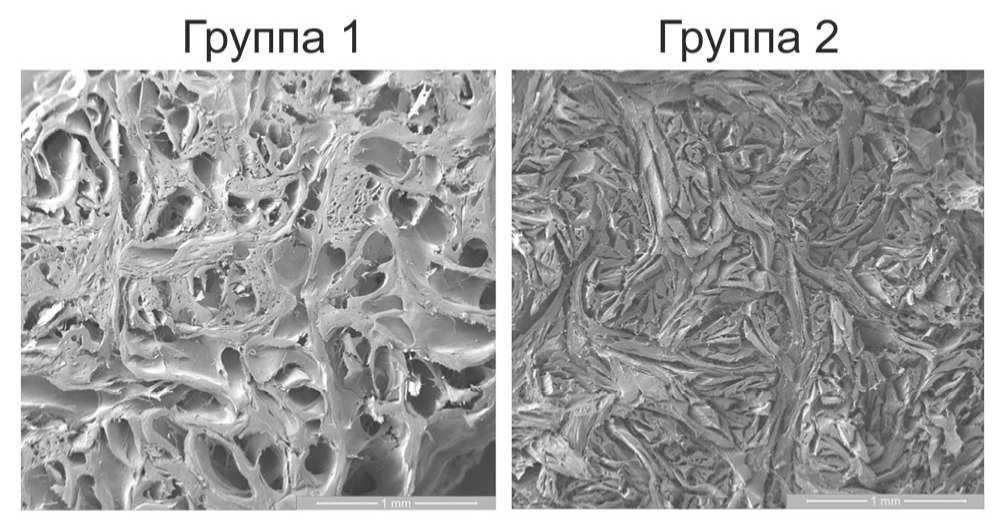
Рис. 4. Репрезентативные микрофотографии срезов боковой поверхности ВКМ, полученных методами простой (группа 1) и многокомпонентной очистки (группа 2). Сканирующая электронная микроскопия.
Группа 1 Группа 2

Рис. 5. Репрезентативные микрофотографии верхней поверхности ВКМ, полученных методами простой (группа 1) и многокомпонентной очистки (группа 2). Сканирующая электронная микро-
скопия.
децеллюляризации обеспечивают сохранение целостности цепей основного структурного белка ВКМ сетчатого слоя дермы.
Существенным фактором, влияющим на пространственную топологию очищенного ВКМ, является набухание пучков волокон коллагена, происходящее при обработке щелочными растворами. Процесс набухания обусловлен ионизацией боковых групп цепей тропоколлагена, происходящей в растворе с высоким pH, а также вследствие диссоциации связанных с коллагеном молекул гликозамигликанов [7]. «Щелочное набухание» приводит к увеличению расстояния между пучками волокон коллагена и, как следствие, к «разрыхлению» сети волокнистого компонента ВКМ и увеличению его «пористости». Добавление в щелочной раствор различных солей сульфата известно в качестве способа, позволяющего уменьшить набухание ВКМ [5, 7, 11] за счет связывания большого количества молекул воды при сольватации сульфат ионов. В используемом в настоящей работе многокомпонентном методе щелочной очистки сульфат натрия был добавлен в высокощелочной раствор на втором этапе обработки дермы. После этого образцы инкубировали в растворе, содержащем только сульфат натрия. На заключительном этапе применяли обработку борной кислотой для нейтрализации оставшихся щелочных компонентов и удаления избытка солей [10]. Сравнительное гистологическое исследование полученных образцов очищенного ВКМ показало уменьшение плотности упаковки пучков волокон коллагена по сравнению с интактной дермой (рис. 1), менее выраженное в образцах подвергнутых многокомпонентной обработке по сравнению с однокомпонентной. Качественный анализ срезов боковых поверхностей данных образцов методом СЭМ также показал увеличение «разрыхления» сети волокон ВКМ после однокомпонентной очистки относительно многокомпонентной (рис. 4). Морфологическая структура ВКМ, очищенного обоими методами, была представлена разнонаправленными тяжами пучков коллагеновых волокон со значительно варьирующей толщиной (10-300 мкм). Структура данных тяжей на гистологических препаратах образцов, полученных однокомпонентным методом, была преимущественно гомогенна (рис. 1). В то же время в ВКМ, полученном многокомпонентным методом, в составе тяжей были хорошо различимы волокна, диаметром 1-10 мкм (рис. 1), что соответствует диаметру волокон коллагена [23, 24].
Исследование верхней поверхности образцов методом СЭМ также позволило визуализировать отдельные коллагеновые волокна в составе разнонаправленных пучков ВКМ после многокомпонентной очистки (рис. 5), тогда как пучки в составе ВКМ после однокомпонентной очистки имели преимущественно аморфную структуру (рис. 5). Морфометрический анализ СЭМ-микрофотографий верхней поверхности пластов ВКМ выявил значительные отличия между двумя экспериментальными группами по размерам и количеству пор в материале. Так, средняя величина диаметра пор в образцах, обработанных по многокомпонентной методике (79,9 мкм), была более чем в 2 раза меньше, чем в образцах, очищенных однокомпонентным методом (218,6 мкм), а количество пор на единицу площади, наоборот – в среднем в 2 раза больше (рис. 2).
В целом, результаты морфологического исследования свидетельствуют о том, что щелочная децеллюляризация оказывает значительное влияние на структуру ВКМ дермы. Однако применение многокомпонентного метода обеспечивает лучшую сохранность его волокнистого компонента по сравнению с однокомпонентным. При использовании многокомпонентного метода не происходит дезорганизации структуры коллагеновых волокон в составе пучков, вызываемой, вероятно, «щелочным набуханием» образцов. Менее выраженное «разрыхление» волокнистого матрикса, очевидно, обуславливает уменьшение размера пор и увеличения их числа. Согласно данным литературы, уменьшение структурных элементов трехмерных матриксов способствует увеличению жизнеспособности, ускорению миграции и дифференцировки клеток при культивировании в системе in vitro [25], что связывают с увеличением площади поверхности и, как следствие, количества доступных сайтов связывания с рецепторами клеточных мембран. Также показано, что фибробласты при контакте с матриксом могут связываться с порами широкого диапазона диаметров: от 63 до 150 мкм, но при этом их жизнеспособность увеличивается с уменьшением размера пор материала [26]. Исходя из этого, можно предположить, что структура ВКМ, очищенного многокомпонентным методом будет обеспечивать лучшие кондуктивные свойства материала при использовании его в качестве скаффолда для регенерации соединительной ткани.
Понижение как термостабильности, так и механических свойств при децеллюляризации главным образом связывают с процессом разрушения и вымывания гликозаминогликанов, входящих в состав гликопротеинов, участвующих в процессе «упаковки» волокон коллагена в пучки [7]. Исследование термомеханических показателей выявило, что оба метода щелочной очистки ВКМ вызывают значительное снижение температуры сваривания, предела прочности при растяжении и удлинения при разрыве по сравнению с интактной дермой (табл. 1).
Очевидно, что данный эффект напрямую связан с обнаруженными структурными изменениями матрикса (рис. 1), вызванными химической обработкой. Сравнительный анализ децеллю-ляризованных ВКМ показал уменьшение величины прочности при растяжении и увеличение
Таблица 1
Термомеханические показатели образцов, полученных методами простой (группа 1) и многокомпонентной очистки (группа 2), а также сетчатого слоя дермы до химической обработки. * - p<0,05 (по сравнению с группой 1)
Выводы. Результаты проведенного исследования свидетельствуют о том, что изученные методики щелочной децеллюляризации ВКМ дермы КРС позволяют эффективно удалить клеточные компоненты, не вызывая гидролиза цепей молекул тропоколлагена. Применение многокомпонентного метода очистки, включающего обработку дермы высокощелочным и отмывочным растворами, содержащими сульфат натрия, позволяет по сравнению с однокомпонентной высокощелочной обработкой: (1) уменьшить количество остаточной ДНК, (2) уменьшить дезорганизацию волокнистой сети ВКМ с сохранением структуры коллагеновых волокон, (3) уменьшить размер и увеличить число пор в материале, (4) снизить потерю его эластичности. Полученные данные указывают на большую сохранность нативной структуры де-целлюляризированного ВКМ при данном методе очистки. Можно заключить, что использование многокомпонентной очистки с использованием растворов, содержащих соли сульфата является более предпочтительным для осуществления щелочной децеллюляризации дермы КРС. Однако применение простого однокомпонентного метода очистки высокощелочным раствором гидроксида натрия может быть оправдано в случае необходимости получения матрикса с более высокими прочностными характеристиками.
Список литературы Сравнительный анализ эффективности простого и многокомпонентного методов щелочной децеллюляризации на примере очистки волокнистого внеклеточного матрикса дермы
- Crapo P.M., Gilbert T.W., BadylakS.F. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011; 32 (12): 3233-3243. DOI: 10.1016/j.biomaterials.2011.01.057
- Badylak S.F., Taylor D., Uygun K. Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds. Annu Rev Biomed Eng. 2011; 13:27-53. DOI: 10.1146/annurev-bioeng-071910-124743
- Badylak, S.F. Xenogeneic extracellular matrix as a scaffold for tissue reconstruction. Transpl Immunol. 2004; 12:367-377. DOI: 10.1016/j.trim.2003.12.016
- Goissis G., da Silva Maginador S.V., da Conceiҫão Amaro Martins V. Biomimetic mineralization of charged collagen matrices: in vitro and in vivo study. Artifical organs. 2003; 27 (5): 437-443.
- Reing J.E., Brown B.N., Daly K.A., Freund J.M., Gilbert T.W., Hsiong S.X., Huber A., Kullas K.E., Tottey S., Wolf M.T., Badylak S.F. The effects of processing methods upon mechanical and biologic properties of porcine dermal extracellular matrix scaffolds. Biomaterials. 2010; 31(33): 8626-8633. DOI: 10.1016/j.biomaterials.2010.07.083
- Sheridan W.S., Duffy G.P., Murphy B.P. Mechanical characterization of a customized decellularized scaffold for vascular tissue engineering. J Mech BehavBiomed Mater. 2012; 8:58-70. 10.1016/j. jmbbm.2011.12.003.
- DOI: 10.1016/j.jmbbm.2011.12.003
- Mendoza-Novelo B., Avila E.E., Cauich-Rodriguez J.V., Jorge-Herrero E., Rojo F.J., Guinea G.V., Mata-Mata J.L. Decellularization of pericardial tissue and its impact on tensile viscoelasticity and glycosaminoglycan content. Acta Biomater. 2011; 7: 1241-1248.
- DOI: 10.1016/j.actbio.2010.11.017
- Tsuchiya T., Balestrini J.L., Mendez J., Calle E.A., Zhao L., Niklason L.E. Influence of pH on extracellular matrix preservation during lung decellularization. Tissue Eng Part C Methods. 2014; 20(12): 1028-1036.
- DOI: 10.1089/ten.TEC.2013.0492
- Keane T.J., Swinehart I., Badylak S.F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 2015; 16(84): 25-34.
- DOI: 10.1016/j.ymeth.2015.03.005
- Goissis G., Piccirili L., Goes J.C., Plepis A., Das-Gupta D.K. Anionic Collagen: Polymer Composites with Improved Dielectric and Rheological Properties. Artif organs. 1998; 22(3): 203-209.
- Bet M.R., Goissis G., Lacerda C. Characterization of polyanionic collagen prepared by selective hydrolysis of asparagine and glutamine carboxyamide side chains. Biomacromolecules. 2001; 2(4): 1074-1079.
- Patent № 2353397 RF. Biorassasyvaemaja kollagenovaja matrica, sposob ee poluchenija i primenenija. Safojan A.A., Nesterenko S.V., Nesterenko V.G., Alekseeva N.Ju.
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature.1970; 227: 680-68.
- Gilbert T.W., Freund J.M., Badylak S.F. Quantification of DNA in biologic scaffold materials. J Surg Res. 2009; 152(1): 135-139. 10.1016/j. jss.2008.02.013.
- DOI: 10.1016/j.jss.2008.02.013
- Liang H.C., Chang Y., Hsu C.K., Lee M.H., Sung H.W. Effects of crosslinking degree of an acellular biological tissue on its tissue regeneration pattern. Biomaterials. 2004; 25(17): 3541-3552.
- DOI: 10.1016/j.biomaterials.2003.09.109
- Burger J.W., Halm J.A., Wijsmuller A.R., ten Raa S., Jeekel J. Evaluation of new prosthetic meshes for ventral hernia repair. Surg endosc. 2006; 20(8): 1320-1325.
- DOI: 10.1007/s00464-005-0706-4
- Gaertner W.B., Bonsack M.E., Delaney J.P. Experimental evaluation of four biologic prostheses for ventral hernia repair. Journal of gastrointestinal surgery. 2007; 11(10): 1275-1285. 10.1007/ S11605-007-0242-8.
- DOI: 10.1007/S11605-007-0242-8
- Zhang X., Deng Z., Wang H., Yang Z., Guo W. Expansion and delivery of human fibroblasts on micronized acellular dermal matrix for skin regeneration. Biomaterials. 2009; 30(14): 2666-2674.
- DOI: 10.1016/j.biomaterials.2009.01.018
- Cornwell K.G., Landsman A., James K.S. Extracellular matrix biomaterials for soft tissue repair. Clinics in podiatric medicine and surgery. 2009; 26(4): 507-523.
- DOI: 10.1016/j.cpm.2009.08.001
- Keane T.J., Londodo R., Turner N.J., Badylak S.F. Consequences of ineffective decellularization of biologic scaffolds on the host response. Biomaterials. 2012; 33(6): 1771-1781. 10.1016/j. Biomaterials.2011.10.054.
- DOI: 10.1016/j.biomaterials.2011.10.054
- Cox B., Emili A. Tissue subcellular fractionation for use in mass-spectrometry-based proteomics. Nat protoc. 2006; 1(4): 1872-1878. 10.1038/ nprot.2006.273.
- DOI: 10.1038/nprot.2006.273
- Deyl Z., Miksil I. Advanced separation methods for collagen parent a-chains, their polymers and fragments. J Chromatogr B. 2000; 739:3-31.
- Ushiki T. Collagen fibers, reticular fibers and elastic fibers. A comprehensive understanding from a morphological viewpoint. Arch Histol Cytol. 2002; 65(2): 109-126.
- DOI: 10.1679/aohc.65.109
- Stevens M.M., George J.H. Exploring and Engineering the cell surface interface. Science. 2005
- Stevens M.M., George J.H. Exploring and Engineering the cell surface interface. Science. 2005; 310(5751): 1135-1138.
- DOI: 10.1126/science.1106587
- O’Brien F.J., Harley B.A., Yannas I.V., Gibson L.J. The effect of pore size on cell adhesion in collagen-GAG scaffolds. Biomaterials. 2005; 26(4): 433-441.
- DOI: 10.1016/j.biomaterials.2004.02.052


